文章信息
- 恶性肿瘤中泛素化修饰对Warburg效应调控机制的研究进展
- Research Progress on Regulatory Mechanism of Ubiquitin Modification on Warburg Effect in Malignant Tumors
- 肿瘤防治研究, 2022, 49(6): 616-622
- Cancer Research on Prevention and Treatment, 2022, 49(6): 616-622
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2022.21.1123
- 收稿日期: 2021-10-08
- 修回日期: 2022-01-03
泛素化(ubiquitinating, UB)是一种蛋白质翻译后修饰(protein post-translational modifications, PTM)过程,其特征是泛素分子与蛋白质底物共价连接。泛素化修饰过程是可逆的、动态的,通过参与调节基因转录、炎性反应和DNA损伤修复等多种生物过程介导肿瘤的发生发展[1]。随着对泛素化修饰研究的深入,越来越多的证据表明肿瘤细胞能够通过泛素化修饰调节底物蛋白的表达水平,进而影响蛋白对Warburg效应的激活或抑制。瓦博格效应(Warburg effect)是指癌细胞即使在氧气充足的条件下也会偏向使用糖酵解作用来取代正常细胞的有氧循环,这也是癌细胞的生长速度远大于正常细胞的原因[2]。肿瘤细胞中蛋白质的泛素化修饰作用对Warburg效应的调控机制研究越来越得到研究者们的关注,本文就此作一综述。
1 泛素化修饰/去泛素化修饰与Warburg效应泛素化与去泛素化相关的翻译后修饰通过影响蛋白质的功能调控肿瘤细胞DNA损伤、凋亡、自噬、分子信号通路和染色质重塑,进而影响肿瘤细胞的增殖、侵袭、转移以及治疗耐药[3]。最新的研究发现,肿瘤泛素化修饰过程与糖酵解也密切相关,即肿瘤细胞中的泛素化修饰作用能够调控Warburg效应相关的底物蛋白的表达水平。肿瘤细胞泛素化相关的能量代谢重编程尤其是Warburg效应已经成为肿瘤研究领域的一大热点,并且Warburg效应在缺氧条件下更为显著。
1.1 泛素化修饰与去泛素化修饰泛素分子通过泛素激活酶(E1酶)、泛素结合酶(E2酶)和泛素连接酶(E3酶)的顺序作用被共价连接到底物蛋白上,即泛素分子间可以通过酶促反应相互连接进而介导靶蛋白的降解,这种蛋白质翻译后修饰过程被称为泛素化。首先,泛素激活酶水解三磷酸腺苷(adenosine-triphosphate, ATP),并将一个泛素分子腺苷酸化; 随后,泛素被转移到E1酶的活性中心的半胱氨酸残基上,并伴随着第二个泛素分子的腺苷酸化,被腺苷酸化的泛素分子再被转移到泛素结合酶的半胱氨酸残基上; 最后,高度保守的泛素连接酶识别特定的需要被泛素化的靶蛋白,并催化泛素分子从E2酶上转移到靶蛋白[4]。然而,泛素化的过程也是可逆的。在泛素-蛋白酶体系统中泛素化的蛋白底物,通过去泛素化酶(deubiquitinating enzymes, DUBs)裂解切断泛素链与底物蛋白之间的连接,使泛素分子从蛋白质底物中脱离出来,这一过程称为去泛素化(deubiquitinating, DUB)。总之,泛素化是蛋白酶体对蛋白质降解的一种调节过程[1],肿瘤细胞可以通过泛素化或去泛素化修饰一些重要的具有抑癌或者促癌作用的蛋白质来调控癌症的发生、发展。
1.2 Warburg效应Warburg效应指恶性肿瘤细胞在氧含量正常的情况下糖酵解代谢同样活跃,表现为葡萄糖摄取率高和代谢产物乳酸含量高[2, 5],是恶性肿瘤重要的代谢途径之一。由于肿瘤细胞的快速增殖需要消耗大量葡萄糖和氧气,导致营养相对缺乏并促使局部缺氧微环境的形成。低氧、低pH值、营养缺乏等理化条件则有利于肿瘤细胞的增殖、转移[6]。这些特征性的理化条件参与调控肿瘤能量代谢重编程[7],也是肿瘤细胞生存不可或缺的[8]。Warburg效应可通过提高肿瘤细胞对缺氧条件的耐受性,促进糖酵解关键酶己糖激酶2(hexokinase 2, HK2)、葡萄糖转运蛋白(recombinant glucose transporter 1, GLUT1)、乳酸脱氢酶A(L-lactate dehydrogenase A chain, LDHA)、磷酸肌醇依赖性蛋白激酶-1(3-Phosphoinositide-dependent protein kinase 1, PDK1)和丙酮酸激酶M2(pyruvate kinase M2, PKM2)的表达上调,进而促进恶性肿瘤的侵袭和转移。
2 泛素化修饰与Warburg效应关键因子 2.1 HIF1α有研究认为,缺氧能够促进Warburg效应的发生[9],而缺氧诱导因子1α(hypoxia-inducible factor, HIF1α)正是加剧Warburg效应的重要调控因子。HIF1α还可通过泛素-蛋白酶体途径参与靶蛋白的泛素化修饰,进而影响肿瘤细胞对缺氧微环境反应和激活Warburg效应。因此,可以通过抑制Warburg效应相关的关键酶如GLUT1、HK2、PKM2和LDHA来促进肿瘤细胞凋亡和活性氧(ROS)敏感度进而抑制肿瘤的发生发展[10]。HIF1α是一种广泛表达的转录调节因子,是希佩尔林道病肿瘤抑制蛋白(von hipel-linda, pVHL)抑癌剂中最著名的靶标,是降解所需的E3连接酶。研究表明,HPV16 E6通过阻碍HIF1α和VHL的结合来促进低氧诱导的Warburg效应。这种解离减弱了VHL介导的HIF1α泛素化并导致HIF1α积累[11]。此外,HIF1α可以通过蛋白酶体介导的降解来控制T淋巴细胞分化中转录因子叉状头P3(Foxp3)蛋白的表达。体内泛素化试验表明,Foxp3可以剂量依赖性方式降低HIF1α降解。同时,Foxp3表达可以增加HIF1α靶基因(如血管内皮生长因子(VEGF)和葡萄糖转运蛋白(GLUT))的表达,进而促进肿瘤细胞的发生、发展[12]。
2.2 己糖激酶2己糖激酶2(Hexokinase 2, HK2)是糖酵解关键酶,其泛素化修饰可以激活Warburg效应。有研究证实,HK2的过表达可维持肿瘤细胞无限的生长,而HK2的抑制剂丹参酮ⅡA(tanshinone ⅡA, TanⅡA)可抑制AKT-c-Myc信号转导,并促进E3连接酶FBW7(F-box/WD repeat-containing protein 7)介导的c-Myc泛素化和降解,最终在转录水平上降低HK2的表达[13]。此外,还有证据表明,E3连接酶肿瘤坏死因子相关受体6(TNF receptor associated factor 6, TRAF6)通过催化HK2的赖氨酸Lys63的泛素化降解调控自噬和Warburg效应[14]。由此可见HK2泛素化修饰影响Warburg效应进而促进肿瘤的发生发展。
2.3 AKTAKT又称蛋白激酶B(protein kinase B, PKB), 是肿瘤细胞内重要的信号转导通路, 在肿瘤细胞生长、代谢、侵袭和转移中起关键作用。AKT通过增强葡萄糖转运蛋白的转录和膜转位来增加葡萄糖的摄取,此外AKT降低HK2泛素化修饰进而增加HK2和磷酸果糖激酶活性来促进糖酵解。越来越多的证据表明,AKT通路的激活导致对有氧糖酵解的依赖性增加,这表明以AKT通路为靶点的治疗策略可以阻止葡萄糖代谢,从而导致肿瘤消退,其机制是通过泛素化修饰促进AKT活化来激活AKT-mTOR信号通路(The serine/threonine kinase/mechanistic target of rapamycin kinase signal pathway)进而调控Warburg效应,最终影响肿瘤增殖和转移[13]。另有研究证实,USP53作为一种肿瘤抑制因子,通过泛素化FK506结合蛋白(FK506 binding protein 51, FKBP51)使AKT1去磷酸化失活抑制FKBP51-AKT信号通路,进而促进肺腺癌细胞的凋亡并抑制Warburg效应,抑制肺腺癌的进展[15]。研究发现,通过泛素化激活AKT可以激活代谢重编程,促进肿瘤细胞发生糖酵解。丝氨酸/苏氨酸激酶35(serine/threonine kinase 35, STK35)在结直肠癌(colorectal cancer, CRC)中高表达,通过促进Warburg效应和AKT泛素化来抑制肿瘤细胞的凋亡、上调p-AKT的表达并抵消5-Fu的抗肿瘤作用,进而影响结直肠癌的化学药耐药性[16]。因此,AKT影响Warburg效应关键酶进而影响肿瘤发生发展及治疗耐药。
2.4 F-box蛋白S期激酶相关蛋白2F-box蛋白S期激酶相关蛋白2(S-phase kinase associated protein2, SKP-2)是泛素化和Warburg效应的关键因子,它与SKP-1、枯灵素(Cullin-1, CUL-1)和RBx1形成SKP-2 SCF复合物,构成E3连接酶活性,从而触发蛋白质泛素化和降解。SKP-2通过调节细胞周期进程、衰老和转移来显示致癌活性。SKP-2在癌症中普遍高表达,是癌症的独立预后不良因素。SKP-2泛素化降解可以抑制HK2活性和Warburg效应,并抑制CRC细胞的生长增殖。SKP-2的抑制剂通过促进SKP-2的泛素化降解下调SKP-2的表达水平,抑制CRC细胞的增殖、侵袭和转移[17-18]。在鼻咽癌中,通过抑制SKP-2的泛素化降解上调SKP-2的表达水平; 使高表达的SKP-2通过抑制凋亡信号通路促进肿瘤细胞对顺铂的耐药,进而促进肿瘤细胞的生长和糖酵解的激活[19]。研究表明,AKT的泛素化还可通过激活人表皮生长因子受体2(Epidermal growth factor receptor-2, HER2)来诱导。SKP-2是通过促进AKT泛素化和激活来调节曲妥珠单抗抵抗。靶向糖酵解可提高HER2阳性肿瘤细胞对曲妥珠单抗(Trastuzumab)的敏感度[20]。SKP-2沉默使HER2过表达的肿瘤对曲妥珠单抗治疗敏感。因此,SKP-2沉默与曲妥珠单抗联合治疗导致肿瘤显著消退,这也表明SKP-2与曲妥珠单抗联合用于抗癌治疗的一个有吸引力的治疗靶点,见图 1。

|
| The light green boxes represent ubiquitin enzymes, the light orange boxes indicate deubiquitinating enzymes, and the other color boxes indicate other molecules. The PI3K-AKT signal pathways and downstream transcription factor HIF1α are regulated by E3 ligases and deubiquitinating enzymes, which results in the change of aerobic glycolysis in cancer. 图 1 E3连接酶和去泛素化酶在肿瘤中调节糖酵解相关的信号通路和转录因子 Figure 1 E3 ligases and deubiquitinating enzymes regulate glycolysis-associated signalling pathways and transcription factors in cancer |
越来越多的研究证实泛素化修饰对Warburg效应的调控作用在乳腺癌、肺癌、肝癌、结直肠癌等多种恶性肿瘤中发挥着重要作用,并与恶性肿瘤的发生发展密切相关,见图 2。
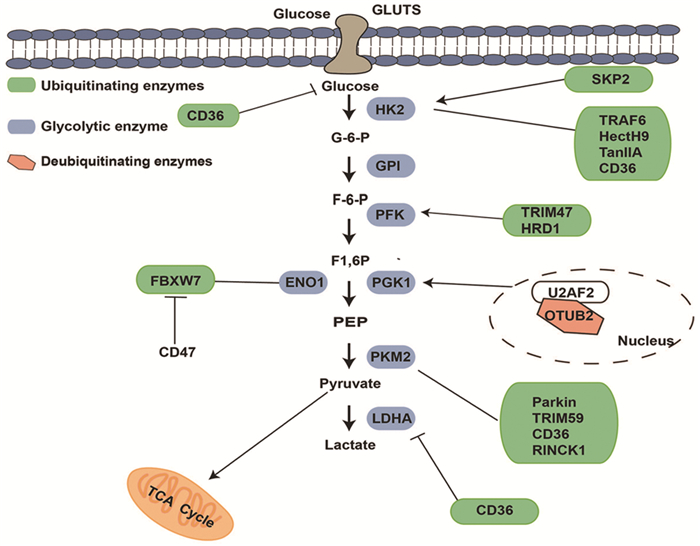
|
| The light green boxes represent ubiquitin enzymes, the light orange boxes indicate deubiquitinating enzymes, the white boxe indicates other molecules, and the blue boxes represent glycolytic enzymes. GLUTs and glycolytic enzymes are modulated by E3 ligases and deubiquitinating enzymes, thereby changing glycolysis of cancer. 图 2 E3连接酶和去泛素化酶调节肿瘤中的糖酵解过程 Figure 2 E3 ligases and deubiquitinating enzymes regulate glycolytic process in cancer |
研究发现,Warburg效应的关键酶磷酸果糖激酶(platelet isoform of phosphofructokinase, PFKP)是与羟甲基戊二酰辅酶A还原酶降解蛋白1(HmgCoA reductase degradation1, HRD1)直接相互作用并共定位。在机制上,HRD1作为E3泛素连接酶,催化PFKP泛素化并促进PFKP降解,抑制乳腺癌细胞中的PFKP表达和活性以及HRD1-PFKP途径,能够抑制Warburg效应进而抑制乳腺癌的增殖和侵袭[21]。还有研究证实,定位于线粒体外膜的E3泛素连接酶(mitochondrial E3 ubiquitin ligase 1, MUL1)能够通过调节UBXN7辅助因子蛋白(即MUL1的特异性底物)来调控HIF1α和代谢重编程。由于MUL1的失活可使UBXN7不被泛素化降解,细胞内蛋白水平增加,进而促进HIF1α的表达上调、抑制氧化磷酸化和激活Warburg效应。总之,肿瘤细胞中泛素化修饰作用对Warburg效应的调控作用在乳腺癌的发生发展中起关键作用[22]。
3.2 肺癌研究证实,去泛素化酶在肺癌的发生发展中发挥重要作用。去泛素化酶OTUB2在非小细胞肺癌(non-small cell lung cancer, NSCLC)组织中普遍高表达,与TNM分期(临床病理分期)、淋巴结转移、预后差、复发转移正相关。OTUB2通过去泛素化修饰稳定U2AF2的表达,激活AKT/mTOR通路和Warburg效应,成为促进NSCLC发生的关键驱动因子[23]。此外,在肺腺癌中,E3连接酶环指蛋白115(RING finger protein 115, RNF115)过表达并促进结肠腺瘤样息肉基因(adenomatous polyposis coli, APC)泛素化激活Wnt/β-catenin信号通路和Warburg效应,进而促进肿瘤细胞增殖、侵袭和转移[24]。研究表明,在肺腺癌的顺铂耐药细胞系A549/DDP中,TRIM59可以介导顺铂耐药性,并且TRIM59和HK2的过表达促进葡萄糖摄取和乳酸产生,通过敲低TRIM59抑制PTEN泛素化进而逆转A549/DDP细胞系的耐药性[25]。
3.3 肝癌在肝癌细胞中,Bcl-2相关转录因子1(BCL2-associated transcription factor 1, Bclaf1)能够激活HIF1α介导的Warburg效应。低氧条件下,中药中提取的人参皂苷化合物K(ginsenoside compound K, CK)能够下调Bclaf1的表达,并通过泛素化降解HIF-1α的表达抑制Warburg效应进而抑制肝癌细胞的侵袭转移[5]。泛素特异性蛋白酶22(ubiquitin specific proteases 22, USP22)也可以通过去泛素化修饰稳定HIF1α的表达水平,促进缺氧诱导的Warburg效应的激活[26]。研究表明,在低氧条件下,敲除去泛素化酶USP22的表达能够促进肝癌细胞对索拉非尼的敏感度,并且HIF1α能够促进USP22和TP53的转录并上调其表达。总之,USP22通过TP53-HIF1α-USP22正反馈环来促进缺氧诱导的HCC干细胞的产生并抑制肿瘤对索拉非尼的药物敏感度[26]。
3.4 结直肠癌去泛素酶OTUB2在CRC中高表达,阻断PKM2与其泛素E3连接酶Parkin连接来抑制其泛素化,而直接与PKM2相互作用来增强PKM2的活性,促进糖酵解及其产物乳酸和ATP生成[27]。这一机制促进CRC细胞增殖和迁移并促进化疗药物的敏感度。此外,Skp2在CRC中高表达,是结直肠癌的独立预后不良因素。Skp2的泛素化降解抑制了HK2活性和Warburg效应进而抑制CRC细胞的增殖、侵袭和转移[17-18]。此外,有研究发现,CD36也是参与结直肠癌中泛素化修饰激活Warburg效应的关键因素。CRC细胞中CD36发挥抑癌作用,CD36通过促进磷脂酰肌醇蛋白聚糖4(glypican-4 human recombinant protein, GPC4)的泛素化降解,抑制下游糖酵解靶基因GLUT1、HK2、PKM2和LDHA的表达和β-catenin/c-myc通路的激活,导致糖酵解效应的下调,进而抑制结直肠肿瘤的发生[28]。Smad泛素化调节因子2(SMURF2)通过蛋白酶体途径促进E3连接酶葡萄糖反应性转录因子碳水化合物反应元件结合蛋白(carbohydrate response element binding protein, ChREBP)的泛素化降解,进而抑制Warburg效应和CRC的增殖[29]。研究表明,GLCC1是一种长链非编码RNA(long non-coding RNA, lncRNA),并在CRC中显著上调,通过与HSP90分子伴侣直接相互作用来泛素化稳定c-Myc转录因子,从而促进Warburg效应和CRC的增殖[30]。丝氨酸/苏氨酸激酶35(serine/threonine kinase 35, STK35)通过促进Warburg效应和AKT泛素化来抑制肿瘤细胞的凋亡、上调p-AKT的表达并抵消5-氟脲嘧啶的抗肿瘤作用,进而影响结直肠癌的化学药耐药性[16],提示OTUB2、SKP-2、SMURF2有望成为CRC治疗靶点。
3.5 胰腺癌泛素化修饰激活Warburg效应信号通路进而促进胰腺癌的增殖、侵袭和转移。胰腺癌中TRIM47(tripartite motif containing 47)显著高表达,激活Warburg效应促进肿瘤增殖,果糖-1,6-二磷酸酶(recombinant human fructose-1, 6-bisphosphatase 1, FBP1)能够通过泛素化降解下调TRIM47的表达水平,逆转TRIM47的致癌作用[31]。胰腺癌中作为独立不良预后因子的E3泛素连接酶组件n-识别蛋白5(ubiquitin protein ligase E3 component n-recognin 5, UBR5)与FBP1的表达水平负相关,UBR5能够使CCAAT增强子结合蛋白α(CCAAT enhancer binding protein alpha, C/EBPα)直接结合并促进其泛素化降解,进而抑制FBP1的表达,促进Warburg效应的激活和肿瘤增殖[32]。此外,E3泛素连接酶环指蛋白18(RING finger protein 18, RNF8)介导的组蛋白H3多泛素化在调控组蛋白H3稳定性和染色质修饰中发挥重要作用,并促进MYC和细胞周期蛋白D1(Cyclin D1, CCND1)的基因转录,从而促进糖酵解、细胞增殖和肿瘤发生[33]。在胰腺癌细胞中,E3连接酶FBW7是含有F-box和WD重复域的肿瘤抑制因子,通过诱导线粒体定位的肿瘤抑制因子-硫氧还蛋白(thioredoxin-interacting protein, TXNIP),来抑制胰腺癌细胞泛素化降解对Warburg效应的激活作用。FBW7的过表达可提高胰腺癌对吉西他滨的敏感度[34]。
3.6 胶质母细胞瘤有氧条件下,维持肿瘤细胞的新陈代谢也需要优先适应糖酵解的能量代谢模式。研究发现,抑癌基因类视黄醇干扰素诱导的死亡率相关基因19(gene associated with retinoid-interferon-induced mortality-19, GRIM-19)与肿瘤细胞的生长及细胞凋亡相关,更重要的是,GRIM-19还有助于氧化效应和糖酵解效应之间的转换。在胶质母细胞瘤中,HIF1α是GRIM-19的下游因子,GRIM-19的下调以信号转导与转录激活因子3(signal transducer and activator of transcription 3, STAT3)依赖的方式促进HIF1α的合成,这是von Hippel-Lindau(pVHL)-HIF1α相互作用的潜在竞争性抑制剂,从而阻止HIF1α受到pVHL介导的泛素化和蛋白酶体降解。潜在的抑癌基因GRIM-19部分通过STAT3-HIF1α信号轴调节胶质母细胞瘤的代谢重编程来部分发挥其功能[35]。此外,表皮生长因子受体(epidermal growth factor receptor, EGFR)激活在RINCK1泛素连接酶介导的Lys321上诱导PLCγ1依赖性PKCε单泛素化。激活的RelA与HIF1α相互作用,这是RelA结合PKM启动子所必需的。EGFR通过上调PKCε和PKM2促进糖酵解和肿瘤的发生[36]。同时,长链非编码RNA LINC00470通过激活pAKT来抑制HK1的泛素化进而促进Warburg效应和胶质母细胞瘤增殖[37]。
3.7 肾细胞癌在肾细胞癌(renal cell carcinoma, RCC)中,热休克蛋白12A(heat shock protein 12, HSPA12A)普遍下调,而HSPA12A过表达通过增加CD147泛素-蛋白酶体的降解而使CD147不稳定,来抑制乳酸盐的输出和Warburg效应的激活,进而抑制RCC迁移[38]。
3.8 前列腺癌丛状蛋白A1(Plexin A1, PLXNA1)可以促进前列腺癌的增殖、侵袭和迁移,是前列腺癌恶性进展的重要标志物。PLXNA1的蛋白水平在上游受到HECT家族E3泛素连接酶Smurf2的调控进而促进PLXNA1泛素化降解; 而在下游通过与OS-9蛋白结合来阻遏对HIF1α的降解来稳定HIF1α,并促进下游糖酵解信号通路关键酶的变化和Warburg效应激活,最终调节肿瘤的发生发展[39]。
3.9 其他研究表明,泛素化修饰作用对激活Warburg效应信号通路在多种类型的恶性肿瘤中都广泛存在。在骨肉瘤中,泛素样蛋白FAT10通过稳定表皮EGFR来上调6-磷酸果糖-2-激酶(6-phosphofructo-2-kinase/fructose-2, 6-biphosphatase3, PFKFB3)进而促进骨肉瘤Warburg效应激活[40]。在卵巢癌中,扩增的TRIM59通过MKP3/ERK泛素化修饰作用激活Warburg效应来增加葡萄糖摄取和乳酸产生,进而促进肿瘤的发生[41]。总之,泛素化修饰作用对Warburg效应的调控影响肿瘤细胞的发生发展,见表 1。

|
目前,肿瘤细胞耐药性的产生是导致临床中癌症治疗失败的重要因素之一。由于肿瘤细胞耐药机制与癌基因和抑癌基因的异常表达、DNA损伤修复、耐药相关蛋白异常表达以及药物进入肿瘤细胞内浓度减少等多种因素相关,近年来关于泛素化修饰通过调控Warburg效应进而对癌症治疗耐药的作用机制研究也越来越多[34]。
另外有研究表明,泛素连接酶HectH9通过K63泛素化修饰作用来调节HK2的线粒体定位进而促进糖酵解激活和细胞凋亡,而HectH9的缺失可抑制HK2的表达进而抑制肿瘤糖代谢和生长。HectH9/HK2通路可以调节肿瘤干细胞(cancer stem cell, CSC)的增殖和化疗药耐药的产生,此发现可以用于指导临床治疗[42]。
总之,我们发现泛素化作用对Warburg效应的调控通过促进葡萄糖摄取和乳酸的生成进而促进肿瘤细胞的发生发展、增殖、侵袭和转移,并可以指导临床肿瘤的治疗。
5 展望癌症的早期诊断和早期治疗能够有效阻断肿瘤细胞代谢、克服耐药发生和破坏肿瘤微环境。本课题组一直致力于研究去泛素化修饰在肺癌和乳腺癌中的作用机制,发现去泛素化酶特别是USP22和USP46在乳腺癌中可能通过调控Warburg效应促进肿瘤的进展。目前研究发现[43],肿瘤细胞中泛素化/去泛素化作用对Warburg效应的调控机制错综复杂,其发生机制是正常细胞与肿瘤细胞重要的调控点,但其具体机制有待进一步挖掘,为肿瘤的诊断、治疗以及预后判断提供新思路和新靶点。
作者贡献:
王凤丽:文献查阅、撰写论文
胡晶:论文选题和基金支持、论文审核
| [1] |
Huang Q, Zhang X. Emerging Roles and Research Tools of Atypical Ubiquitination[J]. Proteomics, 2020, 20(9): e1900100. DOI:10.1002/pmic.201900100 |
| [2] |
Warburg O. On the origin of cancer cells[J]. Science, 1956, 123(3191): 309-314. DOI:10.1126/science.123.3191.309 |
| [3] |
Satija YK, Bhardwaj A, Das S. A portrayal of E3 ubiquitin ligases and deubiquitylases in cancer[J]. Int J Cancer, 2013, 133(12): 2759-2768. |
| [4] |
Yang L, Zhou W, Lin H. Posttranslational Modifications of Smurfs: Emerging Regulation in Cancer[J]. Front Oncol, 2020, 10: 610663. |
| [5] |
Zhang S, Zhang M, Chen J, et al. Ginsenoside Compound K Regulates HIF-1α-Mediated Glycolysis Through Bclaf1 to Inhibit the Proliferation of Human Liver Cancer Cells[J]. Front Pharmacol, 2020, 11: 583334. DOI:10.3389/fphar.2020.583334 |
| [6] |
Vaupel P, Schmidberger H, Mayer A. The Warburg effect: essential part of metabolic reprogramming and central contributor to cancer progression[J]. Int J Radiat Biol, 2019, 95(7): 912-919. DOI:10.1080/09553002.2019.1589653 |
| [7] |
Logozzi M, Mizzoni D, Angelini DF, et al. Microenvironmental pH and Exosome Levels Interplay in Human Cancer Cell Lines of Different Histotypes[J]. Cancers (Basel), 2018, 10(10): 370. DOI:10.3390/cancers10100370 |
| [8] |
Luo Z, Wang Q, Lau WB, et al. Tumor microenvironment: The culprit for ovarian cancer metastasis?[J]. Cancer Lett, 2016, 377(2): 174-182. DOI:10.1016/j.canlet.2016.04.038 |
| [9] |
Vander Heiden MG, Cantley LC, Thompson CB. Understanding the Warburg effect: the metabolic requirements of cell proliferation[J]. Science, 2009, 324(5930): 1029-1033. DOI:10.1126/science.1160809 |
| [10] |
Caniglia JL, Jalasutram A, Asuthkar S, et al. Beyond glucose: alternative sources of energy in glioblastoma[J]. Theranostics, 2021, 11(5): 2048-2057. DOI:10.7150/thno.53506 |
| [11] |
Guo Y, Meng X, Ma J, et al. Human papillomavirus 16 E6 contributes HIF-1α induced Warburg effect by attenuating the VHL-HIF-1α interaction[J]. Int J Mol Sci, 2014, 15(5): 7974-7986. DOI:10.3390/ijms15057974 |
| [12] |
Jou YC, Tsai YS, Lin CT, et al. Foxp3 enhances HIF-1α target gene expression in human bladder cancer through decreasing its ubiquitin-proteasomal degradation[J]. Oncotarget, 2016, 7(40): 65403-65417. DOI:10.18632/oncotarget.11395 |
| [13] |
Li M, Gao F, Zhao Q, et al. Tanshinone ⅡA inhibits oral squamous cell carcinoma via reducing Akt-c-Myc signaling-mediated aerobic glycolysis[J]. Cell Death Dis, 2020, 11(5): 381. DOI:10.1038/s41419-020-2579-9 |
| [14] |
Jiao L, Zhang HL, Li DD, et al. Regulation of glycolytic metabolism by autophagy in liver cancer involves selective autophagic degradation of HK2 (hexokinase 2)[J]. Autophagy, 2018, 14(4): 671-684. DOI:10.1080/15548627.2017.1381804 |
| [15] |
Zhao X, Wu X, Wang H, et al. USP53 promotes apoptosis and inhibits glycolysis in lung adenocarcinoma through FKBP51-AKT1 signaling[J]. Mol Carcinog, 2020, 59(8): 1000-1011. DOI:10.1002/mc.23230 |
| [16] |
Yang H, Zhu J, Wang G, et al. STK35 Is Ubiquitinated by NEDD4L and Promotes Glycolysis and Inhibits Apoptosis Through Regulating the AKT Signaling Pathway, Influencing Chemoresistance of Colorectal Cancer[J]. Front Cell Dev Biol, 2020, 8: 582695. DOI:10.3389/fcell.2020.582695 |
| [17] |
Zhou L, Yu X, Li M, et al. Cdh1-mediated Skp2 degradation by dioscin reprogrammes aerobic glycolysis and inhibits colorectal cancer cells growth[J]. EBioMedicine, 2020, 51: 102570. DOI:10.1016/j.ebiom.2019.11.031 |
| [18] |
Wu Z, Han X, Tan G, et al. Dioscin Inhibited Glycolysis and Induced Cell Apoptosis in Colorectal Cancer via Promoting c-myc Ubiquitination and Subsequent Hexokinase-2 Suppression[J]. Onco Targets Ther, 2020, 13: 31-44. DOI:10.2147/OTT.S224062 |
| [19] |
Yu X, Wang R, Zhang Y, et al. Skp2-mediated ubiquitination and mitochondrial localization of Akt drive tumor growth and chemoresistance to cisplatin[J]. Oncogene, 2019, 38(50): 7457-7472. DOI:10.1038/s41388-019-0955-7 |
| [20] |
Chan CH, Li CF, Yang WL, et al. The Skp2-SCF E3 ligase regulates Akt ubiquitination, glycolysis, herceptin sensitivity, and tumorigenesis[J]. Cell, 2012, 149(5): 1098-1111. DOI:10.1016/j.cell.2012.02.065 |
| [21] |
Fan Y, Wang J, Xu Y, et al. Anti-Warburg effect by targeting HRD1-PFKP pathway may inhibit breast cancer progression[J]. Cell Commun Signal, 2021, 19(1): 18. DOI:10.1186/s12964-020-00679-7 |
| [22] |
Cilenti L, Di Gregorio J, Ambivero CT, et al. Mitochondrial MUL1 E3 ubiquitin ligase regulates Hypoxia Inducible Factor (HIF-1α) and metabolic reprogramming by modulating the UBXN7 cofactor protein[J]. Sci Rep, 2020, 10(1): 1609. DOI:10.1038/s41598-020-58484-8 |
| [23] |
Li J, Cheng D, Zhu M, et al. OTUB2 stabilizes U2AF2 to promote the Warburg effect and tumorigenesis via the AKT/mTOR signaling pathway in non-small cell lung cancer[J]. Theranostics, 2019, 9(1): 179-195. DOI:10.7150/thno.29545 |
| [24] |
Wu XT, Wang YH, Cai XY, et al. RNF115 promotes lung adenocarcinoma through Wnt/β-catenin pathway activation by mediating APC ubiquitination[J]. Cancer Metab, 2021, 9(1): 7. DOI:10.1186/s40170-021-00243-y |
| [25] |
He R, Liu H. TRIM59 knockdown blocks cisplatin resistance in A549/DDP cells through regulating PTEN/AKT/HK2[J]. Gene, 2020, 747: 144553. DOI:10.1016/j.gene.2020.144553 |
| [26] |
Ling S, Shan Q, Zhan Q, et al. USP22 promotes hypoxia-induced hepatocellular carcinoma stemness by a HIF1α/USP22 positive feedback loop upon TP53 inactivation[J]. Gut, 2020, 69(7): 1322-1334. DOI:10.1136/gutjnl-2019-319616 |
| [27] |
Yu S, Zang W, Qiu Y, et al. Deubiquitinase OTUB2 exacerbates the progression of colorectal cancer by promoting PKM2 activity and glycolysis[J]. Oncogene, 2022, 41(1): 46-56. DOI:10.1038/s41388-021-02071-2 |
| [28] |
Fang Y, Shen ZY, Zhan YZ, et al. CD36 inhibits β-catenin/c-myc-mediated glycolysis through ubiquitination of GPC4 to repress colorectal tumorigenesis[J]. Nat Commun, 2019, 10(1): 3981. DOI:10.1038/s41467-019-11662-3 |
| [29] |
Li Y, Yang D, Tian N, et al. The ubiquitination ligase SMURF2 reduces aerobic glycolysis and colorectal cancer cell proliferation by promoting ChREBP ubiquitination and degradation[J]. J Biol Chem, 2019, 294(40): 14745-14756. DOI:10.1074/jbc.RA119.007508 |
| [30] |
Tang J, Yan T, Bao Y, et al. LncRNA GLCC1 promotes colorectal carcinogenesis and glucose metabolism by stabilizing c-Myc[J]. Nat Commun, 2019, 10(1): 3499. DOI:10.1038/s41467-019-11447-8 |
| [31] |
Li L, Yu Y, Zhang Z, et al. TRIM47 accelerates aerobic glycolysis and tumor progression through regulating ubiquitination of FBP1 in pancreatic cancer[J]. Pharmacol Res, 2021, 166: 105429. DOI:10.1016/j.phrs.2021.105429 |
| [32] |
Chen L, Yuan R, Wen C, et al. E3 ubiquitin ligase UBR5 promotes pancreatic cancer growth and aerobic glycolysis by downregulating FBP1 via destabilization of C/EBPα[J]. Oncogene, 2021, 40(2): 262-276. DOI:10.1038/s41388-020-01527-1 |
| [33] |
Xia Y, Yang W, Fa M, et al. RNF8 mediates histone H3 ubiquitylation and promotes glycolysis and tumorigenesis[J]. J Exp Med, 2017, 214(6): 1843-1855. DOI:10.1084/jem.20170015 |
| [34] |
Hu Q, Qin Y, Zhang B, et al. FBW7 increases the chemosensitivity of pancreatic cancer cells to gemcitabine through upregulation of ENT1[J]. Oncol Rep, 2017, 38(4): 2069-2077. DOI:10.3892/or.2017.5856 |
| [35] |
Liu Q, Wang L, Wang Z, et al. GRIM-19 opposes reprogramming of glioblastoma cell metabolism via HIF1α destabilization[J]. Carcinogenesis, 2013, 34(8): 1728-1736. DOI:10.1093/carcin/bgt125 |
| [36] |
Yang W, Xia Y, Cao Y, et al. EGFR-induced and PKCε monoubiquitylation-dependent NF-κB activation upregulates PKM2 expression and promotes tumorigenesis[J]. Mol Cell, 2012, 48(5): 771-784. DOI:10.1016/j.molcel.2012.09.028 |
| [37] |
Liu C, Zhang Y, She X, et al. A cytoplasmic long noncoding RNA LINC00470 as a new AKT activator to mediate glioblastoma cell autophagy[J]. J Hematol Oncol, 2018, 11(1): 77. DOI:10.1186/s13045-018-0619-z |
| [38] |
Dong B, Gao Y, Kang X, et al. SENP1 promotes proliferation of clear cell renal cell carcinoma through activation of glycolysis[J]. Oncotarget, 2016, 7(49): 80435-80449. DOI:10.18632/oncotarget.12606 |
| [39] |
Lee HJ, Li CF, Ruan D, et al. Non-proteolytic ubiquitination of Hexokinase 2 by HectH9 controls tumor metabolism and cancer stem cell expansion[J]. Nat Commun, 2019, 10(1): 2625. DOI:10.1038/s41467-019-10374-y |
| [40] |
Deng X, Deng J, Yi X, et al. Ubiquitin-like protein FAT10 promotes osteosarcoma glycolysis and growth by upregulating PFKFB3 via stabilization of EGFR[J]. Am J Cancer Res, 2020, 10(7): 2066-2082. |
| [41] |
Tong X, Mu P, Zhang Y, et al. TRIM59, amplified in ovarian cancer, promotes tumorigenesis through the MKP3/ERK pathway[J]. J Cell Physiol, 2020, 235(11): 8236-8245. DOI:10.1002/jcp.29478 |
| [42] |
Lee HJ, He J, Chan CH. HectH9 hijacks glucose metabolism to fuel tumor growth[J]. Mol Cell Oncol, 2019, 6(5): e1644599. DOI:10.1080/23723556.2019.1644599 |
| [43] |
Deng L, Meng T, Chen L, et al. The role of ubiquitination in tumorigenesis and targeted drug discovery[J]. Signal Transduct Target Ther, 2020, 5(1): 11. |
 2022, Vol. 49
2022, Vol. 49


