文章信息
- Pin1对内质网应激下肝癌HepG2细胞增殖和凋亡的影响
- Effects of Pin1 on Proliferation and Apoptosis of HepG2 Cells Under Endoplasmic Reticulum Stress
- 肿瘤防治研究, 2022, 49(6): 575-580
- Cancer Research on Prevention and Treatment, 2022, 49(6): 575-580
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2022.21.1097
- 收稿日期: 2021-09-26
- 修回日期: 2022-02-22
2. 350122 福州,福建省癌症和神经退行性疾病转化研究重点实验室;
3. 350122 福州,福建医科大学公共技术中心
2. Fujian Key Laboratory for Translational Research in Cancer and Neurodegenerative Diseases, Fuzhou 350122, China;
3. Public Technology Service Center, Fujian Medical University, Fuzhou 350122, China
内质网应激(endoplasmic reticulum stress, ERS)是细胞受到钙稳态失衡、能量缺失、氧化还原环境改变、局部缺血、病毒感染等因素的影响,导致错误折叠或未折叠蛋白质在内质网腔中堆积,细胞所产生的应激反应,是细胞的自我保护机制。细胞发生ERS时,未折叠蛋白信号(unfold protein response, UPR)通路被激活,减少蛋白质翻译,促进蛋白质恢复正确构象,使细胞恢复稳态[1];但过强或者是长时间的ERS,UPR信号通路则促发CHOP凋亡信号通路,诱导细胞死亡[2]。研究表明,肿瘤细胞较快的生长速度和血液供应不足,使肿瘤细胞处于低氧、低pH、能量缺乏的微环境中,导致错误折叠蛋白在内质网腔中积累,最终引起ERS[3-4]。ERS介导的凋亡途径与多种肿瘤的发生发展密切相关,通过诱导ATF6、CHOP等基因表达可以促进肿瘤细胞凋亡[5-6],ERS介导的细胞凋亡是肿瘤治疗的潜在机制。
肝细胞癌(hepatocellular carcinoma, HCC)占原发性肝癌的主要病理类型。世界卫生组织估计,2030年将有超过100万患者死于肝癌[7-8]。凋亡抵制在HCC的发生发展过程中发挥重要作用,也是HCC对化疗药物产生抗药性的主要原因[9-10]。Pin1是一种肽基脯氨酰胺顺反异构酶(peptidyl-prolyl cis/trans isomerase, PPIase),可特异性结合并催化磷酸化的丝氨酸/苏氨酸-脯氨酸基序(pSer/Thr-Pro motif)发生顺反异构,改变靶蛋白的活性、稳定性或亚细胞定位[11]。Pin1在包括HCC在内的多种肿瘤组织中高表达,可以调节多个靶标分子的活性,参与各类细胞应激应答、调控细胞增殖和凋亡[12-13]。有研究发现在人结直肠癌细胞HCT116发生ERS时,Pin1表达量减少,细胞凋亡数量增加[14];研究表明HepG2细胞中Pin1异构酶活性比其他肝癌细胞株高[15],ERS状态下HepG2细胞中Pin1的表达情况和作用尚不清楚,因此本研究利用ERS诱导剂——衣霉素(tunicamycin, TM)诱导HepG2细胞产生ERS,检测Pin1蛋白水平变化,探讨Pin1在ERS状态下对HepG2细胞增殖和凋亡的影响,为特异性提高ERS介导的细胞凋亡敏感度作为肝癌治疗策略提供新思路。
1 材料与方法 1.1 材料 1.1.1 主要试剂衣霉素(TM)、全反式维甲酸(ATRA)购自美国Sigma公司,CCK-8试剂盒、Actin抗体(HC201-02)购自北京全式金生物技术有限公司,Bip抗体(11587-1-AP)购自武汉三鹰生物技术有限公司,Pin1抗体(#3722)购自美国Cell Signaling Technology公司,BCA蛋白浓度测定试剂盒购自上海碧云天生物技术研究所,Annexin V FITC细胞凋亡检测试剂盒购自美国BD公司,DMEM、PBS、胰酶购自美国Hyclone公司,胎牛血清购自美国Gibco公司。
1.1.2 细胞系人正常肝细胞THLE3和人肝癌细胞HepG2购自中国科学院细胞库。
1.2 实验方法 1.2.1 细胞培养HepG2细胞、THLE3细胞采用含10%胎牛血清的DMEM培养基、在37℃、5%CO2饱和湿度的培养箱中培养,1~2 d换液一次,取对数生长期细胞进行后续实验。
1.2.2 细胞增殖检测实验分组:(1)THLE3细胞TM组:设置0(只加DMSO)、1、2、4、6、8 μg/ml六个TM浓度;(2)HepG2细胞TM组:六个TM浓度同组(1);(3)HepG2细胞TM+ATRA组:在组(2)的六个TM浓度上分别加25 μmol/L ATRA。实验步骤:取对数生长期细胞,经胰酶消化后,按5×103个细胞每孔接种于96孔板中,每个浓度设置3个复孔,培养箱培养12 h后,加入指定浓度的TM或ATRA,再培养48 h后,在每孔200 μl培养基中加入20 μl CCK-8试剂,37℃孵育1 h,用酶标仪测定450 nm处的吸光值(A)。细胞增殖抑制率
实验分组与细胞增殖检测相同,分别为:(1)THLE3细胞TM组;(2)HepG2细胞TM组;(3)HepG2细胞TM+ATRA组。实验步骤:取对数生长期细胞,按(1.5~2)×105个细胞每孔接种于6孔板中,培养箱培养12 h后,加入指定浓度的TM或ATRA,继续培养48 h后,用RIPA细胞裂解液提取蛋白,BCA试剂盒进行蛋白定量,蛋白样本与上样缓冲液充分混匀后,95℃金属浴10 min。进行聚丙烯凝胶电泳(浓缩胶5%,分离胶10%),分离蛋白后用湿转法转印至PVDF膜上,5%牛血清白蛋白封闭液中封闭1 h,一抗室温孵育3 h,TBST洗膜3次,二抗室温孵育1 h,TBST洗膜3次,采用ECL化学发光。采用Image J软件进行蛋白质相对定量分析。
1.2.4 细胞凋亡检测实验组:4 μg/ml TM作用于THLE3细胞,4 μg/ml TM、25 μmol/L ATRA、4 μg/ml TM+25 μmol/L ATRA分别作用于HepG2细胞,以DMSO处理的细胞作为对照组。实验步骤:取对数生长期细胞,按3×105个细胞每孔接种于6孔板,12 h后进行加药处理,48 h后收集加药实验组细胞和对照组细胞,用结合缓冲液重悬细胞进行计数,取2×105个细胞重悬于100 μl结合缓冲液中,加入5 μl FITC Annexin V和5 μl PI染料,轻柔混匀,室温避光染色15 min后,每管加入400 μl结合缓冲液,混匀后上流式细胞仪分析细胞凋亡率。
1.3 统计学方法采用Graphpad Prism 8统计软件进行分析,所有数据以( x±s )表示,两组间数据采用双尾非配对t检验,多组间采用单因素方差分析,检验水准为α=0.05。
2 结果 2.1 ERS状态下Pin1蛋白水平变化Western blot结果显示,随着TM浓度的升高,THLE3和HepG2细胞内ERS标志物Bip蛋白表达水平增高,说明细胞发生ERS。与DMSO对照组比较,THLE3细胞发生ERS后,Pin1蛋白水平逐渐减少,差异有统计学意义(均P=0.000),见图 1A;而HepG2细胞中Pin1蛋白表达差异无统计学意义(均P > 0.05),见图 1B。
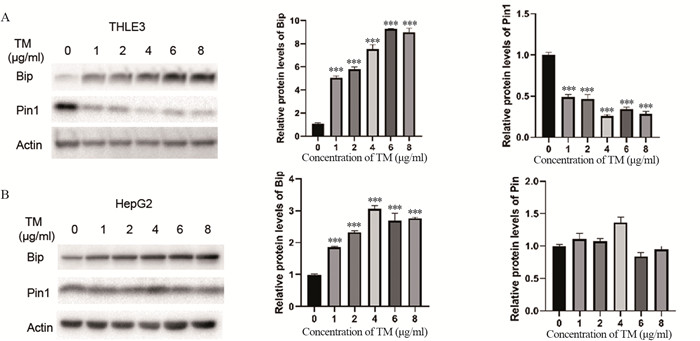
|
| TM: tunicamycin; ***: P<0.001, compared with DMSO (0 μg/ml TM) group. 图 1 Western blot检测THLE3(A)和HepG2(B)细胞发生ERS后Bip和Pin1蛋白的表达情况 Figure 1 Expression of Bip and Pin1 proteins in THLE3 cells(A) and HepG2 cells(B) under endoplasmic reticulum stress (ERS) detected by Western blot |
CCK-8检测结果显示,与HepG2 TM组相比,THLE3 TM组细胞增殖被明显抑制,差异有统计学意义(均P=0.000),见图 2。
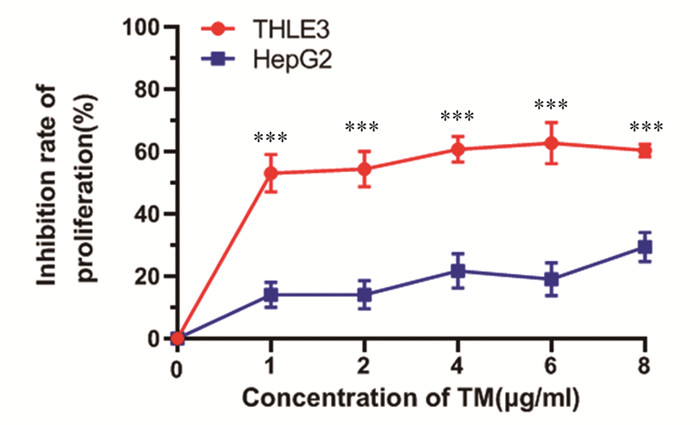
|
| ***: P<0.001, compared with HepG2 cells. 图 2 THLE3和HepG2细胞ERS后细胞的增殖变化 Figure 2 Inhibitory effect of ERS on THLE3 and HepG2 cells proliferation |
Western blot检测显示,TM组细胞Bip蛋白水平上调,说明细胞发生ERS;HepG2细胞Pin1的本底水平高于THLE3,差异有统计学意义(P=0.000),见图 3A;与DMSO组相比,THLE3 TM组细胞中Pin1的蛋白水平显著减少(P=0.000),而HepG2 TM组细胞中的Pin1表达不受影响,见图 3A。流式细胞术结果显示,与THLE3细胞DMSO组((3.57±0.31)%)相比,TM组的细胞凋亡率((22.25±0.78)%)升高,差异有统计学意义(P=0.001),见图 3B、C、F;HepG2细胞DMSO组和TM组的凋亡率分别为(5.10±1.00)%和(7.36±0.11)%,两组比较差异无统计学意义(P=0.086),见图 3D、E、F。表明ERS诱导剂TM会促进正常肝细胞的凋亡,而不能促进HepG2细胞凋亡,Pin1蛋白可能在其中发挥重要作用。
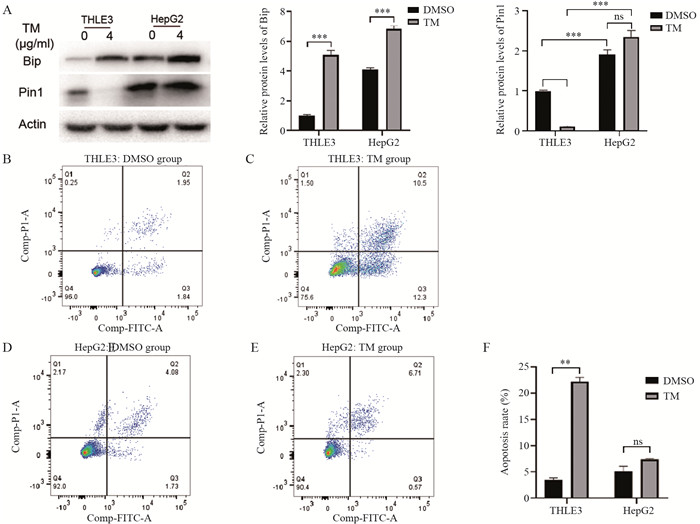
|
| A: Western blot assay; B: THLE3 DMSO group; C: THLE3 TM group; D: HepG2 DMSO group; E: HepG2 TM group; F: statistical analysis of apoptosis rate; ns: no significance; **: P<0.01. 图 3 THLE3和HepG2细胞ERS后细胞凋亡情况 Figure 3 Apoptosis of THLE3 cells and HepG2 cells under ERS |
Western blot结果显示,TM和ATRA的共同作用下,HepG2细胞中ERS标志物Bip蛋白水平随着TM浓度的升高而增加,说明细胞发生ERS;Pin1蛋白水平随着TM浓度的增加而减少,除1 μg/ml TM组外,其他TM浓度组与0 μg/ml TM组比较,差异均有统计学意义(均P < 0.01),见图 4。

|
| ns: no significance; **: P<0.01, ***: P<0.001, compared with 0 μg/ml TM group. 图 4 ATRA对ERS状态下HepG2细胞中Pin1蛋白表达的影响 Figure 4 Effect of ATRA on expression of Pin1 protein in HepG2 cells under ERS |
CCK-8实验结果显示,与TM组相比,TM+ATRA组细胞增殖抑制率明显升高,差异有统计学意义(均P < 0.01),见图 5。提示降低Pin1的蛋白水平,可以增加ERS对HepG2细胞增殖的抑制能力。
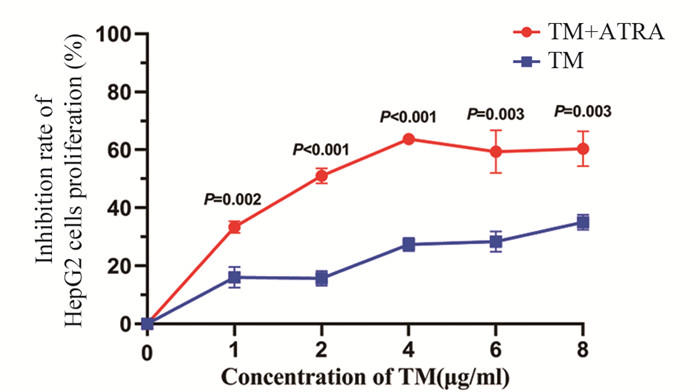
|
| 图 5 ATRA对ERS状态下HepG2细胞增殖能力的影响 Figure 5 Effect of ATRA on proliferation of HepG2 cells under ERS |
流式细胞术结果显示,与DMSO组((5.10±1.00)%)相比,HepG2细胞TM组的细胞凋亡率((7.36±0.11)%)有所升高,但差异无统计学意义(P=0.086);ATRA组((10.03±0.49)%)和TM+ATRA组((23.70±0.75)%)的细胞凋亡率均显著升高,差异有统计学意义(PATRA组=0.024, PTM+ATRA组=0.002),见图 6。表明抑制Pin1蛋白,可提高ERS诱导HepG2细胞凋亡的作用。
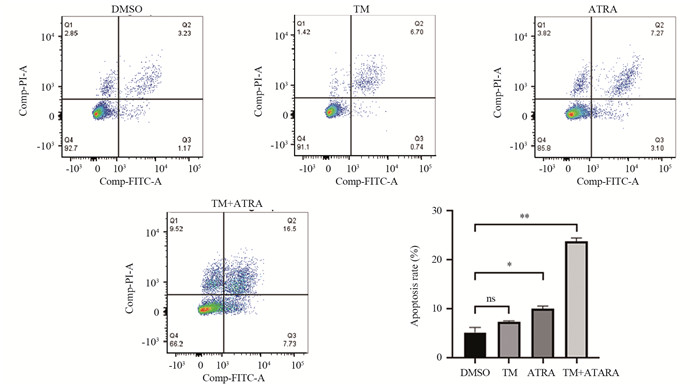
|
| ns: no significance; *: P<0.05;**: P<0.01. 图 6 ATRA对ERS下HepG2细胞凋亡的影响 Figure 6 Effect of ATRA on apoptosis of HepG2 cells under ERS |
ERS是机体的自我保护机制,细胞通过UPR信号通路恢复内质网功能,维持细胞稳态,促进细胞存活;当细胞过度损伤,无法恢复正常功能,ERS激活CHOP/GADD153细胞凋亡信号通路,清除受损细胞,维护机体生理平衡[16]。通过诱导肿瘤细胞发生ERS介导的细胞凋亡是一种新的肿瘤治疗策略,但有研究表明,即使给予ERS诱导剂,肿瘤细胞的凋亡率并没有明显增加,说明肿瘤细胞可以抵制ERS介导的细胞凋亡[17]。本研究用ERS诱导剂TM作用于正常肝细胞THLE3和肝癌细胞HepG2,结果显示正常肝细胞发生ERS后,细胞增殖抑制率和细胞凋亡率显著增加,而HepG2细胞中没有明显变化。
HCC是常见的恶性肿瘤,具有发生隐匿、发展迅速、恶性程度高等特点,多数患者确诊时已到了中晚期,错过了手术的最佳时机,因此化疗是主要的治疗方法,但由于存在化疗抗药的情况,其治疗效果并不理想[18]。凋亡抵制与肿瘤的发生发展密切相关,也是HCC对化疗药物产生抗药性的主要原因[19]。研究HCC凋亡抵抗的原因和调控机制,对特异性提高细胞的凋亡敏感度,增强治疗效果具有重要意义。既往研究表明,过表达Pin1蛋白可以保护HCT116细胞免受ERS诱导的细胞凋亡[14];而与正常细胞相比,HepG2细胞中Pin1表达较高,且具有较强的异构酶活性[15]。那么Pin1在HepG2细胞中是否也起到了抵抗ERS所诱导的细胞凋亡的作用?本研究结果显示,与正常肝细胞相比,HepG2细胞发生ERS后,Pin1蛋白仍然维持在一定水平,且细胞增殖未受明显影响。但在加入Pin1抑制剂ATRA后,细胞的增殖抑制率和凋亡率明显增加。Jeong等研究报道表明,ERS状态下人结直肠癌细胞通过p53抑制Pin1的表达,从而促进细胞凋亡[14],然而ERS状态下HepG2中Pin1的表达调控及其蛋白稳定性调控还需进一步探讨;Bae等报道与Huh7、HLE等肝癌细胞系相比,HepG2细胞中p53是野生型的,Pin1蛋白表达相对较少,但异构酶活性较高[15],这些差异是否会影响肝癌细胞应对ERS介导的细胞凋亡,还需要进一步实验。
综上所述,在HepG2细胞中Pin1蛋白可以抵制ERS诱导的细胞凋亡,Pin1有可能成为提高ERS介导的凋亡敏感度的潜在靶点。联合ERS诱导剂和Pin1抑制剂是否能有效的治疗肝癌,还需进一步在更多的肝癌细胞株以及肿瘤小鼠模型中开展实验。
作者贡献:
江铭婷:实验设计及实施、论文撰写
黄晶:实验实施
郑淑萍:数据分析
| [1] |
Almanza A, Carlesso A, Chintha C, et al. Endoplasmic reticulum stress signalling- from basic mechanisms to clinical applications[J]. FEBS J, 2019, 286(2): 241-278. DOI:10.1111/febs.14608 |
| [2] |
Hu H, Tian M, Ding C, et al. The C/EBP Homologous Protein (CHOP) Transcription Factor Functions in Endoplasmic Reticulum Stress-Induced Apoptosis and Microbial Infection[J]. Front Immunol, 2019, 9: 3083. DOI:10.3389/fimmu.2018.03083 |
| [3] |
Chipurupalli S, Kannan E, Tergaonkar V, et al. Hypoxia Induced ER Stress Response as an Adaptive Mechanism in Cancer[J]. Int J Mol Sci, 2019, 20(3): 749. DOI:10.3390/ijms20030749 |
| [4] |
Oakes SA. Endoplasmic Reticulum Stress Signaling in Cancer Cells[J]. Am J Pathol, 2020, 190(5): 934-946. DOI:10.1016/j.ajpath.2020.01.010 |
| [5] |
Sisinni L, Pietrafesa M, Lepore S, et al. Endoplasmic Reticulum Stress and Unfolded Protein Response in Breast Cancer: The Balance between Apoptosis and Autophagy and Its Role in Drug Resistance[J]. Int J Mol Sci, 2019, 20(4): 857. DOI:10.3390/ijms20040857 |
| [6] |
Siwecka N, Rozpedek W, Pytel D, et al. Dual role of Endoplasmic Reticulum Stress-Mediated Unfolded Protein Response Signaling Pathway in Carcinogenesis[J]. Int J Mol Sci, 2019, 20(18): 4354. DOI:10.3390/ijms20184354 |
| [7] |
Llovet JM, Kelley RK, Villanueva A, et al. Hepatocellular carcinoma[J]. Nat Rev Dis Primers, 2021, 7(1): 7. DOI:10.1038/s41572-021-00245-6 |
| [8] |
Villanueva A. Hepatocellular Carcinoma[J]. N Engl J Med, 2019, 380(15): 1450-1462. DOI:10.1056/NEJMra1713263 |
| [9] |
Fabregat I. Dysregulation of apoptosis in hepatocellular carcinoma cells[J]. World J Gastroenterol, 2009, 15(5): 513-520. DOI:10.3748/wjg.15.513 |
| [10] |
Wu XZ. New strategy of antiangiogenic therapy for hepatocellular carcinoma[J]. Neoplasma, 2008, 55(6): 472-481. |
| [11] |
Yu JH, Im CY, Min SH. Function of PIN1 in Cancer Development and Its Inhibitors as Cancer Therapeutics[J]. Front Cell Dev Biol, 2020, 8: 120. DOI:10.3389/fcell.2020.00120 |
| [12] |
Pu W, Zheng Y, Peng Y. Prolyl Isomerase Pin1 in Human Cancer: Function, Mechanism, and Significance[J]. Front Cell Dev Biol, 2020, 8: 168. DOI:10.3389/fcell.2020.00168 |
| [13] |
Nakatsu Y, Matsunaga Y, Ueda K, et al. Development of Pin1 Inhibitors and their Potential as Therapeutic Agents[J]. Curr Med Chem, 2020, 27(20): 3314-3329. DOI:10.2174/0929867325666181105120911 |
| [14] |
Jeong K, Kim SJ, Oh Y, et al. p53 negatively regulates Pin1 expression under ER stress[J]. Biochem Biophys Res Commun, 2014, 454(4): 518-523. DOI:10.1016/j.bbrc.2014.10.101 |
| [15] |
Bae JS, Noh SJ, Kim KM, et al. PIN1 in hepatocellular carcinoma is associated with TP53 gene status[J]. Oncol Rep, 2016, 36(4): 2405-2411. DOI:10.3892/or.2016.5001 |
| [16] |
Lukas J, Pospech J, Oppermann C, et al. Role of endoplasmic reticulum stress and protein misfolding in disorders of the liver and pancreas[J]. Adv Med Sci, 2019, 64(2): 315-323. DOI:10.1016/j.advms.2019.03.004 |
| [17] |
Zhang LJ, Chen S, Wu P, et al. Inhibition of MEK blocks GRP78 up-regulation and enhances apoptosis induced by ER stress in gastric cancer cells[J]. Cancer Lett, 2009, 274(1): 40-46. DOI:10.1016/j.canlet.2008.08.030 |
| [18] |
Rampone B, Schiavone B, Martino A, et al. Current management strategy of hepatocellular carcinoma[J]. World J Gastroenterol, 2009, 15(26): 3210-3216. DOI:10.3748/wjg.15.3210 |
| [19] |
Bukowski K, Kciuk M, Kontek R. Mechanisms of Multidrug Resistance in Cancer Chemotherapy[J]. Int J Mol Sci, 2020, 21(9): 3233. DOI:10.3390/ijms21093233 |
 2022, Vol. 49
2022, Vol. 49
