文章信息
- 中国食管癌病因学、筛查及早期诊断研究进展
- Research Progress of Etiology, Screening and Early Diagnosis of Esophageal Cancer in China
- 肿瘤防治研究, 2022, 49(3): 169-175
- Cancer Research on Prevention and Treatment, 2022, 49(3): 169-175
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2022.21.1033
- 收稿日期: 2021-09-10
- 修回日期: 2022-01-06
2. 310058 杭州,浙江大学公共卫生学院流行病与卫生统计学系
2. Department of Epidemiology and Biostatistics, School of Public Health, Zhejiang University, Hangzhou 310058, China
2020年全球约有60万食管癌新发病例和54万例食管癌死亡病例,分别位于恶性肿瘤发病和死亡顺位的第7位和第6位。其中,79.4%的新发病例和79.8%的死亡病例发生在亚洲,其次是欧洲(新发病例8.8%,死亡病例8.4%)和非洲(新发病例4.6%,死亡病例4.8%)[1]。食管癌的发病率和死亡率也受到地理因素的影响,例如在伊朗北部地区、俄罗斯南部某些地区和中国北部的“亚洲食管癌带”,食管癌的发病率超过100/10万[2]。据统计,全世界的食管癌患者中,约有半数都在我国[3]。根据我国肿瘤登记数据,2015年共有24.6万食管癌新发病例和18.8万死亡病例,分别位于我国恶性肿瘤发病和死亡顺位的第6位和第4位[4]。本研究回顾了我国食管癌流行病学、危险因素、筛查与早期诊断研究,以期为我国食管癌的预防及早诊早治提供参考。
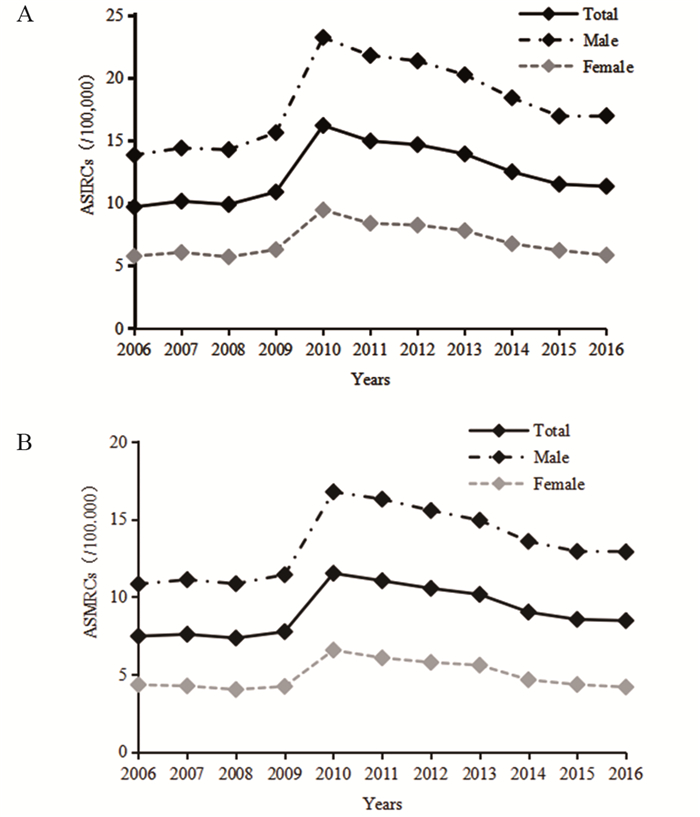
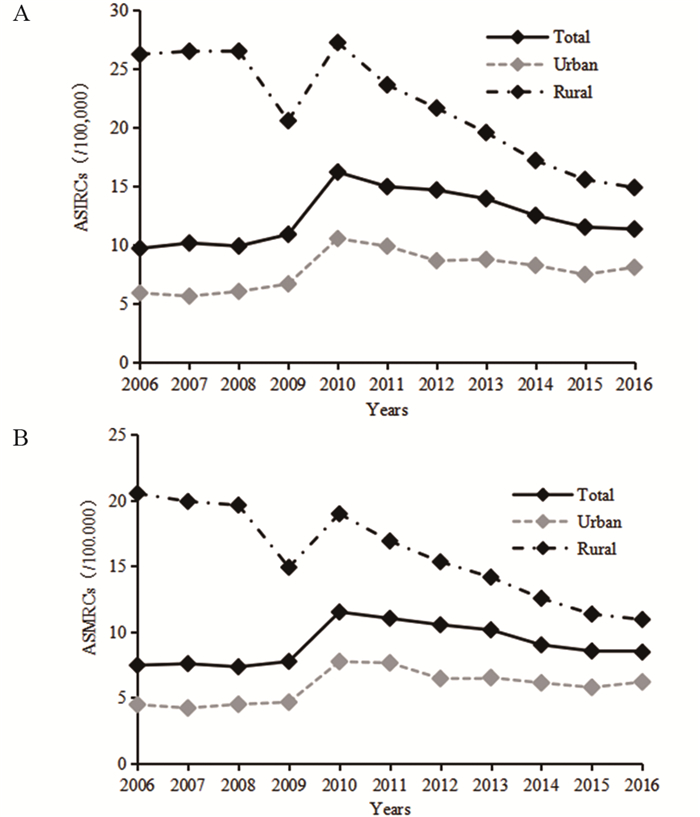
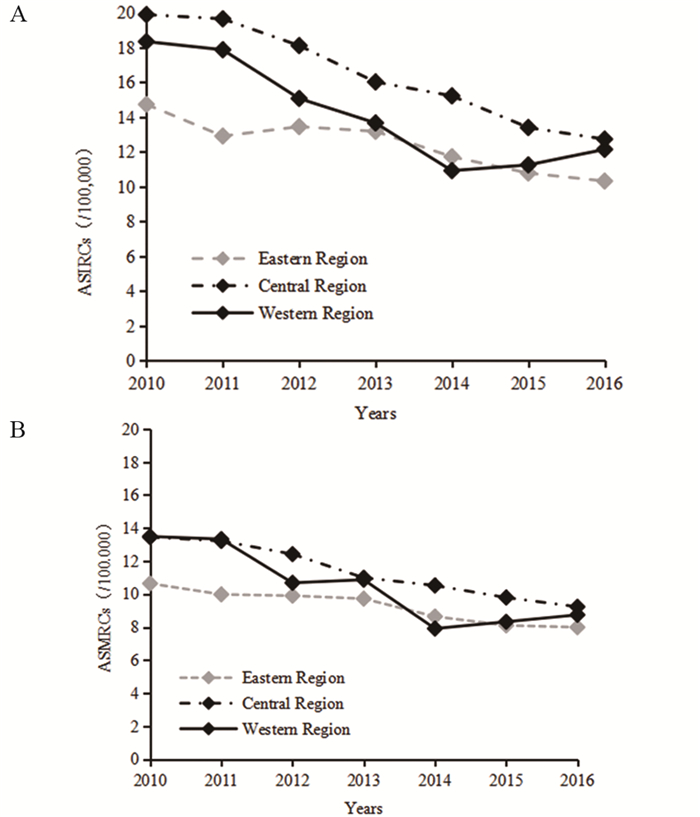
1 我国食管癌流行特征的变化趋势根据2006—2016年发布的《中国肿瘤登记年报》数据绘制食管癌发病和死亡中标率曲线,可以看出,2010年之前,食管癌发病和死亡总体呈上升趋势,发病率由2006年的9.68/10万上升至2010年的16.19/10万,死亡率在2006—2009年波动不大(7.34/10万至7.75/10万),于2010年显著上升至11.51/10万;2010年后发病率和死亡率呈下降趋势,发病率下降至2016年的11.33/10万,死亡率下降至8.46/10万,发病率和死亡率均存在着男性高于女性、农村高于城市的差异,见图 1~2。自2010年以来,我国肿瘤登记数据增加报道了不同地区癌症的流行特征,从2010—2016年我国东部、中部、西部地区的食管癌发病率和死亡率变化情况看,我国中部地区的食管癌发病率和死亡率基本高于东部和西部地区,见图 3。我国食管癌高发省份为河北、河南、山西、福建等,以河南林州(原林县)、河北磁县、河北涉县、四川盐亭尤甚。其中大部分省份位于中部地区,而高发区特有的地理环境因素(如土壤中微量元素缺乏)以及当地居民不良生活习惯等,可能导致食管癌疾病地区差异。
|
| ASIRCs: age-standardized incidence rates by Chinese standard population; ASMRCs: age-standardized mortality rates by Chinese standard population. 图 1 2006—2016年我国肿瘤登记地区不同性别人群食管癌发病率(A)及死亡率(B) (/10万) Figure 1 Esophageal cancer incidence(A) and mortality(B) rates by gender in China registry regions, 2006-2016 (/100 000) |
|
| 图 2 2006—2016年我国肿瘤登记地区城市和农村人群食管癌发病率(A)及死亡率(B) (/10万) Figure 2 Esophageal cancer incidence(A) and mortality(B) rates by urban and rural areas in China registry regions, 2006-2016 (/100 000) |
|
| 图 3 2010—2016年我国东部、中部、西部肿瘤登记地区食管癌发病率(A)及死亡率(B) (/10万) Figure 3 Esophageal cancer incidence(A) and mortality(B) rates by eastern, central and western regions in China registry regions, 2010-2016 (/100 000) |
国际癌症研究机构将吸烟与饮用酒精饮料归类为食管癌的病因[5]。2019年发表在Nature上的一项研究,检测了139例患者的食管组织样本以调查基因是否发生变异,结果发现,检测到的突变数目随个体年龄增加而增加,并且饮酒和吸烟作为危险因素显著增加了检测到的突变数目,表明吸烟、饮酒会从基因水平影响食管癌的进展[6]。亚硝胺(TSNA)和多环芳烃(PAH)被认为是烟草中的主要致癌物质。有研究显示,与美国吸烟者相比,中国吸烟者接触的TSNA较少,但同时,尿液中N'硝基旋烟碱的浓度与食管鳞癌的风险有密切联系,推断其可能是吸烟者的致病因素[7]。Chang等对94例中国食管癌患者进行了DNA和RNA的全基因组测序,并鉴定了6个突变标记(E1-E6),其中E4标记在ESCC中是独特的,与酒精摄入和酒精代谢酶的遗传变异有关[8]。吸烟与饮酒可能在食管癌发生过程中存在相互作用,但目前大型队列研究尚未找到这方面的证据[9]。值得注意的是,一项Meta分析发现:亚洲人群中吸烟对食管癌的效应比欧洲人群要弱[10],表明可能存在其他重要危险因素,以解释亚洲地区较高的食管癌发病率,未来需要更多的研究了解亚洲地区食管癌高发的原因。
2.2 饮食因素良好的饮食习惯,如食用新鲜水果可以降低食管癌风险,而有限的证据表明,食用加工肉类、热饮热食、食用腌制蔬菜等不良饮食习惯可能增加食管癌风险[11]。我国人群的前瞻性研究也证实了新鲜水果的摄入对食管癌的保护作用[12],但对于加工肉类、烫热饮食等饮食因素与食管癌关系的证据较为有限[2]。随着经济水平的提高,我国食管癌高发区的饮食认知与习惯已发生较大变化。黄桁等研究结果显示,四川盐亭县3个乡镇20岁以上共计937例农村居民中仍有部分居民喜食较硬米饭(14.5%)、高盐蔬菜(17.2%)、温度较高的食物(46.5%)、进食速度较快(32.4%)等不良饮食习惯[13]。张粟等研究显示,河南林县居民食用酸菜、腌菜的频率很小,较二三十年前有很大改善,但食用西兰花等有益食物频率仍较低,烟熏制品的食用频率仍较高[14]。另外一项研究结果发现,盐亭县居民对健康饮食知识的知晓程度均高于另一食管癌低发区,但与低发区相比,盐亭居民仍然存在较多的不良饮食习惯,如喜食腌菜、腌肉和辛辣食品等[15]。2017年一项调查显示,新疆哈萨克族食管癌高发区居民每日平均摄入谷类、薯类、肉类、奶类高于膳食指南建议量,而蛋类、豆类、水果类、鱼虾类食物的摄入量均低于膳食指南建议量[16]。上述研究结果表明,我国食管癌高发地区的防治工作已有明显成效,但当地居民的不良饮食习惯仍然存在,应进一步加强良好饮食习惯与食管癌一级预防的联系,降低食管癌风险。
2.3 营养素缺乏不良饮食习惯最直接的影响就是导致人体内多种营养素和矿物质摄入不均衡,从而导致疾病的发生[17]。我国食管癌高发区因地质环境因素和不良饮食习惯等而存在不同程度的微量营养素缺乏,而在营养缺乏地区,营养素补充剂能够在短期内有效、迅速提高人群体内营养物质含量,降低食管癌的发病率和死亡率。维生素如核黄素以及矿物质如锌、硒、钼等缺乏与食管癌发生的关系已经被许多研究揭示[18]。我国林县营养干预研究的15年随访结果表明,在基线年龄小于55岁的人群中,服用β-胡萝卜素、维生素E和硒复方胶囊可以将食管癌死亡率降低17%[2],但随访30年后,该类营养素补充对食管癌的保护作用不再显著[19]。“八五”期间,在四川盐亭进行的核黄素强化碘盐干预试验10年随访结果显示,试验组的食管癌发病率显著低于对照组,试验组男性食管癌的发病率下降了30.2%,女性下降了35.9%[20]。以上研究结果提示,营养素补充能够降低食管癌风险,但其属于消耗性物质,需要长期持续补充,且越早进行营养素补充带来的效果可能越好。
2.4 感染因素食管癌患者与健康者的食管黏膜菌群存在较大差异,健康者食管的微生物环境中主要有链球菌等革兰氏阳性菌,而具有食管病变和食管癌的患者病变组织中主要存在革兰氏阴性菌。现有食管菌群研究显示,变形菌门、拟杆菌门、放线菌门、厚壁菌门以及梭杆菌门细菌为食管鳞癌的前5种优势菌种[21]。真菌毒素也是长期以来危害人类健康的一类感染因素,其中,WHO将黄曲霉毒素(AFB1)作为一类致癌物,我国一项延安的病例对照研究指出,玉米粉摄入量与血清AFB1- alb加合物水平、食物中AFB1暴露量以及食管癌前病变风险有关[22]。有证据表明,幽门螺杆菌(Helicobacter pylori, HP)、人乳头瘤病毒(human papillomavirus, HPV)等微生物感染可能与巴雷特食管或食管癌的发生存在关联,但相关的发病机制尚不完全清楚。Teng等研究显示,HP感染可以改变食管上皮细胞的miRNA特征,即导致miR-212~3p和miR-361~3p的异常沉默,进而通过调节蛋白CDX2和COX2的表达而使食管发生癌变[23]。然而,Gao等研究未观察到HP感染与食管癌发病风险之间存在关联[24]。Wang等研究发现,在中国、亚洲乃至全世界,HPV感染与食管癌密切相关[25],综合OR值为1.62(95%CI: 1.33~1.98);而我国一项多中心研究分别检测了食管癌高发区患者的食管癌新鲜组织、正常组织、病理蜡块以及血液中HPV感染状况,结果提示HPV感染与食管癌的发生发展无关,以往诸多研究的阳性结果可能由标本采集、试验过程中的污染造成[26]。
2.5 家族史及遗传因素在病因学研究中,家族史研究可以观察环境与遗传因素对疾病发展的共同作用。在我国食管癌高发区,如河南林州、江苏泰安、山西等地进行的研究均发现,食管癌存在家族聚集现象[27]。有研究显示,河南林县上消化道肿瘤家族史阳性受试者的食管癌发病与死亡风险显著高于无家族史者,且在一级亲属患食管癌的受试者中,这种有害效应更加显著[28];在河南滑县进行的一项食管内镜筛查随机对照试验表明,食管癌家族史是食管重度增生及以上病变的独立危险因素[29]。对于多基因遗传性的疾病,常用遗传度来衡量环境与遗传因素对疾病的贡献大小,疾病受遗传因素影响越大,其遗传度越趋近于100%;反之,若疾病受环境因素影响越大,则遗传度趋近于0。有研究表明,我国林州市的遗传度(53.4%)明显高于非食管癌高发区,如上海(35.7%)、西安(48.14%)[28],提示在高发区居民中遗传因素的贡献更大。
食管癌分子流行病学研究证明,致癌物代谢基因、叶酸生物转化基因、细胞周期控制基因的遗传变异和DNA修复基因涉及食管癌的发生或发展[30]。全基因组关联研究时代,食管癌的流行病学研究已经探索了影响细胞增殖或侵袭的信号、表观遗传调控、RNA、蛋白质和通路的基因组变异[31]。目前研究较为成熟的食管癌相关癌基因主要包括:Ras、C-myc、MDM-2等基因,抑癌基因主要包括p53、p16、FHIT、PTEN、NMES等[32-35]。近年来,我国在食管癌基因组研究方面取得了较大突破。Song等利用基因组学、生物信息学、分子生物学、临床病理学理论和技术,结合我国食管鳞癌患者样本和临床信息,发现了包括FAM135B基因在内的8个与食管鳞癌发生相关的重要基因,同时获得了食管鳞癌拷贝数变异的重要数据,发现位于染色体11q13.3-13.4扩增区域的MIR548K参与食管鳞癌的恶性表型形成[36]。Cao等研究发现,表观遗传学介导的非典型WNT/β-catenin/MMP信号通路的激活和YY1/lncRNA ESCCAL-1/核糖体蛋白网络可能为食管鳞癌发病机制[22]。Deng等研究发现相比于高加索食管鳞癌患者,中国等亚裔人种食管鳞癌患者中NFE2L2基因的“胚系突变”明显更高。该研究团队表示,这种NFE2L2基因能保护细胞避免发生氧化损伤,而我国人群摄入维生素等营养物质不足,加之NFE2L2基因“胚系突变”的双重作用,导致食管黏膜更易受损,进而导致食管癌的发病风险增加[37]。我国食管癌多组学研究为揭示食管鳞癌的发病机制、寻找食管鳞癌诊断的分子标志物、确定和研发临床治疗的药物靶点以及制定有效的治疗方案提供了有力的理论和实验依据。
2.6 其他因素其他较明确的食管癌危险因素有社会经济因素、咀嚼槟榔、贲门失迟缓症、Fanconi贫血等。有关社会经济地位等因素与食管癌的关系,我国的研究也提供了有力证据,如有研究发现我国农村地区食管鳞癌、食管腺癌的发病高峰较城市提前10年,且中、晚期病例占比更高[38];一项研究指出中国台湾食管癌与槟榔摄入的剂量-风险关系呈曲线和线性关系,咀嚼槟榔者食管癌的发生风险更大。与不食用槟榔者相比,食用槟榔者第一段食管癌风险更高[39]。然而,目前国内关于贲门失迟缓症及Fanconi贫血与食管癌之间关系的研究仍较少。国际上有待确认的食管癌危险因素还包括生殖因素、萎缩性胃炎和口腔卫生等。我国一项病例对照研究表明,性激素可能在食管癌发生发展中发挥重要作用,且晚育可能增加女性食管癌的发生风险[40];泰兴市一项病例对照研究发现,胃萎缩会增加食管鳞癌的发生风险,且与口腔卫生存在交互作用[41];口腔卫生不良者会出现口腔生理的异常情况,如黏膜白斑。在中国林县食管重度增生人群的队列研究中发现,口腔黏膜白斑可能增加食管鳞状细胞癌的死亡风险,在年轻人群、女性、不喝酒、不吸烟和有癌症家族史的受试者中效应更强[42]。
3 筛查与早期诊断由于在全国范围内开展大规模的食管癌人群筛查并不符合我国国情,因此,提高各级医疗机构食管癌机会性筛查的检出率是现阶段较为可行的策略。目前,我国主要在高发区开展食管癌筛查和早诊早治。2019年版《专家共识》推荐40岁为食管癌筛查起始年龄,75岁或预期寿命小于5年时终止筛查。当符合筛查年龄的人群且具有以下任意一个危险因素者为筛查的目标人群:(1)出生或长期居住于食管癌高发地区;(2)一级亲属有食管癌病史;(3)患有食管癌前疾病或癌前病变;(4)有头颈部肿瘤病史;(5)合并其他食管癌高危因素:热烫饮食、饮酒(≥15 g/d)、吸烟、进食过快、室内空气污染、牙齿缺失等[43]。2016年,我国国家癌症中心联合87家医疗机构/大学和16个高发现场,系统整合人群社区和临床两个层面的食管癌及癌前病变资源,围绕食管癌专病队列标准和规范制定、生物样本库和信息库建立、队列人群终点结局动态随访、食管癌专病队列资源共享四个关键科学问题,发起了“食管癌专病队列”项目。在食管癌病因学研究成果的基础上,专病队列中的“基于高危人群的中国食管癌筛查前瞻性队列研究”也参考了国外大型队列研究设计了危险因素调查问卷,拟通过危险因素调查确定高危人群进行筛查,旨在节约筛查时间和成本[44]。目前该队列研究正在进行中。
我国科研工作者根据多年来高发现场的研究经验,形成了内镜下碘染色及指示性活检筛查方案。自2005年起在农村高发区开展以人群为基础的上消化道癌筛查和早诊早治研究,研究选择全国上消化道癌早诊早治项目开展较早、基础较好、人群稳定且具备肿瘤登记工作随访基础的6个项目点,包括河北磁县、河南林州市、山东肥城市、山西阳城县、四川盐亭县和江苏扬中市,收集人群基本信息和内镜筛查信息,并通过当地医务人员入户主动随访和依靠肿瘤登记系统被动随访两种方式,密切追踪肿瘤发病和死亡信息。2005—2015年食管癌发病和死亡随访数据显示,与没有参加内镜筛查的人群相比,参加筛查和早诊早治人群食管癌发病率和死亡率分别降低20%和37%[45],经过单次上消化道内镜筛查后,包括食管癌、贲门癌、胃癌在内的上消化道癌的发病率可降低23%,病死率降低57%,证实在上消化道癌高发地区,仅通过单次上消化道内镜筛查即可以有效降低发病率和病死率[46]。2019年版《专家共识》,推荐以群体普查与机会性筛查结合的形式进行食管癌筛查,对于食管癌高发地区,推荐筛查的目标人群每5年1次内镜普查,其他地区人群推荐先进行食管癌风险分层初筛[43]。虽然我国包括食管癌在内的上消化道肿瘤筛查和早诊早治项目已经取得了较好效果,但是从全国范围来看,上消化道内镜筛查总体情况仍不容乐观,存在早诊率低、规范化诊疗水平参差不齐、各级医疗机构技术、能力和服务效果差异较大等问题。因此,需要做好提供居民防癌意识、培训基层医务工作人员能力、长期进行筛查与早诊早治工作的质量监督与控制、建立健全的制度等,以全面提升消化道癌早诊率与医疗服务质量[45]。
4 总结目前,我国食管癌高发区已进行了大量的病因学研究来探讨食管癌的潜在危险因素,但我国食管癌主要危险因素和病因尚未完全了解,现有病因学研究尚不能确定哪些因素在食管癌发病机制中占主导地位。食管癌的一级预防可通过消除危险因素如戒烟戒酒、均衡摄入营养素、改善不良的生活方式和饮食习惯来实现。然而对于二级预防,目前没有关于食管癌筛查及早期诊断的国际规范或建议。虽然我国已结合现有食管癌的危险因素和流行特征制定出了高危人群的评估和筛查方案,但是,国内基于大规模全人群进行有组织的筛查是有限的,现有筛查与早诊早治方案是否符合我国国情还有待验证。在过去的几十年间,我国食管癌的疾病负担普遍下降,但因为人口基数大,我国食管癌疾病负担较其他国家相比仍较高。因此,我国仍需结合现有公共卫生资源,总结食管癌防控经验,以期更好地降低食管癌疾病负担。
作者贡献:
杨欢:提纲设计、论文撰写
孙宛怡:引文资料查询、论文修改
王建炳:论文修改
王晓坤、张锦雨:数据信息核对
范金虎:论文审阅
乔友林:论文复审
| [1] |
Sung H, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
Liang H, Fan JH, Qiao YL. Epidemiology, etiology, and prevention of esophageal squamous cell carcinoma in China[J]. Cancer Bio Med, 2017, 14(1): 33-41. DOI:10.20892/j.issn.2095-3941.2016.0093 |
| [3] |
魏文强. 我国食管癌防控的现状与挑战[J]. 中华预防医学杂志, 2019, 53(11): 1081-1083. [Wei WQ. Current status and challenges of prevention and control of esophageal cancer in China[J]. Zhonghua Yu Fang Yi Xue Za Zhi, 2019, 53(11): 1081-1083.] |
| [4] |
Zhang S, Sun K, Zheng R, et al. Cancer incidence and mortality in China, 2015[J]. J Natl Cancer Center, 2021, 1(1): 2-11. DOI:10.1016/j.jncc.2020.12.001 |
| [5] |
International Agency for Research on Cancer. List of Classifications by Cancer Sites with Sufficient or Limited Evidence in Humans[Z]. 2021. https://monographs.iarc.who.int/wp-content/uploads/2019/07/classifications_by_cancer_site.pdf
|
| [6] |
Yokoyama A, Kakiuchi N, Yoshizato T, et al. Age-related remodelling of oesophageal epithelia by mutated cancer drivers[J]. Nature, 2019, 565(7739): 312-317. DOI:10.1038/s41586-018-0811-x |
| [7] |
Yershova K, Yuan JM, Wang R, et al. Tobacco-specific N-nitrosamines and polycyclic aromatic hydrocarbons in cigarettes smoked by the participants of the Shanghai Cohort Study[J]. Int J Cancer, 2016, 139(6): 1261-1269. DOI:10.1002/ijc.30178 |
| [8] |
Chang J, Tan W, Ling Z, et al. Genomic analysis of oesophageal squamous-cell carcinoma identifies alcohol drinking-related mutation signature and genomic alterations[J]. Nat Commun, 2017, 8: 15290. DOI:10.1038/ncomms15290 |
| [9] |
Abnet CC, Arnold M, Wei WQ. Epidemiology of Esophageal Squamous Cell Carcinoma[J]. Gastroenterology, 2018, 154(2): 360-373. DOI:10.1053/j.gastro.2017.08.023 |
| [10] |
Prabhu A, Obi KO, Rubenstein JH. Systematic review with meta-analysis: race-specific effects of alcohol and tobacco on the risk of oesophageal squamous cell carcinoma[J]. Aliment Pharmacol Ther, 2013, 38(10): 1145-1155. DOI:10.1111/apt.12514 |
| [11] |
World Cancer Research Fund/American Institute for Cancer R. Continuous Update Project Expert Report, Diet, Nutrition Physical Activity and Pancreatic[Z]. https://www.wcrf.org/dietandcancer/oesophageal-cancer/
|
| [12] |
梁赫, 王少明, 杨召, 等. 新鲜水果可能降低男性吸烟人群中食管癌的长期死亡风险: 林县营养干预试验30年随访研究[J]. 中国肿瘤, 2017, 26(12): 953-959. [Liang H, Wang SM, Yang Z, et al. Fresh Fruit Intake and Long-term Risk of Esophageal Cancer Among Male Smokers: Finding from the Linxian Nutrition Intervention Trials After 30 Years of Follow Up[J]. Zhongguo Zhong Liu, 2017, 26(12): 953-959. DOI:10.11735/j.issn.1004-0242.2017.12.A006] |
| [13] |
黄桁, 王喻, 姜凯元, 等. 食管癌高发区农村居民饮食状况调查及防治分析[J]. 现代肿瘤医学, 2018, 26(22): 3667-3670. [Huang H, Wang Y, Jiang KY, et al. Survey on dietary of residents in high-incidence area of esophageal cancer and recommendations for prevention and treatment of esophageal cancer[J]. Xian Dai Zhong Liu Yi Xue, 2018, 26(22): 3667-3670. DOI:10.3969/j.issn.1672-4992.2018.22.036] |
| [14] |
张粟, 杨欢, 王国清, 等. 河南省林州市食管鳞癌及癌前病变的影响因素研究[J]. 中国肿瘤, 2020, 29(5): 327-333. [Zhang S, Yang H, Wang GQ, et al. Risk Factors of Esophageal Squamous Cell Carcinoma and Precancerous Lesions in Linzhou, Henan[J]. Zhongguo Zhong Liu, 2020, 29(5): 327-333.] |
| [15] |
Tian D, Mo SJ, Han LK, et al. Investigation of Dietary Factors and Esophageal Cancer Knowledge: Comparison of Rural Residents in High- and Low-incidence Areas[J]. Sci Rep, 2018, 8(1): 4914. DOI:10.1038/s41598-018-23251-3 |
| [16] |
陈艳, 尹钰, 吐尔逊江·买买提明, 等. 新疆哈萨克族食管癌高发区居民膳食状况及一碳单位代谢相关营养素水平调查[J]. 中国公共卫生, 2017, 33(5): 780-782. [Chen Y, Yin Y, Maimaitiming T, et al. Dietary nutrition and nutrients associated with one carbon unit metabolism among Kazakh people in areas with high esophageal cancer incidence in Xinjiang[J]. Zhongguo Gong Gong Wei Sheng, 2017, 33(5): 780-782.] |
| [17] |
Yu E, Malik VS, Hu FB. Cardiovascular Disease Prevention by Diet Modification: JACC Health Promotion Series[J]. J Am Coll Cardiol, 2018, 72(8): 914-926. DOI:10.1016/j.jacc.2018.02.085 |
| [18] |
赵静颖, 纪爱芳, 程亚平. 食管癌的病因学研究进展[J]. 世界最新医学信息文摘, 2021, 21(15): 87-88, 91. [Zhao JY, Ji AF, Cheng YP. Advances in Etiology of Esophageal Cancer[J]. Shi Jie Zui Xin Yi Xue Xin Xi Wen Zhai, 2021, 21(15): 87-88, 91. DOI:10.3969/j.issn.1671-3141.2021.15.032] |
| [19] |
Wang SM, Taylor PR, Fan JH, et al. Effects of Nutrition Intervention on Total and Cancer Mortality: 25-Year Post-trial Follow-up of the 5.25-Year Linxian Nutrition Intervention Trial[J]. J Natl Cancer Inst, 2018, 110(11): 1229-1238. DOI:10.1093/jnci/djy043 |
| [20] |
罗贤懋, 林培中, 刘雨菁, 等. 核黄素预防恶性肿瘤的研究进展[J]. 癌症进展, 2020, 18(4): 325-330. [Luo XM, Lin PZ, Liu YJ, et al. Research progress of riboflavin in cancer prevention[J]. Ai Zheng Jin Zhan, 2020, 18(4): 325-330.] |
| [21] |
刘轲, 崔露琼, 蒋盼盼, 等. 感染与食管癌的研究进展[J]. 食管疾病, 2020, 2(3): 161-164, 205. [Liu K, Cui LQ, Jiang PP, et al. Research Progress in Infection and Esophageal Cancer[J]. Shi Guan Ji Bing, 2020, 2(3): 161-164, 205.] |
| [22] |
Cao W, Lee H, Wu W, et al. Multi-faceted epigenetic dysregulation of gene expression promotes esophageal squamous cell carcinoma[J]. Nat Commun, 2020, 11(1): 3675. DOI:10.1038/s41467-020-17227-z |
| [23] |
Teng G, Dai Y, Chu Y, et al. Helicobacter pylori induces caudal-type homeobox protein 2 and cyclooxygenase 2 expression by modulating microRNAs in esophageal epithelial cells[J]. Cancer Sci, 2018, 109(2): 297-307. DOI:10.1111/cas.13462 |
| [24] |
Gao H, Li L, Zhang C, et al. Systematic Review with Meta-analysis: Association of Helicobacter pylori Infection with Esophageal Cancer[J]. Gastroenterol Res Pract, 2019, 2019: 1953497. |
| [25] |
Wang J, Zhao L, Yan H, et al. A Meta-Analysis and Systematic Review on the Association between Human Papillomavirus (Types 16 and 18) Infection and Esophageal Cancer Worldwide[J]. PLoS One, 2016, 11(7): e0159140. DOI:10.1371/journal.pone.0159140 |
| [26] |
Koshiol J, Wei WQ, Kreimer AR, et al. No role for human papillomavirus in esophageal squamous cell carcinoma in China[J]. Intl J Cancer, 2010, 127(1): 93-100. DOI:10.1002/ijc.25023 |
| [27] |
陈甜甜. 泰兴地区食管癌发病趋势及家族聚集性研究[D]. 山东: 山东大学, 2013. [Chen TT. Research of the Incidence Trend and familial aggregation of esophageal cancer in Taixing city[D]. Shandong: Shandong Da Xue, 2013.]
|
| [28] |
Yang H, Wang JB, Zhang JY, et al. Family History and Risk of Upper Gastrointestinal Cancer in the Linxian General Population[J]. Front Oncol, 2021, 11: 605106. DOI:10.3389/fonc.2021.605106 |
| [29] |
He Z, Liu Z, Liu M, et al. Efficacy of endoscopic screening for esophageal cancer in China (ESECC): design and preliminary results of a population-based randomised controlled trial[J]. Gut, 2019, 68(2): 198-206. DOI:10.1136/gutjnl-2017-315520 |
| [30] |
林东昕, 谭文, 陆士新, 等. 中国食管癌分子流行病学研究[J]. 中华流行病学杂志, 2003, 24(10): 939-943. [Lin DX, Tan W, Lu SX, et al. Molecular Epidemiology Studies of Esophageal Cancer in China[J]. Zhonghua Liu Xing Bing Xue Za Zhi, 2003, 24(10): 939-943. DOI:10.3760/j.issn:0254-6450.2003.10.023] |
| [31] |
Wang AH, Liu Y, Wang B, et al. Epidemiological studies of esophageal cancer in the era of genome-wide association studies[J]. World J Gastrointest Pathophysiol, 2014, 5(3): 335-343. DOI:10.4291/wjgp.v5.i3.335 |
| [32] |
Lin DC, Wang MR, Koeffler HP. Genomic and Epigenomic Aberrations in Esophageal Squamous Cell Carcinoma and Implications for Patients[J]. Gastroenterology, 2018, 154(2): 374-389. DOI:10.1053/j.gastro.2017.06.066 |
| [33] |
Jiang JH, Pi J, Jin H, et al. Oridonin-induced mitochondria-dependent apoptosis in esophageal cancer cells by inhibiting PI3K/AKT/mTOR and Ras/Raf pathways[J]. J Cell Biochem, 2019, 120(3): 3736-3746. DOI:10.1002/jcb.27654 |
| [34] |
Li W, Zhang L, Guo B, et al. Exosomal FMR1-AS1 facilitates maintaining cancer stem-like cell dynamic equilibrium via TLR7/NFκB/c-Myc signaling in female esophageal carcinoma[J]. Mol Cancer, 2019, 18(1): 22. DOI:10.1186/s12943-019-0949-7 |
| [35] |
Pühringer-Oppermann F, Stahl M, Keller G, et al. Lack of prognostic impact of p53 gene mutation and p53 phosphorylation at serine 15 in multimodally treated adenocarcinomas of the gastroesophageal junction[J]. J Cancer Res Clin Oncol, 2006, 132(7): 433-438. DOI:10.1007/s00432-006-0085-9 |
| [36] |
Song Y, Li L, Ou Y, et al. Identification of genomic alterations in oesophageal squamous cell cancer[J]. Nature, 2014, 509(7498): 91-95. DOI:10.1038/nature13176 |
| [37] |
Deng J, Chen H, Zhou D, et al. Comparative genomic analysis of esophageal squamous cell carcinoma between Asian and Caucasian patient populations[J]. Nat Commun, 2017, 8(1): 1533. DOI:10.1038/s41467-017-01730-x |
| [38] |
Fan YJ, Song X, Li JL, et al. Esophageal and gastric cardia cancers on 4238 Chinese patients residing in municipal and rural regions: a histopathological comparison during 24-year period[J]. World J Surg, 2008, 32(9): 1980-1988. DOI:10.1007/s00268-008-9674-x |
| [39] |
Lee CH, Lee KW, Fang FM, et al. The neoplastic impact of tobacco-free betel-quid on the histological type and the anatomical site of aerodigestive tract cancers[J]. Int J Cancer, 2012, 131(5): E733-E743. DOI:10.1002/ijc.27401 |
| [40] |
Chen ZH, Shao JL, Lin JR, et al. Reproductive factors and oesophageal cancer in Chinese women: a case-control study[J]. BMC Gastroenterol, 2011, 11: 49. DOI:10.1186/1471-230X-11-49 |
| [41] |
Ekheden I, Yang X, Chen H, et al. Associations Between Gastric Atrophy and Its Interaction With Poor Oral Health and the Risk for Esophageal Squamous Cell Carcinoma in a High-Risk Region of China: A Population-Based Case-Control Study[J]. Am J Epidemiol, 2020, 189(9): 931-941. DOI:10.1093/aje/kwz283 |
| [42] |
Yang H, Zhang S, Wang J, et al. Oral leukoplakia and the long-term risk of upper gastrointestinal cancer deaths in the Linxian dysplasia population[J]. Thorac Cancer, 2020, 11(10): 2804-2811. DOI:10.1111/1759-7714.13595 |
| [43] |
国家消化内镜专业质控中心, 国家消化系疾病临床医学研究中心(上海), 国家消化道早癌防治中心联盟, 等. 中国早期食管癌及癌前病变筛查专家共识意见(2019年, 新乡)[J]. 中华消化内镜杂志, 2019, 36(11): 793-801. [National Quality Control Center of Digestive Endoscopy, National Clinical Research Center for Digestive Diseases (Shanghai), National Early Gastrointestinal-Cancer Prevention & Treatment Center Alliance(GECA), et al. China experts consensus on the protocal of early esophageal cancer and pre-cancerous lesion screening (2019, Xinxiang)[J]. Zhonghua Xiao Hua Nei Jing Za Zhi, 2019, 36(11): 793-801. DOI:10.3760/cma.j.issn.1007-5232.2019.11.001] |
| [44] |
刘璇, 张一方, 湛永乐, 等. 食管癌筛查队列操作流程与建设标准方案探讨[J]. 中华流行病学杂志, 2021, 42(8): 1504-1508. [Liu X, Zhang YF, Zhan YL, et al. Study on the operation process and construction standard of an esophageal cancer screening cohort study[J]. Zhonghua Liu Xing Bing Xue Za Zhi, 2021, 42(8): 1504-1508. DOI:10.3760/cma.j.cn112338-20200930-01215] |
| [45] |
王贵齐, 魏文强. 上消化道癌筛查和早诊早治项目的新转变: 机会性筛查[J]. 中华预防医学杂志, 2019, 53(11): 1084-1087. [Wang GQ, Wei WQ. A new transition of the screening, early diagnosis and early treatment project of the upper gastrointestinal cancer: opportunistic screening[J]. Zhonghua Yu Fang Yi Xue Za Zhi, 2019, 53(11): 1084-1087.] |
| [46] |
Chen R, Liu Y, Song G, et al. Effectiveness of one-time endoscopic screening programme in prevention of upper gastrointestinal cancer in China: a multicentre population-based cohort study[J]. Gut, 2021, 70(2): 251-260. |
 2022, Vol. 49
2022, Vol. 49


