文章信息
- BDH2基因在代谢与肿瘤发生发展中的作用与机制
- Role and Mechanism of BDH2 Gene in Metabolism, Tumorigenesis and Progression of Cancer
- 肿瘤防治研究, 2022, 49(3): 230-234
- Cancer Research on Prevention and Treatment, 2022, 49(3): 230-234
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2022.21.0995
- 收稿日期: 2021-09-03
- 修回日期: 2021-11-01
2. 010050 呼和浩特,内蒙古医科大学第一临床医学院;
3. 010050 呼和浩特,内蒙古医科大学附属医院检验科
2. The Affiliated Hospital of Inner Mongolia Medical University, Huhhot 010050, China;
3. Department of Laboratory Medicine, The Affiliated Hospital of Inner Mongolia Medical University, Huhhot 010050, China
人BDH2基因(3-hydroxybutyrate dehydrogenase 2,3-羟基丁酸脱氢酶2型,曾用名DHRS6)在2006年由Kunde Guo首次报道,位于染色体4q24上,编码一种新型胞质型Ⅱ-R-β羟基丁酸脱氢酶。随后,研究者对BDH2的功能进行了更深入的研究,Devireddy于2010年提出BDH2是合成哺乳动物铁载体的酶,敲减BDH2会引起细胞质和线粒体铁稳态的失衡。在体外培养的人巨噬细胞中,BDH2受炎性反应和内质网应激的负调控[1]。BDH2在发育过程中也发挥重要功能,Crispr/Cas9敲除BDH2使小鼠胚胎干细胞向内胚层方向分化[2]。BDH2通过代谢相关的网络调控,在不同微环境的细胞生理过程中发挥不同的作用,本文就BDH2在铁代谢、脂代谢、酮体代谢以及在肿瘤中的功能与意义作一分析。
1 BDH2在代谢中的作用 1.1 铁代谢除少数利用其他金属元素进行氧化还原反应的微生物以外,铁(Fe)对所有生物都是不可或缺的,对细胞生存、生长以及分化至关重要,铁是合成血红蛋白和铁硫蛋白的重要成分,参与电子传递及氧化磷酸化、氧气运输与呼吸作用、DNA复制转录及损伤修复等重要的生物学过程[3-4]。然而铁的低溶解度和高毒性是细胞处理铁时面临的难题,1995年Neilands研究发现铁载体(siderophores)便是微生物为了克服这个难题合成的一种低分子量铁螯合剂,帮助清除环境中的铁。大肠杆菌(E. coli)的肠菌素即是一种经典的铁载体,它的铁结合部分是2, 3-二羟基苯甲酸(2, 3-dihydroxybenzoic acid, 2, 3-DHBA),由细菌EntA催化合成[5]。无独有偶,哺乳动物中也存在与肠菌素类似的铁载体,并在哺乳动物细胞铁转运中发挥重要作用。2021年Devireddy在Cell杂志发表的研究显示哺乳动物的铁载体是细胞内铁平衡的重要调节器,其铁结合部分是类似于2, 3-DHBA的2, 5-二羟基苯甲酸(2, 5-dihydroxybenzoic acid, 2, 5-DHBA)。BDH2是合成2, 5-DHBA的酶,是细菌EntA的同工酶。缺乏铁载体的哺乳动物细胞积累异常高的细胞质铁,而线粒体缺铁,细胞游离活性氧(reactive oxygen species, ROS)水平升高。BDH2敲减的细胞ROS含量升高,过量的ROS积累引起氧化应激,进而导致细胞凋亡。此外,敲减BDH2致使铁载体耗尽的哺乳动物细胞和斑马鱼胚胎不能合成血红蛋白,这是由于合成血红蛋白是铁依赖的线粒体过程,BDH2敲减的细胞线粒体中铁水平显著减低,导致血红蛋白水平降低。Devireddy团队的其他研究也证明了BDH2-铁载体在红细胞中的作用,如BDH2缺失的小鼠出现了小细胞贫血和组织铁超载,表明BDH2是红细胞生成中的关键基因;在斑马鱼中BDH2失活导致线粒体功能障碍并延迟红细胞成熟[6]。
缺铁饮食的大鼠的肝脏基因表达谱显示,无论短期缺铁还是长期缺铁,都会引起BDH2表达的显著下调[7]。铁代谢和癌症之间的紧密联系已被众多研究者发掘,从统计学上看,饮食中铁摄入过多会增加几种恶性肿瘤的风险,包括食管癌、结直肠癌、肝癌和肺癌。癌细胞依赖于高水平的细胞内铁,从而使铁代谢转向增加铁摄取和减缓铁输出,而铁螯合剂具有很强的抗肿瘤活性[8]。
1.2 脂代谢和酮体代谢BDH2与脂代谢存在密切的关联,有报道BDH2表达通过生成脂质和甾醇合成前体从而于肥胖呈正相关[9]。然而在高脂肪的南阳猪中BDH2的表达显著低于低脂肪组,这可能是因为BDH2与脂肪酸氧化有关[10]。脂质代谢与肿瘤的发生和发展有着重要的关系,不同类型肿瘤的脂质代谢异常均可促进肿瘤生长[11],BDH2作为脂代谢相关的新型基因,在肿瘤中研究的价值还有待挖掘。
酮体是脂肪酸在肝细胞分解过程中产生的中间产物,包括乙酰乙酸、β-羟丁酸和丙酮,作为机体重要产物代谢产物之一的酮体,与肿瘤发生发展的机制密切相关。在不同肿瘤中酮类代谢异常的研究一直存在争议。在恶性脑肿瘤、胰腺癌、前列腺癌、乳腺癌、结肠癌、胃癌、肺癌等肿瘤中,酮代谢相关基因在肿瘤的发生发展中扮演着重要的角色[12]。BDH2在细胞质酮体利用和饥饿期间能量供应的次级系统中发挥作用[13]。恶性胶质瘤样本中BDH2大多呈阳性表达,提示BDH2可能有作为恶性胶质瘤生酮饮食治疗靶点的潜在价值[14]。
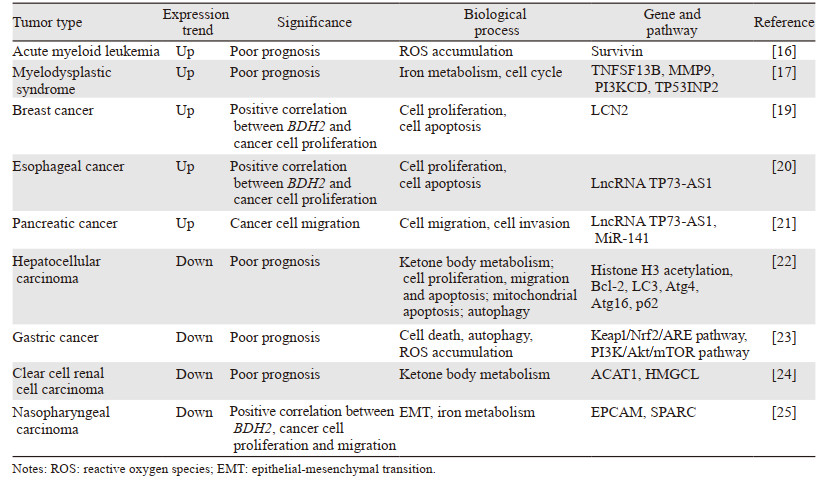
2 BDH2在肿瘤发生发展中的作用与机制 2.1 按照解剖学肿瘤分类进行总结与分析 2.1.1 淋巴血液系统肿瘤急性髓系白血病中40%~50%的患者不存在染色体畸变,在细胞遗传学正常的急性髓系白血病(cytogenetically normal acute myeloid leukemia, CN-AML)中,尽管约80%的CN-AML成人患者可达到完全缓解,但其中一半以上会复发[15],因此发掘新型相关分子靶标对其诊断和预后有重要意义。2013年BDH2被报道是CN-AML的独立不良预后因素[16],研究者将113例CN-AML患者骨髓样本与43例正常对照样本比较,发现CN-AML患者骨髓样本中BDH2的mRNA表达水平较对照组显著升高。86例患者中,BDH2高表达患者的完全缓解率(60%)低于BDH2低表达患者(80.42%);生存分析结果显示,BDH2高表达患者的总生存期较低,中位生存期为9月,而BDH2低表达患者中位生存期为53.67月(P=0.007)。随后在白血病细胞系THP1和HL60中利用shRNA敲减BDH2,发现BDH2敲减的细胞对ROS刺激更敏感,更容易凋亡,这个过程是通过抑制ROS暴露后Survivin的释放来介导。该研究组在2020年再次报道了骨髓增生异常综合征(myelodysplastic syndrome, MDS)中BDH2的意义[17],通过检测187例MDS患者、119例AML患者和43例骨髓正常淋巴瘤患者的骨髓样本中BDH2基因的mRNA的表达情况,发现MDS患者BDH2表达显著上调(P=0.009),且与铁蛋白水平有关,BDH2高表达的患者血清铁蛋白水平显著高于对照组。BDH2高表达的患者白血病进展的风险更高(P=0.017),无白血病生存期更短(P=0.024)。BDH2敲减的THP1细胞周期延缓,生长速度降低,有分化趋势,可能与敲减后TNFSF13B、MMP9、PI3KCD和TP53INP2的下调有关。
2.1.2 生殖系统肿瘤研究者对小鼠MMTV-PyMT转基因乳腺癌模型研究发现BDH2在肿瘤组中的mRNA水平显著低于非肿瘤组,但BDH2在LCN2缺失肿瘤模型与LCN2野生型肿瘤模型中的表达无显著差异,表明小鼠乳腺癌BDH2的表达与LCN2无相关性[18]。与先前小鼠模型中的结论不同,在女性乳腺癌患者中,BDH2的表达与LCN2正相关,还与体重指数(body mass index, BMI)正相关,乳腺癌细胞系(ZR75-1, T47D, MCF7, EFM19)的细胞增殖与细胞内BDH2表达显著正相关,RNAi诱导的BDH2缺失可促进乳腺癌细胞系凋亡易感性[19]。
2.1.3 消化系统肿瘤BDH2在食管癌组织中普遍上调,并与临床样本肿瘤位置或TNM分期密切相关。LncRNA TP73-AS1敲减可抑制食管癌细胞EC9706和KYSE30细胞中BDH2的表达,而BDH2敲减可通过caspase-3依赖的凋亡途径抑制食管癌细胞增殖并诱导凋亡。在LncRNA TP73-AS1敲减细胞中过表达BDH2可部分挽救细胞增殖率并抑制细胞凋亡。在小鼠移植瘤中,LncRNA TP73-ASI siRNA转染的肿瘤体积减小,表明LncRNA TP73-AS1的下调在体内和体外均可抑制食管癌的增殖。此外,BDH2或LncRNA TP73-AS1敲减可增强食管癌细胞对5-Fu和顺铂的化疗敏感度[20]。
在77例胰腺癌样本的研究中,与癌旁组织相比,胰腺癌组织的BDH2表达显著上调,MiR-141靶向调控BDH2,而LncRNA TP73-AS1通过调控MiR-141靶向调控BDH2,LncRNA TP73-AS1的下调显著降低了BDH2的表达,MiR-141的下调可部分恢复BDH2的表达水平,提示LncRNA TP73-AS1通过调控MiR-141正向调控BDH2,此外,MiR-141抑制剂能显著逆转LncRNA TP73-AS1抑制的胰腺癌细胞系PANC-1和BxPC-3的细胞迁移和细胞侵袭,提示LncRNA TP73-AS1-MiR-141-BDH2轴在胰腺癌细胞迁移和侵袭中起关键作用,值得作为胰腺癌治疗的潜在靶点进行更深入的研究[21]。
BDH2在肝细胞癌组织与肝癌细胞系(HepG2、Hep3B、QGY-7703、HuH-7、MHCC-97L和MHCC-97H)中均下调,低BDH2表达与总生存率低、肿瘤分化差、肿瘤体积增大、静脉浸润和BCLC晚期显著相关。单因素分析和多因素分析结果表明,BDH2可作为独立的预后指标,BDH2表达抑制肿瘤细胞的生长、增殖和迁移,还通过蛋白折叠反应诱导线粒体凋亡并抑制自噬。因此,BDH2可能成为新的肝癌预后标志物和有效的治疗靶点[22]。
BDH2在胃癌组织和细胞中明显下调,BDH2低表达与胃癌患者TNM分期、浸润深度、淋巴结转移以及预后不良呈正相关,表明BDH2在胃癌中是一个重要的肿瘤抑制因子,可作为胃癌预后不良的独立分子标志物。胃癌细胞系(AGS、BGC823、MGC803、MKN45、MKN1、SGC7901、HGC27)中BDH2的mRNA和蛋白水平显著低于对照组细胞,裸鼠移植瘤模型中过表达BDH2,过表达组的肿瘤体积和净重较对照组明显减小。BDH2过表达抑制胃癌细胞在体内和体外的生长并通过ROS诱导胃癌细胞的凋亡和自噬。深入探讨其机制发现,BDH2促进Keap1与Nrf2的相互作用,增加Nrf2的泛素化水平,Nrf2的泛素化/降解抑制ARE的活性,进而增加ROS的积累,ROS/PI3K/Akt/mTOR轴参与BDH2诱导的凋亡和自噬启动[23]。
2.1.4 泌尿系统肿瘤透明肾细胞癌中BDH2转录水平和蛋白水平均显著降低,BDH2蛋白表达与TNM分期相关及肿瘤大小相关,可能与BDH2、ACAT1和HMGCL参与的酮体代谢有关。BDH2表达较低的患者预后较差,提示BDH2是透明肾细胞癌中潜在的抑癌基因,可能成为有效的预后分子标志物。验证实验显示在过表达的透明肾细胞癌细胞系786-0中过表达BDH2显著抑制了透明肾细胞癌细胞的增殖和侵袭能力[24]。
2.1.5 头颈部肿瘤BDH2在鼻咽癌组织中和鼻咽癌细胞系鼻咽癌细胞系(HONE1、HK1、CNE1、CNE2、TW03和5-8F)中的表达明显下调。BDH2过表达抑制鼻咽癌细胞增殖和集落形成。裸鼠体内研究显示,过表达BDH2的鼻咽癌细胞体内形成的肿瘤较对照组更小。BDH2的高表达可逆转上皮-间充质转化(epithelial-mesenchymal transition, EMT)削弱鼻咽癌细胞的迁移能力,提示BDH2通过EMT逆转抑制鼻咽癌细胞的迁移和侵袭。此外,高水平的BDH2还通过降低细胞内铁水平而抑制鼻咽癌细胞的生长和转移。因此BDH2可能是鼻咽癌的候选抑癌基因,降低细胞内铁含量可能是治疗鼻咽癌的有效途径[25],见表 1。
癌症表型通常与铁稳态失调相关,在细胞代谢中,铁蓄积可能提升了致癌的风险。原因可能是癌细胞表现出对铁的强烈依赖,其分裂、生长和生存均需要大量的铁。铁代谢失衡和随之而来的过量铁积累与癌症的发生和发展密切相关,其中的机制可能是由于铁的促氧化性质及其对DNA的破坏作用[26]。因此,肿瘤的发生发展也伴随着铁调节基因的变化[27],BDH2作为编码哺乳动物铁载体的限速酶,也参与维持机体铁稳态。研究发现BDH2缺失会造成细胞质中铁的异常积累,进而引起ROS过量生成,最终导致细胞过早死亡[28]。这些证据提示BDH2很可能通过影响铁代谢和ROS而参与肿瘤代谢过程。
铁代谢与骨髓增生异常综合征的白血病进展有关,研究发现BDH2表达较正常组织上调,血清铁蛋白的变化趋势与BDH2一致,即高表达BDH2的患者血清铁蛋白含量更高。同时高表达BDH2的患者白血病进展风险更大,在此研究中,研究者发现骨髓增生异常综合征患者的BDH2表达与血清铁蛋白呈正相关,但BDH2在铁转运以及骨髓增生异常综合征中的作用和机制还需要进一步的研究来确定[17]。
ROS是细胞中重要的信号分子,通过多种信号通路参与信息传递,且与肿瘤的发生和发展有显著相关性[29-30]。急性髓系白血病中,BDH2高表达是患者预后不良的独立指标,BDH2敲减白血病细胞对ROS的刺激更敏感,也更容易凋亡[16]。而在胃癌患者和细胞系中,BDH2表达显著下调,同时BDH2低表达是预后不良指标,胃癌细胞过表达BDH2可使细胞内ROS升高,进而促使胃癌细胞凋亡和自噬导致死亡[23]。由此可见,不同癌种中BDH2参与ROS过程的作用存在差异,其中的分子机制尚未阐明。
铁代谢异常导致的细胞铁蓄积可能导致肿瘤的发生,而肿瘤的铁代谢需求明显高于正常组织,因此铁代谢相关基因在肿瘤的筛查与预后中有作为标志物的潜质。BDH2作为参与铁代谢的相关基因之一,目前相关研究较少,但在上文总结的临床样本研究中已体现出了其作为标志物在不同肿瘤中的意义,而BDH2在肿瘤代谢过程中发挥作用的机制仍不明确。鉴于癌细胞中铁调节基因的复杂网络及其对肿瘤生长和存活的作用,有必要更好地了解BDH2在肿瘤铁代谢调节和相互作用的机制。
3 讨论与展望综上所述,BDH2是哺乳动物细胞中的一个多功能基因,参与机体酮体代谢、脂代谢,并在维持细胞铁稳态过程中起关键作用。BDH2通过这些代谢相关的生理作用密切影响着肿瘤的发生发展,在已报道的多个研究中BDH2的表达与临床意义存在多元化差异,与肿瘤类型直接相关,但目前关于BDH2基因在肿瘤领域的研究仍然较少,因此BDH2的潜在诊断价值与临床预后相关性值得进一步探索。
作者贡献:
刘秉春:文章选题与撰稿
李康:文献整理与校对
袁建龙:文章修改与资金支持
| [1] |
Zughaier xcSM, Stauffer BB, McCarty NA. Inflammation and ER stress downregulate BDH2 expression and dysregulate intracellular iron in macrophages[J]. J Immunol Res, 2014, 2014: 140728. |
| [2] |
Fu Y, Liu F, Cao S, et al. Bdh2 Deficiency Promotes Endoderm-Biased Early Differentiation of Mouse Embryonic Stem Cells[J]. Front Cell Dev Biol, 2021, 9: 655145. DOI:10.3389/fcell.2021.655145 |
| [3] |
Gonciarz RL, Collisson EA, Renslo AR. Ferrous Iron-Dependent Pharmacology[J]. Trends Pharmacol Sci, 2021, 42(1): 7-18. DOI:10.1016/j.tips.2020.11.003 |
| [4] |
McKay AKA, Pyne DB, Burke LM, et al. Iron Metabolism: Interactions with Energy and Carbohydrate Availability[J]. Nutrients, 2020, 12(12): 3692. DOI:10.3390/nu12123692 |
| [5] |
Raymond KN, Dertz EA, Kim SS. Enterobactin: an archetype for microbial iron transport[J]. Proc Natl Acad Sci U S A, 2003, 100(7): 3584-3588. DOI:10.1073/pnas.0630018100 |
| [6] |
Davuluri G, Song P, Liu Z, et al. Inactivation of 3-hydroxybutyrate dehydrogenase 2 delays zebrafish erythroid maturation by conferring premature mitophagy[J]. Proc Natl Acad Sci U S A, 2016, 113(11): E1460-E1469. |
| [7] |
Kamei A, Watanabe Y, Kondo K, et al. Influence of a short-term iron-deficient diet on hepatic gene expression profiles in rats[J]. PLoS One, 2013, 8(6): e65732.. DOI:10.1371/journal.pone.0065732 |
| [8] |
Yang B, Yao H, Tian H, et al. Intratumoral synthesis of nano-metalchelate for tumor catalytic therapy by ligand field-enhanced coordination[J]. Nat Commun, 2021, 12(1): 3393. DOI:10.1038/s41467-021-23710-y |
| [9] |
Bonnet A, Lê Cao KA, Sancristobal M, et al. In vivo gene expression in granulosa cells during pig terminal follicular development[J]. Reproduction, 2008, 136(2): 211-224. DOI:10.1530/REP-07-0312 |
| [10] |
Wang L, Zhang Y, Zhang B, et al. Candidate gene screening for lipid deposition using combined transcriptomic and proteomic data from Nanyang black pigs[J]. BMC Genomics, 2021, 22(1): 441. DOI:10.1186/s12864-021-07764-2 |
| [11] |
Gao Y, Nan X, Shi X, et al. SREBP1 promotes the invasion of colorectal cancer accompanied upregulation of MMP7 expression and NF-kappaB pathway activation[J]. BMC Cancer, 2019, 19(1): 685. DOI:10.1186/s12885-019-5904-x |
| [12] |
Qian L, Li Y, Cao Y, et al. Pan-Cancer Analysis of Glycolytic and Ketone Bodies Metabolic Genes: Implications for Response to Ketogenic Dietary Therapy[J]. Front Oncol, 2021, 11: 689068. DOI:10.3389/fonc.2021.689068 |
| [13] |
Guo K, Lukacik P, Papagrigoriou E, et al. Characterization of human DHRS6, an orphan short chain dehydrogenase/reductase enzyme: a novel, cytosolic type 2 R-beta-hydroxybutyrate dehydrogenase[J]. J Biol Chem, 2006, 281(15): 10291-10297. DOI:10.1074/jbc.M511346200 |
| [14] |
Chang HT, Olson LK, Schwartz KA. Ketolytic and glycolytic enzymatic expression profiles in malignant gliomas: implication for ketogenic diet therapy[J]. Nutr Metab (Lond), 2013, 10(1): 47. DOI:10.1186/1743-7075-10-47 |
| [15] |
Walker CJ, Mrózek K, Ozer HG, et al. Gene expression signature predicts relapse in adult patients with cytogenetically normal acute myeloid leukemia[J]. Blood Adv, 2021, 5(5): 1474-1482. DOI:10.1182/bloodadvances.2020003727 |
| [16] |
Yang WC, Tsai WC, Lin PM, et al. Human BDH2, an anti-apoptosis factor, is a novel poor prognostic factor for de novo cytogenetically normal acute myeloid leukemia[J]. J Biomed Sci, 2013, 20(1): 58. DOI:10.1186/1423-0127-20-58 |
| [17] |
Yang WC, Lin SF, Wang SC, et al. The Effects of Human BDH2 on the Cell Cycle, Differentiation, and Apoptosis and Associations with Leukemia Transformation in Myelodysplastic Syndrome[J]. Int J Mol Sci, 2020, 21(9): 3033. DOI:10.3390/ijms21093033 |
| [18] |
Cramer EP, Glenthøj A, Häger M, et al. No effect of NGAL/lipocalin-2 on aggressiveness of cancer in the MMTV-PyMT/FVB/N mouse model for breast cancer[J]. PLoS One, 2012, 7(6): e39646. DOI:10.1371/journal.pone.0039646 |
| [19] |
Drew BG, Hamidi H, Zhou Z, et al. Estrogen receptor (ER)alpha-regulated lipocalin 2 expression in adipose tissue links obesity with breast cancer progression[J]. J Biol Chem, 2015, 290(9): 5566-5581. DOI:10.1074/jbc.M114.606459 |
| [20] |
Zang W, Wang T, Wang Y, et al. Knockdown of long non-coding RNA TP73-AS1 inhibits cell proliferation and induces apoptosis in esophageal squamous cell carcinoma[J]. Oncotarget, 2016, 7(15): 19960-19974. DOI:10.18632/oncotarget.6963 |
| [21] |
Cui XP, Wang CX, Wang ZY, et al. LncRNA TP73-AS1 sponges miR-141-3p to promote the migration and invasion of pancreatic cancer cells through the up-regulation of BDH2[J]. Biosci Rep, 2019, 39(3): BSR20181937. DOI:10.1042/BSR20181937 |
| [22] |
Liang H, Xiong Z, Li R, et al. BDH2 is downregulated in hepatocellular carcinoma and acts as a tumor suppressor regulating cell apoptosis and autophagy[J]. J Cancer, 2019, 10(16): 3735-3745. DOI:10.7150/jca.32022 |
| [23] |
Liu JZ, Hu YL, Feng Y, et al. BDH2 triggers ROS-induced cell death and autophagy by promoting Nrf2 ubiquitination in gastric cancer[J]. J Exp Clin Cancer Res, 2020, 39(1): 123. DOI:10.1186/s13046-020-01620-z |
| [24] |
Cui W, Luo W, Zhou X, et al. Dysregulation of Ketone Body Metabolism Is Associated With Poor Prognosis for Clear Cell Renal Cell Carcinoma Patients[J]. Front Oncol, 2019, 9: 1422. DOI:10.3389/fonc.2019.01422 |
| [25] |
Li B, Liao Z, Mo Y, et al. Inactivation of 3-hydroxybutyrate dehydrogenase type 2 promotes proliferation and metastasis of nasopharyngeal carcinoma by iron retention[J]. Br J Cancer, 2020, 122(1): 102-110. DOI:10.1038/s41416-019-0638-8 |
| [26] |
Yin M, Liu Y, Chen Y. Iron metabolism: an emerging therapeutic target underlying the anti-cancer effect of quercetin[J]. Free Radic Res, 2021, 55(3): 296-303. DOI:10.1080/10715762.2021.1898604 |
| [27] |
Jung M, Mertens C, Tomat E, et al. Iron as a Central Player and Promising Target in Cancer Progression[J]. Int J Mol Sci, 2019, 20(2): 273. DOI:10.3390/ijms20020273 |
| [28] |
Devireddy LR, Hart DO, Goetz DH, et al. A mammalian siderophore synthesized by an enzyme with a bacterial homolog involved in enterobactin production[J]. Cell, 2010, 141(6): 1006-1017. DOI:10.1016/j.cell.2010.04.040 |
| [29] |
Raja G, Jang YK, Suh JS, et al. Microcellular Environmental Regulation of Silver Nanoparticles in Cancer Therapy: A Critical Review[J]. Cancers (Basel), 2020, 12(3): 664. DOI:10.3390/cancers12030664 |
| [30] |
Xie H, Chun FK, Rutz J, et al. Sulforaphane Impact on Reactive Oxygen Species (ROS) in Bladder Carcinoma[J]. Int J Mol Sci, 2021, 22(11): 5938. DOI:10.3390/ijms22115938 |
 2022, Vol. 49
2022, Vol. 49