文章信息
- 术前乳酸脱氢酶/白蛋白比值联合AFP评估肝细胞癌患者预后的价值
- Value of Preoperative Lactate Dehydrogenase-to-Albumin Ratio Combined with AFP in Evaluating Prognosis of Patients with Hepatocellular Carcinoma
- 肿瘤防治研究, 2022, 49(4): 347-351
- Cancer Research on Prevention and Treatment, 2022, 49(4): 347-351
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2022.21.0994
- 收稿日期: 2021-09-03
- 修回日期: 2021-11-23
2. 730000 兰州,兰州大学第一医院普外科;
3. 730000 兰州,甘肃省生物治疗与再生医学重点实验室;
4. 730000 兰州,兰州大学第一医院耳鼻咽喉头颈外科
2. Department of General Surgery, The First Hospital of Lanzhou University, Lanzhou 730000, China;
3. Key Laboratory of Biotherapy and Regenerative Medicine of Gansu Province, Lanzhou 730000, China;
4. Department of Otolaryngology Head and Neck Surgery, The First Hospital of Lanzhou University, Lanzhou 730000, China
肝癌是全球常见的恶性肿瘤之一,病理类型有肝细胞癌(hepatocellular carcinoma, HCC)、肝内胆管细胞癌、混合癌,其中肝细胞癌占85%~90%[1]。根据2020年癌症全球人数统计,肝癌是全球第三大癌症死亡原因,死亡人数占癌症总死亡人数的8.3%,是中国癌症死亡人数的第2名[2]。我国肝癌5年生存率不足15%[3]。甲胎蛋白(alpha-fetoprotein, AFP)是筛查HCC的常用指标,术后AFP升高常提示HCC复发,但约30%的患者AFP没有升高或不表达,延误治疗最佳时机[4]。临床上需要联合有效的指标协助判断患者预后,提高生存质量。
血清乳酸脱氢酶/白蛋白比值(lactate dehydrogenase to albumin ratio, LAR)是判断恶性肿瘤预后的血清学检测指标之一。在多种癌症的研究中显示,血清乳酸脱氢酶(LDH)水平是肿瘤缺氧、新生血管生成和预后不良的间接标志[5]。术前低蛋白血症是营养不良的指标,与胃癌和肝癌等患者的总体存活率低和复发率高有关[5-6]。LAR在胃癌和鼻咽癌等癌症中的不良预后作用已被验证,而在HCC中研究较少。本研究回顾性分析106例HCC患者临床资料,评价患者术前外周血LAR与预后的关系,并将LAR联合AFP来评估HCC患者预后的价值,以期为HCC的临床判断提供一定的参考。
1 资料与方法 1.1 一般资料回顾性分析2015年1月—2019年12月在兰州大学第一医院普外科行根治性手术的106例HCC患者的临床资料,其中男81例(76.4%),女25例(23.6%);年龄26~78(54.5±10.1)岁。临床分期按照2018年修改的AJCC第8版分期系统。纳入标准:(1)18~80岁;(2)术中肿瘤根治性切除;(3)术后病理证实为HCC;(4)无严重的心、肺、脑、肾严重功能障碍及血液系统疾病;(5)患者临床及随访资料完整。排除标准:(1)不可切除或非根治性切除的肝癌;(2)术后病理证实非HCC;(3)既往有其他恶性肿瘤病史者;(4)拒绝签署知情同意书及随访过程中失访者。本研究通过本院伦理委员会审批(批准号:LDYYLL2021-348)。
1.2 数据收集收集患者的基本信息:性别、年龄、体重指数;术前1周内的血常规检查:肝炎病毒抗原、白蛋白(ALB)、LDH、AFP;影像学检查;疾病信息:肿瘤T分期、N分期、临床分期、术后有无介入手术治疗等。
1.3 随访情况采用住院或门诊就诊、电话等方式进行随访,每3月随访一次,末次随访时间为2021年5月。总生存期(overall survival, OS)是从患者术后第1日开始至末次随访或死亡的时间;无病生存期(disease-free survival, DFS)是患者手术后第1日至疾病复发或(因任何原因)死亡之间的时间[7]。随访时间为0~77月,中位随访时间为28月。106例随访病例复发75例(70.8%),死亡30例(28.3%),1例未复发。
1.4 统计学方法采用SPSS26.0软件进行统计学分析。根据中位数以LAR为4.58进行分层(LAR≥4.58和LAR < 4.58)。计数资料用例数和百分比表示,两组间比较采用χ2或Fisher精确检验,等级变量采用秩和检验。使用Kaplan-Meier绘制生存曲线并采用Log rank检验。利用Cox风险回归模型进行单多因素回归分析,判断影响HCC患者预后的危险因素;对LAR和AFP联合分组进行检验,并绘制Kaplan-Meier生存曲线。P < 0.05为差异有统计学意义。
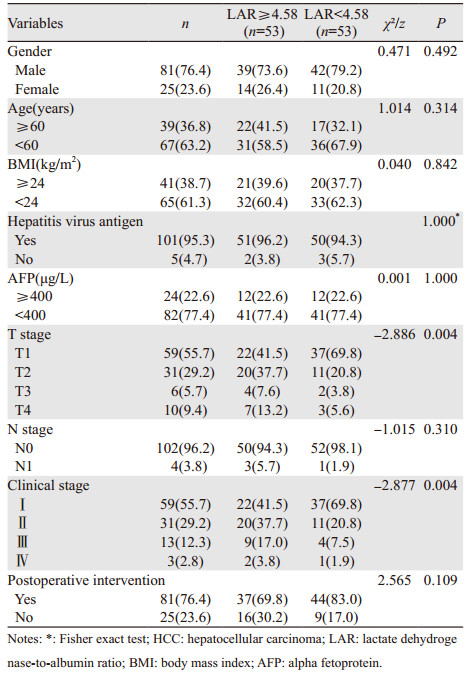
2 结果 2.1 术前LAR水平与HCC患者临床、病理特征的关系106例患者中,1年的DFS为49.1%,3年的DFS为9.4%,1年的OS为81.1%,3年的OS为22.6%。根据既往研究结果,取AFP截断值为400 μg/L,以LAR=4.58为阈值分层,单因素分析显示两组间T分期和临床分期比较差异有统计学意义(均P < 0.05),见表 1。
|
高LAR组(LAR≥4.58, n=53),低LAR组(LAR < 4.58, n=53);高AFP组(AFP≥400 μg/L, n=24),低AFP组(AFP < 400 μg/L, n=82)。Log rank检验单因素分析显示,高LAR组和高AFP组的DFS和OS显著短于低LAR组和低AFP组,差异有统计学意义(P < 0.05),Kaplan-Meier生存曲线见图 1。

|
| 图 1 不同的LAR和AFP值与HCC患者术后无病生存期(A, C)和总生存期(B, D)的关系 Figure 1 Relation between different LAR, AFP values and postoperative DFS(A, C), OS(B, D) of HCC patients |
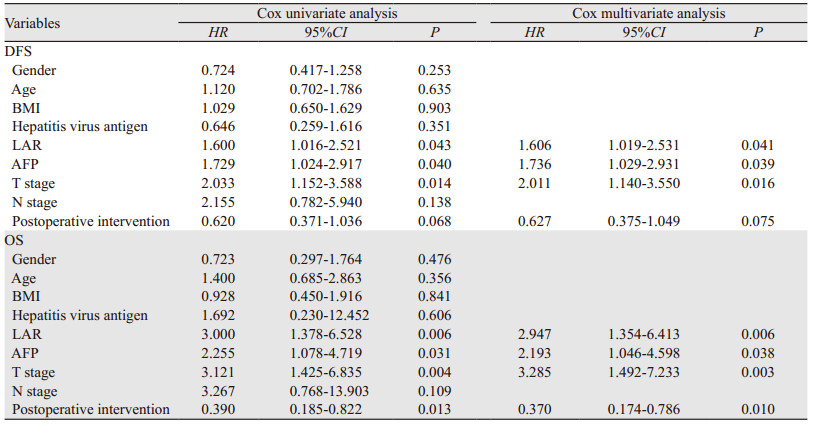
按照中位数患者被分为高LAR组(LAR≥4.58, n=53)和低LAR组(LAR < 4.58, n=53)。根据既往文献对T分期进行分类(T1~T2/T3~T4),将HCC患者性别、年龄、BMI、肝炎病毒抗原、LAR、AFP、T分期、N分期和术后介入治疗等因素纳入Cox单因素回归分析,结果表明LAR、AFP、T分期与DFS相关(P < 0.05),LAR、AFP、T分期、术后介入治疗与OS相关(P < 0.05)。将单因素分析中有临床意义的变量纳入多因素回归分析,结果显示高LAR、高AFP和T3~T4期是HCC患者DFS和OS的独立危险因素(P < 0.05),术后行介入手术治疗可延长HCC患者的OS,见表 2。
|
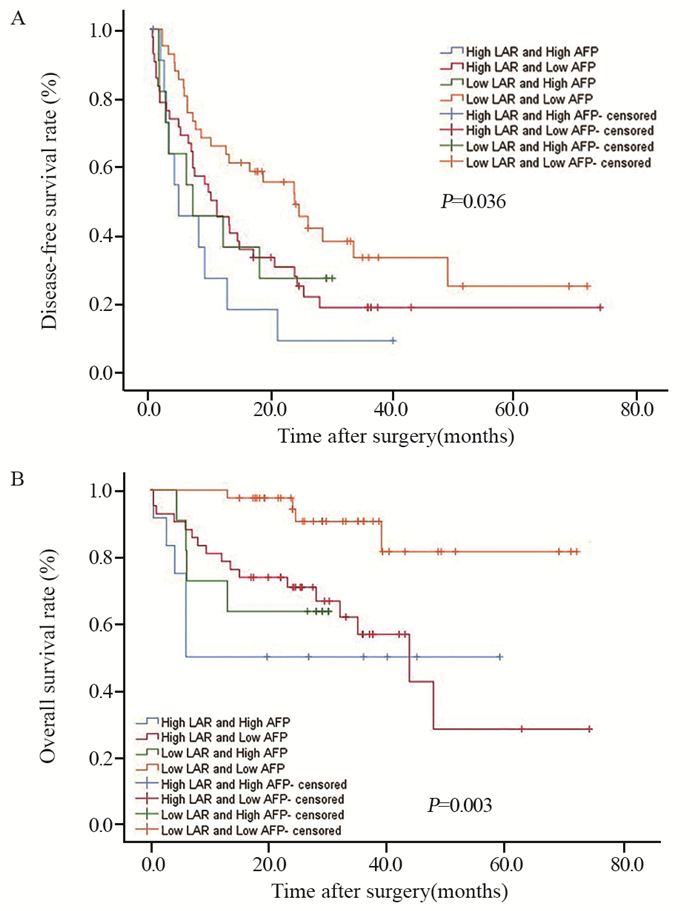
结果显示高LAR且高AFP组(LAR≥4.58且AFP≥400 μg/L, n=12)的DFS和OS最短,低LAR且低AFP组(LAR < 4.58且AFP < 400 μg/L, n=41)的DFS和OS最长(P < 0.05),见图 2。
|
| 图 2 血清LAR及AFP水平与肝细胞患者术后无病生存期(A)和总生存期(B)的关系 Figure 2 Relation between serum LAR, AFP levels and postoperative DFS(A), OS(B) of HCC patients |
肝癌是我国第四大常见恶性肿瘤[8],据2018年世界卫生组织(WHO)统计,我国肝癌人数占全球肝癌病例总数的46.7%[9]。肝癌主要的危险因素有慢性乙型病毒性肝炎、慢性丙型病毒性肝炎、酗酒、代谢性肝病等。目前AFP作为临床最常用的血液学检测方法对HCC进行筛查和预后监测,但其敏感度较低,为25%~65%[1]。因此需联合简单可行的血液学检测方法对HCC预后进行判断,早期实施干预措施,改善HCC预后。
高LDH和低ALB水平提示恶性肿瘤的不良预后,LAR将LDH与ALB结合可在肿瘤血管生成、细胞存活和机体营养状况等方面综合判断肿瘤预后,准确性较单个指标更高,其不良预后作用在结直肠癌、食管癌等多种肿瘤中得到验证[10-11]。Gan等[6]对1 041例原发性肝癌患者进行分析,发现LAR是原发性肝癌患者OS和无进展生存期(progression-free survival, PFS)的准确预测因子。本研究发现术前LAR与肿瘤的T分期和临床分期相关,与以往研究结果一致,高LAR是HCC的独立不良预后因素,高LAR水平的HCC患者,术后复发风险比低LAR组高约1.606倍。
LDH是一种参与无氧糖酵解的代谢酶[11],高LDH与肿瘤血管生成、细胞存活和肿瘤形成相关[12],是胃癌、胰腺癌等恶性肿瘤的不良预后因素[10-11, 13]。Wu等[14]研究显示LDH是原发性肝癌患者OS和PFS的独立预后因素。高LDH提示不良预后的可能原因有:(1)肿瘤细胞增殖活跃、肿瘤微环境氧耗增加[15]、缺氧诱导因子-1(HIF-1)的异常激活可上调肿瘤细胞中的LDH-A,确保肿瘤细胞在低氧条件下进行糖酵解代谢并且减少对氧气的需求[16];(2)PI3K/Akt/mTOR通路是肿瘤中最常被激活的信号通路之一,可通过调节LDH促进肿瘤细胞增殖、生长[17];(3)异常激活的热休克蛋白通过其转录调节因子热休克因子(HSF-1),调节葡萄糖代谢和增加乳酸脱氢酶(LDH-A)的表达[18],促进肿瘤细胞的增值、侵袭和转移。ALB作为肝脏合成的糖蛋白,是判断肝功能是否损伤的早期重要指标[19]。Fox等[20]通过分析2 918例患者的临床资料发现术前低蛋白血症为原发性肝癌不良预后的重要因素。术前白蛋白水平较低的原因可能有:肝功能障碍引起白蛋白合成、分泌较少;肿瘤相关的炎性反应引起蛋白分解加速[5]。LAR为LDH和ALB值之比,LAR升高不仅可以反应LDH升高,也可反应ALB降低。本研究通过对106例患者分析发现高LAR组患者的DFS和OS短于低LAR组患者,且差异有统计学意义(P < 0.05),与上述研究结果基本一致。
本研究发现,LAR和AFP均与HCC的不良预后密切相关,LAR和AFP均升高的组预后最差,对HCC患者术后DFS和OS的判断有统计学意义。本研究为单中心、小样本的回顾性研究,存在一定的局限性,未来需进行多中心、大样本的前瞻性研究,进一步了解影响肝癌预后的危险因素,提高对肝癌预后判断的准确性,及时干预治疗,延长DFS和OS,提高患者生存质量。
作者贡献:
周永婕、徐雯:课题设计,资料分析,撰写论文
王正峰、周文策:拟定写作思路,指导论文撰写与修改
严俊、王海平:数据统计分析,修改核对文章
| [1] |
中华预防医学会肝胆胰疾病预防与控制专业委员会, 中国研究型医院学会肝病专业委员会, 中华医学会肝病学分会, 等. 原发性肝癌的分层筛查与监测指南(2020版)[J]. 中华肿瘤防治杂志, 2021, 28(2): 83-99. [Professional Committee for Prevention and Control of Hepatobiliary and Pancreatic Disease of Chinese Preventive Medicine Association, Professional Committee for Hepatology, Chinese Research Hospital Association, Chinese Society of Hepatology, Chinese Medical Association, et al. Guideline for stratified screening and surveillance of primary liver cancer(2020 Edition)[J]. Zhonghua Zhong Liu Fang Zhi Yan Jiu, 2021, 28(2): 83-99.] |
| [2] |
刘宗超, 李哲轩, 张阳, 等. 2020全球癌症统计报告解读[J]. 肿瘤综合治疗电子杂志, 2021, 7(2): 1-13. [Liu ZC, Li ZX, Zhang Y, et al. Interpretation on the report of Global Cancer Statistics 2020[J]. Zhong Liu Zong He Zhi Liao Dian Zi Za Zhi, 2021, 7(2): 1-13.] |
| [3] |
Craig AJ, von Felden J, Garcia-Lezana T, et al. Tumour evolution in hepatocellular carcinoma[J]. Nat Rev Gastroenterol Hepatol, 2020, 17(3): 139-152. DOI:10.1038/s41575-019-0229-4 |
| [4] |
Wang X, Mao M, He Z, et al. Development and Validation of a Prognostic Nomogram in AFP-negativehepatocellular carcinoma[J]. Int J Biol Sci, 2019, 15(1): 221-228. DOI:10.7150/ijbs.28720 |
| [5] |
Aday U, Tatli F, Akpulat FV, et al. Prognostic significance of pretreatment serum lactatedehydrogenase-to-albumin ratio in gastric cancer[J]. Contemp Oncol (Pozn), 2020, 24(3): 145-149. |
| [6] |
Gan W, Zhang MX, Wang JX, et al. Prognostic impact of lactic dehydrogenase to albumin ratio in hepatocellular carcinoma patients with Child-PughⅠwho underwent curative resection: a prognostic nomogram study[J]. Cancer Manag Res, 2018, 10: 5383-5394. DOI:10.2147/CMAR.S176317 |
| [7] |
付蕾, 李潜, 卢创新, 等. 尿酸联合CA199检测对结直肠癌TNM分期和预后判断的价值[J]. 肿瘤, 2020, 40(7): 496-502. [Fu L, Li Q, Lu CX, et al. The value of combined detection of uric acid and CA199 in TNM stage and prognosis of patients with colorectal cancer[J]. Zhong Liu, 2020, 40(7): 496-502.] |
| [8] |
郑荣寿, 孙可欣, 张思维, 等. 2015年中国恶性肿瘤流行情况分析[J]. 中华肿瘤杂志, 2019, 41(1): 19-28. [Zheng RS, Sun KX, Zhang SW, et al. Report of cancer epidemiology in China, 2015[J]. Zhonghua Zhong Liu Za Zhi, 2019, 41(1): 19-28. DOI:10.3760/cma.j.issn.0253-3766.2019.01.005] |
| [9] |
Feng RM, Zong YN, Cao SM, et al. Current cancer situation in China good or bad news from the 2018 GlobalCancer Statistics?[J]. Cancer Commun (Lond), 2019, 39(1): 22. DOI:10.1186/s40880-019-0368-6 |
| [10] |
Aday U, Böyük A, Akkoc H. The prognostic significance of serum lactate dehydrogenase-to-albumin ratio in colorectal cancer[J]. Ann Surg Treat Res, 2020, 99(3): 161-170. DOI:10.4174/astr.2020.99.3.161 |
| [11] |
Feng JF, Wang L, Yang X, et al. Prognostic value of lactate dehydrogenase to albumin ratio (LAR) in patients with resectable esophageal squamous cell carcinoma[J]. Cancer Manag Res, 2019, 11: 7243-7251. DOI:10.2147/CMAR.S208320 |
| [12] |
丘金梅, 龚娟, 谢青池, 等. 乳酸脱氢酶在肿瘤代谢中的作用及以其为靶标的抗肿瘤药物研发[J]. 肿瘤防治研究, 2020, 47(12): 980-985. [Qiu JM, Gong J, Xie QC, et al. Role of Lactate Dehydrogenase in Tumor Metabolism and Progress of LDH-targeted Drugs[J]. Zhong Liu Fang Zhi Yan Jiu, 2020, 47(12): 980-985. DOI:10.3971/j.issn.1000-8578.2020.20.0279] |
| [13] |
Gao S, Wu M, Chen Y, et al. Lactic dehydrogenase to albumin ratio in prediction of unresectable pancreatic cancer with intervention chemotherapy[J]. Future Oncol, 2018, 14(14): 1377-1386. DOI:10.2217/fon-2017-0556 |
| [14] |
Wu SJ, Lin YX, Ye H, et al. Prognostic value of alkaline phosphatase, gamma-glutamyl transpeptidase andlactate dehydrogenase in hepatocellular carcinoma patients treated with liver resection[J]. Int J Surg, 2016, 36(PtA): 143-151. |
| [15] |
董鑫, 汪海岩. 术前乳酸脱氢酶/白蛋白比值在进展期胃癌中的预后分析[J]. 科学技术与工程, 2019, 19(29): 73-76. [Dong X, Wang HY. Prognosis analysis of preoperative lactate-dehydrogenase/albumin ratio in advanced gastric cancer[J]. Ke Xue Ji Shu Yu Gong Cheng, 2019, 19(29): 73-76. DOI:10.3969/j.issn.1671-1815.2019.29.012] |
| [16] |
Faloppi L, Scartozzi M, Bianconi M, et al. The role of LDH serum levels in predicting global outcome in HCC patients treated with sorafenib: implications for clinical management[J]. BMC Cancer, 2014, 14: 110. DOI:10.1186/1471-2407-14-110 |
| [17] |
Alzahrani AS. PI3K/Akt/mTOR inhibitors in cancer: At the bench and bedside[J]. Semin Cancer Biol, 2019, 59: 125-132. DOI:10.1016/j.semcancer.2019.07.009 |
| [18] |
Manerba M, Di Ianni L, Govoni M, et al. LDH inhibition impacts on heat shock response and induces senescence of hepatocellular carcinoma cells[J]. Eur J Pharm Sci, 2017, 105: 91-98. DOI:10.1016/j.ejps.2017.05.015 |
| [19] |
翟永贞, 岳阳阳, 丁德平, 等. 血清前白蛋白联合终末期肝病模型评分评估失代偿期肝硬化患者预后的临床价值[J]. 中华肝脏病杂志, 2017, 25(7): 533-535. [Zhai YZ, Yue YY, Ding DP, et al. The value of serum prealbumin combined with MELD score in predicting the prognosis of patients with decompensated cirrhosis[J]. Zhonghua Gan Zang Bing Za Zhi, 2017, 25(7): 533-535. DOI:10.3760/cma.j.issn.1007-3418.2017.07.012] |
| [20] |
Fox R, Berhane S, Teng M, et al. Biomarker-based prognosis in hepatocellular carcinoma: validation and extension of the BALAD model[J]. Br J Cancer, 2014, 110(8): 2090-2098. DOI:10.1038/bjc.2014.130 |
 2022, Vol. 49
2022, Vol. 49


