文章信息
- SP600125对人宫颈癌HeLa细胞增殖和侵袭的影响
- Effects of SP600125 on Proliferation and Invasion of Human Cervical Cancer HeLa Cells
- 肿瘤防治研究, 2022, 49(4): 304-313
- Cancer Research on Prevention and Treatment, 2022, 49(4): 304-313
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2022.21.0807
- 收稿日期: 2021-07-12
- 修回日期: 2021-12-16
宫颈癌是当今世界严重威胁女性生殖健康最常见的恶性肿瘤之一,发病机制复杂,近年来病死率呈年轻化增长的趋势,尤其在发展中国家的形势更为严峻[1]。宫颈癌的发生发展是一个渐进变化,涉及到多基因参与、多因素作用及多阶段发展的病理过程,并与细胞的异常增殖、分化、凋亡以及众多原癌基因的激活与抑癌基因的异常表达密切相关。虽然在早期可根据癌前病变细胞非整倍化的复杂程度不同来进行HPV病毒筛查,且对于中晚期的患者采取的手术、化放疗以及靶向药物等联合治疗取得了一定的疗效,但仍存在疗效差、预后不良反应大且易产生耐药性以及复发等弊端[2],从而导致肿瘤复发和进一步发展。因此,致力于寻求一种新型安全有效且不良反应小的细胞信号转导分子为靶点的JNK通路抑制剂来改善宫颈癌患者的预后以及提高生存质量显得尤为重要[3]。
SP600125(C14H8N2O)作为低毒性小分子的JNK抑制剂[4],已广泛应用于干细胞(embryonic stem cell, ES)干性特性的维持[5]、诱导细胞多倍体[6]以及抑制肿瘤细胞的增殖并促进其凋亡等方面[7]。基于本课题组前期研究表明SP600125能够通过对p53通路和纺锤体组装检验点(spindle assembly checkpoint, SAC)信号通路中MAD2和CDC20基因表达的调控,将细胞阻滞于有丝分裂M期,进而诱导细胞产生多倍化[8]。最新研究表明有丝分裂检测点相关基因的表达异常(低表达和过表达)或缺陷等均可促进染色体不稳定性的增加,从而产生多倍体或非整倍体细胞,与肿瘤的发生发展密切相关[9-10]。为了进一步深入研究SP600125在宫颈癌中的抗肿瘤作用机制,本研究拟探讨SP600125对宫颈癌HeLa细胞的增殖、迁移和侵袭能力的影响及相关机制,有望为治疗宫颈癌以及其他抗肿瘤药物方面提供一定的借鉴。
1 材料与方法 1.1 主要实验试剂与仪器HeLa细胞(湖南丰晖生物科技公司的细胞资源中心库),JNK抑制剂SP600125(德国Merck-Millipore公司,货号S1460),二甲基亚砜(DMSO,美国Sigma公司),胎牛血清(美国Gibco公司,货号42F7180K),DMEM培养基(美国Hyclone公司,货号SH30022.01),胰酶和青链霉素双抗(美国Genview公司,货号89040101100和DAB000100),4%多聚甲醛和结晶紫(美国碧云天公司,货号P0099-100ml和C0121),CCK-8试剂盒(中国全式金公司,货号FC101-03),抗体包括p53鼠抗(美国Proteintech公司,货号60283-2-AP,50 μl,1:2 000)、Mad2L1兔抗(美国Proteintech公司,货号10337-1-AP,50 μl,1:500)、CDC20兔抗(美国Proteintech公司,货号10252-1-AP,50 μl,1:500)、GAPDH鼠抗(美国Proteintech公司,货号60004-1-Ig,1:5 000);标记的山羊和抗鼠IgG荧光二抗(美国KPL公司,货号074-1506和074-1807,1:5 000)。TRIzol(美国天根公司),RevertAid Reverse Transcriptase(美国Thermo公司,货号EP0441),Matrigel胶(美国Corning公司,货号356234),Transwell小室(美国Corning公司,货号3422),Total RNA提取试剂盒E.Z.N.A.TM Total RNA Kit Ⅱ(美国Omega公司),PerfectStart Green qPCR SuperMix(中国全式金公司,货号AQ601-04),反转录试剂盒(美国Thermo公司,货号EP0441),目的基因和内参基因引物合成(湖南擎科生物技术有限公司),BCA蛋白质浓度测定试剂盒和SDS-PAGE凝胶配置试剂盒(美国BioTime公司),RIPA裂解液、BeyoECL Plus(超敏ECL化学发光试剂盒)均购于美国碧云天公司。在实验中涉及的主要实验仪器包括实时荧光定量PCR仪(美国Bio-Rad公司,7500)、酶标仪(美国Bio-Rad公司)、倒置显微镜(德国Leica)、CO2恒温培养箱(美国Thermo Fisher公司)和超净工作台(中国华宇公司)。
1.2 细胞培养将含10%胎牛血清和含1%青/链霉素双抗的DMEM培养基在37℃饱和湿度和含5%CO2的培养箱中进行培养,2~3 d传代一次,待细胞贴壁后融合度达80%~90%时,取对数生长期的细胞用于后续实验。SP600125配制:利用100%DMSO溶解SP600125后,一次性过滤器过滤除菌,然后用无菌PBS稀释成浓度为100 mmol/L的母液备用。依据预实验将母液稀释到相应浓度后加入细胞培养基中作用于HeLa细胞。
1.3 CCK-8实验利用CCK-8法检测不同浓度SP600125(0、10、20、30、40、50 μmol/L)作用不同时间(24、48、72 h)后的HeLa细胞增殖情况,并以0.1%的DMSO溶剂进行对照。然后取对数生长期的HeLa细胞,利用0.25%胰酶消化并离心后,弃上清液并进行细胞计数,将细胞接种至96孔板,密度为1.0×105个/孔。待细胞稳定增殖后利用SP600125处理细胞且于不同时间点每孔加入1/10体积的CCK-8溶液,37℃、5%CO2培养箱继续培养2 h,在酶标仪上测定各孔450 nm处吸光度(OD)值,分别以浓度为横坐标和相对存活率为纵坐标,并利用Graphpad9.0软件计算并绘制细胞生长曲线图。
1.4 平板克隆实验将处于对数期的细胞消化,以1.0×105个/皿的浓度接种于6孔细胞培养板中,每皿加入2 ml培养基,使细胞均匀分布于37℃、5%CO2细胞培养箱中。待细胞贴壁,利用SP600125分别处理细胞24、48、72 h,更液再置于37℃、5%CO2细胞培养箱中继续培养10~14 d;待肉眼可观察到细胞克隆后弃去培养基,PBS小心润洗两次,用4%的多聚甲醛在室温固定20 min后弃液,PBS润洗1次。室温下利用结晶紫染色10 min,流水轻轻洗去染液并将其置于空气中干燥;最后普通照相机拍照后肉眼直接计数细胞的克隆数。
1.5 DAPI染色基于CCK-8的结果并参考前期研究结果[8],将SP600125处理HeLa细胞的浓度确定为20 μmol/L。胰酶消化细胞后将其接种于6孔细胞培养板中,每皿加入2 ml培养液,使其均匀分布于37℃、5%CO2细胞培养箱中。待细胞贴壁后用SP600125,分别培养24、48和72 h后,PBS洗涤1次,加入DAPI染色液(每孔500 μl),常温条件下静置5 min后吸除DAPI染色液,再用PBS洗涤细胞,重复两次,每次3 min,用荧光相差显微镜观察细胞形态变化。
1.6 细胞周期和细胞凋亡检测细胞周期检测:经20 μmol/L的SP600125分别作用于HeLa细胞(24、48、72 h)后,取对数生长期的各组细胞,利用胰蛋白酶进行消化,1 500 r/min离心5 min,弃上清液,加入预冷的PBS洗涤两次,离心弃上清液,再加入200 μl细胞周期快速检测试剂进行轻柔混匀,制成单细胞悬液,PI染色后室温避光20 min,最后置于流式细胞仪上进行检测,利用Modfit软件分析确定细胞周期分布。
细胞凋亡检测:取对数生长期的各组细胞,利用胰蛋白酶进行消化,收集悬浮的细胞于流式管中,离心弃上清液,4℃预冷PBS洗涤两次,加入500 μl的Binding Buffer结合缓冲液进行重悬细胞,调节其浓度为1.0×107个/毫升;取100 μl细胞悬浮于5 ml流式管中,加入5 μl Annexin V-PE和5 μl 7-氨基放线菌素(7-AAD)混匀,室温避光孵育15 min,于1 h内流式细胞仪上机检测,利用FlowJo软件分析细胞凋亡的比例。
1.7 划痕实验取对数生长期的细胞,用0.25%胰酶消化后进行细胞计数,再将其接种于6孔板中,调整密度为1.0×105个/孔。待细胞贴壁及稳定后用SP600125(20 μmol/L)分别处理24、48和72 h,利用200 μl移液器枪头沿着直尺垂直于背后的横线进行划痕,无菌PBS清洗细胞1次并去除划下的细胞;同时加入含2%FBS的培养基继续培养24、48和72 h,于倒置相差显微镜下进行观察测量并拍照,利用GraphPad 9.0软件分析SP600125对细胞迁移能力的影响。
1.8 Transwell实验利用无血清培养基稀释Matrigel基质胶,在Transewell小室中各加入100 μl的Matrigel基质胶(20~30微克/孔),置于37℃培养箱中待其凝固并出现“白色层”,取出小室并在每室中加入500 μl无血清培养基,放入37℃培养箱中进行水化30 min;然后吸掉已充分浸润基底膜后小室内的培养基;加入SP600125处理分别处理24、48和72 h:下室(侵袭小室外,24孔板孔内)中加500 μl含20 μmol/L SP600125的全培养基;空白组加不含药物全培养基;加药组:上室加300 μl已调节好细胞密度的细胞悬液(1×104个,含20 μmol/L SP600125的无血清培养基稀释);于37℃、5%CO2细胞培养箱继续培养;利用4%多聚甲醛固定20 min,再用棉签轻柔擦拭并去除小室内未浸过基底层膜的细胞,避免刺穿底层聚碳酸酯膜;然后在新的24孔板中分别加入500 μl结晶紫,再将侵袭小室浸入,室温下染色10 min,再用PBS冲洗掉多余的染料并自然晾干;然后在100倍的普通显微镜下随机选取5个视野进行拍照并进行细胞计数,取平均值来计算各孔穿过膜的细胞数量。
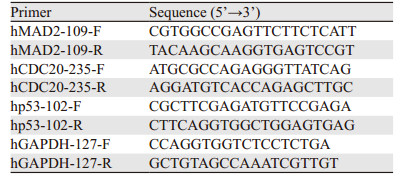
1.9 RNA提取和实时荧光定量PCR检测将细胞制成悬液,以1×106个细胞数接种于10 cm的细胞培养皿中,37℃、5%CO2培养箱中培养。24 h后更换培养液,选取20 μmol/L的SP600125分别处理细胞24、48、72 h。按照试剂盒说明提取RNA,再反转录合成cDNA,反转录体系为20 μl,然后将反转录体系稀释10倍。qRT-PCR反应体系为10 μl,包括:2×PCR Master Mix 5 μl;正反向引物工作液各0.3 μl;cDNA模板0.2 μl;无菌水10 μl。每个时间点均含3个复孔。PCR反应条件:94℃ 10 min;95℃ 5 s;60℃ 15 s;72℃ 10 s;40个循环,在ABI 7500实时荧光定量PCR系统中检测p53、Mad2L1和CDC20的mRNA表达水平,3个基因的相对表达按照2−ΔΔCT方法计算,目的基因的定量表达通过与内参基因GAPDH比较进行分析,利用SDS软件自动生成基因相对表达图谱,相关引物序列见表 1。
采用Western blot检测20 μmol/L SP600125作用不同时间点(24、48和72 h)后HeLa细胞中p53、Mad2L1和CDC20的蛋白水平。将对数生长期的细胞制成悬液,以1×106细胞数接种于24孔细胞培养板中,置于37℃、5%CO2培养箱中培养。24 h后更液,用20 µmol/L SP600125处理24、48、72 h,然后向各组细胞加入RIPA细胞裂解液,12 000 r/min 4℃离心10 min,取上清液,用BCA试剂盒测定总蛋白质浓度,将其分装并保存于-80℃冰箱。细胞裂解液经SDS-PAGE凝胶电泳后,用硝化纤维素膜电转系统转膜后进行免疫印迹,5%脱脂奶粉封闭2 h,4℃冰箱内孵育过夜。辣根过氧化酶标记的二抗孵育1 h,用ECL发光剂显色曝光。使用Bio-Rad Quantity One软件对目的条带进行图像分析并测定灰度值,用GAPDH作为内参表示各组相对表达量,且每组各时间点的取样结果重复3次,步骤均按照SDS-PAGE凝胶配制试剂盒标准流程进行操作(蛋白质上样量均为20 µg),再用图像分析软件Image J对图像进行灰度分析。
1.11 统计学方法实验均独立重复3次,所有实验数据均采用GraphPad Prism 9和SPSS26.0统计软件处理,用Adobe Illustrator Cs 7计算机软件制图。计量资料以均值±标准差(x±s)表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析(one-way ANOVA),P < 0.05为差异有统计学意义。
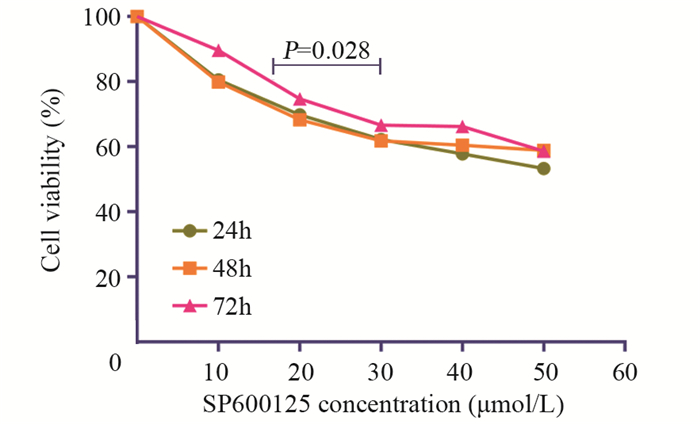
2 结果 2.1 SP600125对宫颈癌HeLa细胞增殖活力的影响CCK-8结果显示,与对照组相比,不同浓度(10, 20, 30, 40, 50 μmol/L)的SP600125作用24 h后细胞增殖均受到明显抑制,差异具有统计学意义(P < 0.05);10、20和30 μmol/L SP600125作用48 h和72 h后细胞增殖的抑制效果比较明显;40和50 μmol/L SP600125作用48和72 h后对细胞增殖的抑制效果不明显。以上结果表明20和30 μmol/L SP600l25抑制细胞增殖呈一定浓度时间依赖性,可能是20 μmol/L SP600125对细胞的抑制作用达到了峰值,故在加大浓度和延长时间后,对细胞的影响不明显,见图 1。为尽量降低药物本身对肿瘤细胞的不良反应,故在后续实验中选择20 μmol/L SP600125。
|
| 图 1 SP600125对宫颈癌HeLa细胞增殖的抑制作用 Figure 1 Inhibitory effect of SP600125 on proliferation of cervical cancer HeLa cells |
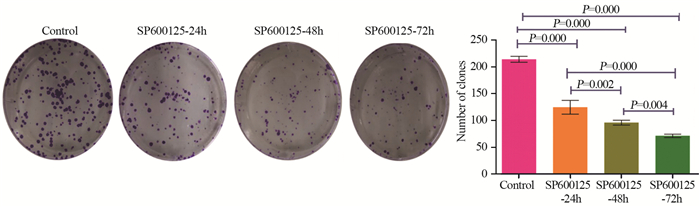
平板克隆实验结果显示,与对照组相比,20 μmol/L SP600125处理HeLa细胞24、48和72 h后细胞克隆数分别为(124.67±12.86)、(96.00±4.58)和(71.33±3.22),差异具有统计学意义(P < 0.001)。以上结果表明,经SP600125处理HeLa细胞不同时间后细胞克隆数明显减少,并随着药物处理时间的延长,抑制克隆形成能力越显著,结果与CCK-8结果相符,见图 2。说明SP600125可明显降低HeLa细胞的克隆能力。
|
| 图 2 SP600125处理不同时间对HeLa细胞克隆形成能力的影响(×100) Figure 2 Effects of SP600125 treatment on clonal formation ability of HeLa cells at different time points (×100) |
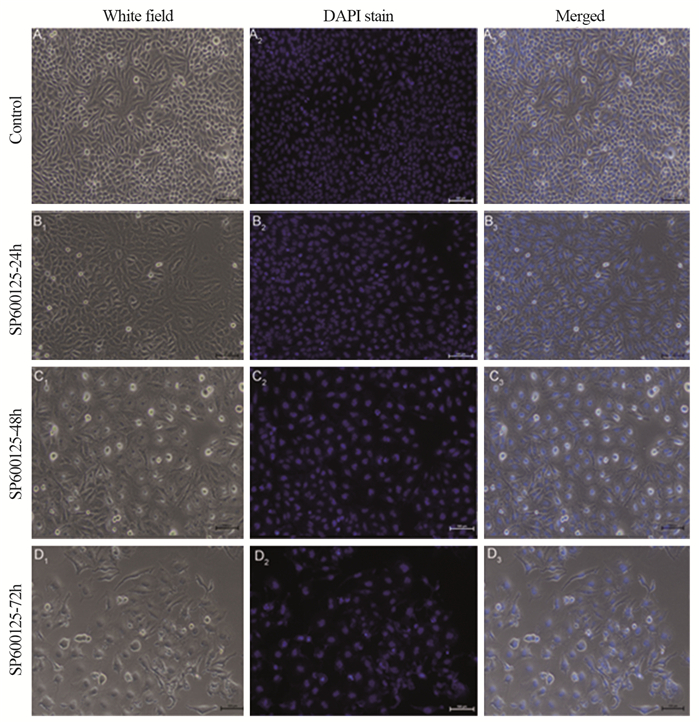
DAPI染核观察结果显示,对照组中的细胞大部分处于间歇期,核膜核仁清晰且核膜完整,呈蓝色,细胞大小匀称,见图 3A2。SP600125处理细胞24 h组可见少量皱缩变形的细胞核,见图 3B2。SP600125处理细胞48和72 h组在一个视野内可见细胞密度明显减少,出现较多亮白的淡蓝色荧光凋亡小体且核膜皱缩,绝大部分细胞处于有丝分裂相且存在多核细胞比例增加和核区碎裂,见图 3C2和D2,这可能与细胞有丝分裂的过程中细胞DNA因胞质分裂失败杂乱排列有关。以上结果表明SP600125能够破坏细胞核的结构而引起HeLa细胞发生G2/M期的阻滞。
|
| 图 3 倒置相差荧光显微镜观察SP600125作用后宫颈癌HeLa细胞的凋亡形态(×200) Figure 3 Morphology of apoptotic cervical cancer HeLa cells treated with SP600125 observed by inverted phase contrast fluorescence microscopy (×200) |
流式细胞术检测结果显示,正常的活细胞不被染色;凋亡早期细胞仅被Annexin V-FITC染色,不被PI染色;凋亡晚期及坏死细胞可同时被Annexin V-FITC和PI染色。20 μmol/L的SP600125处理0、24、48、72 h后HeLa细胞总凋亡率分别为(13.24±0.50)、(23.95±0.11)、(46.00±0.82)和(48.27±0.26),差异有统计学意义(P < 0.001),见图 4。以上结果表明随SP600125处理时间的延长,细胞凋亡率显著提高,SP600125可以诱导HeLa细胞发生凋亡。
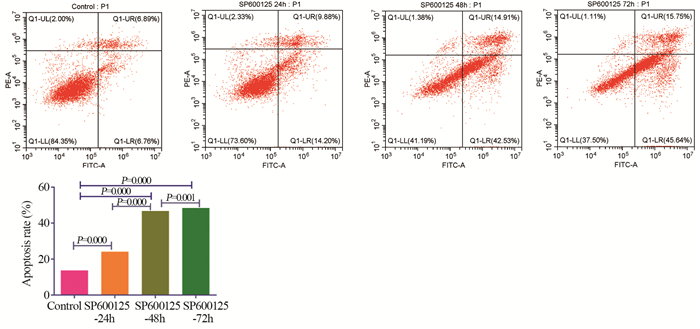
|
| 图 4 流式细胞仪检测SP600125对宫颈癌HeLa细胞凋亡的影响 Figure 4 Effects of SP600125 on apoptosis of cervical cancer HeLa cells detected by flow cytometry |
流式细胞术检测结果显示:对照组G1期的2N峰细胞含量占比为64.79%,G2/M期的4N峰细胞含量占比为6.07%;SP600125处理24 h后,细胞总量减少,G1期的2N峰细胞含量占比降低至54.88%,而G2/M期的4N峰细胞含量占比提高为17.29%;SP600125处理48 h后,G1期的2N峰细胞含量比率下降至36.16%,而G2/M期的4N峰细胞含量占比提高至28.64%;SP600125处理72 h后,G1期的2N峰细胞含量占比为37.53%,而G2/M期的4N峰细胞含量占比为29.24%,差异具有统计学意义(P < 0.01),见图 5。结果表明,SP600125处理HeLa细胞24和48 h的G1期比例明显降低而G2/M期明显升高,此结果与CCK-8细胞增殖实验结果相符。
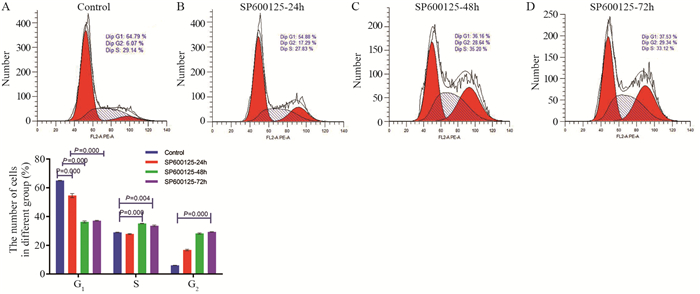
|
| 图 5 流式细胞术检测SP600125对HeLa细胞周期的影响 Figure 5 Effect of SP600125 on HeLa cell cycle detected by flow cytometry |
细胞划痕实验检测结果显示,对照组和SP600125作用HeLa细胞24 h组,在48和72 h时间点已经全部愈合,而SP600125作用48和72 h组HeLa细胞的迁移能力明显减弱,差异具有统计学意义(P < 0.05),见图 6。结果表明,SP600125处理细胞后一定程度上抑制了HeLa细胞的迁移能力且具有时间依赖性。
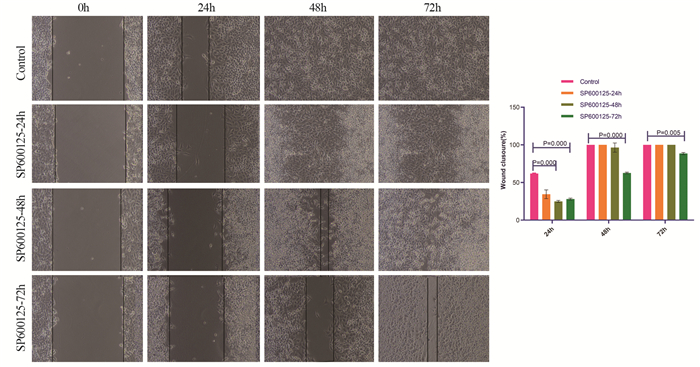
|
| 图 6 划痕试验检测SP600125对HeLa细胞迁移能力的影响(×100) Figure 6 Effect of SP600125 on migration of cervical cancer HeLa cells assessed by wound-healing assay (×100) |
Transwell检测结果显示,对照组和SP600125处理24 h组穿过Transwell小室的细胞数分别为78.67±3.53和61.67±5.03;对照组和SP600125处理48 h组穿过Transwell小室的细胞数分别为160.00±3.53和112.00±3.53;对照组和SP600125处理72 h组穿过Transwell小室的细胞数分别为232.67±3.53和133.67±3.53。20 μmol/L的SP600125作用不同时间点的细胞迁移能力明显低于相同时间点的对照组细胞,差异具有统计学意义(P < 0.001),见图 7。以上结果表明SP600125在一定程度上抑制了宫颈癌细胞的侵袭能力,与划痕实验结果一致。
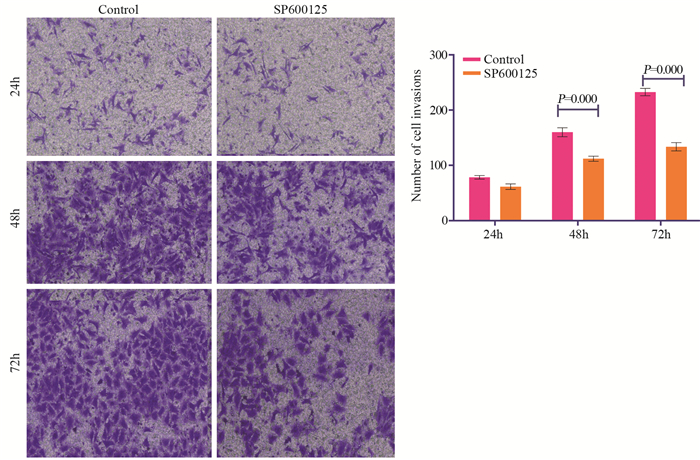
|
| 图 7 Transwell检测SP600125对HeLa细胞侵袭能力的影响(×200) Figure 7 Effect of SP600125 on HeLa cell invasion measured by Transwell assay (×200) |
qRT-PCR检测结果显示:与对照组相比,SP600125处理组HeLa细胞中p53和CDC20 mRNA的表达均显著增加,差异均具有统计学意义(P < 0.05);而Mad2L1 mRNA的表达随着SP600125作用时间的延长呈明显下降趋势,且差异无统计学意义。SP600125作用于各时间点(24、48和72 h)的HeLa细胞中的p53表达量分别为(1.97±0.30)(1.75±0.46)和(1.41±0.21);Mad2L1的表达量分别为(0.58±0.30)(0.50±0.26)和(0.13±0.12);CDC20的表达量分别为(1.32±0.11)(1.39±0.34)和(2.05±0.35),见图 8。
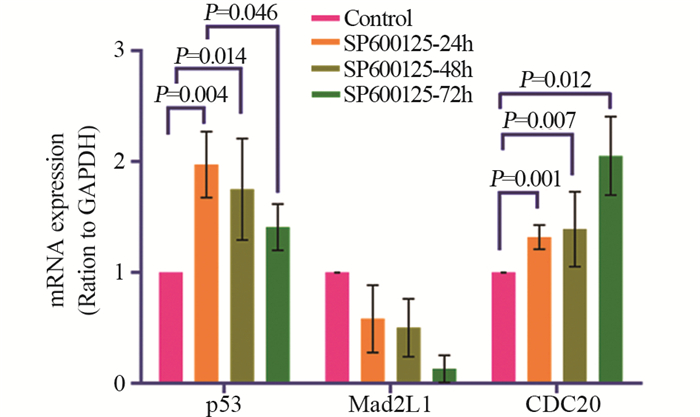
|
| 图 8 qRT-PCR检测HeLa细胞中p53、Mad2L1和CDC20 mRNA的表达水平 Figure 8 Expression of p53, Mad21 and CDC20 mRNA in HeLa cells detected by qRT-PCR |
Western blot检测结果显示:与对照组相比,SP600125处理组HeLa细胞中p53和CDC20蛋白的表达均显著增加,差异均具有统计学意义(P < 0.01);而MAD2L1蛋白的表达随着SP600125作用时间的延长呈下降趋势,且差异无统计学意义。SP600125作用于各时间点(24、48和72 h)的HeLa细胞中p53的蛋白表达量分别为(0.39±0.00)、(0.37±0.00)和(0.35±0.00);MAD2L1的蛋白表达量分别为(0.57±0.24)、(0.53±0.21)和(0.26±0.22);CDC20的蛋白表达量分别为(0.38±0.09)、(0.85±0.20)和(0.87±0.11),这均与qRT-PCR结果相一致,见图 9。研究结果表明SP600125对人宫颈癌HeLa细胞的增殖、侵袭转移具有较明显的抑制作用,这可能与Mad2L1的表达下调以及p53和CDC20的表达上调密切相关,结果提示Mad2L1低表达可能是导致宫颈癌变发生过程中的早期事件,而p53和CDC20高表达是促进宫颈癌变发生发展的致癌因子。
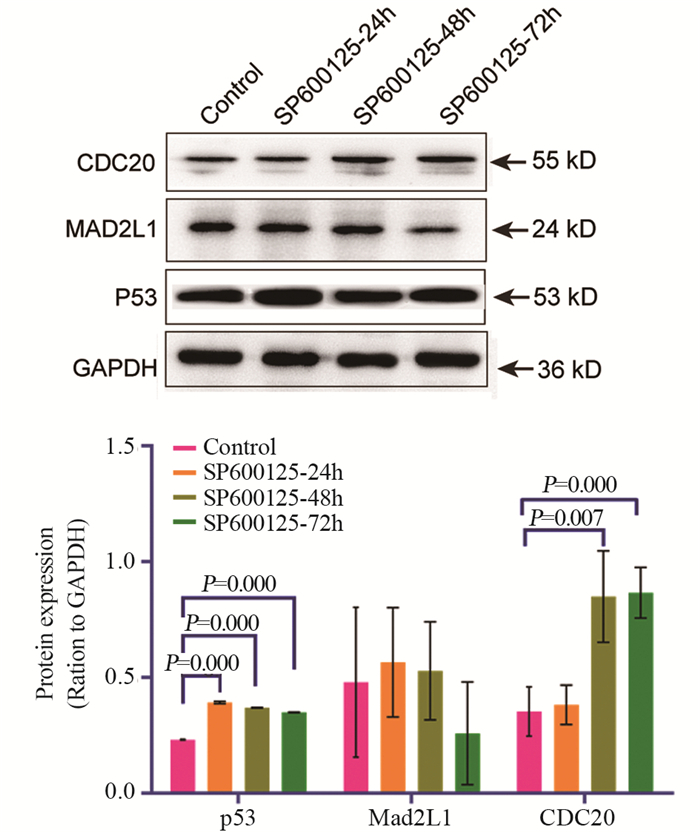
|
| 图 9 Western blot检测HeLa细胞中p53、MAD2L1和CDC20的蛋白表达 Figure 9 Expression of p53, Mad2L1 and CDC20 in HeLa cells detected by Western blot |
据2020年全球最新癌症数据显示,宫颈癌在女性所有癌症中的发病率和死亡率均位列第四,中国宫颈癌的发病率和死亡率分别位于世界第一位和第二位,严重威胁女性的生命健康[11]。大多数晚期或已转移的宫颈癌患者都会出现癌细胞迁移和侵袭,治疗方案有限且不良反应大。肿瘤细胞的侵袭和转移是一个涉及多种遗传因素变化的复杂过程。
SP600125作为一种可逆和可渗透细胞的ATP竞争性JNK抑制剂,已广泛应用于体内外细胞和动物实验研究。既往研究表明在人类肿瘤细胞和组织中,一定剂量范围内的SP600125通过抑制c-Jun的磷酸化,进而抑制下游Bax、Caspase-3和Caspase-9的表达来促进细胞凋亡[12-13]。高天[14]研究发现柴胡皂苷(SSd)和SP600125联合可以抑制人骨肉瘤U-2OS细胞的迁移、增殖和侵袭能力,并促进其凋亡。Qin等[15]研究表明SP600125可以抑制食管癌Eca109细胞的增殖、迁移和凋亡。周燕红等[16]的研究将FN诱导和JNK特异性抑制剂SP600125联合用于大肠癌LoVo细胞中,结果证明SP600125能明显减少FN诱导的大肠癌LoVo细胞的运动和侵袭力。许雪梅[17]研究结果表明SP600125处理人舌癌Tca8U3细胞后能够明显抑制Tca8113细胞的增殖和迁移。Jemaà等[18]观察到SP600125对p53缺陷的肿瘤细胞具有选择性杀伤作用。陈新艳[19]研究证明SB202190和SP600125联合使用可以对奥拉帕尼耐药卵巢癌细胞的生长和侵袭能力产生抑制。上述结果表明,SP600125可在不同类型的肿瘤中表现出不同程度的抑制作用。虽然国外学者[20]研究显示SP600125对宫颈癌HeLa细胞具有明显的抑制作用并能引起纺锤体形态结构畸形而产生抗肿瘤的效果,但其具体机制尚未阐明。为了探究SP600125抗宫颈癌的具体作用机制,本研究通过CCK-8实验研究结果表明SP600125可以有效阻止宫颈癌HeLa细胞的增殖,利用DAPI染色和流式细胞术检测进一步表明SP600125能够诱导HeLa细胞发生凋亡,并将细胞周期阻滞在G2/M期,通过细胞划痕和Transwell实验观察到SP600125可明显抑制宫颈癌HeLa细胞的迁移和侵袭能力,本研究结果表明宫颈癌HeLa细胞的增殖和迁移与JNK信号通路密切相关,并与上述相关研究结果一致。
p53作为重要的抑癌基因,对维持基因组的稳定与调控细胞周期检测点具有重要作用[21-22]。当DNA发生损伤或原癌基因突变可导致p53激活,使其在细胞内的蛋白表达水平迅速升高,从而引起下游相关靶基因的应激反应,并且对G1/S和G2/M期细胞以及有丝分裂期进行周期调控[21, 23]。纺锤体组装检查点在有丝分裂过程中精细调控动粒与微管之间的动态平衡,是确保细胞在有丝分裂过程中经染色体复制后可将遗传物质稳定且准确分配到每一个子细胞中[24]。作为p53下游的SAC关键靶基因如有丝分裂阻滞缺陷蛋白-2(mitotic arrest deficient-2, Mad2)和细胞分裂周期蛋白(cell division cycle 20, CDC20)的表达水平异常而产生的异倍体细胞可进一步导致基因组的不稳定性增加,并与肿瘤细胞的增殖活性、恶性程度、侵袭与转移、患者的不良预后以及耐药性等密切相关[25]。有研究发现在多种体外培养的肿瘤细胞系如卵巢癌、肺癌和宫颈癌等[26-28]中Mad2低表达,可增加有丝分裂错误的发生概率,并与染色体的不稳定性增加和多倍体或非整倍体细胞的产生导致细胞发生癌变有关[25]。侵袭和转移的发生是导致宫颈癌患者生存率低、死亡率高的主要原因。因此,探寻宫颈癌转移及进展的机制,寻找预测宫颈癌发生及进展新的潜在分子靶点具有重要临床价值。作为调控细胞周期进展的关键基因CDC20在染色体分离和有丝分裂退出中起着重要的作用[29]。近年来多项研究发现CDC20参与肿瘤的发生与发展,与肿瘤细胞的增殖、凋亡、黏附及侵袭等密切相关。然而CDC20在宫颈癌侵袭转移中的作用及潜在机制的研究目前尚未见相关报道。在多种人类肿瘤如前列腺癌、胶质母细胞瘤、膀胱癌、乳腺癌、口腔癌、淋巴瘤和肺腺癌等中CDC20高表达,可通过促进上皮间质转化来促进肿瘤的发生发展,且与肿瘤患者的临床阶段、病理程度、预后密切相关[30-31]。Guo等[32]研究表明,与胰腺癌患者正常邻近组织相比,在胰腺肿瘤组织中CDC20过度表达,利用长链非编码核糖核酸(SPRY4-IT1)的抑制剂可以明显降低胰腺癌细胞中CDC20的表达,从而可明显抑制胰腺癌细胞的增殖、凋亡以及侵袭。此外,最新研究还发现CDC20蛋白过表达可增强癌细胞的增殖和侵袭,Cheng等[33]研究发现敲低CDC20基因能够抑制具有化疗耐药性的胰腺癌PANC-1细胞和转移性人乳腺癌MDA-MB-231细胞的迁移能力。有研究表明通过调节JNK信号通路影响癌细胞的侵袭和迁移能力[34]。然而,CDC20在肿瘤转移过程中的功能仍有待完全阐明。
课题组前期研究已证实SP600125通过对p53通路和纺锤体组装检验点相关基因表达的调控使分裂细胞阻断在M期,进而诱导细胞产生多倍化[6]。CDC20在宫颈癌中高表达并且促进宫颈癌细胞的侵袭和迁移,而且CDC20可以影响JNK的激活。本研究结果表明加入JNK抑制剂SP600125后,宫颈癌HeLa细胞的侵袭和迁移能力明显减弱,实验结果与Qin[15]和许雪梅等[17]的研究结果一致。这表明宫颈癌HeLa细胞的增殖和迁移都与JNK信号通路有关。在此基础上,进一步结合SP600125能够有效阻断有丝分裂异常产生异倍体从而导致基因组不稳定与肿瘤发生发展密切相关这一特性,本研究通过qRT-PCR和Western blot结果进一步验证SP600125可以通过上调p53和CDC20以及下调Mad2基因表达,影响肿瘤细胞增殖、凋亡并将细胞周期阻滞于G2/M期,从而破坏有丝分裂纺锤体的形成来抑制肿瘤细胞的增殖、克隆、迁移和侵袭,提示宫颈癌变发生过程中的早期事件可能是SAC基因的异常表达。以上研究结果提示Mad2低表达可能是恶性宫颈癌发生发展的较早期事件,CDC20的高表达提示其在人类肿瘤组织和细胞中大量表达并对肿瘤生长和侵袭具有促进作用。基于多组生信数据分析,研究发现CDC20的异常表达与各种肿瘤细胞的增殖、病理分期、侵袭转移以及患者的预后和免疫细胞浸润密切相关[35-36]。本研究中, 经SP600125作用后的宫颈癌HeLa细胞中p53和CDC20的mRNA和蛋白高表达,提示其与人宫颈癌HeLa细胞的增殖、转移侵袭密切相关,而Mad2L1 mRNA和蛋白低表达,提示与宫颈癌早期癌变密切相关。然而,关于CDC20在宫颈癌迁移和侵袭过程中发挥的作用及调控机制还有待进一步探讨,以期为宫颈癌的基因治疗提供新的靶点。同时,SP600125在体内外应用中不良反应较小且具有作为抗癌治疗药物的良好潜力,其具体作用机制后续可从Wnt/β-catenin的信号分子通路来进一步阐明。
作者贡献:
莫艳秀:实验设计及操作,数据统计分析,文章撰写
姚飞虹、李木兰:实验操作
刘峻彤、胡紫昂:数据统计分析
| [1] |
Lindeque G. A perspective on cervical cancer prevention and screening in Africa[J]. Int J Gynecol Obstet, 2021, 152(1): 133-134. DOI:10.1002/ijgo.13476 |
| [2] |
Kops GJ, Weaver BA, Cleveland DW. On the road to cancer: aneuploidy and the mitotic checkpoint[J]. Nat Rev Cancer, 2005, 5(10): 773-785. DOI:10.1038/nrc1714 |
| [3] |
Wu Q, Wu W, Jacevic V, et al. Selective inhibitors for JNK signalling: a potential targeted therapy in cancer[J]. J Enzyme Inhib Med Chem, 2020, 35(1): 574-583. DOI:10.1080/14756366.2020.1720013 |
| [4] |
Bennett BL, Sasaki DT, Murray BW, et al. SP600125, an anthrapyrazolone inhibitor of Jun N-terminal kinase[J]. Proc Natl Acad Sci U S A, 2001, 98(24): 13681-13686. DOI:10.1073/pnas.251194298 |
| [5] |
Zhou Y, Jiang M, Wang M, et al. Effect of SP600125 on proliferation of embryonic stem cell[J]. Am J Mol Biol, 2013, 3(2): 67-71. DOI:10.4236/ajmb.2013.32009 |
| [6] |
莫艳秀. SP600125诱导鱼类细胞多倍化的分子机制研究[D]. 长沙: 湖南师范大学, 2019. [Mo YX. Molecular mechanism of SP600125-induced cell polyploidization in fish[D]. Changsha: Hunan Normal University, 2019.]
|
| [7] |
Kim JH, Chae M, Choi AR, et al. SP600125 overcomes antimitotic drug-resistance in cancer cells by increasing apoptosis with independence of P-gp inhibition[J]. Eur J Pharmacol, 2014, 723: 141-147. DOI:10.1016/j.ejphar.2013.11.026 |
| [8] |
Xu W, Mo Y, He Y, et al. A New Method for Chromosomes Preparation by ATP-Competitive Inhibitor SP600125 via Enhancement of Endomitosis in Fish[J]. Front Bioeng Biotechnol, 2021, 8: 606496. DOI:10.3389/fbioe.2020.606496 |
| [9] |
Schvartzman JM, Sotillo R, Benezra R. Mitotic chromosomal instability and cancer: mouse modelling of the human disease[J]. Nat Rev Cancer, 2010, 10(2): 102-115. DOI:10.1038/nrc2781 |
| [10] |
Sarkar S, Sahoo PK, Mahata S, et al. Mitotic checkpoint defects: en route to cancer and drug resistance[J]. Chromosome Res, 2021, 29(2): 131-144. DOI:10.1007/s10577-020-09646-x |
| [11] |
Arbyn M, Gultekin M, Morice P, et al. The European response to the WHO call to eliminate cervical cancer as a public health problem[J]. Int J Cancer, 2021, 148(2): 277-284. DOI:10.1002/ijc.33189 |
| [12] |
Lee HJ, Wang CJ, Kuo HC, et al. Induction apoptosis of luteolin in human hepatoma HepG2 cells involving mitochondria translocation of Bax/Bak and activation of JNK[J]. Toxicol Appl Pharmacol, 2005, 203(2): 124-131. DOI:10.1016/j.taap.2004.08.004 |
| [13] |
Lu Z, Chen H, Zheng XM, et al. Experimental study on the apoptosis of cervical cancer Hela cells induced by juglone through c-Jun N-terminal kinase/c-Jun pathway[J]. Asian Pac J Trop Med, 2017, 10(6): 572-575. DOI:10.1016/j.apjtm.2017.06.005 |
| [14] |
高天. 单独或联合应用柴胡皂苷D和JNK抑制剂SP600125对人骨肉瘤U-2OS细胞的影响[D]. 南昌: 南昌大学, 2019. [Gao T. Use of Saikosaponin D and JNK inhibitor SP6oo125, alone or in combination, inhibits malignant properties of human osteosarcoma U-2OS cells[D]. Nanchang: Nanchang University, 2019.]
|
| [15] |
Qin X, Zheng S, Liu T, et al. Roles of phosphorylated JNK in Esophageal Squamous Cell Calcinoma of Kazakh Ethnic[J]. Mol Carcinog, 2014, 53(7): 526-536. DOI:10.1002/mc.22004 |
| [16] |
周燕红, 何小飞, 高卉, 等. JNK信号通路在大肠癌侵袭和转移中的作用及机制[J]. 世界华人消化杂志, 2009, 17(21): 2142-2146. [Zhou YH, He XF, Gao H, et al. Mechanisms underlying the role of JNK signaling pathway in the invasion and metastasis of colon cancer cells[J]. Shijie Hua Ren Xiao Hua Za Zhi, 2009, 17(21): 2142-2146. DOI:10.3969/j.issn.1009-3079.2009.21.005] |
| [17] |
许雪梅. JNK抑制剂SP600125对人舌鳞癌Tca8113细胞增殖、迁移的影响[D]. 延吉: 延边大学, 2017. [Xu XM. Effects of JNK inhibitor SP600125 on proliferation and migration of Human Tongue Squamous Carcinoma Tca8113 cells[D]. Yanji: Yanbian University, 2017.]
|
| [18] |
Jemaà M, Vitale I, Kepp O, et al. Selective killing of p53-deficient cancer cells by SP600125[J]. EMBO Mol Med, 2012, 4(6): 500-514. DOI:10.1002/emmm.201200228 |
| [19] |
陈新艳. 丝裂原活化蛋白激酶抑制剂逆转卵巢癌细胞奥拉帕尼耐药性的试验研究[D]. 济南: 山东大学, 2019. [Chen XY. Mitogen-activated protein kinase inhibitors increase sensitivity of olaparib-resistant ovarian cancer[D]. Ji'nan: Shandong University, 2019.]
|
| [20] |
Mili D, Abid K, Rjiba I, et al. Effect of SP600125 on the mitotic spindle in HeLa Cells, leading to mitotic arrest, endoreduplication and apoptosis[J]. Mol Cytogenet, 2016, 9: 86. DOI:10.1186/s13039-016-0296-y |
| [21] |
Agarwal ML, Agarwal A, Taylor WR, et al. p53 controls both the G2/M and the G1 cell cycle checkpoints and mediates reversible growth arrest in human fibroblasts[J]. Proc Natl Acad Sci U S A, 1995, 92(18): 8493-8497. DOI:10.1073/pnas.92.18.8493 |
| [22] |
Aylon Y, Oren M. p53: guardian of ploidy[J]. Mol Oncol, 2011, 5(4): 315-323. DOI:10.1016/j.molonc.2011.07.007 |
| [23] |
Sun C, Li M, Feng Y, et al. MDM2-P53 signaling pathway-mediated upregulation of CDC20 promotes progression of human diffuse large B-cell lymphoma[J]. Onco Targets Ther, 2020, 13: 10475-10487. DOI:10.2147/OTT.S253758 |
| [24] |
Musacchio A, Salmon ED. The spindle-assembly checkpoint in space and time[J]. Nat Rev Mol Cell Biol, 2007, 8(5): 379-393. |
| [25] |
Barbosa J, Nascimento AV, Faria J, et al. The spindle assembly checkpoint: perspectives in tumorigenesis and cancer therapy[J]. Front Biol, 2011, 6(2): 147-155. DOI:10.1007/s11515-011-1122-x |
| [26] |
Furlong F, Fitzpatrick P, O'Toole S, et al. Low MAD2 expression levels associate with reduced progression-free survival in patients with high-grade serous epithelial ovarian cancer[J]. J Pathol, 2012, 226(5): 746-755. DOI:10.1002/path.3035 |
| [27] |
Takahashi T, Haruki N, Nomoto S, et al. Identification of frequent impairment of the mitotic checkpoint and molecular analysis of the mitotic checkpoint genes, hsMAD2 and p55CDC, in human lung cancers[J]. Oncogene, 1999, 18(30): 4295-4300. DOI:10.1038/sj.onc.1202807 |
| [28] |
Wang L, Wang J, Jin Y, et al. Downregulation of Mad2 and BubR1 increase the malignant potential and nocodazole resistance by compromising spindle assembly checkpoint signaling pathway in cervical carcinogenesis[J]. J Obstet Gynaecol Res, 2019, 45(12): 2407-2418. DOI:10.1111/jog.14120 |
| [29] |
Clijsters L, Ogink J, Wolthuis R. The spindle checkpoint, APC/C(Cdc20), and APC/C(Cdh1) play distinct roles in connecting mitosis to S phase[J]. J Cell Biol, 2013, 201(7): 1013-1026. DOI:10.1083/jcb.201211019 |
| [30] |
Wang S, Chen B, Zhu Z, et al. CDC20 overexpression leads to poor prognosis in solid tumors: a system review and meta-analysis[J]. Medicine(Baltimore), 2018, 97(52): e13832. |
| [31] |
齐晓光, 祁春艳, 秦博宇, 等. 基于TCGA数据库筛选和鉴定肺腺癌免疫治疗临床获益关键基因[J]. 肿瘤防治研究, 2020, 47(11): 839-845. [Qi XG, Qi CY, Qin BY, et al. Screening and Identification of Key Genes for Clinical Benefit of Immunotherapy on Lung Adenocarcinoma Based on TCGA Database[J]. Zhong Liu Fang Zhi Yan Jiu, 2020, 47(11): 839-845. DOI:10.3971/j.issn.1000-8578.2020.20.0115] |
| [32] |
Guo W, Zhong K, Wei H, et al. Long non-coding RNA SPRY4-IT1 promotes cell proliferation and invasion by regulation of Cdc20 in pancreatic cancer cells[J]. PLoS One, 2018, 13(2): e0193483. DOI:10.1371/journal.pone.0193483 |
| [33] |
Cheng S, Castillo V, Sliva D. CDC20 associated with cancer metastasis and novel mushroom-derived CDC20 inhibitors with antimetastatic activity[J]. Int J Oncol, 2019, 54(6): 2250-2256. |
| [34] |
Supsavhad W, Hassan BB, Simmons JK, et al. Effect of Dickkopf-1 (Dkk-1) and SP600125, a JNK Inhibitor, on Wnt Signaling in Canine Prostate Cancer Growth and Bone Metastases[J]. Vet Sci, 2021, 8(8): 153. DOI:10.3390/vetsci8080153 |
| [35] |
Xiong C, Wang Z, Wang G, et al. Identification of CDC20 as an immune infiltration-correlated prognostic biomarker in hepatocellular carcinoma[J]. Invest New Drugs, 2021, 39(5): 1439-1453. DOI:10.1007/s10637-021-01126-1 |
| [36] |
Zhang Q, Huang H, Liu A, et al. Cell division cycle 20 (CDC20) drives prostate cancer progression via stabilization of beta-catenin in cancer stem-like cells[J]. EBio Medicine, 2019, 42: 397-407. |
 2022, Vol. 49
2022, Vol. 49