文章信息
- 放化疗与单纯化疗对原发纵隔大B细胞淋巴瘤患者生存的影响比较
- Effects of Chemoradiotherapy Versus Chemotherapy Alone on Survival of Patients with Primary Mediastinal Large B-cell Lymphoma
- 肿瘤防治研究, 2022, 49(3): 205-212
- Cancer Research on Prevention and Treatment, 2022, 49(3): 205-212
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2022.21.0716
- 收稿日期: 2021-06-21
- 修回日期: 2021-10-25
原发纵隔大B细胞淋巴瘤是一种罕见且独特的淋巴瘤类型,占所有非霍奇金淋巴瘤的2%~4%[1],在世界卫生组织分类中被定义为一个独特的临床病理实体[2-3]。原发纵隔大B细胞淋巴瘤与结节性霍奇金淋巴瘤在组织病理特征和临床表现上有相似之处,临床多表现为纵隔肿块,患者常出现咳嗽、呼吸困难、胸痛和上腔静脉综合征[4]。
原发纵隔大B细胞淋巴瘤患者对治疗反应较好、生存期较长,研究报道患者在2~3年生存曲线上呈现平台期,晚期复发并不常见[5-6]。因此,选择治疗方案时应充分考虑放疗和化疗药物的不良反应,在提高治愈率和降低死亡风险之间取得平衡[7],尤其对于年轻女性患者,放疗有引起乳腺癌及心肺功能损伤的风险[8-10]。原发纵隔大B细胞淋巴瘤临床发病率较低,缺乏大样本的临床研究,目前尚无标准的治疗方案。为了进一步明确原发纵隔大B细胞淋巴瘤的临床特征以及治疗策略对患者生存的影响,本研究回顾性分析了2001—2015年间SEER数据库中统计的原发纵隔大B细胞淋巴瘤患者资料,以期指导临床治疗方案的选择。
1 资料与方法 1.1 病例选择本研究从SEER Stat软件中获取了2001年至2015年诊断为原发纵隔大B细胞淋巴瘤患者的信息。由于2016年确诊患者的分期未明,因此不再纳入研究中。纳入标准:(1)肿瘤学国际分类ICD-0-3编码为C9679/3;(2)诊断年份为2001—2015年;(3)病理活检确诊。排除标准:(1)临床数据不完整;(2)尸检确诊。根据上述标准,共确定了635例原发纵隔大B细胞淋巴瘤患者,本研究分析包括以下人口统计学和临床变量:年龄、性别、种族、诊断年份、婚姻状况、手术、放疗、化疗、生存月数、生存状况和死因。
一项研究[11]表明在美国的弥漫大B细胞淋巴瘤患者中,利妥昔单抗联合化疗方案的应用比例从2000年的11%上升到2007年的76%,并且美国食品药品监督管理局(Food and Drug Administration, FDA)于2006年推荐使用利妥昔单抗,在2006年之后,绝大多数原发纵隔大B细胞淋巴瘤患者使用了利妥昔单抗治疗。因此我们以2006年为界,分析利妥昔单抗时代前后接受不同治疗的患者的生存情况。
1.2 统计学方法使用SEER Stat(版本8.3.9)计算美国每100 000人中的原发纵隔大B细胞淋巴瘤的发病率,并将年龄调整为2 000个美国标准人口。使用SPSS21.0和R-Project(版本3.5.3)进行统计分析。采用Kaplan-Meier法进行生存分析,组间差异比较采用Log rank检验。Cox比例风险模型进行单因素和多因素分析,计算危险比(HR)。双侧P值均 < 0.05,表示差异有统计学意义。
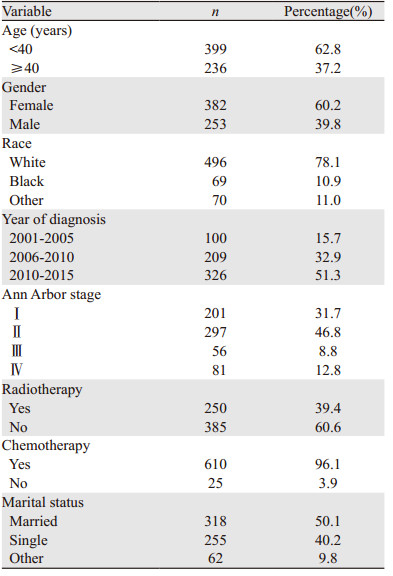
2 结果 2.1 临床资料特征本研究纳入SEER数据库中2001—2015年确诊的635例原发纵隔大B细胞淋巴瘤患者,见图 1。其中男性253例(39.8%),女性382例(60.2%),确诊时的中位年龄为36岁(范围为9~94岁),年龄 < 40岁的患者399例(62.8%),Ann Arbor分期Ⅰ~Ⅱ期患者498例(78.4%)。在治疗方面,接受化疗者610例(96.1%),接受放疗者250例(39.4%)。随访结束时有103例(16.2%)死亡,其中死于该肿瘤的有76例(73.8%),见表 1。

|
| 图 1 筛选符合条件患者的流程图 Figure 1 Flow chart for selecting eligible patients |
|
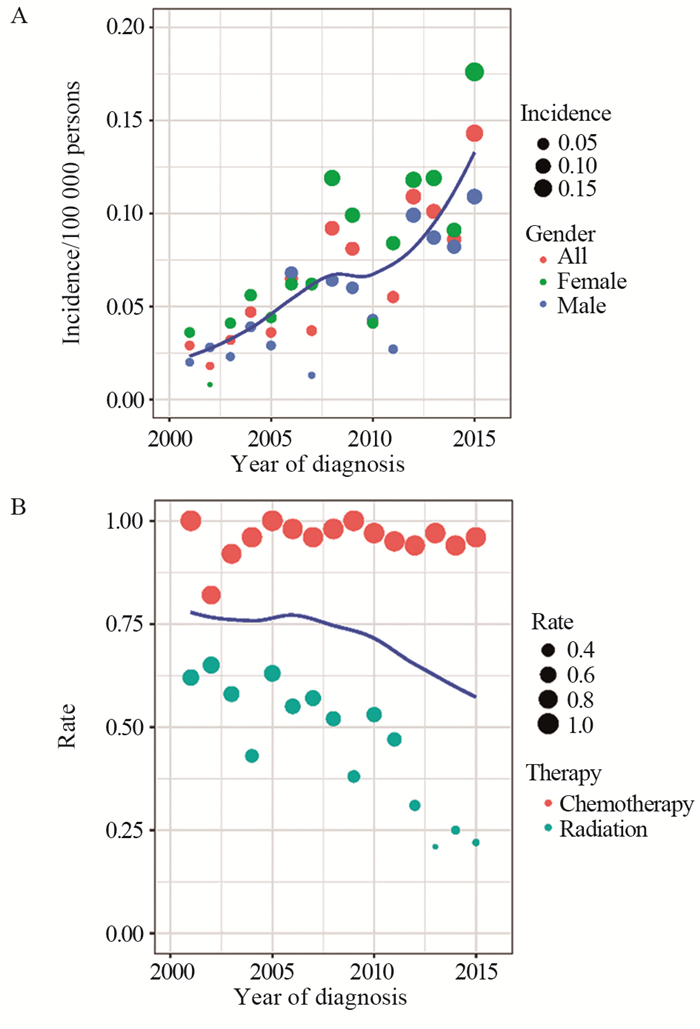
原发纵隔大B细胞淋巴瘤在2001—2015年的发病率呈相对稳定上升趋势,女性患者发病率高于男性患者,见图 2A。2001—2015年接受放疗的患者比例呈下降趋势,接受化疗的患者比例较为稳定,见图 2B。2001—2005年接受放疗的患者57例(57.0%),2006—2015年接受放疗的患者193例(36.1%),接受放疗的患者比例逐渐降低(χ2=15.455, P < 0.001),两组间其他一般资料未见明显差异,见表 2。
|
| 图 2 原发纵隔大B细胞淋巴瘤的年发病率趋势(A)及接受不同治疗策略的患者比例变化(B) Figure 2 Annual incidence trends of primary mediastinal large B-cell lymphoma(A) and changes in proportion of patients receiving different treatment strategies(B) |
|
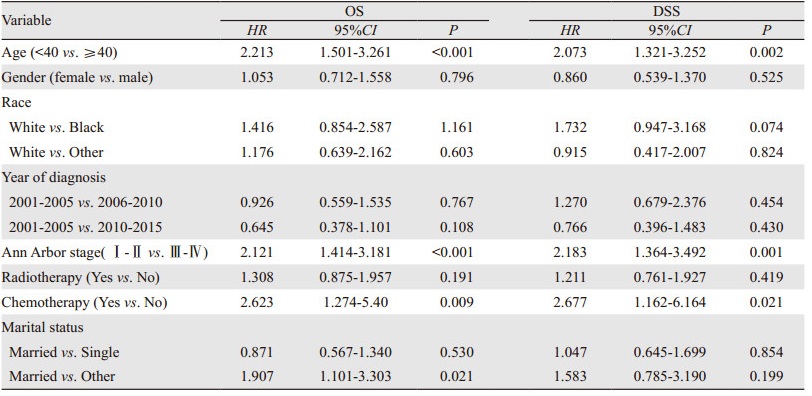
原发纵隔大B细胞淋巴瘤患者的5年和10年的总生存(overall survival, OS)率分别为83.4%和79.4%,疾病特异性生存(disease-specific survival, DSS)率分别为87.1%和85.2%。单因素Cox回归分析结果见表 3,将有统计学意义的变量纳入多因素Cox回归分析中,结果显示,年龄、分期、化疗是OS和DSS的独立预后因素,见表 4。年龄 < 40岁患者的OS和DSS均优于年龄≥40岁患者,Ⅰ~Ⅱ期患者的预后优于Ⅲ~Ⅳ期患者,接受化疗患者的OS和DSS优于未接受化疗患者。
|
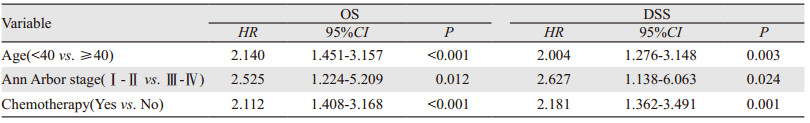
|
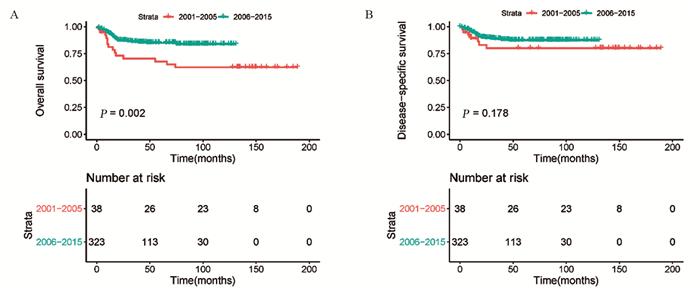
2001—2005年(利妥昔单抗前时代)确诊的原发纵隔大B细胞淋巴瘤患者的5年OS率和DSS率分别为80.8%和86.4%,2006—2015年(利妥昔单抗时代)确诊患者的5年OS率和DSS率分别为84.0%和87.1%,Kaplan-Meier生存分析显示,不同年份组的OS(χ2=1.042, P=0.307)和DSS(χ2 < 0.001, P=0.999)无明显差异,见图 3。2001—2005年(利妥昔单抗前时代)接受单纯化疗患者的5年OS率和DSS率分别为67.7%和80.0%,2006—2015年(利妥昔单抗时代)接受单纯化疗患者的5年OS率和DSS率分别为85.0%和87.4%。Kaplan-Meier生存分析显示,2006—2015年接受单纯化疗患者的OS明显优于2001—2005年的患者(χ2=10.002, P=0.002),见图 4A,两组患者的DSS无明显差异(χ2=1.811, P=0.178),见图 4B。

|
| 图 3 按诊断年份分层的原发纵隔大B细胞淋巴瘤患者的总生存(A)和疾病特异性生存(B)分析 Figure 3 Overall survival(A) and disease-specific survival(B) analysis of patients with primary mediastinal large B-cell lymphoma stratified by year of diagnosis |
|
| 图 4 按诊断年份分层的接受单纯化疗的原发纵隔大B细胞淋巴瘤患者的总生存(A)和疾病特异性生存(B)分析 Figure 4 Overall survival(A) and disease-specific survival(B) analysis of primary mediastinal large B-cell lymphoma patients who received chemotherapy alone according to year of diagnosis |
对610例接受化疗的患者进行了亚组分析,其中联合放疗的249例(40.8%),未行放疗的361例(59.2%)。化疗联合放疗组的5年OS率和DSS率分别为85.9%和88.8%,单纯化疗组的5年OS率和DSS率分别为82.8%和86.7%。Kaplan-Meier生存分析显示,化疗联合放疗组与单纯化疗组的OS和DSS差异无统计学意义,见图 5A~B。2001—2005年(利妥昔单抗前时代)接受化疗联合放疗患者的OS(χ2=6.745, P=0.009)明显优于接受单纯化疗的患者,两组患者的DSS(χ2=1.914, P=0.167)未见明显差异。然而,在2006—2015年(利妥昔单抗时代)确诊的患者中,联合治疗在OS和DSS上均未体现出明显优势(OS: χ2=0.008, P=0.927; DSS: χ2=0.010, P=0.921),见图 6。

|
| 图 5 原发纵隔大B细胞淋巴瘤患者接受放化疗对比化疗的总生存(A)和疾病特异性生存(B)分析 Figure 5 Overall survival(A) and disease-specific survival(B) analysis of primary mediastinal large B-cell lymphoma patients receiving chemoradiotherapy versus chemotherapy |

|
| 图 6 利妥昔单抗时代前(A, B)后(C, D)的原发纵隔大B细胞淋巴瘤患者接受放化疗对比化疗的生存分析 Figure 6 Survival analysis of primary mediastinal large B-cell lymphoma patients receiving radiochemotherapy versus chemotherapy before(A, B) and after(C, D) rituximab era |
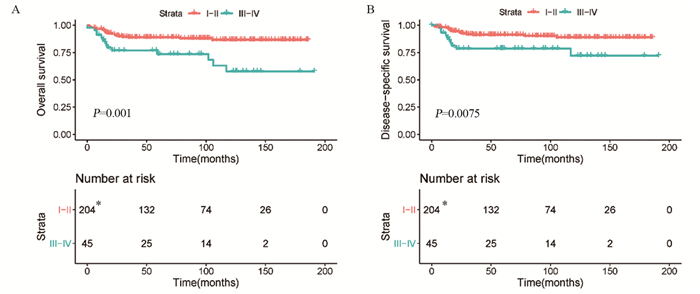
Ⅰ~Ⅱ期患者的5年OS率和DSS率分别为86.2%和89.3%,Ⅲ~Ⅳ期患者的5年OS率和DSS率分别为73.4%和78.7%。Ⅰ~Ⅱ期组接受放疗的患者205例(41.2%),Ⅲ~Ⅳ期组接受放疗的患者45例(32.8%),Kaplan-Meier生存分析显示,接受化疗联合放疗的Ⅰ~Ⅱ期患者的OS(χ2=11.615, P=0.001)和DSS(χ2=7.150, P=0.0075)均优于Ⅲ~Ⅳ期患者,见图 7。
|
| *: one patient in stageⅠ-Ⅱ who received radiotherapy alone was excluded from the statistical analysis. 图 7 按分期分层的接受放化疗的原发纵隔大B细胞淋巴瘤患者的总生存(A)和疾病特异性生存(B)分析 Figure 7 Overall survival(A) and disease-specific survival(B) analysis of patients with primary mediastinal large B-cell lymphoma receiving chemoradiotherapy stratified by Ann Arbor stage |
原发纵隔大B细胞淋巴瘤具有独特的病理特征和临床表现,远期预后明显优于弥漫大B细胞淋巴瘤患者,目前治疗方式包括化疗、放疗、靶向治疗、造血干细胞移植和CAR-T治疗[12-14]。由于该病发病率较低、生存期长,因此在选择治疗方案时应充分考虑较强化疗方案和放疗对患者体质的影响,避免并发第二肿瘤和心肺疾病。Giri等[15]分析了基于SEER数据库于2006—2011年确诊的原发纵隔大B细胞淋巴瘤患者,结果提示放疗未能改善利妥昔单抗时代患者的OS,但这项研究未特异性分析放疗在接受化疗的患者中的作用。为了进一步明确放化疗联合治疗与单纯化疗对患者生存的影响,本研究重点选择了接受化疗的人群,同时扩大了样本量,进一步探索预后相关变量以及指导治疗方案选择。
在本研究中,2006—2015年的放疗比例低于2001—2005年,但两组不同诊断时间患者的OS和DSS未见明显差异,这可能表明在利妥昔单抗时代,可在不影响预后的情况下逐渐降低放疗的应用比例。为了进一步明确利妥昔单抗对患者生存的影响,我们分析了2006年前后接受单纯化疗患者的OS和DSS,结果表明,2006年后(利妥昔单抗时代)接受单纯化疗患者的OS优于2006年前(利妥昔单抗前时代)接受单纯化疗的患者。在一些回顾性研究中也得到了相似的结果[16],利妥昔单抗的广泛应用使原发纵隔大B细胞淋巴瘤患者的生存率明显提高。
化疗是原发纵隔大B细胞淋巴瘤患者的首选治疗方案,多项研究提出化疗后行纵隔放疗可提高局部控制率、改善长期生存[17],然而还有一些研究认为化疗联合放疗的远期收益并不优于单纯化疗[18]。虽然药力较重的化疗和强辐射的放疗提高了短期疾病缓解率,但是对于可获得长期生存的人群,化疗和放疗的并发症可能是真正影响生活质量和生存率的因素。一项研究提出,治疗结束时的PET-CT结果为Deauville1~3分的患者可在不影响生存的情况下放弃放疗,对于PET-CT结果阳性的患者应综合考虑患者的病情,动态观察,谨慎选择是否放疗[19]。Vassilakopoulos等[20]同样认为治疗结束时的PET-CT结果对于评估是否采取后续放疗至关重要,这种适配治疗能使更多的患者获益。为了避免常规放疗的不良反应,仅采用R-DA-EPOCH和R-CHOP/ICE方案也可取得较好的疗效[6]。本研究Cox回归分析表明,化疗是原发纵隔大B细胞淋巴瘤的独立预后影响因素,放疗对患者预后无明显影响。化疗亚组分析显示,放化疗组患者的OS和DSS与单纯化疗组患者无明显差异。为了进一步明确不同治疗策略对患者生存的影响,本研究分析了2006年前后患者的生存情况,结果提示,在利妥昔单抗时代之前(2001—2006年),放化疗联合治疗能够显著改善患者生存。然而在利妥昔单抗时代(2006—2015年),放化疗与单纯化疗对患者的生存影响无显著差异。本研究的时间范围较长,人数较多,对于临床治疗选择具有一定指示作用。
原发纵隔大B细胞淋巴瘤患者在诊断时多为Ⅰ~Ⅱ期(78.4%),Ann-Arbor分期较早患者的OS和DSS均优于晚期患者。此外,本研究中初诊年龄 < 40岁的患者占62.8%,Cox回归分析显示年龄 < 40岁是患者的预后良好因素。因此,分期早、低龄可能是原发纵隔大B细胞淋巴瘤预后较好的原因。目前抗PD-1/PD-L1抗体、JAK2抑制剂、抗CD30抗体药物耦联物在原发纵隔大B细胞淋巴瘤中逐渐应用[21-23],进一步提高了复发难治患者的生存率,部分患者在接受挽救治疗后行造血干细胞移植仍能够获得长期生存。
本研究纳入了美国15年来确诊的原发纵隔大B细胞淋巴瘤患者,通过分析患者的长期生存进一步明确放疗对预后的影响,但仍有一些局限性。首先,该研究是回顾性研究,本身具有一定偏倚性;其次,SEER数据库中未包含患者的具体化疗方案、放疗剂量和放疗靶点的信息;另外,为了方便对比利妥昔单抗时代前后患者治疗方案选择和生存预后的差异,本研究以美国开始普遍应用利妥昔单抗的2006年为分界点,虽然不够完全精确,但仍具有一定指导意义;最后,SEER数据库中缺少免疫组织化学染色结果、乳酸脱氢酶、纵隔肿块大小、PET-CT结果等信息,这些因素对患者的预后非常重要。
总之,在利妥昔单抗时代前,接受放化疗的PMBCL患者的OS优于接受单独化疗的患者。在利妥昔单抗时代,PMBCL患者具有更好的预后,在接受化疗的患者中,联合放疗不能进一步改善长期生存。
作者贡献:
范冰杰:研究设计、统计分析、论文撰写
常宇:文献查阅、统计分析
柳喜洋:数据汇总、文献查阅
张明智、张蕾:论文指导与修改
| [1] |
Mottok A, Wright G, Rosenwald A, et al. Molecular classification of primary mediastinallarge B-cell lymphoma using routinely available tissue specimens[J]. Blood, 2018, 132(22): 2401-2405. DOI:10.1182/blood-2018-05-851154 |
| [2] |
Swerdlow SH, Campo E, Pileri SA, et al. The 2016 revision of the World Health Organization classification of lymphoid neoplasms[J]. Blood, 2016, 127(20): 2375-2390. DOI:10.1182/blood-2016-01-643569 |
| [3] |
Ahmed Z, Afridi SS, Shahid Z, et al. Primary Mediastinal B-Cell Lymphoma: A2021Updateon Genetics, Diagnosis, and Novel Therapeutics[J]. Clin Lymphoma Myeloma Leuk, 2021, 21(11): e865-e875. DOI:10.1016/j.clml.2021.06.012 |
| [4] |
Martelli M, Ferreri A, Di Rocco A, et al. Primary mediastinal large B-cell lymphoma[J]. Crit Rev Oncol Hematol, 2017, 113: 318-327. DOI:10.1016/j.critrevonc.2017.01.009 |
| [5] |
Zhou H, Xu-Monette ZY, Xiao L, et al. Prognostic factors, therapeutic approaches, and distinct immunobiologic features in patients with primary mediastinal large B-cell lymphoma on long-term follow-up[J]. Blood Cancer J, 2020, 10(5): 49. DOI:10.1038/s41408-020-0312-7 |
| [6] |
Dunleavy K, Pittaluga S, Maeda LS, et al. Dose-adjusted EPOCH-rituximab therapy in primary mediastinal B-cell lymphoma[J]. N Engl J Med, 2013, 368(15): 1408-1416. DOI:10.1056/NEJMoa1214561 |
| [7] |
Wilson WH, Jung SH, Porcu P, et al. A Cancer and Leukemia Group B multi-center study of DA-EPOCH-rituximab in untreated diffuse large B-cell lymphoma with analysis of outcome by molecular subtype[J]. Haematologica, 2012, 97(5): 758-765. DOI:10.3324/haematol.2011.056531 |
| [8] |
Dunleavy K, Wilson WH. Primary mediastinal B-cell lymphoma and mediastinal gray zone lymphoma: do they require a unique therapeutic approach?[J]. Blood, 2015, 125(1): 33-39. DOI:10.1182/blood-2014-05-575092 |
| [9] |
Goldschmidt N, Kleinstern G, Orevi M, et al. Favorable outcome of primary mediastinallarge B-cell lymphoma patients treated with sequential RCHOP-RICE regimen without radiotherapy[J]. Cancer Chemother Pharmacol, 2016, 77(5): 1053-1060. DOI:10.1007/s00280-016-3024-8 |
| [10] |
Bhakta N, Liu Q, Yeo F, et al. Cumulative burden of cardiovascular morbidity in paediatric, adolescent, and young adult survivors of Hodgkin's lymphoma: an analysis from the St Jude Lifetime Cohort Study[J]. Lancet Oncol, 2016, 17(9): 1325-1334. DOI:10.1016/S1470-2045(16)30215-7 |
| [11] |
Hamlin PA, Satram-Hoang S, Reyes C, et al. Treatment patterns and comparative effectiveness in elderly diffuse large B-cell lymphoma patients: a surveillance, epidemiology, and end results-medicare analysis[J]. Oncologist, 2014, 19(12): 1249-1257. DOI:10.1634/theoncologist.2014-0113 |
| [12] |
Neelapu SS, Locke FL, Bartlett NL, et al. Axicabtagene Ciloleucel CAR T-Cell Therapy in Refractory Large B-Cell Lymphoma[J]. N Engl J Med, 2017, 377(26): 2531-2544. DOI:10.1056/NEJMoa1707447 |
| [13] |
Locke FL, Ghobadi A, Jacobson CA, et al. Long-term safety and activity of axicabtagene ciloleucel in refractory large B-cell lymphoma (ZUMA-1): a single-arm, multicentre, phase 1-2 trial[J]. Lancet Oncol, 2019, 20(1): 31-42. DOI:10.1016/S1470-2045(18)30864-7 |
| [14] |
Vardhana S, Hamlin PA, Yang J, et al. Outcomes of Relapsed and Refractory Primary Mediastinal (Thymic) Large B Cell Lymphoma Treated with Second-Line Therapy and Intent to Transplant[J]. Biol Blood Marrow Transplant, 2018, 24(10): 2133-2138. DOI:10.1016/j.bbmt.2018.06.009 |
| [15] |
Giri S, Bhatt VR, Pathak R, et al. Role of radiation therapy in primary mediastinal large B-cell lymphoma in rituximab era: A US population-based analysis[J]. Am J Hematol, 2015, 90(11): 1052-1054. DOI:10.1002/ajh.24172 |
| [16] |
Vassilakopoulos TP, Pangalis GA, Katsigiannis A, et al. Rituximab, cyclophosphamide, doxorubicin, vincristine, and prednisone with or without radiotherapy in primary mediastinal large B-cell lymphoma: the emerging standard of care[J]. Oncologist, 2012, 17(2): 239-249. DOI:10.1634/theoncologist.2011-0275 |
| [17] |
Filippi AR, Piva C, Giunta F, et al. Radiation therapy in primary mediastinal B-cell lymphoma with positron emission tomography positivity after rituximab chemotherapy[J]. Int J Radiat Oncol Biol Phys, 2013, 87(2): 311-316. DOI:10.1016/j.ijrobp.2013.05.053 |
| [18] |
Messmer M, Tsai HL, Varadhan R, et al. R-CHOP without radiation in frontline management of primary mediastinal B-cell lymphoma[J]. Leuk Lymphoma, 2019, 60(5): 1261-1265. DOI:10.1080/10428194.2018.1519812 |
| [19] |
Hayden AR, Tonseth P, Lee DG, et al. Outcome of primary mediastinal large B-cell lymphoma using R-CHOP: impact of a PET-adapted approach[J]. Blood, 2020, 136(24): 2803-2811. DOI:10.1182/blood.2019004296 |
| [20] |
Vassilakopoulos TP, Papageorgiou SG, Angelopoulou MK, et al. Positron emission tomography after response to rituximab-CHOP in primary mediastinal large B-cell lymphoma: impact on outcomes and radiotherapy strategies[J]. Ann Hematol, 2021, 100(9): 2279-2292. DOI:10.1007/s00277-021-04421-2 |
| [21] |
Armand P, Rodig S, Melnichenko V, et al. Pembrolizumab in Relapsed or Refractory Primary Mediastinal Large B-Cell Lymphoma[J]. J Clin Oncol, 2019, 37(34): 3291-3299. DOI:10.1200/JCO.19.01389 |
| [22] |
Zinzani PL, Santoro A, Gritti G, et al. Nivolumab Combined With Brentuximab Vedotin for Relapsed/Refractory Primary Mediastinal Large B-Cell Lymphoma: Efficacy and Safety From the Phase Ⅱ CheckMate 436 Study[J]. J Clin Oncol, 2019, 37(33): 3081-3089. DOI:10.1200/JCO.19.01492 |
| [23] |
Hatic H, Sampat D, Goyal G. Immune checkpoint inhibitors in lymphoma: challenges and opportunities[J]. Ann Transl Med, 2021, 9(12): 1037. DOI:10.21037/atm-20-6833 |
 2022, Vol. 49
2022, Vol. 49


