文章信息
- 白花檵木对肺腺癌A549细胞增殖的抑制作用
- Inhibitory Effect of Loropetalum Chinense on Proliferation of Lung Adenocarcinoma A549 Cells
- 肿瘤防治研究, 2022, 49(3): 182-186
- Cancer Research on Prevention and Treatment, 2022, 49(3): 182-186
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2022.21.0708
- 收稿日期: 2021-06-17
- 修回日期: 2021-12-13
2. 100025 北京,全国卫生产业企业管理协会肥胖与相关疾病防治分会
2. Obesity and Related Diseases Prevention Branch of National Association of Health Industry and Enterprise Management, Beijing 100025, China
白花檵木(Loropetalum chinensis(R.Br.)Oliv)是金缕梅科檵木属的长青灌木植物,始载于《植物名实图考》,因具有清热解毒、通经活络等功效,很早以前就作为药用植物在民间使用[1]。近年来对其化合物的分离和药用活性成分鉴定发现,白花檵木含有挥发油、鞣质、黄酮、木脂素类等多种具有药理活性的次生代谢物[2-3]。目前研究集中在治疗创伤出血及促伤口愈合方面[4-5]。因白花檵木含有黄酮类化合物,推测其可能具有一定的抗肿瘤作用,但目前尚未见相关报道。本研究以白花檵木粗提物为研究对象、人肺腺癌细胞A549作为研究模型,探讨白花檵木体外抑制肺腺癌细胞增殖的功效,为更好地开发利用白花檵木资源提供理论依据。
1 材料与方法 1.1 细胞株人肺癌A549细胞株购自中国医学科学院基础医学研究所细胞中心。
1.2 实验试剂白花檵木粗提物,为白花檵木叶子醇提物,棕色粉末,由北京白花檵木有限公司提供(批号20190516)。DMEM培养基购自美国Sigma公司。胎牛血清、胰蛋白酶购自美国Gibco公司。CCK-8细胞增殖毒性检测试剂盒购自日本同仁化学研究所。Annexin V-APC、PI流式细胞凋亡试剂盒购自美国Thermo公司。兔抗人Caspase-3抗体(货号:19677-1-AP)、鼠抗人GAPDH抗体(货号:HRP-60004)和兔抗人Bax抗体(货号:50599-2-Ig)均购自中国Proteintech公司;兔抗人Bcl-2(货号:CAS7511)购自美国Bioworld公司;兔抗人Fas抗体(货号:ab133619)、山羊抗兔IgG二抗抗体(货号:ab6721)和兔抗小鼠IgG二抗抗体(货号:ab6728)均购自美国Abcam公司。0.22 μm PVDF膜(货号:ISEQ00010)、DMSO(D2650)均购自德国Merck公司。
1.3 仪器BD CantoⅡ流式细胞仪购自美国BD公司。Western blot电泳仪和ChemiDoc成像仪均购自美国Bio-Rad公司。
1.4 方法 1.4.1 试剂配制称取0.5 g白花檵木粗提物溶于2 ml DMSO,配制浓度为0.25 g/ml的储存液,经0.22 μm膜过滤,得到250 mg/ml的无菌储存液。
1.4.2 细胞培养A549细胞培养于含10%胎牛血清的DMEM完全培养基,置于37℃、5%CO2培养箱中培养。待细胞汇合至瓶底面积80%~90%时进行传代。细胞传代时,弃去培养基,D-Hanks洗细胞2次,0.1%胰蛋白酶-0.1%EDTA消化细胞。随后加入含有胎牛血清的培养基终止消化,离心收集细胞。以新鲜的DMEM完全培养基重悬细胞,将细胞传至3个新的培养瓶中,加入适量DMEM完全培养基继续培养。选取对数生长期细胞用于实验。
1.4.3 CCK-8法检测细胞增殖能力取对数生长期的A549细胞,胰酶消化制备细胞悬液,随后按2×104细胞/孔的浓度将细胞接种于96孔板,24 h后加入白花檵木粗提物进行后续处理。实验共设6组:1.25、1、0.75、0. 5、0. 25 mg/ml白花檵木粗提物处理组和溶媒对照组(仅含5‰DMSO,不含白花檵木),及不含细胞仅有等体积DMSO完全培养基的空白对照组,以排除培养基干扰。实验共设置3个检测时间点:24、48和72 h,每组设置3个复孔。白花檵木粗提物处理24、48和72 h后,每孔加入10 μl的CCK-8试剂,继续培养2 h。酶标仪检测450 nm波长下各孔的光密度(OD)值,计算细胞存活率。
1.4.4 集落形成实验取对数生长期的A549细胞,胰酶消化制备细胞悬液,随后按2×102个/孔的密度将细胞接种于6孔板,待24 h细胞贴壁后,分别给予不同浓度的白花檵木粗提物并连续作用14天,白花檵木粗提物的浓度为0、10、20和40 μg/ml,其中0 μg/ml为对照组。每个浓度设置3个复孔,待培养结束后2.5%结晶紫染色,计算集落个数。
1.4.5 Annexin V-APC/PI法检测细胞凋亡取对数生长期的A549细胞,按照2×105个/孔的密度将细胞接种于6孔板,接种24 h后加入白花檵木粗提物。实验共设4组,白花檵木粗提物浓度分别为0、0.25、0.5和1 mg/ml,其中0 mg/ml为对照组。处理24 h后收集细胞,以不含EDTA的0.25%胰蛋白酶消化细胞,按照试剂盒说明书进行Annexin V-APC/PI染色,随后上机检测细胞凋亡情况。
1.4.6 Western blot法检测凋亡相关蛋白表达用0、0.25、0.5和1 mg/ml白花檵木粗提物处理A549细胞24 h后提取细胞总蛋白,其中0 mg/ml为对照组。100℃加热10 min,蛋白变性后,立即进行蛋白电泳、转膜。转膜结束后,PVDF膜以5%脱脂牛奶室温封闭2 h,随后分别加入Bax(1:1 000稀释)、Bcl-2 (1:1 000稀释)、Fas(1:1 000稀释)、活性Caspase3(1:1 000稀释)、GAPDH(1:10 000稀释)一抗,4℃摇床孵育过夜。TBST洗4次,随后加入HRP标记的二抗(1:20 000稀释),室温摇床上孵育2 h,TBST洗4次。根据ECL化学发光检测试剂盒说明书配置发光液,以Bio-Rad成像仪进行条带显色。
1.5 统计学方法所有数据采用SPSS23.0统计学软件进行分析,计数资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,以P < 0.05为差异有统计学意义。
2 结果 2.1 白花檵木粗提物对A549肺癌细胞增殖的影响CCK-8实验结果显示,白花檵木粗提物对A549细胞增殖具有抑制作用,作用24、48和72 h后的IC50值分别为1.12、0.48和0.36 mg/ml。随着白花檵木粗提物浓度的增加,抑制效应逐渐增强,除0.25 mg/ml白花檵木粗提物组外,其余浓度24、48、72 h组与溶媒对照组相比差异均具有统计学意义(均P < 0.01)。随作用时间延长,抑制效应逐渐增强(P < 0.001),见图 1。

|
| Compared with vehicle control (0 μg/ml) group, **: P < 0.01, ***: P < 0.001; compared with 24h, ###: P < 0.001. 图 1 CCK-8检测白花檵木粗提物对肺腺癌A549细胞增殖的影响 Figure 1 Effect of Loropetalum chinense extracts on proliferation of lung adenocarcinoma A549 cells measured by CCK-8 assay |
集落形成实验结果显示,经过14天的集落培养,白花檵木粗提物呈浓度依赖性地抑制A549细胞的集落形成能力。40 μg/ml白花檵木粗提物处理组作用14天未见到任何集落形成,见图 2。
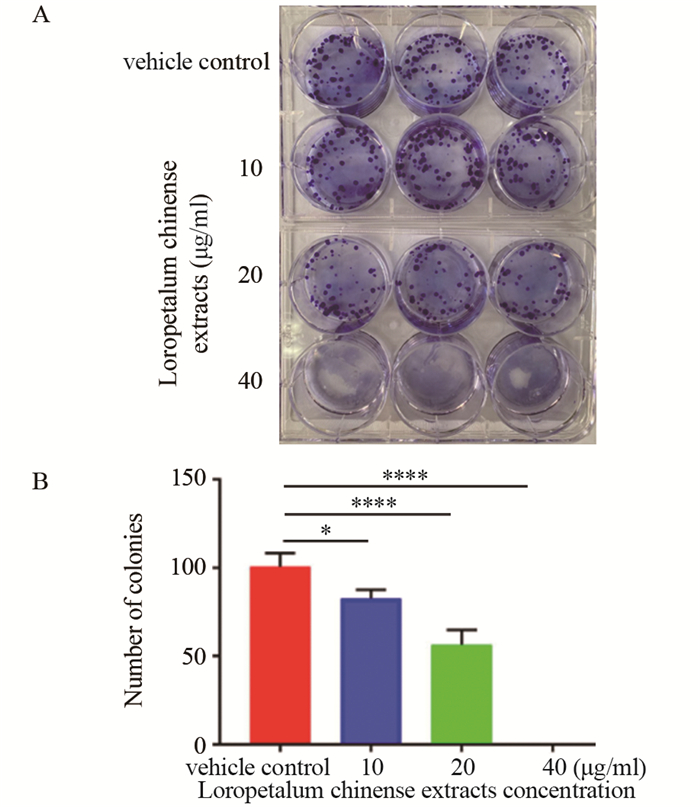
|
| A: colony formation; B: number of colonies; compared with vehicle control group, *: P < 0.05, ****: P < 0.0001. 图 2 集落形成实验检测白花檵木粗提物对肺腺癌A549细胞克隆形成能力的影响 Figure 2 Effect of Loropetalum chinense extracts on colony formation ability of lung adenocarcinoma A549 cells detected by colony formation experiment |
流式细胞术检测结果显示,不同浓度的白花檵木粗提物处理A549细胞24 h后细胞呈现不同程度的凋亡,用0.25、0.5和1 mg/ml的白花檵木粗提物处理后,早期凋亡细胞的比例分别为19.50%、38.90%和55.40%,晚期凋亡细胞的比例分别为2.07%、7.52%和18.50%,早、晚期凋亡率均随药物浓度依次递增,见图 3。
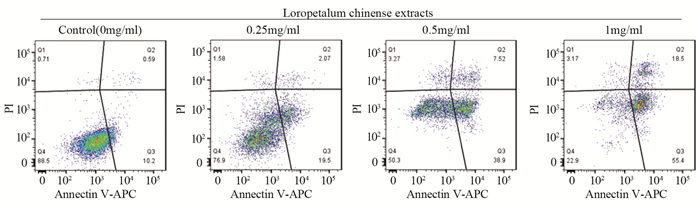
|
| 图 3 流式细胞术检测白花檵木粗提物对肺腺癌A549细胞凋亡的影响 Figure 3 Effect of Loropetalum chinense extracts on apoptosis of lung adenocarcinoma A549 cells determined by flow cytometry |
Western blot结果显示,不同浓度白花檵木粗提物处理A549细胞24 h后,与对照组(0 μg/ml)相比,各浓度处理组A549细胞中Bcl-2蛋白表达水平降低,Bax、Fas及活性Caspase3蛋白表达水平升高,见图 4。提示白花檵木粗提物可能通过同时激活线粒体和死亡受体通路促进A549细胞的凋亡。

|
| 图 4 Western blot检测凋亡相关蛋白在白花檵木粗提物作用后的肺腺癌A549细胞中的表达 Figure 4 Expression of apoptosis-related proteins in lung adenocarcinoma A549 cells treated with Loropetalum chinense extracts measured by Western blot |
天然产物是人类药物研发的宝库,很多植物来源的天然产物具有抗癌作用已有较多报道[6-7],已有研究显示白花檵木含有多种具有抗癌活性的物质,如:檞皮素、没食子酸等[8],提示白花檵木可能具有一定的抗癌作用。
本实验对白花檵木粗提物的抗癌作用进行了初步研究,结果显示白花檵木粗提物可以显著抑制人A549肺癌细胞的增殖,并且呈现明显的剂量和时间依赖性;同时,提示白花檵木粗提物能够抑制A549细胞的集落形成能力,并且呈浓度依赖性,作用时间较短的时候抑制肺癌细胞生长需要的白花檵木粗提物浓度稍高一些,0.5 mg/ml的药物作用48 h后,细胞生长率下降50%。但当药物处理14天时,仅非常低的浓度,如40 μg/ml的浓度就可以完全抑制A549细胞集落形成。这些结果均证实白花檵木粗提物对人肺腺癌细胞增殖具有一定的抑制作用,并且作用时间越长,抑制效果越好。
为进一步了解白花檵木粗提物抑制肺腺癌A549细胞增殖的可能机制,我们进行了流式细胞凋亡检测和凋亡相关蛋白免疫印迹检测。细胞凋亡在分子水平受多种凋亡相关基因/基因产物调控。目前认为细胞凋亡主要有两条调节途径[9]:线粒体通路及细胞表面死亡受体通路。前者主要由促凋亡蛋白(如:Bax)和抗凋亡蛋白(如:Bcl-2)共同参与调控细胞程序性死亡。二者的比例决定细胞在收到凋亡信号时是否发生凋亡,也被作为评判肿瘤细胞对药物敏感或耐受的指标。后者主要是Fas/FasL途径。由这些细胞表面的蛋白质与携带凋亡信号的特异性配体结合,诱导细胞凋亡。半胱氨酸天门冬氨酸蛋白酶(cysteinyl aspartate specific proteinase, Caspase)家族在细胞凋亡的分子机制中发挥关键作用,是多条凋亡通路的汇聚点,尤其是其中的Caspase3[10-12]。通过流式细胞术检测,我们发现白花檵木粗提物处理A549细胞24 h后细胞就开始出现不同程度的凋亡,且凋亡率呈剂量依赖性,说明白花檵木粗提物可能通过激活凋亡通路抑制肺腺癌细胞增殖,但还需要进一步的验证,其机制也有待进一步研究。
在蛋白免疫印迹实验中,我们进一步检测了凋亡相关蛋白Bcl-2、Bax、Fas、Caspase3及活性Caspase3在白花檵木粗提物作用A549细胞后的表达,结果发现,随着白花檵木粗提物浓度的增加,促凋亡基因Bax表达上调,而凋亡抑制基因Bcl-2表达减弱,且Bax/Bcl-2的比例也逐渐增加。此外,Fas、活性Caspase3的表达也随白花檵木粗提物浓度的增加而上调。以上结果提示:白花檵木粗提物的抗癌机制可能与同时激活线粒体和死亡受体凋亡通路有关。考虑到本实验中用的是粗提物,产物中的成分相对较多,作用机制也比较复杂,激活线粒体通路和凋亡通路可能是由不同提取物成分引起的,但这一推测还需要进一步验证。后续实验中,还将进一步了解白花檵木粗提物中的关键有效成分,明确是哪些成分起到的抗癌作用,为新药研发积累数据基础。
总之,本研究首次报道了白花檵木粗提物在肺癌细胞中的体外抗癌作用,并对其抗癌作用的量效关系和作用机制进行了初步的研究,结果显示白花檵木粗提物对于肺腺癌A549细胞的生长具有一定的抑制作用,其机制可能通过激活线粒体及死亡受体信号通路激活凋亡,抑制A549细胞增殖。提示白花檵木粗提物在肺癌的治疗中有一定的应用前景,后续可以进一步进行体内实验研究,明确该粗提物在小鼠体内的安全性和有效性。
作者贡献:
夏启胜、邓婷婷:实验实施、数据处理及论文撰写
徐雅平:细胞培养及克隆形成实验的实施
刘虹麟:实验设计、数据处理及论文修改
刘浩元:课题的构思、指导实验设计
| [1] |
王刚, 刘劲松, 李红艳, 等. 檵木化学成分研究[J]. 天然产物研究与开发, 2011, 23(2): 267-269. [Wang G, Liu JS, Li HY, et al. Chemical constituents of Loropetalum chinense[J]. Tian Ran Chan Wu Yan Jiu Yu Kai Fa, 2011, 23(2): 267-269.] |
| [2] |
肖珑, 岳勇志, 陈靖宇, 等. 檵木药用活性成分及药理作用研究进展[J]. 湖南农业科学, 2017(6): 119-121, 126. [Xiao L, Yue YZ, Chen JY, et al. Research progress of active pharmaceutical ingredients and pharmacological action of Loropetalum chinense var. rubrum[J]. Hunan Nong Ye Ke Xue, 2017(6): 119-121, 126.] |
| [3] |
潘晓军, 吕圭源, 陈素红, 等. 白花檵木花黄酮提取及其抗氧化活性的研究[J]. 中国医药指南, 2012, 10(26): 75-76. [Pan XJ, Lyu GY, Chen SH, et al. The extraction of flavonoids from Loropetalum chinense and its' antioxidant activity[J]. Zhongguo Yi Yao Zhi Nan, 2012, 10(26): 75-76.] |
| [4] |
连泽勤, 高健, 李晓滨, 等. 白花檵木促大鼠皮肤伤口愈合物质基础初步研究[J]. 中国中药杂志, 2013, 38(20): 3566-3570. [Lian ZQ, Gao J, Li XB, et al. Primary study of skin wound healing in rays for Loropetalum chinense[J]. Zhongguo Zhong Yao Za Zhi, 2013, 38(20): 3566-3570.] |
| [5] |
张季林, 徐彭, 董德刚, 等. 白花檵木有效部位治疗糖尿病皮肤溃疡机制研究[J]. 中草药, 2017, 48(14): 2907-2911. [Zhang JL, Xu P, Dong DG, et al. Mechanism of loropetalum chinensis in treatment of diabetic skin ulcer[J]. Zhong Cao Yao, 2017, 48(14): 2907-2911.] |
| [6] |
Crawford JM, Tang GL, Herzon SB. Natural Products: An Era of Discovery in Organic Chemistry[J]. J Org Chem, 2021, 86(16): 10943-10945. DOI:10.1021/acs.joc.1c01753 |
| [7] |
Dias AS, Helguero L, Almeida CR, et al. Natural Compounds as Metabolic Modulators of the Tumor Microenvironment[J]. Molecules, 2021, 26(12): 3494. DOI:10.3390/molecules26123494 |
| [8] |
涂越, 刘建平, 郭雄昌, 等. 白花檵木中主要活性成分及其治疗慢性难愈性创面的展望[J]. 江西科学, 2021, 39(4): 585-592. [Tu Y, Liu JP, Guo XC, et al. Phytochemical components and bioactivities of Loropetalum cinense: research advances[J]. Jiangxi Ke Xue, 2021, 39(4): 585-592.] |
| [9] |
Hafezi S, Rahmani M. Targeting BCL-2 in Cancer: Advances, Challenges, and Perspectives[J]. Cancers (Basel), 2021, 13(6): 1292. DOI:10.3390/cancers13061292 |
| [10] |
Zhang Y, Yang X, Ge X, et al. Puerarin attenuates neurological deficits via Bcl-2/Bax/cleaved caspase-3 and Sirt3/SOD2 apoptotic pathways in subarachnoid hemorrhage mice[J]. Biomed Pharmacother, 2019, 109: 726-733. DOI:10.1016/j.biopha.2018.10.161 |
| [11] |
钟大仓, 陈超, 李桐, 等. 胡椒碱诱导人胰腺癌PANC-1细胞凋亡的Caspase 3/Bax/Bcl-2信号通路机制研究[J]. 中国现代应用药学, 2020, 37(14): 1687-1691. [Zhong DC, Chen C, Li T, et al. Study on the caspase 3/bax/bcl-2 signal pathway mechanism of induction apoptosis effect of piperine in human pancreatic cancer PANC-1 cell[J]. Zhongguo Xian Dai Ying Yong Yao Xue, 2020, 37(14): 1687-1691.] |
| [12] |
谷泽慧, 任立群, 李琪, 等. 奥沙利铂通过调控miRNA-7-5p/RAF-1促进胃癌SGC-7901细胞凋亡的研究[J]. 肿瘤防治研究, 2020, 47(3): 175-180. [Gu ZH, Ren LQ, Li Q, et al. Oxaliplatin Promotes Apoptosis of Gastric Cancer Cell Line SGC-7901 by Regulating miRNA-7-5p/RAF-1[J]. Zhong Liu Fang Zhi Yan Jiu, 2020, 47(3): 175-180.] |
 2022, Vol. 49
2022, Vol. 49


