文章信息
- 淋巴结转移对M1a期小细胞肺癌患者预后的影响——基于SEER数据库的研究
- Effect of Lymph Node Metastasis on Prognosis of Small Cell Lung Cancer with M1a Disease: A Study Based on SEER database
- 肿瘤防治研究, 2022, 49(2): 116-122
- Cancer Research on Prevention and Treatment, 2022, 49(2): 116-122
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2022.21.0553
- 收稿日期: 2021-05-17
- 修回日期: 2021-08-15
小细胞肺癌(small cell lung cancer, SCLC)是一种低分化神经内分泌肿瘤,占所有肺癌的13%~15%。相比于非小细胞肺癌(non-small cell lung cancer, NSCLC),其侵袭性高,倍增时间短,易早期转移,预后差[1-3]。目前使用最广泛的SCLC分期手段是以美国退伍军人肺癌协会(Veterans Administration Lung Study Group, VALG)的局限期和广泛期为主[4-5]。但NCCN和国际肺癌研究协会(International Association for the Study of Lung Cancer, IASLC)建议在临床研究优先使用肿瘤-淋巴结-转移(tumor-node-metastasis, TNM)分期系统,以期更好地进行预后分层及指导临床决策[4, 6-7]。在最新的第八版TNM分期系统中,M1a期定义为肺癌转移局限于胸腔内,包括胸膜播散如胸膜结节、恶性胸腔积液(malignant pleural effusion, MPE)或恶性心包积液(malignant pericardial effusion, MPCE)以及对侧肺叶出现分散的单个或多个癌结节[8]。
在临床实践中,淋巴结转移是M0期SCLC最重要的独立预后因素之一[9],然而无论淋巴结状态如何,M1a期都归为Ⅳ期。一项基于大量人群的研究[10]表明淋巴结转移情况可以对M1a期NSCLC患者进行预后分层。然而淋巴结状态对M1a期SCLC患者的临床影响尚未得到广泛研究。本研究基于美国监测、流行病学和最终结果(Surveillance, Epidemiology, and End Results, SEER)数据库,分析淋巴结转移对M1a期患者的生存影响,以期增加预后信息。
1 资料与方法 1.1 数据来源及研究对象本研究基于SEER数据库纳入的SCLC患者临床数据覆盖28%美国人口。通过SEER*Stat软件(v8.3.6,https://seer.cancer.gov/seerstat/)提取2004—2015年SEER数据库(http://seer.cancer.gov/)登记的所有M1a期SCLC患者信息。
1.2 纳入及排除标准纳入标准:(1)根据ICD-O-3代码,病理学或细胞学确诊为原发性SCLC(肿瘤形态学编码为8041、8042、8043、8044和8045);(2)SEER数据库M1a期定义:对侧肺肿瘤结节、胸膜播散(包括胸膜结节、MPE或MPCE);(3)随访信息完整;(4)年龄≥18岁。排除标准:(1)多源性肿瘤;(2)N状态未知者(NX);(3)生存信息不明或小于1月。
1.3 观察指标收集包括患者人口统计学特征(年龄、性别、种族、婚姻)、肿瘤特征(原发部位、大小、淋巴结状态)以及治疗方式(放疗、化疗)等数据进行研究。采用国际抗癌联盟/美国癌症联合会(Union for International Cancer Control/American Joint Committee on Cancer, UICC/AJCC)第7版肺癌分期系统对病例进行肿瘤TNM分期。随访终止时间为2016年12月31日,研究结果为总体生存率(overall survival, OS),OS定义为从诊断到因任何原因死亡的时间或随访终止时间。
1.4 统计学方法采用Empower Stats(易侕统计)、R软件及GraphPad Prism 8.0对数据进行统计分析及作图。年龄等计量资料采用中位数(四分位数间距)(interquartile range, IQR)表示,计数资料以n(%)形式表示,组间比较采用卡方检验。采用Kaplan-Meier法绘制生存曲线并进行生存分析,Log rank检验评价不同亚组之间生存差异的显著性,Cox比例风险模型分析患者的独立预后因素。采用双侧检验,P < 0.05为差异有统计学意义。
2 结果 2.1 患者的临床特征本研究共纳入符合条件的患者7 027例,基本情况见表 1。中位年龄67岁(IQR: 60~75),大部分为白人(85.14%),男女发病率相似,更倾向于采取化疗(77.30%)。全组中位随访时间为85月,随访期间共死亡6 771例患者,其中6 321例患者死于SCLC。全组中位OS为7月,1年和2年OS分别为24.50%和8.30%。
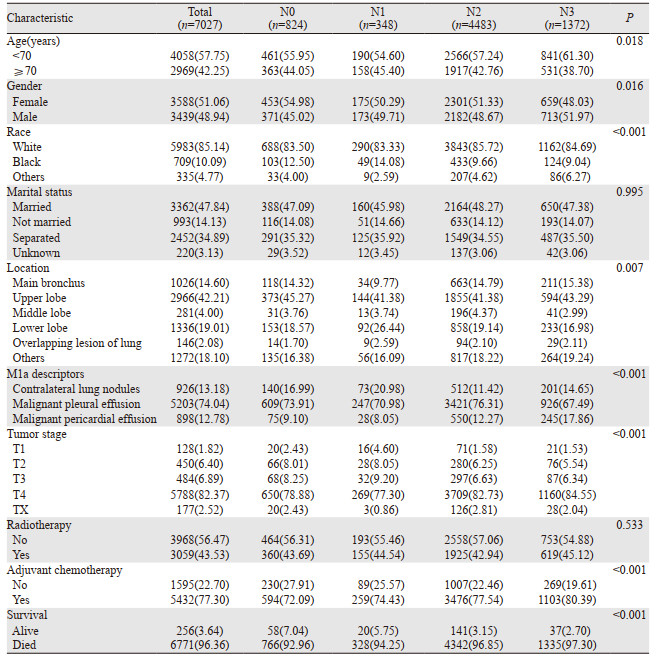
|
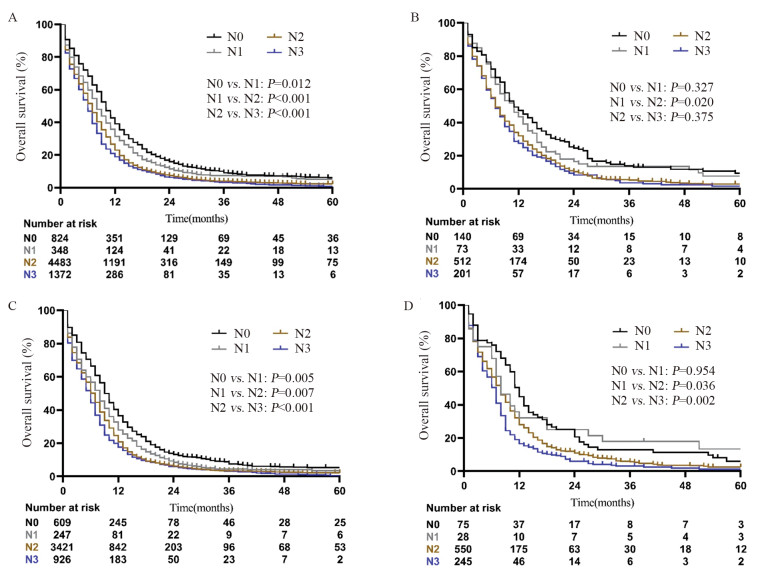
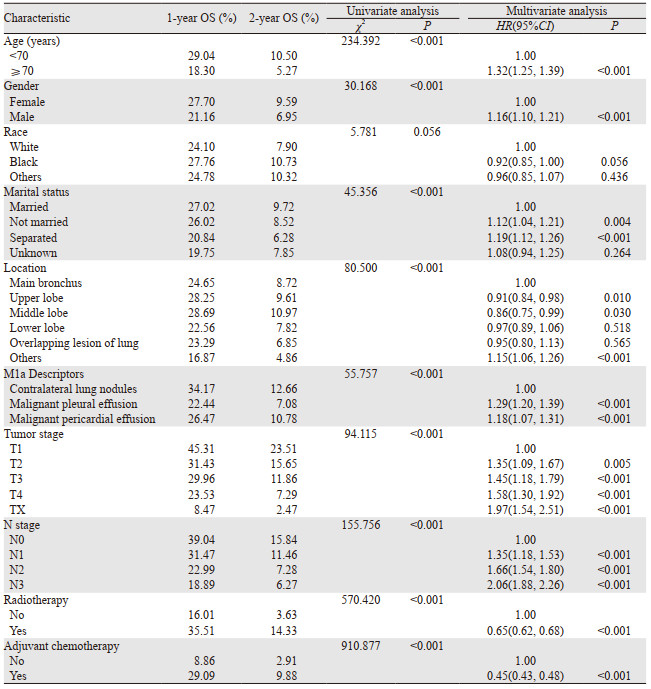
结果显示N0患者的OS最好,其次是N1患者,而N2和N3患者的预后最差,1年OS分别为39.04%、31.47%、22.99%和18.89%(P < 0.001),而2年OS分别为15.84%、11.46%、7.28%和6.27%(P < 0.001),见图 1A。对M1a类别进行亚组分析,结果显示对侧肺结节组、恶性胸腔积液(MPE)组和恶性心包积液(MPCE)组也存在随N分期升高OS递减的趋势,见图 1B~D(具体数据请扫描本文OSID码)。多因素分析显示:年龄、性别、婚姻、肿瘤原发部位、肿瘤大小、M1a类别、淋巴结转移、放疗和化疗是M1a期SCLC患者的独立预后因素,见表 2。
|
| 图 1 不同N分期下的全组(A)、对侧肺结节组(B)、恶性胸腔积液组(C)和恶性心包积液组(D)患者的OS比较 Figure 1 Comparison of OS among all included SCLC patients with M1a disease(A), contralateral lung nodules group (B), malignant pleural effusion group(C) and malignant pericardial effusion group(D) according to N categories |
|
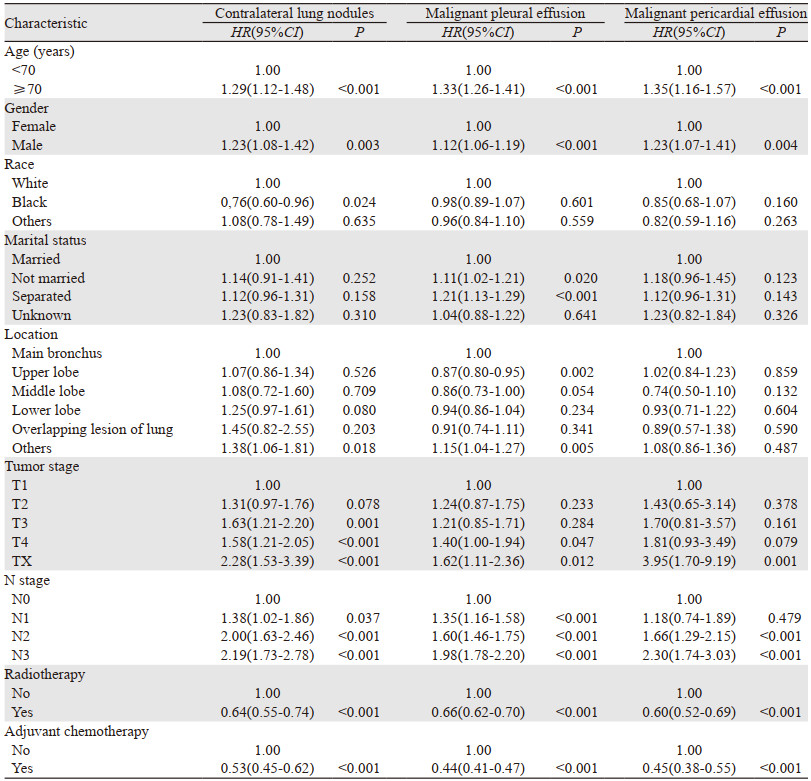
在所有M1a期患者中,对侧肺结节患者926例,MPE患者5 203例,MPCE患者898例。多因素分析显示年龄、性别、肿瘤大小、淋巴结转移、放疗和化疗是对侧肺结节患者的独立预后因素;年龄、性别、婚姻、肿瘤原发部位、肿瘤大小、淋巴结转移、放疗和化疗是MPE患者的独立预后因素;而MPCE患者的独立预后因素为年龄、性别、淋巴结转移、放疗和化疗,见表 3。
|
新制定的第八版肺癌TNM分期手册对T和M描述符均进行了修订,而N描述符保持不变[11-12]。对于M0期的患者,淋巴结受累情况影响SCLC的分期和预后,然而M1a期的患者无论淋巴结状态如何均被归为ⅣA期,忽略了淋巴结受累情况。Iida等[13]回顾性分析日本国家数据库329例M1a期肺癌胸膜播散患者临床资料,发现与N2/N3相比,N0/N1是生存较好的独立预后影响因素。另一项对来源于SEER数据库的39 731例患者的研究[10]表明淋巴结转移是M1a期NSCLC患者的独立预后影响因素,其中N0患者的生存最好,其次是N1患者;而N2和N3患者生存无明显差别(N0 vs. N1, P < 0.001;N1 vs. N2, P < 0.001;N2 vs. N3, P=0.478),亚组分析也表明淋巴结转移是胸膜播散和对侧肺结节的独立预后因素。目前尚无研究分析淋巴结转移情况在M1a期SCLC中的预后价值。本研究表明淋巴结转移是M1a期SCLC患者的独立预后影响因素,无淋巴结转移患者的预后最好,其次是N1患者,而N2和N3患者的预后最差;同样在各亚组中,包括对侧肺结节、MPE以及MPCE患者中,均观察到这种随N分期升高OS递减的趋势。
目前尚不明确为何N分期越高,M1a期SCLC患者预后越差,可能的解释是N分期越早的患者有少量胸腔积液、心包积液或没有弥漫性胸膜、对侧肺转移结节;在这类患者中,通过综合治疗,癌细胞可能得到很好的控制。此外N分期越高往往表明肿瘤临床进展较快,难以控制,导致生存率随之显著降低。一项来自韩国的研究[14]表明无胸腔积液、少量胸腔积液(< 10 mm)和MPE(≥10 mm)中N2/N3比例分别为81.8%(166/203)、91.9%(68/74)和97.6%(81/83)(P=0.001),而中位生存时间分别为11.20、5.93和4.83月(P < 0.001);然后以10 mm胸腔积液厚度进行划分,生存分析结果显示胸腔积液量越多,患者的预后越差,其中每增加10 mm厚度胸腔积液,死亡风险增加14.6%(P=0.041)。另一项来自日本的研究[15]显示无心包积液、少量心包积液(< 10 mm)和MPCE(≥10 mm)中N2/N3比例分别为65.43%(213/327)、82.0%(50/61)和97.5%(39/40)(P < 0.001),而中位OS分别为15.0、10.1和7.6月(P=0.003);由于有14.75%(9/61)的少量心包积液患者随后发展为MPCE,且与其他少量心包积液相比,这9例患者的OS也明显缩短(中位OS 6.2 vs. 10.8月,P=0.033),故推测心包积液状态与预后相关,少量心包积液可能代表MPCE发展的早期阶段;且淋巴结转移,尤其是纵隔淋巴结转移可破坏正常淋巴引流的平衡,从而参与MPCE的发生和发展。然而本研究缺乏心包积液、胸腔积液量以及对侧肺结节状态的信息,故不能对此进行验证,有待于其他大样本研究进一步评估,为早期的临床决策提供信息。
本研究在亚组分析中还发现对侧肺结节患者预后较MPE和MPCE患者更好。同样的,Morris等[16]的一项基于SEER数据库的研究表明对侧肺结节的M1a期NSCLC患者与其他类型的M1a患者相比有更好的OS(P < 0.0001),然后根据原发肿瘤大小和N分期进行分层后也观察到相同的生存差异。但有研究[17]报道MPE、MPCE与对侧肺结节的OS均无显著差异。需要指出的是,对侧肺结节既可能为一个独立的同步原发肿瘤,也可能代表一个血行转移的部位,而前者的预后相对较好。在临床实践中,对侧肺转移与同步原发肿瘤的患者难以区分。尽管目前采用1975年提出的Martini和Melamed临床组织学标准进行区分,但是随着分子诊断技术的迅速发展,一些研究显示与基因组图谱或突变分析比较时,肿瘤错分率高达32%[18-19]。因此,同步原发肿瘤与对侧肺转移的错误分类可能是对侧肺结节患者较MPE和MPCE患者预后更好的一个原因。
M1a患者不同亚群的多因素分析显示,诊断年龄、性别、放疗和化疗均是对侧肺结节、MPE和MPCE患者预后的独立影响因素。年龄作为影响人体脏器功能状况和治疗耐受的重要因素,对于预后有显著影响,与既往大多数研究一致[20-21]。有研究[22-24]报道男性较女性预后差,与本研究结果相同。不同体质及生理因素可能是其生存差异的原因,具体机制尚待进一步研究。目前SCLC的标准治疗方式为局限期采用放化疗结合,广泛期采用化疗为主的综合治疗模式[6]。本研究显示对患者进行放疗和化疗可显著改善预后,与以往报道类似[25-28]。
作为回顾性研究,潜在的选择偏差是不可避免的。由于SEER数据库固有的限制,该数据库没有提供关于吸烟史、体力状态、基因突变状态、基础疾病及合并症的信息,也没有关于全身化疗方案信息和放疗的详细参数(如剂量、分割大小、照射范围、放射技术),而且也缺乏胸腔积液、心包积液容量以及对侧肺结节状态的信息。此外,SEER数据库没有提供关于肿瘤临床分期和病理分期信息,故不能明确N分期的诊断是否基于影像学或病理学诊断,这可能会对实际淋巴结分期产生影响。最后,由于对侧肺转移与同步原发肿瘤患者很难区分,可能会高估对侧肺结节患者的OS,因此将来需要更多的研究来提高区分的准确性。
综上所述,本研究发现淋巴结转移是M1a期SCLC患者的独立预后影响因素,其中N0期预后最好,其次是N1期,N2和N3患者的预后最差。因此,对于M1a期患者,确认淋巴结是否受累和受累程度对临床有重要意义。建议在对M1a期SCLC患者的进一步评价中引入N分期作为重要指标。
作者贡献:
阳昊:查阅文献、提取数据、统计分析、论文撰写
梅同华:把握研究方向、论文指导及修改
| [1] |
Rudin CM, Brambilla E, Faivre-Finn C, et al. Small-cell lung cancer[J]. Nat Rev Dis Primers, 2021, 7(1): 3. DOI:10.1038/s41572-020-00235-0 |
| [2] |
Hiddinga BI, Raskin J, Janssens A, et al. Recent developments in the treatment of small cell lung cancer[J]. Eur Respir Rev, 2021, 30(161): 210079. DOI:10.1183/16000617.0079-2021 |
| [3] |
Poirier JT, George J, Owonikoko TK, et al. New Approaches to SCLC Therapy: From the Laboratory to the Clinic[J]. J Thorac Oncol, 2020, 15(4): 520-540. DOI:10.1016/j.jtho.2020.01.016 |
| [4] |
Nicholson AG, Chansky K, Crowley J, et al. The International Association for the Study of Lung Cancer Lung Cancer Staging Project: Proposals for the Revision of the Clinical and Pathologic Staging of Small Cell Lung Cancer in the Forthcoming Eighth Edition of the TNM Classification for Lung Cancer[J]. J Thorac Oncol, 2016, 11(3): 300-311. DOI:10.1016/j.jtho.2015.10.008 |
| [5] |
Lin X, Xiao Z, Hu Y, et al. Combining 18F-FDG PET/CT and Serum Lactate Dehydrogenase for Prognostic Evaluation of Small Cell Lung Cancer[J]. Front Pharmacol, 2020, 11: 592768. DOI:10.3389/fphar.2020.592768 |
| [6] |
Dingemans AC, Früh M, Ardizzoni A, et al. Small-cell lung cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2021, 32(7): 839-853. DOI:10.1016/j.annonc.2021.03.207 |
| [7] |
张文珏, 朱慧, 周宗玫, 等. TNM分期在局限期小细胞肺癌预后评估中的价值[J]. 中华肿瘤杂志, 2015, 37(12): 917-922. [Zhang WJ, Zhu H, Zhou ZM, et al. Prognostic value of AJCC TNM Staging 7th edition in limited-stage small cell lung cancer: validation in 437 patients[J]. Zhonghua Zhong Liu Za Zhi, 2015, 37(12): 917-922. DOI:10.3760/cma.j.issn.0253-3766.2015.12.008] |
| [8] |
Goldstraw P, Chansky K, Crowley J, et al. The IASLC Lung Cancer Staging Project: Proposals for Revision of the TNM Stage Groupings in the Forthcoming (Eighth) Edition of the TNM Classification for Lung Cancer[J]. J Thorac Oncol, 2016, 11(1): 39-51. DOI:10.1016/j.jtho.2015.09.009 |
| [9] |
Vallières E, Shepherd FA, Crowley J, et al. The IASLC Lung Cancer Staging Project: proposals regarding the relevance of TNM in the pathologic staging of small cell lung cancer in the forthcoming (seventh) edition of the TNM classification for lung cancer[J]. J Thorac Oncol, 2009, 4(9): 1049-1059. DOI:10.1097/JTO.0b013e3181b27799 |
| [10] |
Dai C, Ren Y, Xie D, et al. Does Lymph Node Metastasis Have a Negative Prognostic Impact in Patients with NSCLC and M1a Disease?[J]. J Thorac Oncol, 2016, 11(10): 1745-1754. DOI:10.1016/j.jtho.2016.06.030 |
| [11] |
Rami-Porta R, Asamura H, Travis WD, et al. Lung cancer - major changes in the American Joint Committee on Cancer eighth edition cancer staging manual[J]. CA Cancer J Clin, 2017, 67(2): 138-155. DOI:10.3322/caac.21390 |
| [12] |
Asamura H, Chansky K, Crowley J, et al. The International Association for the Study of Lung Cancer Lung Cancer Staging Project: Proposals for the Revision of the N Descriptors in the Forthcoming 8th Edition of the TNM Classification for Lung Cancer[J]. J Thorac Oncol, 2015, 10(12): 1675-1684. DOI:10.1097/JTO.0000000000000678 |
| [13] |
Iida T, Shiba M, Yoshino I, et al. Surgical Intervention for Non-Small-Cell Lung Cancer Patients with Pleural Carcinomatosis: Results From the Japanese Lung Cancer Registry in 2004[J]. J Thorac Oncol, 2015, 10(7): 1076-1082. DOI:10.1097/JTO.0000000000000554 |
| [14] |
Ryu JS, Lim JH, Lee JM, et al. Minimal Pleural Effusion in Small Cell Lung Cancer: Proportion, Mechanisms, and Prognostic Effect[J]. Radiology, 2016, 278(2): 593-600. DOI:10.1148/radiol.2015142388 |
| [15] |
Kato R, Hayashi H, Chiba Y, et al. Prognostic Impact of Minimal Pericardial Effusion in Patients With Advanced Non-small-cell Lung Cancer[J]. Clin Lung Cancer, 2017, 18(6): e449-e455. DOI:10.1016/j.cllc.2017.05.011 |
| [16] |
Morris ZS, Cannon DM, Morris BA, et al. Impact of a Contralateral Tumor Nodule on Survival in Non-Small-Cell Lung Cancer[J]. J Thorac Oncol, 2015, 10(11): 1608-1615. DOI:10.1097/JTO.0000000000000655 |
| [17] |
Ignatius Ou SH, Zell JA. The applicability of the proposed IASLC staging revisions to small cell lung cancer (SCLC) with comparison to the current UICC 6th TNM Edition[J]. J Thorac Oncol, 2009, 4(3): 300-310. DOI:10.1097/JTO.0b013e318194a355 |
| [18] |
Girard N, Ostrovnaya I, Lau C, et al. Genomic and mutational profiling to assess clonal relationships between multiple non-small cell lung cancers[J]. Clin Cancer Res, 2009, 15(16): 5184-5190. DOI:10.1158/1078-0432.CCR-09-0594 |
| [19] |
王继凡, 张特, 丁翰林, 等. 同时性多原发肺癌与肺内转移鉴别方法研究进展[J]. 中国肺癌杂志, 2021, 24(5): 365-371. [Wang JF, Zhang T, Ding HL, et al. Research Progress in Distinguishing Methods of Simultaneous Multiple Primary Lung Cancer and Intrapulmonary Metastasis[J]. Zhongguo Fei Ai Za Zhi, 2021, 24(5): 365-371.] |
| [20] |
Zou J, Guo S, Xiong MT, et al. Ageing as key factor for distant metastasis patterns and prognosis in patients with extensive-stage Small Cell Lung Cancer[J]. J Cancer, 2021, 12(6): 1575-1582. DOI:10.7150/jca.49681 |
| [21] |
Huang LL, Hu XS, Wang Y, et al. Survival and pretreatment prognostic factors for extensive-stage small cell lung cancer: A comprehensive analysis of 358 patients[J]. Thorac Cancer, 2021, 12(13): 1943-1951. DOI:10.1111/1759-7714.13977 |
| [22] |
Lim JH, Ryu JS, Kim JH, et al. Gender as an independent prognostic factor in small-cell lung cancer: Inha Lung Cancer Cohort study using propensity score matching[J]. PLoS One, 2018, 13(12): e0208492. DOI:10.1371/journal.pone.0208492 |
| [23] |
Zhou K, Shi H, Chen R, et al. Association of Race, Socioeconomic Factors, and Treatment Characteristics With Overall Survival in Patients With Limited-Stage Small Cell Lung Cancer[J]. JAMA Netw Open, 2021, 4(1): e2032276. DOI:10.1001/jamanetworkopen.2020.32276 |
| [24] |
Shan Q, Shi J, Wang X, et al. A new nomogram and risk classification system for predicting survival in small cell lung cancer patients diagnosed with brain metastasis: a large population-based study[J]. BMC Cancer, 2021, 21(1): 640. DOI:10.1186/s12885-021-08384-5 |
| [25] |
Daly ME, Ismaila N, Decker RH, et al. Radiation Therapy for Small-Cell Lung Cancer: ASCO Guideline Endorsement of an ASTRO Guideline[J]. J Clin Oncol, 2021, 39(8): 931-939. DOI:10.1200/JCO.20.03364 |
| [26] |
Sheikh S, Dey A, Datta S, et al. Role of radiation in extensive stage small cell lung cancer: a National Cancer Database registry analysis[J]. Future Oncol, 2021, 17(21): 2713-2724. DOI:10.2217/fon-2020-1095 |
| [27] |
Lee JS, Kim S, Sung SY, et al. Treatment Outcomes of 9, 994 Patients With Extensive-Disease Small-Cell Lung Cancer From a Retrospective Nationwide Population-Based Cohort in the Korean HIRA Database[J]. Front Oncol, 2021, 11: 546672. DOI:10.3389/fonc.2021.546672 |
| [28] |
Noronha V, Ravind R, Patil VM, et al. The role of chemotherapy in patients with small cell lung cancer and poor performance status[J]. Acta Oncol, 2020, 59(12): 1520-1527. DOI:10.1080/0284186X.2020.1819562 |
 2022, Vol. 49
2022, Vol. 49


