文章信息
- 非小细胞肺癌组织中circ_0006692的表达及其对肺癌细胞增殖转移的调控机制
- Expression of circ_0006692 in Non-small Cell Lung Cancer and Its Regulatory Mechanism on Proliferation and Metastasis of Lung Cancer Cells
- 肿瘤防治研究, 2021, 48(9): 846-852
- Cancer Research on Prevention and Treatment, 2021, 48(9): 846-852
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.21.0383
- 收稿日期: 2021-04-09
- 修回日期: 2021-06-16
2. 350014 福州,福建省科技厅转化医学重点实验室;
3. 350014 福州,福建医科大学附属福建省肿瘤医院病理科
2. Fujian Provincial Key Laboratory of Translational Cancer Medicine, Fuzhou 350014, China;
3. Department of Pathology, Fujian Cancer Hospital and Fujian Medical University Cancer Hospital, Fuzhou 350014, China
2020年前肺癌的发病率及死亡率在我国均居首位,非小细胞肺癌(non-small cell lung cancer, NSCLC)占肺癌的80%~85%,虽然近年来针对肿瘤驱动基因和免疫检查点的靶点治疗取得了振奋人心的成果,继发性耐药等问题迫使人们不断寻找新的生物标志物和干预靶点[1]。环状RNA是一种新型内源性长链非编码RNA,由外显子或内含子经套索驱动或内含子配对形成的,无5'帽端和3'尾端的共价闭合环状结构,不受RNA外切酶影响[2]。近年来,环状RNA (circRNA)作为一种新型分子标志物在肿瘤诊疗中的作用备受关注[3]。研究表明,环状RAN在肿瘤组织中表达异常,与肿瘤的发生发展密切相关[4]。在前期工作中,通过分析文献的数据库[5],利用生物信息手段筛查出肺癌密切相关的环状RNA circ_0006692。circ_0006692与非小细胞肺癌之间的关系尚未见报道。据文献报道,circRNAs在调控肿瘤细胞发生EMT过程中也具有重要作用[6]。本研究就circ_0006692与非小细胞肺癌发生、发展之间的关系及其在EMT过程中所起的作用进行探讨。
1 资料与方法 1.1 样本收集、细胞和主要试剂收集2016年1月—2018年6月于福建省肿瘤医院进行外科手术的50例非小细胞肺癌病例(癌和癌旁组织),其中男27例,女23例。所有患者术前均未接受过任何治疗,新鲜组织获取后立即放入液氮保存,随后转入-80℃冰箱保存,整个收集过程及保存过程均按照无菌原则操作。按照UICC/AJCC第8版肺癌TNM分期:Ⅰ、Ⅱ病例组40例,Ⅲ、Ⅳ病例组10例。鳞癌16例,腺癌34例。本研究经福建省肿瘤医院伦理委员会批准(审批号:SQ2019-021-01),所有纳入患者均在手术前签署知情同意书。人肺上皮细胞株BEAS-2B和非小细胞肺癌细胞株(HCC827, PC-9, H358, H1299, A549)购自美国典型培养物保藏中心(ATCC),主要试剂还包括RPMI 1640培养基(美国Gibco公司)、胎牛血清(FBS, 美国Gibco公司)、RNeasy Mini Kit(德国Qiagen公司)、CDH1、CDH2、MMP7(美国Cell Signaling Technology公司)、β-actin、anti-rabbit HRP-conjugated IgG antibody(美国Cell Signaling Technology公司)、RevertAid™第一链cDNA Synthesis试剂盒、HRP的增强型化学发光底物(美国Thermo公司)、Millicell cell culture inserts(美国Millipore公司)、MTS细胞活力检测试剂盒(美国Promega公司)以及hsa_circ_0006692过表达慢病毒HBLV和HBLV-hsa_circ_0006692(中国汉恒生物科技公司)。
1.2 细胞培养和病毒感染将A549细胞培养于RPMI 1640培养基中,包含10%FBS、100 u/ml青霉素和100 μg/ml链霉素,放置37℃和5%CO2的湿度环境的培养箱中,2~3 d传代一次,所有实验均采用对数生长细胞。A549细胞以5×105个/孔接种于6孔板中,待24 h后换液,HBLV和HBLV-hsa_circ_0006692病毒以MOI值为10,与6 μg/ml聚凝胺混合感染细胞,48 h后,用2 μg/ml嘌呤霉素(Puromycin)筛选细胞两周,获得稳定转染的HBLV-hsa_circ_0006692过表达/敲低细胞株(A549/circ_0006692-OE, A549/circ_0006692-SH)及其空载对照细胞株(A549/NC)。
1.3 实验方法 1.3.1 MTS法检测细胞增殖能力将A549、A549/NC、A549/circ_0006692-OE和A549/circ_0006692-SH细胞以5×103个/孔接种到96孔板中,培养24、48、72 h后,用20 μl MTS加100 μl含血清培养液,37℃孵育2 h,用仅含血清的RPMI 1640培养液作为背景消减,用BIO-RAD Model 680检测490 nm的吸收光。SPSS17.0进行计算。实验重复三次。
1.3.2 实时荧光定量PCR(qRT-PCR)实验qRT-PCR检测非小细胞肺癌、癌旁组织以及A549各实验组细胞中circ_0006692和EMT相关基因CDH1、CDH2和MMP7 mRNA水平,按照说明书用RevertAid First Strand cDNA sythesis kit将1 μg总RNA反转录为cDNA。取1 μl cDNA利用LightCycler 480 SYBR GreenⅠMaster按照说明书进行qRT-PCR,扩增程序为:95℃ 15 min; 40个循环,每个循环中:95℃ 15 s; 55℃ 30 s; 72℃ 10 s; 最后40℃ 1 min; GAPDH作为内参基因。
1.3.3 数据分析和修正以GAPDH为内参基因对各基因表达进行标准化,同时以近平均值癌组织表达为准(作为对照组),即它的表达量设为1,量化其他样本的表达量; 在调整基线循环和计算阈值后,采用2-ΔΔCt法比较hsa_circ_0006692的相对表达量,仪器自动根据得出的Ct值(threshold cycle)运用相对定量的计算公式ΔCtpatient=Ctcirc_0006692-CtGAPDH,ΔΔCt=ΔCtpatient-ΔCtX,RQ值为2-ΔΔCt,计算得出代表相对表达量的RQ值,为了便于统计,把RQ值取logl0进行分析。
1.3.4 Western blot检测蛋白表达将细胞在冰上裂解,超声离心后取上清液,BCA法测定蛋白浓度,并进行聚丙烯酰胺凝胶电泳,湿法转印至硝酸纤维素膜上。3%BSA封闭1 h后分别加入稀释好的一抗4℃环境过夜,1×TBST洗涤4次,加入二抗封闭120 min,1×TBST洗涤3次后ECL发光试剂盒显色,凝胶成像系统照相,分析灰度值。
1.3.5 Transwell侵袭实验把各细胞浓度调整为每毫升7×105个细胞,Transwell上室包被Matrigel,取100 μl接种于Transwell上室,下方用1 mg/ml的Fibronectin(美国Millipore公司)进行包被,下室用含20%FBS的培养基作为趋化吸引条件,把小室悬挂在24孔板中。37℃孵育48 h,上室细胞用棉签擦除,小室用甲醇固定15 min晾干,用0.1%的结晶紫进行染色。随机选择5个视野进行观察,200倍倒置显微镜下观察计数,以确定各组细胞的平均数。实验重复三次。
1.3.6 克隆形成实验克隆形成实验中,A549各实验组细胞(约500个/孔)接种在6孔板中生长48 h。14 d后,细胞固定在甲醇中,用0.2%结晶紫染色。细胞集落(> 50个/菌落)用图像扫描仪(GE,Pis cataway,NJ,USA)拍摄。用ImageJ计数每个孔中的菌落数。
1.3.7 划痕实验接种A549各实验组细胞于6孔板中,当达到80%融合时用移液头轻轻划过细胞,形成宽度为200 μm左右的无细胞划痕区,继续培养48 h,观察划痕愈合能力。用倒置荧光显微镜拍摄。用Image J测量划痕间隙距离。
1.4 统计学方法采用SPSS17.0统计软件进行数据分析。配对资料的比较采用配对t检验; 两组间比较先进行正态性检验及方差齐性分析,后进行两独立样本t检验。计量资料以均数士标准差(x±s)表示,两组之间均数比较采用t检验,P < 0.05为差异有统计学意义。
2 结果 2.1 circ_0006692相关信息通过circBase数据库(http://www.circbase.org/)检索circ_0006692相关信息,发现circ_0006692源自TCONS基因,该基因位于17号染色体上,由334个碱基组成。由外显子1号和2号前体RNA(pre-mRNA)反向剪切形成,设计环状RNA的divergent引物用于实时荧光定量PCR实验,见图 1。
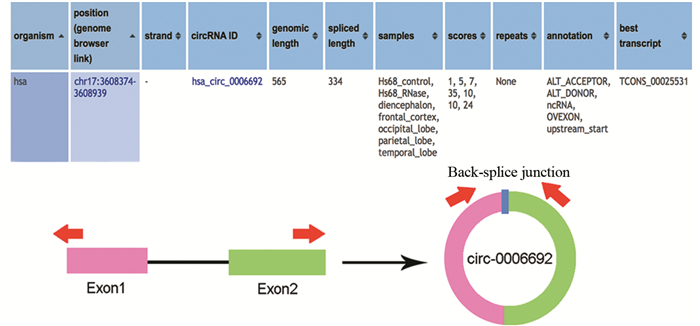
|
| 图 1 circ_0006692相关信息 Figure 1 Relevant information of circ_ 0006692 |
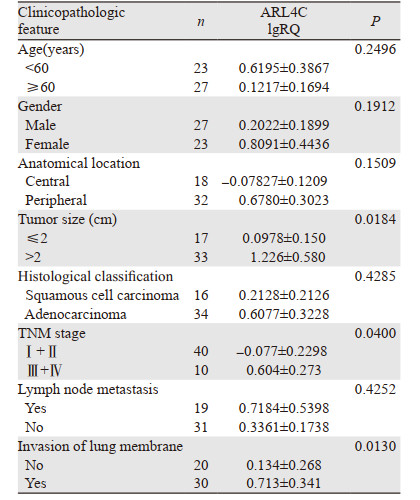
qRT-PCR检测结果表明,NSCLC癌组织中circ_0006692的表达量(0.327±0.147(log10RQ,RQ=2-ΔΔCt))比相应癌旁组织的表达量(-0.0589±0.0853)上调了2.43倍(P=0.0256),见图 2。circ_0006692表达与NSCLC TNM分期、肿瘤大小和肺膜侵犯密切相关(均P < 0.05),而与患者性别、年龄、肿瘤部位、淋巴结转移及组织分型无显著相关性(均P > 0.05),见表 1。
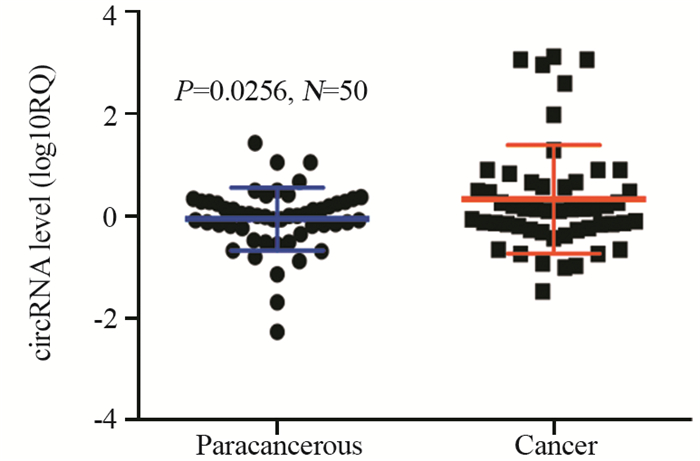
|
| 图 2 circ_0006692在非小细胞肺癌及癌旁组织中的表达 Figure 2 Expression of circ_ 0006692 in NSCLC and paracancerous tissues |
|
qRT-PCR检测结果发现HCC827、PC-9、H358、H1299和A549相较于BEAS-2B细胞hsa_circ_0006692的表达水平有不同程度的上调,其中A549上调水平最高,见图 3A。因此,后续研究选择A549细胞系进行过表达/敲低实验。circ_0006692在A549/circ_0006692-OE组表达水平显著高于A549/NC组(P < 0.001),而circ-0006692在A549/circ_0006692-SH组表达水平显著低于A549/NC组(P < 0.001),见图 3B~C。以上结果表明A549/circ_0006692-OE和A549/circ_0006692-SH肺癌细胞株构建成功。
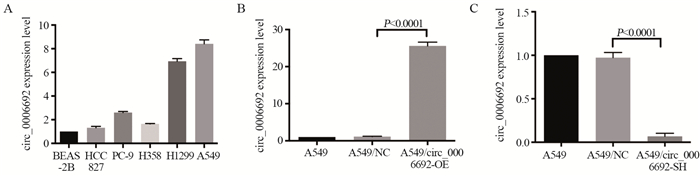
|
| 图 3 circ_0006692在非小细胞肺癌细胞系中的表达(A)以及其过表达(B)或敲低(C)细胞株的构建 Figure 3 Expression of circ_0006692 in NSCLC cell line(A) and construction of A549 cell line with circ_0006692 overexpression(B) or knockdown(C) |
MTS实验结果显示,24、48 h A549/circ_0006692-OE组增殖能力显著高于A549/NC组(P < 0.001),见图 4A; 克隆实验结果显示,A549/circ_0006692-OE组克隆数显著高于A549/NC组(P < 0.001),见图 4B; 表明circ_0006692过表达促进细胞增殖。流式细胞术周期检测结果显示A549/circ_0006692-OE组在S期的百分比较A549/NC组显著上调(P < 0.0001),见图 4C。
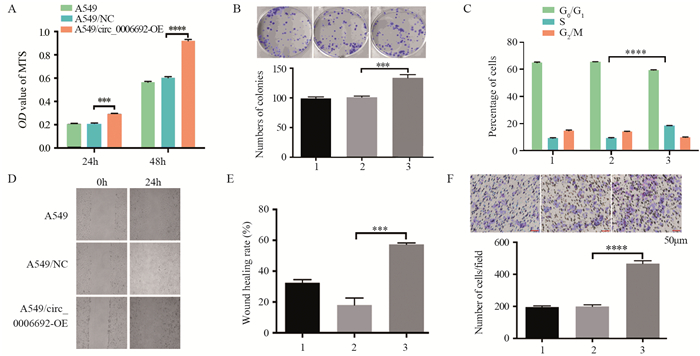
|
| 1: A549; 2: A549/NC; 3: A549/circ_0006692-OE; ***: P < 0.001; ****: P < 0.0001. 图 4 circ_0006692过表达对A549细胞活力(A)、增殖(B)、细胞周期(C)、迁移(D, E)和侵袭(F)能力的影响 Figure 4 Effect of circ_0006692 overexpression on viability(A), proliferation(B), cell cycle(C), migration(D, E) and invasion(F) abilites of A549 cells |
划痕实验结果显示,A549/circ_0006692-OE创伤愈合率显著高于A549/NC(P < 0.05),见图 4D~E; Transwell实验结果显示,A549/circ_0006692-OE组细胞穿膜数显著高于A549/NC组(P < 0.05),见图 4F。表明circ_0006692过表达促进A549肺癌细胞侵袭、转移。
2.5 circ_0006692敲低对肺癌细胞增殖、侵袭及转移的影响MTS实验结果显示,24、48h A549/circ_00066 92-SH组增殖能力显著低于A549/NC组(P < 0.05),见图 5A; 克隆实验结果显示,A549/circ_0006692-SH组克隆数表达显著低于A549/NC组(P < 0.05),见图 5B; 表明circ_0006692敲低抑制细胞增殖。流式细胞术周期检测结果显示A549/circ_0006692-SH组在S期的百分比相比于A549/NC组显著下调(P < 0.001),见图 5C。
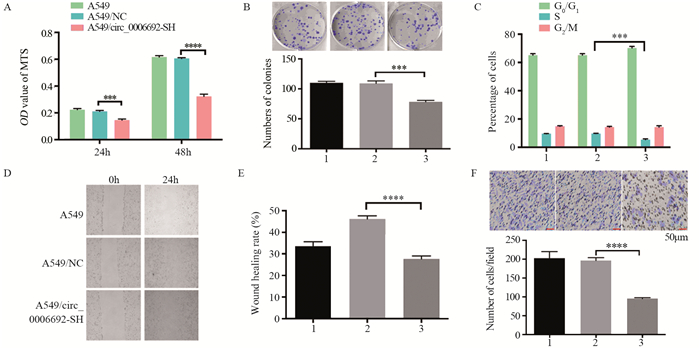
|
| 1: A549; 2: A549/NC; 3: A549/circ_0006692-SH; ***: P < 0.001; ****: P < 0.0001. 图 5 circ_0006692的敲低对A549细胞活力(A)、增殖(B)、细胞周期(C)、迁移(D, E)和侵袭(F)能力的影响 Figure 5 Effect of circ_0006692 knockdown on viability(A), proliferation(B), cell cycle(C), migration(D, E) and invasion(F) abilites of A549 cells |
划痕实验结果显示A549/circ_0006692-SH组创伤愈合率显著低于A549/NC组(P < 0.0001),见图 5D~E; Transwell实验结果显示A549/circ_0006692-SH组细胞穿膜数显著低于A549/NC组(P < 0.05),见图 5F。表明circ_0006692敲低抑制A549肺癌细胞侵袭、转移。
2.6 circ_0006692表达与EMT信号通路相关基因的关系qRT-PCR和Western blot检测结果显示:circ_0006692过表达组中,CDH2和MMP7高表达,而CDH1低表达; circ_0006692敲低组中,CDH1高表达,而CDH2和MMP7低表达,差异有统计学意义(P < 0.001),见图 6。以上结果表明,circ_0006692表达变化与EMT信号通路密切相关,circ_0006692异常表达促进上皮间质转化。
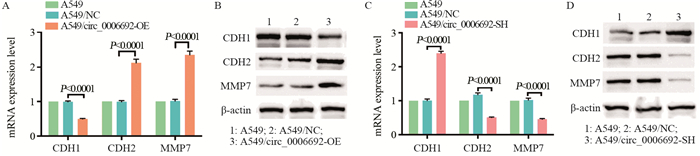
|
| The expression of CDH1, CDH2 and MMP7 in A549 cells were detected by qRT-PCR (A, C) and Western blot (B, D). 图 6 circ_0006692表达与EMT相关基因的关系 Figure 6 Relation between circ_0006692 expression and EMT-related genes |
作为新型非编码RNA, 环状RAN是一类不具有5’和3’末端头尾结构,以共价键形成环状结构的RNA分子,且具有高度保守性和组织、时序、疾病特异性[7]。研究显示,环状RNA在肝癌、胃癌、乳腺癌、结肠癌、膀胱癌、卵巢肿瘤、皮肤鳞状上皮癌等多种癌症中存在异常表达,而且与临床病理特征及预后密切相关[8-9]。hsa_circ_0001649在肝癌组织中的表达与正常组织有显著差异,且与肝癌肿瘤大小和癌栓的发生密切相关,是肝癌潜在的分子标志物[10]。
最近的研究表明,环状RNA可能在肺癌的发生发展和预后中起重要作用。hsa_circRNA_012515在NSCLC患者中高表达并影响其预后[11]。环状RNA 100146在非小细胞肺癌细胞中通过直接结合miR-361-3p和miR-615-5p发挥癌基因的作用[12]。circRNA_102179通过调节miR-330-5p/HMGB3轴促进非小细胞肺癌细胞的增殖、迁移和侵袭[13]。
在前期工作中,通过分析文献的数据库,利用生物信息手段筛查出肺癌密切相关的环状RNA circ_0006692。本研究结果显示,相较于正常肺上皮细胞株及癌旁组织,circ_0006692在肺癌细胞株及非小细胞肺癌组织中表达显著上调(P < 0.05)。进一步临床病理分析表明,circ_0006692的表达与肿瘤大小、TNM分期及肺膜侵犯密切相关(P < 0.05)。以上临床检测结果表明,circ_0006692在非小细胞肺癌中异常表达,在NSCLC发生、发展中起重要作用。
同时生物学功能研究表明,circ_0006692过表达促进A549肺癌细胞的增殖、侵袭和转移; circ_0006692敲低抑制A549肺癌细胞的增殖侵袭、转移。癌相关成纤维细胞衍生的CXCL11通过circUBAP2/miR-4756/IFIT1/3轴调节肝癌细胞迁移和肿瘤转移[14]。circ_0000735通过调节miR-635/FAM83F轴促进非小细胞肺癌的增殖、转移和糖酵解[15],这与我们的结果相一致。以上结果表明,circRNA在调控肿瘤细胞增殖、迁移和肿瘤转移发挥重要作用。本研究还发现,circ_0006692异常表达影响EMT进程。circRNAs含有miRNA反应元件(MREs),可以竞争性结合miRNA,并且circRNAs可以作为竞争性内源性RNA(ceRNAs)或miRNA海绵发挥作用,抑制miRNA对靶基因的负调控,参与了肿瘤的侵袭和转移[16]。circRNA_ACAP2通过靶向miR-21-5p/STAT3信号轴抑制头颈部鳞状细胞癌中的EMT[17]。circRNA-circPTPRA通过吸附miR-96-5p抑制NSCLC细胞的上皮-间充质转化和转移[18]。我们推测circ_0006692发挥miRNA海绵作用,抑制miRNA对靶基因的负调控,进而调控EMT进程,影响肺癌的侵袭和转移,具体机制需进一步研究。
综上所述,circ_0006692在非小细胞肺癌的发生发展过程中发挥重要作用,并且与肿瘤大小、TNM分期及肺膜侵犯密切相关。circ_0006692异常表达影响肺癌细胞增殖、侵袭、转移及EMT进程。circ_0006692可能是NSCLC的新的标志物和治疗靶点。
作者贡献
陈增:实验设计、实施及文章撰写
廖锦容:实验实施及文章执笔
邹长棪、苏颖、林可焴:部分生物学功能研究
金善丰、郑倩兰:提供病例及收集临床资料
林贤东:实验设计、评估及文章审校
| [1] |
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2019[J]. CA Cancer J Clin, 2019, 69(1): 7-34. DOI:10.3322/caac.21551 |
| [2] |
Zhang HD, Jiang LH, Sun DW, et al. CircRNA: a novel type of biomarker for cancer[J]. Breast Cancer, 2018, 25(1): 1-7. DOI:10.1007/s12282-017-0793-9 |
| [3] |
Jiang C, Zeng X, Shan R, et al. The Emerging Picture of the Roles of CircRNA-CDR1as in Cancer[J]. Front Cell Dev Biol, 2020, 8: 590478. DOI:10.3389/fcell.2020.590478 |
| [4] |
Chen D, Ma W, Ke Z, et al. CircRNA hsa_circ_100395 regulates miR-1228/TCF21 pathway to inhibit lung cancer progression[J]. Cell Cycle, 2018, 17(16): 2080-2090. DOI:10.1080/15384101.2018.1515553 |
| [5] |
Liang ZZ, Guo C, Zou MM, et al. circRNA-miRNA-mRNA regulatory network in human lung cancer: an update[J]. Cancer Cell Int, 2020, 20: 173. DOI:10.1186/s12935-020-01245-4 |
| [6] |
Shang BQ, Li ML, Quan HY, et al. Functional roles of circular RNAs during epithelial-to-mesenchymal transition[J]. Mol Cancer, 2019, 18(1): 138. DOI:10.1186/s12943-019-1071-6 |
| [7] |
Kristensen LS, Andersen MS, Stagsted LVW, et al. The biogenesis, biology and characterization of circular RNAs[J]. Nat Rev Genet, 2019, 20(11): 675-691. DOI:10.1038/s41576-019-0158-7 |
| [8] |
Patop IL, Kadener S. circRNAs in Cancer[J]. Curr Opin Genet Dev, 2018, 48: 121-127. DOI:10.1016/j.gde.2017.11.007 |
| [9] |
张旭, 马芳, 纳玮, 等. 环状RNA Hsa_circ_0026352在乳腺癌中的表达及临床意义[J]. 肿瘤防治研究, 2021, 48(1): 43-48. DOI:10.3971/j.issn.1000-8578.2021.20.0310 |
| [10] |
Zhang X, Qiu S, Luo P, et al. Down-regulation of hsa_circ_0001649 in hepatocellular carcinoma predicts a poor prognosis[J]. Cancer Biomark, 2018, 22(1): 135-142. DOI:10.3233/CBM-171109 |
| [11] |
Fu Y, Huang L, Tang H, et al. hsa_circRNA_012515 Is Highly Expressed in NSCLC Patients and Affects Its Prognosis[J]. Cancer Manag Res, 2020, 12: 1877-1886. DOI:10.2147/CMAR.S245525 |
| [12] |
Chen L, Nan A, Zhang N, et al. Circular RNA 100146 functions as an oncogene through direct binding to miR-361-3p and miR-615-5p in non-small cell lung cancer[J]. Mol Cancer, 2019, 18(1): 13. DOI:10.1186/s12943-019-0943-0 |
| [13] |
Zhou ZF, Wei Z, Yao JC, et al. CircRNA_102179 promotes the proliferation, migration and invasion in non-small cell lung cancer cells by regulating miR-330-5p/HMGB3 axis[J]. Pathol Res Pract, 2020, 216(11): 153144. DOI:10.1016/j.prp.2020.153144 |
| [14] |
Liu G, Sun J, Yang ZF, et al. Cancer-associated fibroblast-derived CXCL11 modulates hepatocellular carcinoma cell migration and tumor metastasis through the circUBAP2/miR-4756/IFIT1/3 axis[J]. Cell Death Dis, 2021, 12(3): 260. DOI:10.1038/s41419-021-03545-7 |
| [15] |
Tai G, Zhang M, Liu F. Circ_0000735 enhances the proliferation, metastasis and glycolysis of non-small cell lung cancer by regulating the miR-635/FAM83F axis[J]. Exp Lung Res, 2021, 47(3): 136-148. |
| [16] |
Lin X, Chen Y. Identification of Potentially Functional CircRNA-miRNA-mRNA Regulatory Network in Hepatocellular Carcinoma by Integrated Microarray Analysis[J]. Med Sci Monit Basic Res, 2018, 24: 70-78. DOI:10.12659/MSMBR.909737 |
| [17] |
Ma C, Shi T, Qu Z, et al. CircRNA_ACAP2 Suppresses EMT in Head and Neck Squamous Cell Carcinoma by Targeting the miR-21-5p/STAT3 Signaling Axis[J]. Frontiers Oncol, 2020, 10: 583682. DOI:10.3389/fonc.2020.583682 |
| [18] |
Wei S, Zheng Y, Jiang Y, et al. The circRNA circPTPRA suppresses epithelial-mesenchymal transitioning and metastasis of NSCLC cells by sponging miR-96-5p[J]. EBioMedicine, 2019, 44: 182-93. DOI:10.1016/j.ebiom.2019.05.032 |
 2021, Vol. 48
2021, Vol. 48


