文章信息
- 莱菔硫烷下调miR-200c启动子甲基化水平抑制肺腺癌干细胞的干性特征
- Sulforaphane Suppressed Stemness Characters of Lung Adenocarcinoma Stem Cells by Down-regulating Methylation of miR-200c Promoter
- 肿瘤防治研究, 2021, 48(10): 934-940
- Cancer Research on Prevention and Treatment, 2021, 48(10): 934-940
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.21.0375
- 收稿日期: 2021-04-07
- 修回日期: 2021-08-26
肺癌是我国发病率和病死率均位居前列的恶性肿瘤[1]。非小细胞肺癌(NSCLC)是最常见的肺癌亚型,占肺癌病例的85%[2]。肿瘤干细胞(cancer stem cells, CSCs)是恶性肿瘤复发或转移的主要原因,具有自我更新、无限增殖和形成异质性肿瘤细胞的肿瘤细胞亚群。CSCs对几乎所有常规肿瘤药物具有抗药性或不敏感,能在多数现有肿瘤治疗手段中存活下来并引起肿瘤复发和转移。CSCs通过活化多种不同信号通路,如Wnt/β-catenin、Sonic Hedgehog、Notch、PI3K/Akt/mTOR、STAT3等,获得强大的存活能力。醛脱氢酶1(ALDH1)、致癌微RNA及上皮-间质转化(EMT)[3]也参与了CSCs的干性维持和存活调控。以CSCs为靶点的药物研究为肿瘤临床治疗提供新的治疗思路[4]。
莱菔硫烷(sulforaphane, SFN)是从绿花椰菜或其幼芽中提取的一种经葡糖异硫氰酸盐转化的天然化合物,其预防和抗肿瘤的效果在乳腺癌、膀胱癌、结肠癌、肺癌等多种恶性肿瘤中得到证实[5-8]。本课题组前期研究表明,SFN不仅能有效抑制肺癌细胞的增殖能力,还能在较低药物浓度下特异地抑制肺癌干细胞的增殖;SFN处理后伴随着细胞内大量miRNAs改变[8-9],推测SFN可能通过调控肺癌干细胞miRNAs转录水平而介导肺癌干细胞的活性,但SFN与miRNAs的相互作用关系至今仍不清楚。本研究旨在探索SFN在抑制肺癌干细胞的干性和EMT特征过程中miRNA的调控机制。
1 材料与方法 1.1 试剂莱菔硫烷购于美国Sigma公司;鼠抗人β-catenin、Klf4、c-myc和E-cadherin等单克隆抗体购自美国Santa Cruz公司。莱菔硫烷用DMSO溶解分装并贮存在-20℃冰箱中待用。miR-200c拮抗物(iRNA-200c)由上海凯基生物科技公司合成,PCR引物由美国Invitrogen公司合成,First strand cDNA synthesis Kit和QPCR premix(SYB)购于美国Fermantas公司,Ase Ⅰ、Hind Ⅲ等核酸内切酶购于美国NEB公司,psiCHECH-2购于美国Promega公司。
1.2 细胞株人肺癌细胞株H460和A549购于中科院上海细胞中心,常规培养备用,在10%新生牛血清DMEM高糖培养液中常规培养及备用。肿瘤球培养以无血清培养基培养。iRNA-200c转染的肿瘤细胞使用Lipofectamine2000(美国Thermo Fisher Scientific公司),按产品说明书操作。实验用细胞均处于对数生长期。
1.3 MTT细胞增殖实验贴壁细胞经胰酶消化后制备单细胞悬液,计数并调整细胞密度为(1.0~1.5)×104个/毫升,加入96孔板中,每孔200 μl,即2 000~3 000个/孔,共9孔。设3个重复孔。常规培养过夜后(12 h以上)加入不同浓度SFN(0、0.5、1.0、5.0、10、12.5、15、20 μmol/L)处理72 h。加入噻唑蓝(MTT),MTT终浓度为5.0 mg/ml,孵育4 h后弃上清液,加入DMSO,每孔200 µl,37℃恒温摇床振荡10 min,用酶标仪在490 nm波长处测定各孔吸光度值。
1.4 肿瘤球形成实验细胞经胰酶消化后以1 000 r/min离心2 min,弃上清液。以无菌PBS反复离心、洗涤3次后加入无血清培养液,制备单细胞悬液。调整细胞密度为50个/毫升,将单细胞悬液按5毫升/孔均匀地转移到超低黏附6孔板内,进行肿瘤球培养72 h。分为对照组和SFN-S组(5.0 μmol/L)。
1.5 蛋白印迹法实验细胞分为空白组和SFN-S组。按5×105个/毫升密度接种于200 ml培养瓶中,接种8 h贴壁后加入SFN(5.0 μmol/L)处理72 h,收获细胞并提取细胞总蛋白测量蛋白含量,置入-20℃冰箱备用。加入等量的3×SDS PAGE缓冲液,96℃恒温水浴加热5 min,各组取等量蛋白进行12%SDS PAGE电泳并转移到NC膜上,NC膜用5%脱脂奶粉4℃封闭2 h,TBST洗涤后将膜与稀释的一抗置入4℃冰箱中孵育过夜,TBST液充分洗膜3次,每次振摇10 min。加入二抗室温孵育2 h。冲洗除去未结合过氧化物酶标记的羊抗鼠二抗,TBST摇洗3次,每次8 min。取出NC膜应用免疫发光反应,在数字成像系统中显影。
1.6 NGS测序法肿瘤细胞以无血清培养基培养并加入不同浓度SFN(0、5.0 μmol/L),72 h后加入适量新鲜无血清培养基。继续培养72 h后按600 r/min离心×3 min收获肿瘤球。另取部分细胞常规培养72 h,以PBS洗涤3次后加入适量TRIzol裂解细胞。实验分组:常规培养Control组(贴壁细胞)、Sphere组(肿瘤球空白对照)和SFN-S组(以SFN处理肿瘤球),按不同细胞沉淀量加入适量TRIzol裂解细胞,在干冰条件下送测序公司,对细胞总miRNA进行高通量测序。安诺优达基因科技(北京)有限公司提供测序服务。
1.7 实时荧光定量PCR(qRT-PCR)检测实验分为Control组、Sphere组(即肿瘤球不经任何处理)和SFN-S组(以SFN处理肿瘤球)。SFN-S组在H460和A549细胞贴壁后更换培养液(SFN终浓度5 μmol/L),对照组不作任何处理。常规培养72 h后使用TRIzol试剂提取细胞总RNA。利用SYBR Green试剂盒进行qRT-PCR验证,GAPDH基因为内参。扩增程序为97℃ 3 min;95℃变性30 s,56℃退火20 s,72℃延伸30 s,40个循环。实验重复3次。结果以2-ΔΔCt表示。具体步骤参考产品说明。miR-200c引物序列如下:miR-200c-Forward:5'-GGTAATACTGCCGGGTAAT-3',miR-200c-Reverse:5'-CAGTGCGTGTCGTGGAGT-3',退火温度60℃,长度63bp。U6-Forward:5'-CTCGCTTCGGCAGCACA-3';U6-Reverse:5'-AACGCTTCACGAATTTGCGT-3'。
1.8 构建转染miR-200c启动子-GFP质粒与筛选稳定表达的细胞株使用psiCHECH-2质粒为模板,经RT-PCR法获得miR-200c CDS上游约350 bp启动子片段(序列两端引入AseⅠ和HindⅢ两种酶切位点),即:miR-200c Ase I-F: 5'-GAATTAATTC-GCCCGGTGACAGGTAAAGG-3’;miR-200c HindⅢ-R: 5'-CTA AGCTTAGCAAACACTGCTGGGTAAGACG-3’。将上述DNA片段重组到pEGFP质粒GFP基因上游,获得pEGFP-R200c质粒,经转导至感受态大肠杆菌后扩增,所提取的质粒DNA经双酶切后电泳并经产物测序证实。pEGFP-R200c质粒使用Lipofectamine2000试剂盒转染到A549和H460细胞,经G418筛选获得稳定表达的细胞株。所得细胞株用于肿瘤球形成实验和基因甲基化检测。
1.9 细胞免疫荧光检测将一定数量的H460、A549细胞接种到预先放置无菌盖玻片的6孔板,以10%新生牛血清RPMI 1640培养基常规培养24 h后,对照组继续培养,SFN-S组加入SFN处理,终浓度为5 μmol/L,处理72 h后取出,PBS洗3次,4%多聚甲醛固定20 min,去垢剂0.1%triton X-100处理10 min,PBS洗3次。加入4%BSA封闭10 min;去除BSA后不需洗涤,加入一抗(浓度按预实验确定),37℃下孵育40 min。PBS洗3次,3分钟/次,加入荧光二抗,37℃下孵育40 min。PBS洗3次,3分钟/次,加入抗荧光猝灭封片剂和DAPI混合液(1:1,DAPI为原液),放置于荧光显微镜观察并拍照。
1.10 亚硫酸氢盐法检测基因甲基化水平使用稳定表达miR-200c启动子-GFP质粒的A549细胞株,均以无血清培养基培养肿瘤球。实验分为3组:Sphere组(肿瘤球空白培养)、SFN-S组(SFN处理浓度为5 μmol/L)、5-氮杂胞苷组(5-氮杂胞苷浓度为0.5 μmol/L)。收获各组细胞DNA,加入亚硫酸氢钠处理后备用。PCR扩增亚硫酸氢钠处理过的DNA样品,将含有目的DNA片段的PCR产物重组到EGFP质粒内。设计PCR引物以扩增miR-200c启动子中CpG丰富区域,跨度从转录启始位点上游-315 ~-169 bp,此段区域包含有9个CpG位点。甲基化引物为:-328 ~-303, Forward: 5’-TAGGTAAAGGTTATTAGGGGAGAGG-3’;-142 ~-165, Reverse: 5’-ACCCAAATTACAATCCAAACAAA-3’。DNA产物大小为185 bp,扩增条件与PCR相同。PCR扩增产物经琼脂糖凝胶电泳分离并纯化,后连接到载体pEGFP内。挑取至少10个菌落进行DNA测序以排除基因变异。使用JASPAR database(http://jaspar.binf.ku.dk/cgi-bin/)进行miR-200c启动子序列的转录因子结合位点预测。验证序列的载体转染至A549细胞,建立稳定表达细胞株。常规进行肿瘤球培养,使用SFN或5-Aza-dC进行干预,72 h后收集肿瘤球并提取质粒DNA,送检测公司测序(实验重复10次),取所插入基因的主要甲基化位点甲基化程度平均值代表该组插入片段甲基化程度。
1.11 统计学方法应用SPSS13.0软件进行统计分析,数据以均数±标准差表示并进行单因素组间方差分析。P < 0.05为差异有统计学意义。
2 结果 2.1 SFN有效抑制肺癌细胞的增殖活性MTT实验结果表明,SFN处理后,A549和H460细胞增殖活性呈剂量依赖性降低,在较低浓度(1.0 μmol/L)下即能发挥抗肿瘤增殖活性,H460和A549的IC50分别为12和10 μmol/L,见图 1。
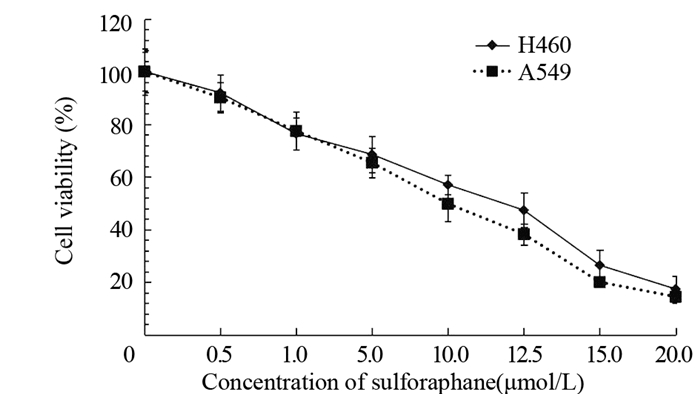
|
| 图 1 MTT法检测莱菔硫烷对肺癌细胞增殖活性的影响 Figure 1 Effect of sulforaphane on viability of lung cancer cells detected by MTT method |
与A549肿瘤球Sphere组比较,SFN-S组存在39个miRNAs转录水平增高,35个miRNAs转录水平下降(按变化 > 1倍);在H460肿瘤球中,与Sphere组比较,SFN-S组出现22个miRNAs转录水平增高,31个miRNAs转录水平下降。其中,转录水平变化 > 10倍的miRNAs在A549肿瘤球SFN-S组存在15个miRNAs增高,4个miRNAs下降;H460肿瘤球SFN-S组存在17个miRNAs增高,6个miRNAs下降,见图 2、表 1。
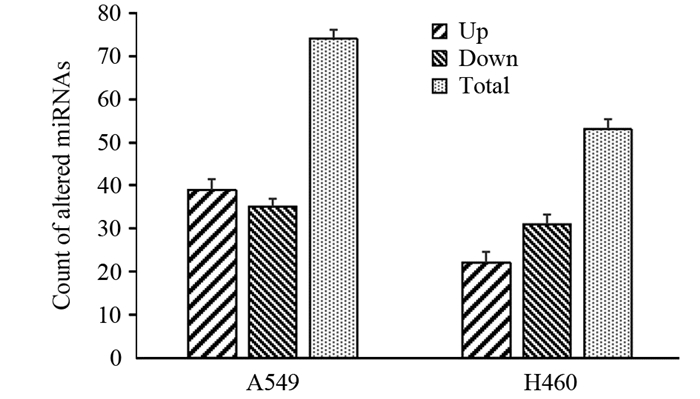
|
| The control group was a blank tumor sphere; the expression change > 1.0 times was the threshold. 图 2 莱菔硫烷处理肺癌细胞肿瘤球后差异表达miRNA的变化 Figure 2 Changes of differentiated expression of miRNAs in lung cancer tumorospheres treated with sulforaphane |
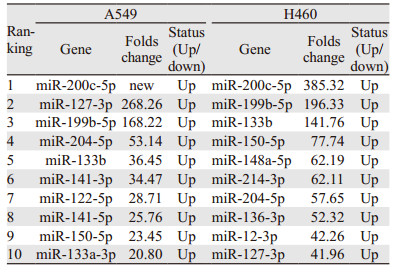
|
SFN处理A549和H460肿瘤球后miR-200c的转录变化水平最为明显。进一步行RT-PCR检测发现,与Control组(贴壁细胞)相比,Sphere组miR-200c的转录水平分别下降了54.1%和42.3%,而在SFN-S组分别上升了119.7%和72.21%,见图 3。

|
| *: P < 0.01, Sphere group vs. SFN-S group. 图 3 莱菔硫烷对A549和H460肿瘤球miRNAs转录的影响 Figure 3 Effect of sulforaphane on transcription of miRNAs in A549 and H460 tumor spheres |
蛋白印迹法检测发现,A549肿瘤球培养72 h后Sphere组肿瘤球中β-catenin、Klf4、c-myc等肿瘤干性相关基因的蛋白表达水平较Control组(贴壁细胞)显著增高,而SFN-S组较Sphere组明显下降;加入iRNA-200c处理后上述基因蛋白表达较Sphere组增高,而在联合组(iRNA-200c+SFN)中这些基因蛋白表达水平低于iRNA-200c组,但高于SFN-S组。Sphere组的E-cadherin蛋白表达水平低于Control组,SFN-S组则明显高于Sphere组和Control组;与Sphere组相比,iRNA-200c组稍有下降;联合组低于SFN-S组,但高于iRNA-200c组,见图 3~4。
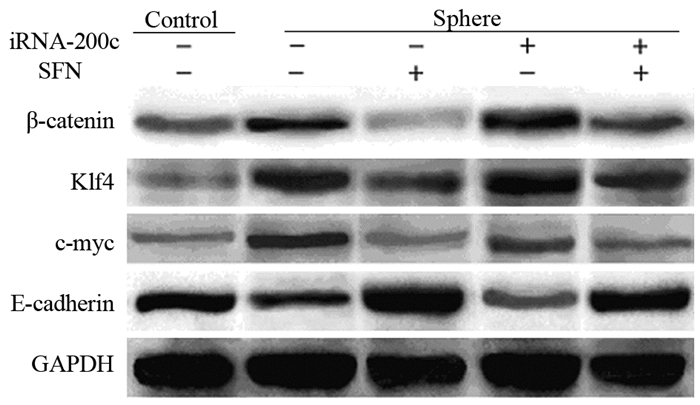
|
| 图 4 莱菔硫烷与RNA-200c拮抗物(iRNA-200c)对肺癌肿瘤球干性相关蛋白表达水平的影响 Figure 4 Effect of sulforaphane and RNA-200c antagonist on expression levels of stemness relative genes in tumor spheres of lung cancer |
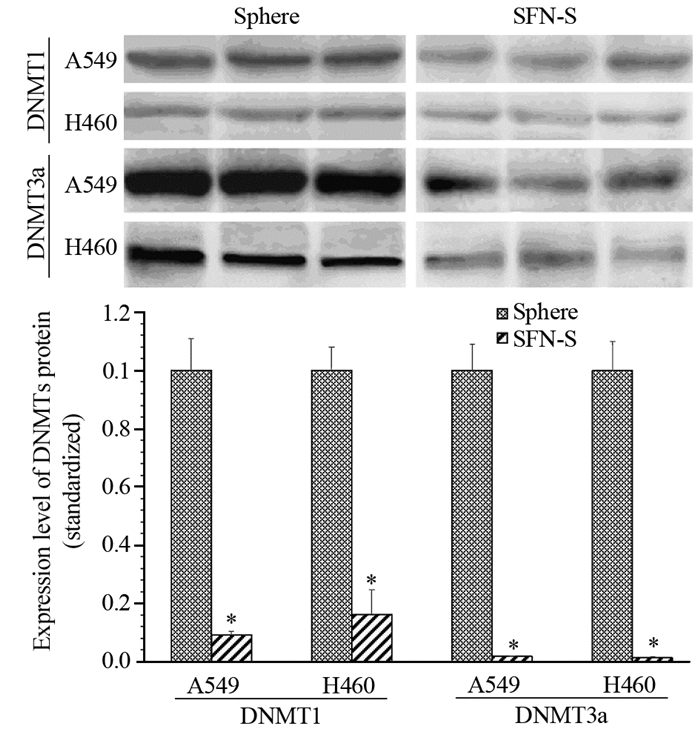
SFN处理后肺癌细胞肿瘤球miR-200c转录水平上调,提示SFN可能参与miR-200c的调控。进一步检测SFN处理肿瘤球前后DNMT1、DNMT3a、DNMT3b mRNA转录水平,结果表明,与Control组比较,Sphere组A549和H460细胞株肿瘤球DNMT1(P=0.041、0.039)、DNMT3a(P=0.034、0.029)、DNMT3b(P=0.216、0.141)mRNA转录水平均不同程度增高;而SFN处理后SFN-S组DNMTs有不同程度下降,其中DNMT1(P=0.028、0.031)和DNMT3a(P=0.019、0.030)下降较为明显。5-Aza-dC组对比Sphere组下降更为明显,见表 2。同时,蛋白印迹法检测A549和H460肿瘤球的结果提示,与Sphere组比较,SFN-S组的DNMT1(P=0.003、0.007)和DNMT3a(均P=0.000)蛋白表达水平均显著下降,见图 5。

|
|
| *: P < 0.05, compared to the Sphere group 图 5 莱菔硫烷处理肺癌细胞肿瘤球后DNMTs蛋白表达变化 Figure 5 Changes of DNMTs proteins level in tumor spheres of lung cancer cells treated by SFN |
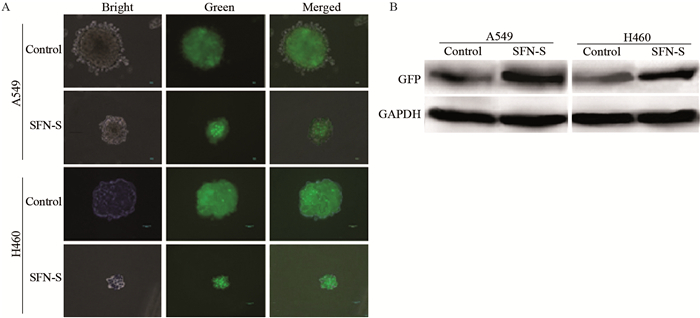
将稳定表达miR-200c启动子-GFP质粒的A549和H460细胞株进行肿瘤球培养,加入SFN(5.0 μmol/L)终浓度处理上述肿瘤球72 h,荧光显微镜下观察对照组(质粒空载)和SFN-S组荧光强度。结果表明,尽管SFN对A549和H460细胞肿瘤球形成有不同程度的抑制作用,SFN-S组肿瘤球荧光强度高于对照组。蛋白印迹法分析发现,SFN-S组GFP蛋白表达水平高于空载组,见图 6。
|
| 图 6 莱菔硫烷对pEGFP-miR200c质粒肿瘤球GFP表达的影响 Figure 6 Effect of sulforaphane on expression of GFP in tumor spheres of lung cancer cells transfected with pEGFP-miR200c plasmid |
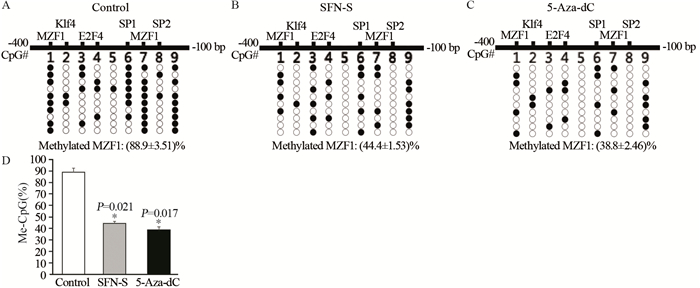
结果表明,上游跨越核苷酸-315至-169 bp(总共9个CpG位点)存在丰富的甲基化位点。对照组存在9个CpG甲基化位点,CpG残基1和7处的MZF1转录因子结合位点被高度甲基化,甲基化水平为(88.9±3.51)%,而SFN-S组和去甲基化剂5-Aza-dC组MZF1甲基化分别为(44.4±1.53)%和(38.8±2.46)%,SFN-S组或5-Aza-dC组与对照组比较差异均具有统计学意义(P < 0.05),见图 7。
|
| *: P < 0.05, compared with the Control group. The dotted graph showed 10 representative clones. Each horizontal line represented the sequencing result of one subclone. Methylated CpG sites were shown as solid circles, while empty circles represented unmethylated CpG sites. 图 7 SFN处理A549肿瘤球前后miR-200c启动子甲基化水平 Figure 7 Methylation level of miR-200c promoter before and after SFN treatment of A549 tumor spheres |
SFN长期以来被用于抗衰老和预防肿瘤发生。近二十年来研究人员发现莱菔硫烷在治疗肿瘤方面也有较强的作用。SFN不仅能有效抑制肺癌细胞的增殖和其形成肿瘤球的能力,还能特异地通过干性相关基因抑制肺癌干细胞的增殖[8]。SFN处理恶性肿瘤细胞(如非小细胞肺癌、胶质瘤、前列腺癌、鼻咽癌、结肠癌等)后可调控β-catenin、Klf4、c-myc、STAT、GSK3β等多种信号通路蛋白的表达水平,从而抑制肿瘤细胞增殖,诱导细胞凋亡,并影响肿瘤干细胞的自我更新[10-12]。Li等[13]发现,SFN通过miR-124-3p靶向STAT通路,诱导肿瘤细胞凋亡并抑制鼻咽癌细胞增殖和自我更新。Georgikou等[14]证实在人胰腺癌组织中高水平的miR-30a-3p和低表达的缝隙连接蛋白Cx43提示肿瘤恶性程度高;在移植瘤模型中转染miR-30a-3p抑制物的肿瘤细胞组移植瘤体积减小且对吉西他滨敏感度增高;SFN显著抑制miR-30a-3p的转录水平,促进缝隙连接细胞间通讯,降低胰腺癌细胞的恶性程度。近年研究发现,在乳腺癌中,SFN(10 μmol/L)同样影响microRNA表达谱,引起60个microRNA的上调和32个microRNA的下调;在3个乳腺癌细胞株中SFN降低了miR-23b、miR-92b、miR-381和miR-382的表达水平[15]。本团队既往研究也发现SFN处理胶质瘤细胞SWO-38时明显改变多种miRNA(如miR-9、21、221、124、128、181等)的转录水平[16]。本研究应用全基因测序法检测SFN处理肺癌细胞肿瘤球时发现,细胞miRNA表达谱发生明显改变,数十种miRNA水平出现上升或下降,miRNA-200c的转录水平上升最为明显。进一步研究发现,SFN处理后E-cadherin表达水平升高,β-catenin、Klf4、c-myc等干性相关基因和DNA甲基化转移酶(DNMT1和DNMT3a)表达水平下降。这些结果提示SFN可能通过影响多种不同miRNA组合的转录,调控一系列细胞信号通路,特别是干细胞相关通路,从而有效抑制肿瘤增殖。
对于SFN对miRNA转录水平的调控机制少有报道。Zhou等[17]通过实验发现SFN可能促进Nrf2的去甲基化启动子区域增加Nrf2的激活,从而诱导结肠癌的化学预防。miR-200c是miR-200家族重要成员,能显著抑制肿瘤增殖和转移,提高化疗药物敏感度。冯浪[18]发现胃癌组织中miR-200c表达水平较癌旁组织低,相关性分析证明癌组织miR-200c表达水平与铂类化疗效果呈正相关关系,说明提高胃癌组织miR-200c表达水平可以提高肿瘤细胞的化疗敏感度。恢复miR-200c的表达可增加子宫内膜癌、卵巢癌、乳腺癌细胞对化疗药物敏感度,逆转耐药性的产生[19-21]。Gao等[22]的实验表明SFN处理人肺癌A549细胞时在表观遗传水平调控miR-9-3启动子的CpG位点去甲基化。张媛悦等[23]通过实验表明肝癌细胞中miR-200c的过表达导致4个启动子甲基化水平显著降低。本实验结果表明,SFN处理后肺癌细胞肿瘤球的miRNA-200c转录水平明显升高。将miR-200c上游启动子序列作为GFP启动子后,构建质粒后转染到肺癌细胞株,发现SFN处理的肿瘤球GFP强度较对照组增高;对插入的miR-200c上游启动子序列甲基化水平检测提示,SFN降低了DNA序列甲基化水平,与去甲基化药物5-Aza-dC效果类似。结合SFN处理肺癌细胞后DNMT1和DNMT3a表达水平上升的实验结果,提示SFN可能在表观遗传学水平下调miR-200c启动子甲基化水平,从而调控miR-200c的转录。
总之,本研究证实,SFN可能经表观遗传学水平下调miR-200c启动子甲基化水平,促进miR-200c的转录,从而调控肺癌干细胞的干性相关基因表达。不排除SFN经DNA甲基化水平调节,调控其他miRNA转录水平。SFN展现出表观遗传机制(包括DNA甲基化和去乙酰化等)调节基因及miRNA水平的强大能力,说明其肿瘤预防和治疗的应用潜力巨大,值得深入研究。
作者贡献
梁广霞:实验执行、数据收集与整理、论文撰写
覃喜团、谢维:部分实验内容操作与培训指导
谢有科:论文立题选择、研究过程统筹、技术支持、研究质量管理、论文修改、资金支持
| [1] |
Torre LA, Siegel RL, Jemal A. Lung Cancer Statistics[J]. Adv Exp Med Biol, 2016, 893: 1-19. |
| [2] |
Wang F, Wang W, Li J, et al. Sulforaphane reverses gefitinib tolerance in human lung cancer cells via modulation of sonic hedgehog signaling[J]. Oncol Lett, 2018, 15(1): 109-114. |
| [3] |
Naujokat C, McKee DL. The "Big Five" Phytochemicals Targeting Cancer Stem Cells: Curcumin, EGCG, Sulforaphane, Resveratrol and Genistein[J]. Curr Med Chem, 2020. |
| [4] |
罗详冲, 刘晶晶, 朱家宏, 等. 肺癌干细胞在肺癌中的研究进展[J]. 癌症进展, 2019, 17(4): 387-391, 398. [Luo XC, Liu JJ, Zhu JH, et al. Research Progress of Lung Cancer Stem Cells in Lung Cancer[J]. Ai Zheng Jin Zhan, 2019, 17(4): 387-391, 398.] |
| [5] |
征宗梅, 苏宁, 卢芬萍, 等. 莱菔硫烷对乳腺癌干细胞增殖影响[J]. 中华肿瘤防治杂志, 2018, 25(13): 924-930. [Zheng ZM, Su N, Lu FP, et al. Effect of sulforaphane on the proliferation of breast cancer stem cell line[J]. Zhonghua Zhong Liu Fang Zhi Za Zhi, 2018, 25(13): 924-930.] |
| [6] |
Justin S, Rutz J, Maxeiner S, et al. Bladder Cancer Metastasis Induced by Chronic Everolimus Application Can Be Counteracted by Sulforaphane In Vitro[J]. Int J Mol Sci, 2020, 21(15): 5582. DOI:10.3390/ijms21155582 |
| [7] |
Santana-Gálvez J, Villela-Castrejón J, Serna-Saldívar SO, et al. Synergistic Combinations of Curcumin, Sulforaphane, and Dihydrocaffeic Acid against Human Colon Cancer Cells[J]. Int J Mol Sci, 2020, 21(9): 3108. DOI:10.3390/ijms21093108 |
| [8] |
谢有科, 张弓, 李雪梅, 等. 莱菔硫烷抑制肺癌干细胞增殖的体外实验[J]. 肿瘤防治研究, 2016, 43(7): 555-559. [Xie YK, Zhang G, Li XM, et al. Sulforaphane Suppressed Proliferation of Lung Cancer Stem Cells in vitro[J]. Zhong Liu Fang Zhi Yan Jiu, 2016, 43(7): 555-559. DOI:10.3971/j.issn.1000-8578.2016.07.003] |
| [9] |
Li QQ, Xie YK, Wu Y, et al. Sulforaphane inhibits cancer stem-like cell properties and cisplatin resistance through miR-214-mediated downregulation of c-myc in non-small cell lung cancer[J]. Oncotarget, 2017, 8(7): 12067-12080. DOI:10.18632/oncotarget.14512 |
| [10] |
Zhu J, Wang S, Chen Y, et al. miR-19 targeting of GSK3β mediates sulforaphane suppression of lung cancer stem cells[J]. J Nutr Biochem, 2017, 44: 80-91. DOI:10.1016/j.jnutbio.2017.02.020 |
| [11] |
Gasparello J, Gambari L, Papi C, et al. High Levels of Apoptosis Are Induced in the Human Colon Cancer HT-29 Cell Line by Co-Administration of Sulforaphane and a Peptide Nucleic Acid Targeting miR-15b-5p[J]. Nucleic Acid Ther, 2020, 30(3): 164-174. DOI:10.1089/nat.2019.0825 |
| [12] |
Kiani S, Akhavan-Niaki H, Fattahi S, et al. Purified sulforaphane from broccoli (Brassica oleracea var. italica) leads to alterations of CDX1 and CDX2 expression and changes in miR-9 and miR-326 levels in human gastric cancer cells[J]. Gene, 2018, 678: 115-123. DOI:10.1016/j.gene.2018.08.026 |
| [13] |
Li X, Zhao Z, Li M, et al. Sulforaphane promotes apoptosis, and inhibits proliferation and self-renewal of nasopharyngeal cancer cells by targeting STAT signal through miRNA-124-3p[J]. Biomed Pharmacother, 2018, 103: 473-481. DOI:10.1016/j.biopha.2018.03.121 |
| [14] |
Georgikou C, Yin L, Gladkich J, et al. Inhibition of miR30a-3p by sulforaphane enhances gap junction intercellular communication in pancreatic cancer[J]. Cancer Lett, 2020, 469: 238-245. DOI:10.1016/j.canlet.2019.10.042 |
| [15] |
Lewinska A, Adamczyk-Grochala J, Deregowska A, et al. Sulforaphane-Induced Cell Cycle Arrest and Senescence are accompanied by DNA Hypomethylation and Changes in microRNA Profile in Breast Cancer Cells[J]. Theranostics, 2017, 7(14): 3461-3477. DOI:10.7150/thno.20657 |
| [16] |
谢有科, 李雪梅, 黄丁平. 莱菔硫烷经由miR-124抑制SWO-38胶质瘤干细胞的增殖[J]. 天津医药, 2016, 44(3): 306-310. [Xie YK, Li XM, Huang DP. Sulforaphane suppressed the proliferation of glioma stem cells via miR-124[J]. Tianjin Yi Yao, 2016, 44(3): 306-310.] |
| [17] |
Zhou J, Wang M, Sun N, et al. Sulforaphane-induced epigenetic regulation of Nrf2 expression by DNA methyltransferase in human Caco-2 cells[J]. Oncol Lett, 2019, 18(3): 2639-2647. |
| [18] |
冯浪. Ⅳ期胃癌肿瘤组织miR-200c表达水平与含铂方案化疗疗效及预后的相关性[J]. 实用癌症杂志, 2019, 34(5): 710-713. [Feng L. Analysis of the Correlation between the Expression of miR-200c in Tumor Tissue and the Efficacy and Prognosis of Platinum-based Chemotherapy in Patients with Stage Ⅳ Gastric Cancer[J]. Shi Yong Ai Zheng Za Zhi, 2019, 34(5): 710-713. DOI:10.3969/j.issn.1001-5930.2019.05.005] |
| [19] |
李丰玲. MiR-200c靶向BMI-1基因抑制子宫内膜癌细胞上皮间质转化的机制研究[D]. 济南: 山东大学, 2018. [Li FL. Mechanism of miR-200c targeting Bmi-1 gene inhibiting epithelial mesenchymal transformation of endometrial cancer cells[D]. Jinan: Shandong University, 2018.]
|
| [20] |
刘杰, 余芙蓉, 董巍檑, 等. miR-200c调控人类卵巢癌对紫杉醇敏感性的影响研究[J]. 临床合理用药杂志, 2019, 12(23): 136-137. [Liu J, Yu FR, Dong WL, et al. Effect of miR-200c regulation on paclitaxel sensitivity of human ovarian cancer[J]. Lin Chuang He Li Yong Yao Za Zhi, 2019, 12(23): 136-137.] |
| [21] |
卢敏莹, 贾小婷, 罗利云, 等. miR-200c-3p靶向FOSL1增加乳腺癌细胞化疗敏感性[J]. 中国生物化学与分子生物学报, 2016, 32(12): 1360-1365. [Lu MY, Jia XT, Luo LY, et al. miR-200c-3p Enhances Sensitivity of Breast Cancer Cells to 5-Fluorouridine via Targeting FOSL1[J]. Zhongguo Sheng Wu Hua Xue Yu Fen Zi Sheng Wu Xue Bao, 2016, 32(12): 1360-1365.] |
| [22] |
Gao L, Cheng D, Yang J, et al. Sulforaphane epigenetically demethylates the CpG sites of the miR-9-3 promoter and reactivates miR-9-3 expression in human lung cancer A549 cells[J]. J Nutr Biochem, 2018, 56: 109-115. DOI:10.1016/j.jnutbio.2018.01.015 |
| [23] |
张媛悦, 王淑青, 刘岩, 等. 乙型肝炎病毒x蛋白通过靶向miR-200c诱导DNA异常甲基化[J]. 生物化学与生物物理进展, 2020, 47(10): 1080-1089. [Zhang YY, Wang SQ, Liu Y, et al. Hepatitis B Virus x Protein Induces Aberrant DNA Methylation by Targeting miR-200c[J]. Sheng Wu Hua Xue Yu Sheng Wu Wu Li Jin Zhan, 2020, 47(10): 1080-1089.] |
 2021, Vol. 48
2021, Vol. 48


