文章信息
- PKCι/YAP1在宫颈癌中的表达及其临床意义
- Expression of PKCι/YAP1 in Cervical Cancer and Its Clinical Significance
- 肿瘤防治研究, 2021, 48(10): 970-973
- Cancer Research on Prevention and Treatment, 2021, 48(10): 970-973
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.21.0340
- 收稿日期: 2021-03-26
- 修回日期: 2021-08-05
高危型HPV持续感染,是引起宫颈鳞状细胞癌的主要原因,有报道90%的女性一生中可能感染HPV,而10%女性发生持续性感染,仅1%的感染者最终转变为宫颈癌,这提示宫颈癌患者体内可能存在免疫抑制微环境,无法全面有效清除HPV[1-2]。有研究报道PKCι蛋白激酶Cι(protein kinase Cι, PKCι)/Yes相关蛋白1(yes-associated protein 1, YAP1)参与肿瘤免疫微环境调节,PKCι通过下游效应因子YAP1促进免疫抑制,而YAP1通过募集骨髓来源的抑制性细胞(myeloid-derived suppressor cells, MDSCs)和CD8+T细胞促进肿瘤的免疫抑制,导致细胞毒性T细胞低浸润,而自然杀伤(natural killer, NK)细胞浸润减少[3]。有文献报道PKCι/YAP1调节肿瘤免疫微环境,但未见PKCι/YAP1与HPV感染在宫颈癌局部免疫微环境中的作用报道[4],因此,本研究检测宫颈正常组织(normal cervical tissue, NCT)、低级别鳞状上皮内病变(low-grade squamous intraepithelial lesions, LSIL)、高级别鳞状上皮内病变(high-grade squamous intraepithelial lesions, HSIL)及宫颈鳞状细胞癌(squamous cell carcinoma, SCC)高危型HPV的感染率,PKCι、YAPl、CD4以及CD8的蛋白表达,分析各组患者HPV感染率、PKCι、YAP1、CD4以及CD8蛋白表达之间的差异及其相关性以及临床病理特征,探讨宫颈癌变的局部免疫微环境的变化,为研究宫颈癌发病机制及诊治提供可能的策略。
1 资料与方法 1.1 资料选择中南大学湘雅医学院附属海口医院2013年1月—2015年1月全子宫术后NCT、LSIL、HSIL及SCC组织学标本各80例,均未经抗肿瘤治疗,各组间年龄无明显差异。所有病例及实验结果均经高级病理医师阅片确认,其中NCT组为妇科肿瘤全子宫切除术后标本。所有试剂(盒)均来自上海信裕公司,按操作说明书进行,本研究经中南大学湘雅医学院附属海口医院伦理委员会审核批准,批准号:2018-(伦审)-173,伦理委员会批准免知情同意。
1.2 方法各组患者的高危型HPV(16、18、31、33、35、39、45、51、52、56、58、59、66、68、69型)感染采用在我院就诊时检测的结果,根据检测报告结果计算各组病患高危型HPV的感染率。IHC二步法检测4组组织中PKCι、YAP1、CD4、CD8蛋白表达水平,兔抗PKCι抗体(批号:BJ07176986)、兔抗YAP1抗体(批号:AI08203707)、兔抗CD4抗体(批号:AI01301602)和兔抗CD8抗体(批号:BJ05096373)均购自北京博奥森生物技术有限公司。在光学显微镜下观察计数,根据阳性细胞百分比和着色强度判断,由两项计分相乘所得,0~1分为-,2~4分为+,5~8分为++,9~12分为+++。其中-为阴性组,+/++/+++为阳性组。两项计分分别为:根据阳性细胞百分比(即阳性细胞数占总细胞数的百分比):< 5%为0分;≥5%~25%为1分;≥25%~50%为2分;≥50%~75%为3分;≥75%~100%为4分;根据细胞染色强度:细胞无显色为0分;浅棕黄色为1分;棕黄色为2分;棕褐色为3分[5]。
1.3 统计学方法采用SPSS18.0软件处理,计数资料行χ2检验,采用n(%)表示,相关性分析采用Spearman分析,P < 0.05为差异有统计学意义。
2 结果 2.1 各组宫颈病变患者高危型HPV感染率及PKCι、YAP1、CD4、CD8阳性率比较320份组织均完成HPV mRNA测定,结果表明:在NCT、LSIL、HSIL及SCC组织中高危型HPV感染率逐渐升高,PKCι、YAP1阳性率越高,CD4阳性率越低,CD8阳性率越高,差异有统计学意义(P < 0.05),见表 1、图 1。
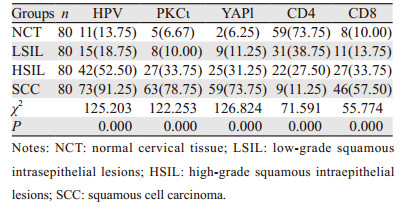
|
|
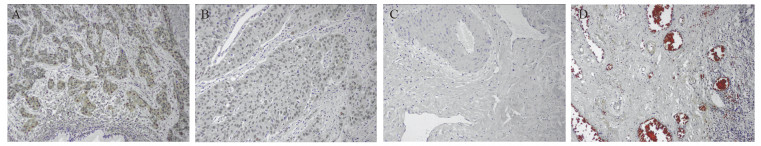
| 图 1 PKCι(A)、YAP1(B)、CD4(C)及CD8(D)在SCC中的表达 Figure 1 Expression of PKCι(A), YAP1(B), CD4(C) and CD8(D) in SCC tissues |
Spearman相关性分析结果表明,宫颈病变级别与高危型HPV感染(r=0.600, P=0.000)、PKCι(r=0.577, P=0.000)、YAP1(r=0.592, P=0.000)以及CD8阳性(r=0.0401, P=0.000)表达均呈正相关,与CD4阳性表达呈负相关(r=-0.458, P=0.000)。
2.3 SCC患者HPV感染与PKCι、YAP1、CD4及CD8表达的相关性Spearman相关性分析结果表明,在SCC中HPV感染与PKCι、YAP1以及CD8阳性表达相互之间的均呈正相关(P < 0.05),而CD4阳性表达与HPV感染以及PKCι、YAP1、CD8阳性表达相互之间均呈负相关(P < 0.05),见表 2。
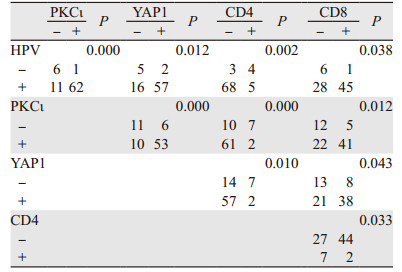
|
HPV感染、PKCι、YAP1以及CD8阳性表达在SCC不同的分化程度以及有无脉管瘤栓之间差异均有统计学意义(P < 0.05),见表 3。
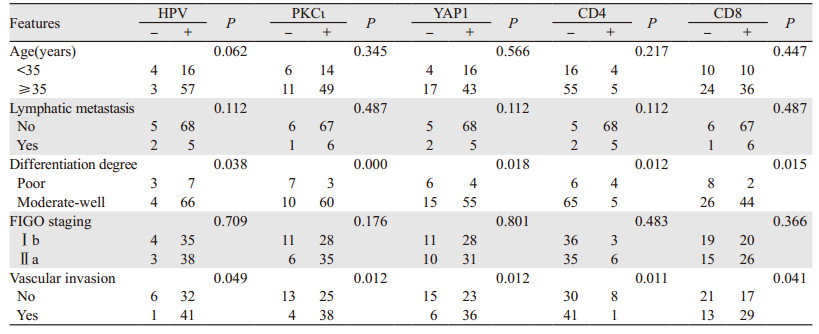
|
宫颈微环境免疫功能受阴道微生态系统、阴道黏膜免疫防御系统、局部微环境免疫细胞及细胞因子调节。任何一个环节发生异常,均有可能改变HPV感染引发宫颈上皮内瘤变以及宫颈癌发生发展的自然演变[6]。免疫调节在HPV导致宫颈病变的过程中至关重要[7]。T淋巴细胞和B淋巴细胞均参加了机体的抗肿瘤免疫反应,其中T淋巴细胞发挥主导作用。研究发现宫颈癌患者的CD4+T细胞百分比和CD4+/CD8+明显低于正常人群,提示宫颈局部细胞免疫与HPV的持续感染有着密切关系,持续的HPV感染破坏了宫颈局部细胞免疫微环境,CD4+和CD8+细胞平衡失调,导致宫颈病变的发生发展[8-11]。本研究中,NCT、LSIL、HSIL以及SCC组织中高危型HPV感染率逐渐升高,CD4阳性表达率逐渐降低,CD4+与病变程度呈负相关,CD8阳性表达率逐渐升高,CD8+与病变程度呈正相关,而CD4与CD8阳性表达率之间呈负相关,说明宫颈癌患者HPV感染检出率最高,且常伴有细胞免疫功能异常,它们在疾病的发生发展中发挥了重要作用。
PKCι(又称为PRKCΙ)是一种非典型PKC(aPKC包括ζ、ι/λ),aPKC通过调控多条信号通路在组织器官的发育和稳态维持、肿瘤发生发展、免疫应答等过程中发挥重要作用。研究表明PKCι信号抑制剂抑制两种关键的致癌信号通路,由PKCι和KCζ驱动,以显著减少肿瘤的生长和转移,抑制非典型PKC信号是治疗肿瘤的一种很有前途的治疗策略[12-13]。有研究表明,PKCι过表达塑造了肿瘤免疫抑制性微环境,导致S100、IL6/1b、CSF3、前列素内环氧化物合成酶2(prostaglandin endoperoxide synthase2, PTGS2)及肿瘤坏死因子-α(tumour necrosis factor-α, TNF-α)等细胞因子过表达,而NK细胞浸润减少。另有研究显示,TNF-α具有抗癌和促癌双向作用,它的抗肿瘤机制是多方面的,目前发现主要有诱导凋亡、影响肿瘤血管系统和增强宿主免疫力三个方面。在卵巢癌细胞中,TNF-α上调炎性细胞因子及趋化因子网络,作用于卵巢癌微环境,影响肿瘤血管发展、癌细胞迁移等,从而促进肿瘤的发展及恶化[3-4]。有研究显示PKCι通过YAP1促进免疫抑制,YAP1是肿瘤进展中的下游效应因子,YAP1通过募集骨髓来源的抑制性细胞和CD8+T细胞来促进肿瘤的免疫抑制,导致细胞毒性T细胞低浸润,PKCι/YAP1调节为高致死性恶性肿瘤提供了一种治疗策略[3, 14],见图 2。本研究结果表明:宫颈病变级别与高危型HPV感染率、PKCι和YAP1蛋白阳性表达、CD8浸润阳性表达呈正相关,与CD4浸润阳性表达呈负相关;在SCC中HPV感染与PKCι、YAP1及CD8阳性表达相互之间的均呈正相关,而CD4阳性表达与HPV感染及PKCι、YAP1、CD8阳性表达相互之间均呈负相关。本研究提示宫颈癌发生发展可能与HPV、PKCι和YAP1、CD4及CD8蛋白表达异常有关,同时可能存在协同作用。
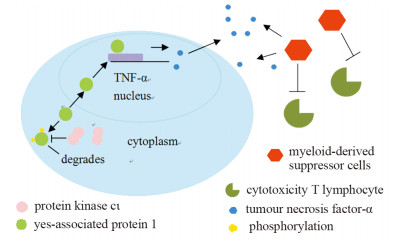
|
| 图 2 PKCι/YAP1免疫调节示意图 Figure 2 Schematic of PKCι/YAP1 immunomodulation |
综上所述,宫颈癌的发生发展与高危型HPV感染密切相关,同时伴随PKCι、YAP1蛋白表达异常,造成局部免疫微环境失衡,为研究宫颈癌的发病机制以及诊治提供可能的策略。
作者贡献
陈胜民:资料收集、实验操作、数据统计及论文撰写
王国平:资料收集、实验操作及数据统计
林志仁:实验操作及结果判读
袁峰:病例采集、实验操作、结果判读及论文撰写
| [1] |
赵婧, 钱延玲. 宫颈局部免疫微环境与宫颈癌[J]. 世界最新医学信息文摘, 2018, 18(43): 61-63. [Zhao J, Qian YL. The Relationship between Immune Microenvironment and Cervical Cancer[J]. Shi Jie Zui Xin Yi Xue Xin Xi Wen Zhai, 2018, 18(43): 61-63.] |
| [2] |
Macartney K, Phillips A, Patel C, et al. Authors'reply: Safety of Human Papillomavirus Vaccines[J]. Drug Saf, 2018, 41(5): 541-543. DOI:10.1007/s40264-018-0655-1 |
| [3] |
Sharmistha S, Christopher AB, Prasenjit D, et al. PRKCI promotes immune suppression in ovarian cancer[J]. Genes Dev, 2017, 31(11): 1109-1121. DOI:10.1101/gad.296640.117 |
| [4] |
陈胜民, 袁峰. 蛋白激酶Cι/Yes相关蛋白1与人乳头瘤病毒在肿瘤微环境中的作用研究进展[J]. 广西医学, 2020, 42(24): 3224-3227. [Chen SM, Yuan F. Progress in the role of PKCι/YAP1 and HPV in the immune microenvironment of tumor[J]. Guangxi Yi Xue, 2020, 42(24): 3224-3227.] |
| [5] |
陈胜民. PTEN、PI3K和Akt蛋白表达与卵巢浆液性癌临床病理学的相关性研究[D]. 石河子: 石河子大学, 2011: 4-5. [Chen SM. Study on correlation of clinical pathology between PTEN and PI3K/Akt protein expression in ovarian serous tumors[D]. Shihezi: Shihezi University, 2011: 4-5.]
|
| [6] |
Sichero L, Rollison DE, Amorrortu RP, et al. Beta Human Papillomavirus and Associated Diseases[J]. Acta Cytol, 2019, 63(2): 100-108. DOI:10.1159/000492659 |
| [7] |
Gilkey MB, Margolis MA. Human Papillomavirus Vaccination Coverage Gaps in Young Adolescents[J]. J Infect Dis, 2019, 220(5): 727-729. DOI:10.1093/infdis/jiy683 |
| [8] |
Hanbazazh M, Gyure KA. Ocular Human Papillomavirus Infections[J]. Arch Pathol Lab Med, 2018, 142(6): 706-710. DOI:10.5858/arpa.2017-0571-RA |
| [9] |
Harden ME, Munger K. Human papillomavirus molecular biology[J]. Mutat Res Rev Mutat Res, 2017, 772: 3-12. DOI:10.1016/j.mrrev.2016.07.002 |
| [10] |
Schiffman M, Doorbar J, Wentzensen N, et al. Carcinogenic human papillomavirus infection[J]. Nat Rev Dis Primers, 2016, 2: 16086. DOI:10.1038/nrdp.2016.86 |
| [11] |
Westricha JA, Warrena CJ, Pyeona D. Evasion of host immune defenses by human papillomavirus[J]. Virus Res, 2017, 231: 21-33. DOI:10.1016/j.virusres.2016.11.023 |
| [12] |
Pearsall EA, Connor KM. Atypical Protein Kinase C: Breaking Down Barriers in Ocular Disease?[J]. Am J Pathol, 2018, 188(10): 2142-2146. DOI:10.1016/j.ajpath.2018.07.006 |
| [13] |
Parker PJ, Justilien V, Riou P, et al. Atypical Protein Kinase Cι as a human oncogene and therapeutic target[J]. Biochem Pharmacol, 2014, 88(1): 1-11. DOI:10.1016/j.bcp.2013.10.023 |
| [14] |
葛彩云, 蔡红兵, 宋紫烨, 等. HPV16-E6上调MIF对宫颈癌细胞增殖和凋亡的影响[J]. 肿瘤防治研究, 2018, 45(7): 468-474. [Ge CY, Cai HB, Song ZY, et al. HPV16-E6 Influences Growth and Apoptosis of Cervical Cancer Cells Through Upregulation of MIF[J]. Zhong Liu Fang Zhi Yan Jiu, 2018, 45(7): 468-474. DOI:10.3971/j.issn.1000-8578.2018.17.1406] |
 2021, Vol. 48
2021, Vol. 48


