文章信息
- cyclin G1表达与原发性肝癌放疗疗效的相关性
- Correlation Between cyclin G1 Expression and Efficacy of Radiotherapy on Primary Hepatocellular Carcinoma
- 肿瘤防治研究, 2021, 48(10): 958-962
- Cancer Research on Prevention and Treatment, 2021, 48(10): 958-962
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.21.0316
- 收稿日期: 2021-03-22
- 修回日期: 2021-07-05
肝癌是一种临床常见的恶性肿瘤,治疗手段主要包括手术、肝动脉栓塞化疗、介入治疗、射频消融及免疫治疗等[1-2]。由于早期技术水平限制,放疗在肝癌的治疗中发挥作用较小。随着三维适形放疗、调强放疗及立体定向放疗等技术的不断进步,放疗渐渐成为了一种有效的肝癌治疗手段,尤其是立体定向放疗的开展,为小肝癌患者提供了一种新的治疗途径[3-5]。
cyclin G1是细胞色素家族的一员,许多研究证实cyclin G1在多种肿瘤中表达异常,是一种癌基因,参与了放疗诱导的G2/M期细胞周期阻滞[6],同时也是抑癌基因p53的靶点之一。我们前期研究表明cyclin G1与肝癌细胞的放射敏感度相关,抑制cyclin G1的表达可以提高肝癌细胞的放疗敏感度[7]。本文主要探讨了cyclin G1在肝癌组织中的表达情况及cyclin G1的表达与肝癌患者放疗疗效之间的关系。
1 资料与方法 1.1 一般资料回顾性分析2015年6月至2018年5月郑州大学附属肿瘤医院收治的68例接受放射治疗的原发性肝癌患者,均经活检穿刺病理证实,所有患者均为肝细胞癌。其中男31例、女37例;年龄32~73岁,中位年龄62岁;病灶直径≤5 cm者37例、> 5 cm者31例;病灶个数≤3个36例、> 3个32例;无门脉癌栓22例、有门脉癌栓46例;临床分期Ⅰ~Ⅱ期16例、Ⅲ~Ⅳ期52例;甲胎蛋白≤400 ng/ml 26例,> 400 ng/ml42例;肝功能分级:Child A级31例,Child B级37例;无乙肝24例、有乙肝44例;未行肝动脉栓塞化疗术(transcatheter arterial chemoembolization, TACE)28例、行TACE术40例;未口服索拉非尼30例、口服索拉非尼38例;ECOG评分0分27例、1分41例。
1.2 放射治疗所有患者均采用调强放疗,CT模拟定位,扫描层厚3 mm,传输图像至计划系统,在定位CT图像上勾画大体肿瘤靶区(gross tumor volume, GTV),GTV包括肝脏病灶和/或门静脉癌栓,周围外扩1 cm形成计划靶区(planning target volume, PTV)。根据肿块大小及肝脏耐受程度,给予处方剂量50~60 Gy,分次剂量2 Gy。同时根据病灶情况及疾病分期,联合应用TACE术和(或)索拉非尼治疗。
1.3 免疫组织化学检测将肝癌患者的活检癌组织标本进行石蜡包埋,切成4 μm切片,对切片进行脱蜡和水合处理。然后将载玻片浸入0.01 m柠檬酸缓冲液(pH6.0)中并微波加热诱导进行抗原修复。一抗选择小鼠单克隆抗人cyclin G1抗体(1:500,美国Invitrogen公司),二抗选择辣根过氧化物酶标记的兔抗鼠抗体。根据cyclin G1染色的范围和强度进行免疫组织化学量化评分,cyclin G1表达强度分为:0为阴性;1为弱;2为中度;3为高;4为强。细胞染色程度分级为:0: 阴性;1: 1%~25%;2: 26%~50%;3: 51%~75%;4: 76%~100%。将两个分数相加得到每个样本的最终得分。
1.4 随访随访方式包括门诊复诊及电话随访。在放疗后2年内每3月随访一次,放疗后2~5年,每6月随访一次。随访内容包括血常规、生化,甲胎蛋白及胸腹部CT,必要时行PET-CT及骨扫描。末次随访时间为2020年6月15日,中位随访时间44月。共有5例患者失访,其中cyclin G1高表达组3例、低表达组2例,失访原因为未进行门诊复诊及电话无法联系。随访完成率为92.6%。
1.5 统计学方法数据分析采用SPSS19.0统计软件,计量资料采用卡方检验,数据以均数±标准差表示。总生存率及无进展生存率采用Kaplan-Meier法计算,Log rank法检验差异,多因素分析采用Cox风险比例回归模型,P < 0.05为差异有统计学意义。
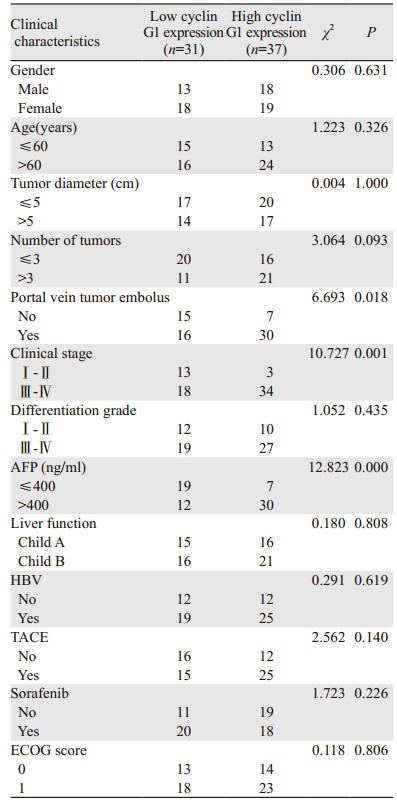
2 结果 2.1 cycin G1表达与患者临床特征的相关性68例肝癌患者免疫组织化学评分中位数为6分,据cyclin G1表达情况,将接受放疗的患者活检标本cyclin G1表达分为高表达和低表达两组,≥6分为高表达,< 6分为低表达。免疫组织化学结果见图 1。卡方检验结果显示有门脉癌栓、临床分期Ⅲ~Ⅳ期及甲胎蛋白 > 400 ng/ml的患者,cyclin G1表达水平较高(P < 0.05),而与性别、年龄、病灶直径、病灶数量及ECOG评分无明显相关性,见表 1。

|
| A: HCC tissues (×100); B: Adjacent tissues (×400). 图 1 免疫组织化学检测肝癌标本中cyclin G1的表达 Figure 1 cyclin G1 expression in hepatocellular carcinoma tissues detected by immunohistochemical staining |
|
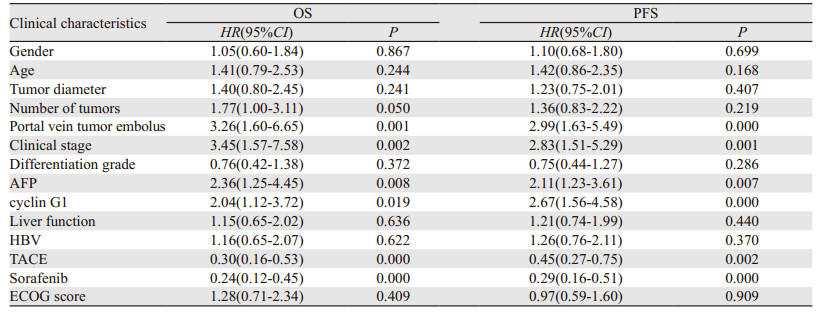
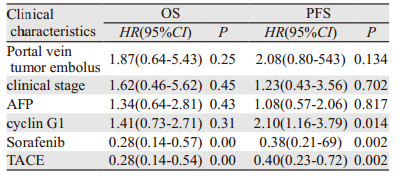
所有接受放疗的肝癌患者的1、2及3年的总生存率(overall survival, OS)分别为74.6%、47.8%和21.5%,1、2及3年的无进展生存率(progression-free survival, PFS)分别为73.5%、39.7%和13.2%。cyclin G1低表达和高表达两组患者1、2、3年的生存率分别为80.6%、63.6%、31.4%和69.5%、34.1%、9.1%,无进展生存率分别为80.6%、58.1%、25.8%和67.6%、24.3%、2.7%见图 2,Log rank检验提示两组间差异有统计学意义(P < 0.05)。单因素分析显示门脉癌栓、临床分期、甲胎蛋白、cyclin G1及联合应用TACE或索拉非尼与患者总生存率及无进展生存率密切相关,见表 2,将单因素分析有统计学意义的因素代入Cox比例风险回归模型进行多因素分析,提示放疗联合应用TACE或索拉非尼是肝癌放疗患者总生存率和无进展生存率的良好预后因素,而cyclin G1高表达是肝癌患者无进展生存率的独立危险因素,见表 3。

|
| 图 2 cyclin G1表达与肝癌放疗患者OS(A)和PFS(B)的关系 Figure 2 Relation between cyclin G1 expression and OS(A), PFS(B) of HCC patients treated with radiotherapy |
|
|
肝癌起病隐匿,只有很少一部分患者有根治的机会,总体治疗效果欠佳。近年来放疗在肝癌治疗中的作用越来越重要。一项前瞻性、Ⅱ期、多中心研究显示TACE联合三维适形放疗效果较好,放疗后12周有23%患者达到完全缓解,61%的患者部分缓解,2年照射野内无进展生存率、总无进展生存率和总生存率分别为45%、29%和61%[8]。SBRT联合TACE在小肝癌治疗中取得了较好的疗效,完全缓解率可以达到96%[9],SBRT和射频消融的治疗效果类似[10]。针对可手术合并门静脉癌栓的肝癌患者,新辅助放疗也可以提高总生存期,在一项随机开放多中心研究中显示,新辅助放疗联合手术6、12、18和24月的总生存率分别为89.0%、75.2%、43.9%和27.4%,优于手术组的81.7%、43.1%、16.7%和9.4%[11]。
肝癌治疗中的预后因素很多,包括肿瘤大小、腹腔淋巴结、门脉癌栓以及有无肝外转移以及综合性治疗手段的应用等[12-13]。放疗疗效的预测也有一定的研究,田小强等[14]回顾性分析了45例行放疗不可手术的原发性肝癌患者,结果提示肿瘤直径、血供、肿瘤处方剂量是影响肝癌放疗疗效的关键因素,肿瘤体积、临床分期以及是否合并门静脉癌栓是影响预后的独立因素。与肝癌预后相关的生物标志物研究也在进行中,目前已经发现多种生物标志因子与肝癌预后相关,如C5L2、NOR1和YTHDF1等[15-17]。本研究中所有患者均接受放疗,并不是所有的肝脏病灶都接受放疗。根据具体情况,部分患者肝脏病灶TACE术后单独针对门脉癌栓行放射治疗。单因素分析发现合并门脉癌栓、临床分期为Ⅲ~Ⅳ期、甲胎蛋白 > 400 ng/ml及cyclin G1高表达是肝癌放疗的不良预后因素,放疗联合应用TACE或索拉非尼可以提高疗效,与文献报道一致。
cyclin G1是细胞周期蛋白家族中的一员,研究表明cyclin G1在多种实体瘤中表达异常增高,以cyclin G1为靶点的治疗方式在许多肿瘤中发挥着很好的抗肿瘤作用,包括胰腺癌、卵巢癌等[18-19]。cyclin G1在肝癌的发生发展中也起着重要作用。Wen等的研究显示cyclin G1在肝癌组织中高表达,并且与肝癌的远处转移和预后不良密切相关[20]。我们的前期研究显示抑制cyclin G1通过调控凋亡相关蛋白Bax和Bcl-2可以上调肝癌细胞的放疗敏感度[7]。在其他肿瘤中也发现cyclin G1与肿瘤放疗敏感复有关,Xu等报道了沉默热休克蛋白27通过下调细胞周期蛋白G1来提高非小细胞肺癌细胞的放射敏感度[21]。所以cyclin G1高表达可能与放疗耐受有关,并进一步影响放疗疗效。本研究中发现在肝癌组织中cyclin G1的表达显著高于癌旁组织,在接受放疗的患者中cyclin G1高表达组的1、2和3年总生存率及无进展生存率明显低于cyclin G1低表达组,多因素分析显示cyclin G1是无进展生存期的独立不良预后因子。
本文回顾性分析cyclin G1在肝癌放疗患者中预后价值,结果提示cyclin G1高表达是肝癌放疗患者的不良预后因素。考虑到本研究是回顾性分析,仍存在一些问题,本研究中所涉及的病例均接受了综合治疗,如TACE及索拉非尼等,临床病理特征分析显示两组患者之间所接受的综合治疗方法无统计学差异,所以一定程度上可以间接反映出cyclin G1在肝癌放疗患者的预后价值。cyclin G1在肝癌放疗中的预测价值,需要前瞻性研究进一步证实。
作者贡献
许刚:课题设计、实验实施及论文撰写
卜珊珊:实验实施、患者随访、统计学分析
王修身:数据审核及论文修改
葛红:技术支持、数据及论文审核
| [1] |
Vogel A, Saborowski A. Current strategies for the treatment of intermediate and advanced hepatocellular carcinoma[J]. Cancer Treat Rev, 2020, 82: 101946. DOI:10.1016/j.ctrv.2019.101946 |
| [2] |
Forner A, Reig M, Bruix J. Hepatocellular carcinoma[J]. Lancet, 2018, 391(10127): 1301-1314. DOI:10.1016/S0140-6736(18)30010-2 |
| [3] |
马中山, 马云玲, 冯丽. 放疗在原发性肝癌非手术治疗中的地位与作用[J]. 中华放射医学与防护杂志, 2010, 30(1): 102-104. [Ma ZH, Ma YL, Feng L. The role of radiotherapy in non-surgical treatment of primary liver cancer[J]. Zhonghua Fang She Yi Xue Yu Fang Hu Za Zhi, 2010, 30(1): 102-104. DOI:10.3760/cma.j.issn.0254-5098.2010.01.035] |
| [4] |
Park S, Yoon WS, Rim CH. Indications of external radiotherapy for hepatocellular carcinoma from updated clinical guidelines: Diverse global viewpoints[J]. World J Gastroenterol, 2020, 26(4): 393-403. DOI:10.3748/wjg.v26.i4.393 |
| [5] |
Choi SH, Seong J. Strategic application of radiotherapy for hepatocellular carcinoma[J]. Clin Mol Hepatol, 2018, 24(2): 114-134. DOI:10.3350/cmh.2017.0073 |
| [6] |
Kimura SH, Ikawa M, Ito A, et al. Cyclin G1 is involved in G2/M arrest in response to DNA damage and in growth control after damage recovery[J]. Oncogene, 2001, 20(25): 3290-3300. DOI:10.1038/sj.onc.1204270 |
| [7] |
许刚, 王燕, 吴立广, 等. Cyclin G1对肝癌细胞HepG2放射敏感度的影响及其机制[J]. 肿瘤防治研究, 2017, 44(9): 590-595. [Xu G, Wang Y, Wu LG, et al. Effect of cyclin G1 on radiosensitivity of hepatocellular carcinoma HepG2 cells and its mechanism[J]. Zhoong Liu Fang Zhi Yan Jiu, 2017, 44(9): 590-595. DOI:10.3971/j.issn.1000-8578.2017.17.0039] |
| [8] |
Choi C, Koom WS, Kim TH, et al. A prospective phase 2 multicenter study for the efficacy of radiation therapy following incomplete transarterial chemoembolization in unresectable hepatocellular carcinoma[J]. Int J Radiat Oncol Biol Phys, 2014, 90(5): 1051-1060. DOI:10.1016/j.ijrobp.2014.08.011 |
| [9] |
Honda Y, Kimura T, Aikata H, et al. Stereotactic body radiation therapy combined with transcatheter arterial chemoembolization for small hepatocellular carcinoma[J]. J Gastroenterol Hepatol, 2013, 28(3): 530-536. DOI:10.1111/jgh.12087 |
| [10] |
Wahl DR, Stenmark MH, Tao Y, et al. Outcomes After Stereotactic Body Radiotherapy or Radiofrequency Ablation for Hepatocellular Carcinoma[J]. J Clin Oncol, 2016, 34(5): 452-459. DOI:10.1200/JCO.2015.61.4925 |
| [11] |
Wei X, Jiang Y, Zhang X, et al. Neoadjuvant Three-Dimensional Conformal Radiotherapy for Resectable Hepatocellular Carcinoma With Portal Vein Tumor Thrombus: A Randomized, Open-Label, Multicenter Controlled Study[J]. J Clin Oncol, 2019, 37(24): 2141-2151. DOI:10.1200/JCO.18.02184 |
| [12] |
Liu PH, Hsu CY, Hsia CY, et al. Prognosis of hepatocellular carcinoma: Assessment of eleven staging systems[J]. J Hepatol, 2016, 64(3): 601-608. DOI:10.1016/j.jhep.2015.10.029 |
| [13] |
Wang CY, Li S. Clinical characteristics and prognosis of 2887 patients with hepatocellular carcinoma: A single center 14 years experience from China[J]. Medicine (Baltimore), 2019, 98(4): e14070. DOI:10.1097/MD.0000000000014070 |
| [14] |
田小强, 鲁世慧, 王礼学, 等. 不可手术的原发性肝癌放疗效果影响因素及预后分析[J]. 东南大学学报(医学版), 2019, 38(6): 1029-1034. [Tian XQ, Lu SH, Wang LX, et al. Analysis of efficiency and influence factor of intensity-modulated radiotherapy for inoperable primary hepatocellular carcinoma[J]. Dongnan Da Xue Xue Bao(Yi Xue Ban), 2019, 38(6): 1029-1034. DOI:10.3969/j.issn.1671-6264.2019.06.019] |
| [15] |
田璐, 吴炯, 朱捷, 等. C5L2表达与肝癌患者预后分析[J]. 复旦学报(医学版), 2017, 44(3): 280-287. [Tian L, Wu J, Zhu J, et al. Prognostic analysis of C5L2 in patients with hepatocellular carcinoma[J]. Fu Dan Xue Bao(Yi Xue Ban), 2017, 44(3): 280-287. DOI:10.3969/j.issn.1672-8467.2017.03.005] |
| [16] |
Deng Y, Zhou X, Xiang X, et al. NOR1 expression and its relationship with prognosis in patients with hepatocellular carcinoma[J]. J BUON, 2017, 22(5): 1186-1190. |
| [17] |
Zhao X, Chen Y, Mao Q, et al. Overexpression of YTHDF1 is associated with poor prognosis in patients with hepatocellular carcinoma[J]. Cancer Biomark, 2018, 21(4): 859-868. DOI:10.3233/CBM-170791 |
| [18] |
Chawla SP, Bruckner H, Morse MA, et al. A Phase Ⅰ-Ⅱ Study Using Rexin-G Tumor-Targeted Retrovector Encoding a Dominant-Negative Cyclin G1 Inhibitor for Advanced Pancreatic Cancer[J]. Mol Ther Oncolytics, 2018, 12: 56-67. |
| [19] |
Yan J, Jiang JY, Meng XN, et al. MiR-23b targets cyclin G1 and suppresses ovarian cancer tumorigenesis and progression[J]. J Exp Clin Cancer Res, 2016, 35: 31. DOI:10.1186/s13046-016-0307-1 |
| [20] |
Wen W, Ding J, Sun W, et al. Cyclin G1-mediated epithelial-mesenchymal transition via phosphoinositide 3-kinase/Akt signaling facilitates liver cancer progression[J]. Hepatology, 2012, 55(6): 1787-1798. DOI:10.1002/hep.25596 |
| [21] |
Xu L, Lin X, Zheng Y, et al. Silencing of heat shock protein 27 increases the radiosensitivity of non-small cell lung carcinoma cells[J]. Mol Med Rep, 2019, 20(1): 613-621. |
 2021, Vol. 48
2021, Vol. 48
