文章信息
- miRNA-152在肝癌组织中的表达及临床意义
- Expression and Clinical Significance of miRNA-152 in Hepatocellular Carcinoma
- 肿瘤防治研究, 2021, 48(8): 769-773
- Cancer Research on Prevention and Treatment, 2021, 48(8): 769-773
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.21.0296
- 收稿日期: 2021-03-17
- 修回日期: 2021-05-10
2. 530021 南宁,广西壮族自治区妇幼保健院临床检验部;
3. 530201 南宁,广西国际壮医医院肝胆外科;
4. 530022 南宁,南宁市第一人民医院肝胆外科
2. Department of Clinical Laboratory, Maternity and Child Health Care of Guangxi Zhuang Autonomous Region, Nanning 530021, China;
3. Department of Hepatobiliary Surgery, Guangxi International Zhuang Medicine Hospital, Nanning 530201, China;
4. Department of Hepatobiliary Surgery, The First People's Hospital of Nanning, Nanning 530022, China
肝细胞癌(hepatocellular carcinoma, HCC)是我国常见的恶性肿瘤,其恶性程度和病死率极高[1]。目前,手术切除仍然是肝癌患者获得长期生存最有效的方法,但大部分肝癌患者就诊时已属中晚期,且多伴有严重的肝硬化,最终能够接受手术治疗的肝癌患者不到15%[2]。因此,探索肝癌侵袭转移的机制,寻找治疗肝癌的新靶点具有重要临床意义。
微小RNA(micro ribonucleic acid, miRNA)是真核生物中一类长约20~25个核苷酸的内源性非编码小分子RNA,可通过碱基互补配对原则与靶基因mRNA的3’端非编码区结合,抑制mRNA的翻译或直接降解目标mRNA,在转录后和翻译水平对下游靶基因的表达进行调控[3],从而参与细胞增殖、分化、凋亡、代谢和胚胎发育等重要生命过程[4]。miRNA与肿瘤发生发展的关系已经引起广泛关注[5]。miR-152是一种重要的miRNA,已被证实在多种恶性肿瘤中异常表达[6-8],但其在肝癌组织中的表达和功能至今鲜见报道。本研究旨在检测肝癌组织中miR-152的表达水平,分析miR-152异常表达与肝癌患者临床病理参数和预后的相关性。
1 资料与方法 1.1 一般资料选择2015年6月—2019年6月在广西国际壮医医院肝胆外科和南宁市第一人民医院肝胆外科行手术切除的肝癌患者共56例,切除后收集肝癌组织和癌旁组织(距离切缘至少3 cm),组织标本置于液氮中,转于-80℃超低温冰箱保存备用。全部病例均经病理确诊为肝细胞肝癌。所有入选的患者均为原发病灶的首次手术切除,术前均未进行放疗、化疗或者激素治疗。其中男37例,女19例;年龄32~71岁,中位年龄46岁;临床病理按TNM分期(美国肿瘤联合委员会(AJCC)2018):Ⅰ期10例、Ⅱ期7例、Ⅲ期37例、Ⅳ期2例;乙肝表面抗原(HBsAg)阳性为乙型肝炎病毒阳性;乙型肝炎病毒DNA(HBV-DNA) > 10³拷贝/毫升为HBV-DNAb阳性;血管侵犯是指微血管侵犯(MVI)。本研究经本单位伦理委员会批准,患者均签署知情同意书。本研究所使用的TRIzol RNA提取试剂盒(货号:9108-1)、PrimeScript miRNA cDNA Synthesis反转录试剂盒(货号:D350A)、SYBR Green Real-time PCR Master Mix试剂盒(货号:RR420L)均购自日本TaKaRa公司,病理切片机(RM2245型)购自德国Leica公司,荧光定量PCR仪(ABI 7500型)购自美国ABI公司。
1.2 组织总RNA提取取200 mg组织剪成小块,置于研钵内,加入液氮研磨成粉末。研磨好的粉末加入1 ml RNAiso并立即混匀,然后加入200 ml三氯甲烷,充分混匀后4℃ 12 000 g离心15 min。取上清液350 µl,加500 µl异丙醇,混匀后静置10 min,4℃ 12 000 g离心15 min,再加入750 µl无水乙醇,涡旋混匀后4℃ 12 000 g离心10 min。弃上清液,静置风干。加入30 µl的DEPC水溶解RNA沉淀,采用Nanodrop检测RNA纯度,反转录合成cDNA。
1.3 Real-time PCR检测组织miR-152的表达采用U6 snRNA作为内参。根据GenBank中miR-152基因序列号(MIMAT0000438),用PrimerPremier5.0软件设计引物,并送北京博奥生物有限公司合成。U6上游引物:5'-CTCGCTTCGGCAGCACA-3',下游引物:5'-AACGCTTCACGAATTTGCGT-3';miR-152上游引物:5'-ACGGTACCGTAAGGGACTCGGGAAGGAG-3',下游引物:5'-TCAAGCTTGCCTCCTTCTTCCAGCTGAT-3'。荧光定量PCR反应总体积25 µl:SYBR Green MIX 12.5 µl、ddH2O 9.5 µl,上下游引物各0.5 µl,cDNA模板2.0 µl。PCR反应条件:95℃预变性15 min,95℃变性15 s,60℃退火60 s,进行40个循环。实验重复3次,采用2-ΔΔCt法计算miR-152的相对表达量。
1.4 miR-152表达水平与肝癌患者病理参数的相关分析根据miR-152在肝癌组织中相对表达水平的中位数(0.561),将56例肝癌患者分为miR-152高表达组和低表达组,并将每例患者肝癌组织miR-152的表达水平与癌旁组织进行比较,采用χ2检验分析肝癌患者的临床病理参数如年龄、性别、AFP水平、肿瘤大小、病理分化、TNM分期、远处转移、手术方式等与其miR-152的表达进行相关分析,并通过随访的方式分析患者癌组织中miR-152的表达水平及其预后的关系。
1.5 统计学方法采用SPSS16.0软件进行统计分析,计量资料采用均数±标准差表示。两组间比较采用t检验。患者临床病理参数分析采用χ2检验,患者生存率分析采用Kaplan-Meier曲线,组间的生存率和复发率的比较采用Log rank检验,P < 0.05为差异有统计学意义。采用单因素Cox回归对所有临床病理指标进行分析,再取P < 0.05的因素进行多因素回归分析。
2 结果 2.1 miR-152在肝癌组织和癌旁组织中的表达Real-time PCR检测结果显示,肝癌(0.616±0.041)与癌旁组织(0.768±0.042)中miR-152的相对表达水平差异有统计学意义(t=2.595, P=0.011),表明miR-152在肝癌组织中的相对表达水平显著下降,见图 1。

|
| 图 1 肝癌和癌旁组织中miR-152相对表达水平 Figure 1 Relative miR-152 expressions in cancerous tissues and non-cancerous tissues |
结果显示,miR-152低表达组中,TNM分期Ⅲ~Ⅳ期患者人数明显多于Ⅰ~Ⅱ期(P=0.042)、低分化患者人数明显多于中高分化组(P=0.035)、有转移患者人数明显多于无转移(P=0.048),有血管侵犯患者人数明显多于无血管侵犯(P=0.042)。而与患者的性别(P=0.397)、年龄(P=0.752)、AFP水平(P=0.365)、肿瘤数量(P=0.584)、肿瘤直径(P=0.397)、手术方式(P=0.274)和乙型肝炎病毒携带状态(P=0.554)等无显著相关,见表 1。提示肝癌组织中miR-152的相对表达水平与肝癌患者肿瘤TNM分期、病理分化、肿瘤转移及血管侵犯相关。
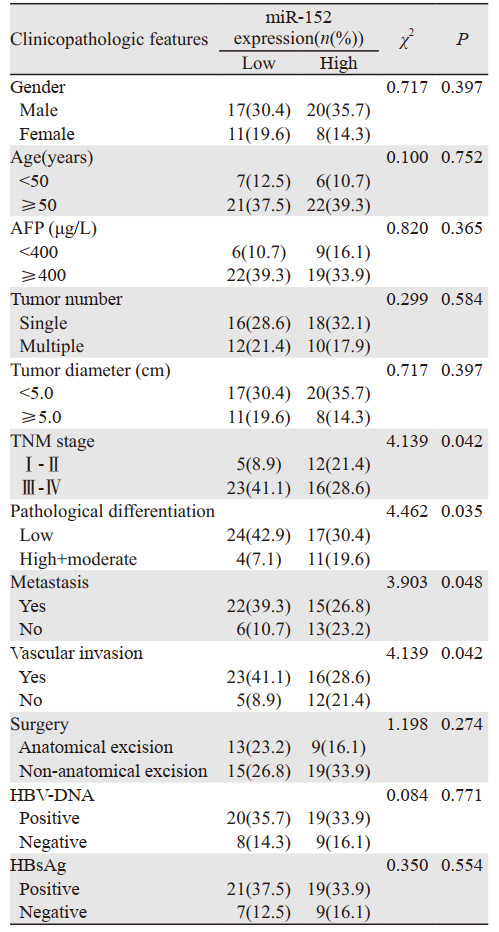
|
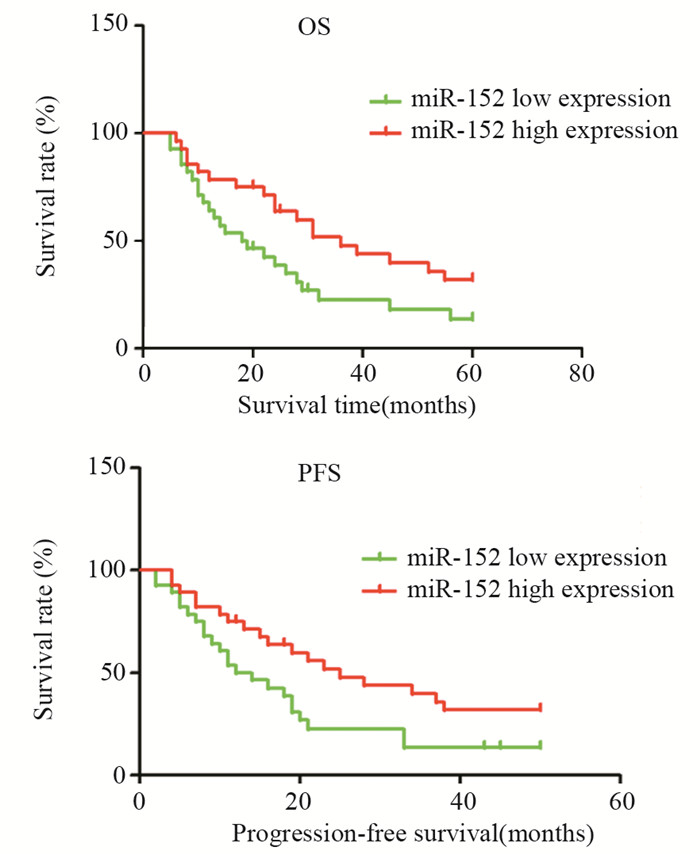
通过分析56例肝癌患者术后生存资料,结果显示miR-152低表达组中位生存时间为18.5月,miR-152高表达组中位生存时间为36.0月,miR-152低表达组生存时间低于miR-152高表达组(P= 0.035);miR-152低表达组无进展中位生存时间为13.0月,miR-152高表达组无进展中位生存时间为25.0月,miR-152低表达组无进展中位生存时间低于miR-152高表达组(P=0.012),见图 2。
|
| 图 2 miR-152表达水平与肝癌患者预后的关系 Figure 2 Relation between miR-52 expression and prognosis of HCC patients |
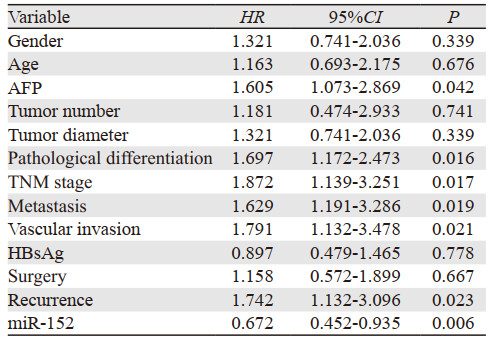
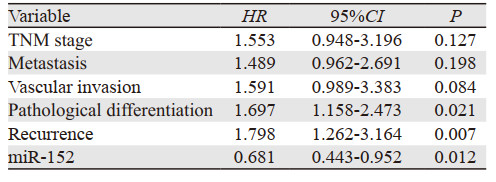
单因素Cox回归分析结果显示:AFP水平、TNM分期、病理分化、肿瘤转移、复发、血管侵犯及miR-152低表达均是影响肝癌患者总体生存的风险因素,见表 2。多因素Cox回归分析结果显示:miR-152表达、肿瘤复发、病理分化可以作为预测HCC患者不良预后的独立风险因素,见表 3。
|
|
miRNA已被证实与多种恶性肿瘤的发生发展密切相关,并且能够作为恶性肿瘤早期诊断和预后预测的标志物,以及肿瘤靶向治疗的靶点[9]。miR-152是miRNA中miR-148/miR-152家族的成员,位于17号染色体长臂21区32带[10]。有研究表明,miR-152在结直肠癌、宫颈癌、前列腺癌等多种恶性肿瘤中异常表达[11-13]。汪毅等[14]对结直肠癌组织和癌旁组织中miR-152的表达量进行检测,结果发现miR-152在结直肠癌组织中的表达水平低于相应癌旁组织,且miR-152表达水平与结直肠癌患者的淋巴结转移和TNM分期有关,miR-152表达越低的结直肠癌患者预后越差,miR-152可以作为结直肠癌患者预后的标志物;张红森等[15]研究也发现miR-152在膀胱癌组织中的表达水平低于相应癌旁组织,miR-152可能通过调节ERBB3/AKT2信号通路发挥抑制膀胱癌发生发展和侵袭转移的功能。
在肝细胞癌中,miR-152表达水平与肿瘤发生发展的关系亦有少量报道。Wang等[16]利用RT-PCR检测肝癌患者和对照组血清miR-152表达水平,发现miR-152表达水平在肝癌患者血清中明显下调,血清miR-152水平可以作为肝癌的诊断标志物。Dang等[17]研究发现,miR-152在肝癌细胞中表达下调,miR-152主要通过靶向TNFRSF6B调节细胞增殖和凋亡在肝癌中发挥抑癌功能。Yin等[18]研究发现,miR-152在肝癌组织中表达下调,miR-152主要通过靶向CDK8发挥抑制肿瘤的作用,miR-152可能是治疗肝癌的潜在靶标。但miR-152表达与肝癌预后的关系如何未见报道。
本研究结果显示,miR-152在肝癌组织中的相对表达量显著低于癌旁组织,提示miR-152在肝癌中表达下调,在生物体内可能发挥抑癌基因的功能。本研究对miR-152高表达组和miR-152低表达组与患者相关临床病理特征进行分析,结果显示,miR-152表达与患者的性别、年龄、AFP水平、肿瘤数量、肿瘤直径、手术方式和乙型肝炎病毒携带状态无显著相关,而与患者的肿瘤TNM分期、病理分化、肿瘤转移及血管侵犯明显相关,miR-152低表达组肝癌TNM分期Ⅲ~Ⅳ期、病理分化低分化、有肿瘤转移及有血管侵犯人数明显高于miR-152高表达组,提示miR-152表达水平与肝癌的恶性程度和预后相关。为进一步探讨miR-152在肝癌患者预后判断中的临床应用价值,我们采用Kaplan-Meier生存曲线法分析肝癌患者的预后与miR-152表达水平之间关系,结果显示,miR-152低表达组的生存时间和无进展生存时间均显著低于miR-152高表达组,差异有统计学意义,表明miR-152表达水平越低的肝癌患者,生存周期越短,存活率越低。多因素Cox回归分析结果显示,肝癌组织miR-152低表达是肝癌患者的独立危险因素。以上结果表明,miR-152在肝癌中异常表达,且参与了肝癌的发生发展,miR-152的表达水平还与肝癌患者的肿瘤进展严重程度呈负相关。
综上所述,本研究结果表明,miR-152在肝癌组织中低表达,且其异常表达与肝癌患者TNM分期、病理分化、肿瘤转移、血管侵犯及预后相关,miR-152在肝癌的发生发展和侵袭转移中起抑制作用,但miR-152在肝癌发生发展过程中的表达变化及其潜在的分子机制尚需进一步研究阐明。
作者贡献:
彭契六:实验操作与数据统计分析、构思与撰写文章
韦尚谋:参与文章整体设计、部分实验操作
张磊、甘丽英、谢珍:参加部分实验操作
陈巧佩:指导实验操作、文章整体构思、内容修改
韦邦宁、张智:标本收集
| [1] |
Komoll RM, Hu Q, Olarewaju O, et al. MicroRNA-342-3p is a potent tumour suppressor in hepatocellular carcinoma[J]. J Hepatology, 2021, 74(1): 122-134. DOI:10.1016/j.jhep.2020.07.039 |
| [2] |
Wu J, Xie N, Xie K, et al. GPR48, a poor prognostic factor, promotes tumor metastasis and activates β-catenin/TCF signaling in colorectal cancer[J]. Carcinogenesis, 2013, 34(12): 2861-2869. DOI:10.1093/carcin/bgt229 |
| [3] |
李自慧, 叶甲舟, 陈洁, 等. 解剖性肝切除术对合并微血管侵犯的肝癌患者早期复发的影响[J]. 中华肝胆外科杂志, 2018, 24(1): 18-22. [Li ZH, Ye JZ, Chen J, et al. The impact of anatomical resection for hepatocellular carcinoma with microvascular invasion on early tumor recurrence[J]. Zhonghua Gan Dan Wai Ke Za Zhi, 2018, 24(1): 18-22. DOI:10.3760/cma.j.issn.1007-8118.2018.01.005] |
| [4] |
Brennan GP, Henshall DC. MicroRNAs as regulators of brain function and targets for treatment of epilepsy[J]. Nat Rev Neurol, 2020, 16(9): 506-519. DOI:10.1038/s41582-020-0369-8 |
| [5] |
Wei L, Wang X, Lv L, et al. The emerging role of microRNAs and long noncoding RNAs in drug resistance of hepatocellular carcinoma[J]. Mol Cancer, 2019, 18(1): 147. DOI:10.1186/s12943-019-1086-z |
| [6] |
Yang C, Zheng X, Ye K, et al. miR-135a Inhibits the Invasion and Migration of Esophageal Cancer Stem Cells through the Hedgehog Signaling Pathway by Targeting Smo[J]. Mol Ther Nucleic Acids, 2020, 19: 841-852. DOI:10.1016/j.omtn.2019.10.037 |
| [7] |
Rezaei T, Amini M, Hashemi ZS, et al. microRNA-181 serves as a dual-role regulator in the development of human cancers[J]. Free Radic Biol Med, 2020, 152: 432-454. DOI:10.1016/j.freeradbiomed.2019.12.043 |
| [8] |
Weng J, Luo J, Cheng X, et al. Deletion of G protein-coupled receptor 48 leads to ocular anterior segment dysgenesis (ASD) through down-regulation of Pitx2[J]. Proc Natl Acad Sci USA, 2008, 105(16): 6081-6086. DOI:10.1073/pnas.0708257105 |
| [9] |
Shen K, Cao Z, Zhu R, et al. The dual functional role of MicroRNA-18a (miR-18a) in cancer development[J]. Clin Transl Med, 2019, 8(1): 32. |
| [10] |
Li B, Xie Z, Li B. miR-152 functions as a tumor suppressor in colorectal cancer by targeting PIK3R3[J]. Tumour Biol, 2016, 37(8): 10075-10084. DOI:10.1007/s13277-016-4888-2 |
| [11] |
Liu Y, Gao S, Du Q, et al. miR-146a and miR-152 in prostate cancer and clinicopathological parameters[J]. J BUON, 2019, 24(4): 1692-1699. |
| [12] |
Ghazanchaei A, Mansoori B, Mohammadi A, et al. Restoration of miR-152 expression suppresses cell proliferation, survival, and migration through inhibition of AKT-ERK pathway in colorectal cancer[J]. J Cell Physiol, 2018, 234(1): 769-776. |
| [13] |
Yang D, Zhang Q. miR-152 may function as an early diagnostic and prognostic biomarker in patients with cervical intraepithelial neoplasia and patients with cervical cancer[J]. Oncol Lett, 2019, 17(6): 5693-5698. |
| [14] |
汪毅, 袁伟, 马肖, 等. miR-152在结直肠癌组织中的表达及其与预后的关系[J]. 中华肿瘤杂志, 2016, 38(10): 763-766. [Wang Y, Yuan W, Ma X, et al. Expression of microRNA-152 in colorectal cancer and its relationship with prognosis[J]. Zhonghua Zhong Liu Za Zhi, 2016, 38(10): 763-766. DOI:10.3760/cma.j.issn.0253-3766.2016.10.010] |
| [15] |
张红森, 郭国营, 杨翠, 等. MiR-152在膀胱癌中的表达以及对ERBB3/AKT2信号通路的调节作用[J]. 中国肿瘤, 2019, 28(1): 55-62. [Zhang HS, Guo GY, Yang C, et al. Expression of MiR-152 in Bladder Cancer and Its Effect on ERBB3/Akt Signal Pathway[J]. Zhongguo Zhong Liu, 2019, 28(1): 55-62.] |
| [16] |
Wang F, Ying H, He B, et al. Circulating miR-148/152 family as potential biomarkers in hepatocellular carcinoma[J]. Tumour Biol, 2016, 37(4): 4945-4953. DOI:10.1007/s13277-015-4340-z |
| [17] |
Dang YW, Zeng J, He RQ, et al. Effects of miR-152 on cell growth inhibition, motility suppression and apoptosis induction in hepatocellular carcinoma cells[J]. Asian Pac J Cancer Prev, 2014, 15(12): 4969-4976. DOI:10.7314/APJCP.2014.15.12.4969 |
| [18] |
Yin T, Liu MM, Jin RT, et al. miR-152-3p Modulates hepatic carcinogenesis by targeting cyclin-dependent kinase 8[J]. Pathol Res Pract, 2019, 215(6): 152406. DOI:10.1016/j.prp.2019.03.034 |
 2021, Vol. 48
2021, Vol. 48


