文章信息
- T1期食管鳞状细胞癌组织肿瘤出芽与内镜分型及恶性程度的关系
- Relation Between Tumor Budding and Endoscopic Classification, Degree of Malignancy in T1 Stage Esophageal Squamous Cell Carcinoma
- 肿瘤防治研究, 2021, 48(10): 952-957
- Cancer Research on Prevention and Treatment, 2021, 48(10): 952-957
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.21.0262
- 收稿日期: 2021-03-11
- 修回日期: 2021-07-25
2. 211102 南京,东南大学医学院附属南京同仁医院消化内科
2. Department of Gastroenterology, Nanjing Tongren Hospital, School of Medicine, Southeast University, Nanjing 211102, China
T1期食管鳞状细胞癌(esophageal squamous cell carcinoma, SCC)曾被认为是“早期”癌症,大多数局限于黏膜固有层的T1期食管SCC通过内镜切除术可治愈,因为该阶段淋巴结转移的风险非常低,然而,一部分T1期食管SCC患者在就诊时就已出现全身性疾病,即使根治性手术也无法治愈,因此将T1期食管SCC统称为浅表性食管SCC更为合理[1-2]。考虑T1期食管SCC患者间存在较大的预后差异性,需寻找一种有价值的预后指标,以识别出在内镜下黏膜切除术(endoscopic mucosal resection, EMR)之后需要接受挽救治疗的患者[3-4],显得很有必要。肿瘤出芽是指分离的单个癌细胞和细胞簇散布在肿瘤浸润前沿,最初被认为是与结肠直肠腺癌侵袭性生物学行为密切相关的病理指标[5-6]。研究发现在食管SCC中肿瘤出芽也同样是一个非常有价值的预后指标[7]。然而,通常反映肿瘤侵袭性的病理特征一般更多见于进展期肿瘤患者的手术标本中[5],肿瘤出芽在T1期的食管SCC中检出率如何?肿瘤出芽与T1期食管SCC的生长方式及恶性程度之间有着怎样的关系?基于以上疑问,本研究通过根治性手术切除的T1期食管SCC标本评估了肿瘤出芽的检出率,以及肿瘤出芽与内镜分型、浸润深度、脉管侵犯、淋巴结转移、临床分期等临床病理参数间的关系。
1 资料与方法 1.1 临床资料收集2018年1月—2021年1月间南京市中医院经内镜活检及术后病理证实的T1期食管SCC30例。其中男25例、女5例,年龄46~78岁,平均64.2岁。30例SCC中,肿瘤最大直径0.8~4 cm,平均2.2 cm。高分化5例,中分化12例,低分化13例;肿瘤浸润黏膜下层24例,肿瘤位于固有层6例;淋巴结有转移13例且均为N1期,淋巴结无转移17例;有脉管侵犯7例,无脉管侵犯23例;30例均未见神经侵犯,且均未见远处转移。所有病例均具有详实的内镜描述、内镜分型、大体及镜检病理资料,该研究排除了术前接受过新辅助治疗的病例。
1.2 HE病理切片制备及免疫组织化学染色方法首先按食管癌根治标本病理检查规范进行取材,肿瘤组织块的大小在15 mm×15 mm以内,厚度2~5 mm,再将组织块放入全自动组织脱水机中,经过固定、透明、脱水、浸蜡等步骤,最后进行包埋切片,切片厚度3~5 μm,然后经铺片、贴片、烘片,最后进行苏木素-伊红染色(HE染色)制作成HE病理组织切片,待诊断医师显微镜下观察。
将制作好的石蜡切片经二甲苯脱蜡、梯度酒精脱水后进行免疫组织化学染色,具体采用免疫组织化学EnVision法,通过高压锅高温抗原修复后在全自动免疫组织化学染色仪进行染色,具体步骤以仪器操作说明书为准。免疫组织化学标志物主要是S-100、CD34、D2-40、Ki67和EGFR。其中神经束标志物为S-100;脉管内皮标志物为CD34、D2-40;反映肿瘤细胞增殖指数的标志物为Ki67;EGFR与食管癌恶性程度成正相关[8-9]。
1.3 结果判断 1.3.1 内镜分型内镜下浅表食管癌(0型)分为息肉样、非息肉样及凹陷型。0~Ⅰ型病变为息肉样病变(浅表隆起型);0~Ⅱ型病变为非息肉样病变,细分为:0~ⅡA(轻微隆起型)、0~ⅡB(平坦型)、0~ⅡC(轻微凹陷型);0~Ⅲ型病变为凹陷型病变[10]。
1.3.2 临床分期根据AJCC第八版食管癌分期系统[11],对患者进行TNM及临床分期。
1.3.3 肿瘤出芽计数与分级日本癌症协会结直肠癌推荐标准指出,要求通过显微镜20倍视野下观察一个0.785 mm2面积下出芽数量,浸润最前沿间质内单个孤立肿瘤细胞或≤5个肿瘤细胞组成的巢团浸润称为1灶,1级为0~4灶、2级为5~9灶、3级为≥10灶[12]。Shinto等[13]在20倍放大视野下观察肿瘤出芽,并计数肿瘤出芽数目最多区域,根据统计结果将肿瘤出芽分为低度(0~9灶)、高度(≥10灶),该研究显示高度出芽与肿瘤恶性度高、预后差密切相关。
1.4 统计学方法应用统计软件SPSS21.0进行数据分析,Microsoft Word用于生成表格。使用卡方检验,P < 0.05为差异有统计学意义。
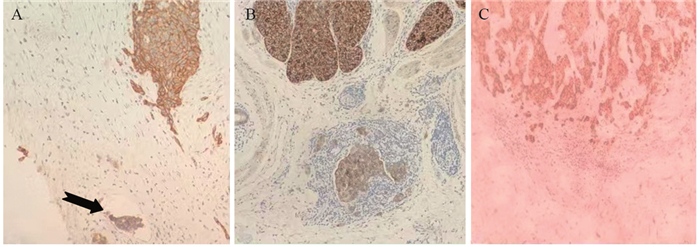
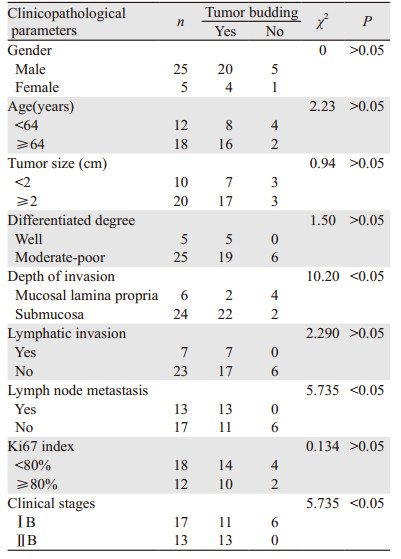
2 结果 2.1 T1期食管SCC中肿瘤出芽计数与分级通过观察HE切片出芽检出率为70%(21/30),经EGFR标记后肿瘤出芽检出率为80%(24/30),共检出肿瘤出芽184灶,EGFR在食管SCC中普遍呈强表达,并着色于胞膜,能清晰勾画出每个细胞的轮廓,见表 1~2、图 1~2。

|

|

|
| A: G1, B: G2, C: G3. 图 1 T1期食管鳞状细胞癌组织肿瘤出芽分级 Figure 1 Tumor budding grade in T1 stage equamous cell carcinoma tissues |
|
| A: G1, B: G2, C: G3; Arrow: tumor thrombus in the vessel. 图 2 EGFR标记T1期食管鳞状细胞癌组织肿瘤出芽情况 Figure 2 EGFR-labeled tumor budding in T1 stage equamous cell carcinoma tissues |
肿瘤出芽分级:1级12例(1~4灶)、2级3例(6~7灶)、3级9例(11~21灶),30例食管SCC中,40%(12/30)出现1级出芽,10%(3/30)出现2级出芽,30%(9/30)出现3级出芽,还有20%(6/30)未发现肿瘤出芽。按Shinto分度分为:低度15例(出芽数1~7灶)、高度9例(11~21灶)。
2.2 T1期食管SCC内镜分型与肿瘤出芽以及其他临床病理参数之间的关系本组病例内镜分型为:0~Ⅰ3例、0~ⅡA 13例、0~ⅡB 7例、0~ⅡC 3例、0~Ⅲ4例,见图 3。本研究显示T1期食管SCC无论有无肿瘤出芽都与内镜分型间无相关性(χ2=6.489, P > 0.05),见表 3。内镜0~Ⅲ型者占13.3%(4/30),且均检出肿瘤出芽,出芽总数为44灶,其中3例出芽分级为3级;内镜0~Ⅱ型者占76.7%(23/30),出芽总数为129灶,其中以0~ⅡA型最多,约占总病例数的43.3%(13/30);内镜0~Ⅰ型最少,占总例数的10%(3/30),其中1例未见肿瘤出芽,其余2例均为肿瘤出芽1级,出芽总数为7灶。

|
| A: Type Ⅰ, B: Type ⅡA, C: Type ⅡB, D: Type ⅡC, E: Type Ⅲ. 图 3 T1期食管鳞状细胞癌组织内镜分型 Figure 3 Endoscopic classification in T1 stage equamous cell carcinoma tissues |

|
T1期食管SCC内镜分型与患者年龄、性别、肿瘤大小、Ki67增殖指数、分化程度、浸润深度、脉管侵犯、淋巴结转移及临床分期之间均无相关性(P > 0.05)。
2.3 T1期食管SCC中肿瘤出芽与临床病理参数之间的关系本组病例临床分期为:ⅠB 17例、ⅡB13例。结果显示肿瘤出芽在T1b期SCC中的检出率为91.7%,显著高于T1a期SCC 33.3%,差异有统计学意义(P < 0.05);有淋巴结转移的病例肿瘤出芽检出率为100%,显著高于无淋巴结转移者64.7%,差异有统计学意义(P < 0.05),进一步分层分析显示不同分级肿瘤出芽组间淋巴结转移率的差异均无统计学意义(χ2=4.196, P=0.123);临床ⅡB期的病例肿瘤出芽检出率为100%,显著高于临床ⅠB期者64.7%,差异有统计学意义(P < 0.05)。肿瘤出芽检出率在有脉管侵犯者为100%,高于无脉管侵犯者73.9%,但差异无统计学意义(P > 0.05);肿瘤出芽检出率在高分化肿瘤中为100%,高于中~低分化者76%,但差异无统计学意义(P > 0.05)。肿瘤出芽与患者年龄、性别、肿瘤大小及Ki67增殖指数均无相关性(均P > 0.05)见表 4。
|
T1期结直肠、胃癌通常被定义为“早期”癌症,而T1期食管SCC也曾被认为是早期癌,即肿瘤浸润深度在黏膜下层以上,伴或不伴淋巴结转移。但新研究发现,T1期食管癌并不是一种单纯的早期癌,而是一组存在较大生物学异质性的浅表性SCC,其中部分可通过内镜手术治愈,然而,部分就诊时已处于进展期,需要接受更积极的治疗[1-2]。因此,筛选出真正的早期食管癌(T1期不伴任何淋巴结转移)显得很重要,但只有根治性手术才能获取足够的淋巴结,因此也存在一定困难。那么探索早期食管SCC预后价值的指标就显得很有意义,近年来已有少数学者提出肿瘤出芽在浅表性食管SCC中存在重要的意义,并证实肿瘤出芽与其淋巴结转移有关[14],Teramoto等[3]发现肿瘤出芽率在发生脉管侵犯及淋巴结转移者中显著高于侵袭性低者,并认为肿瘤出芽是T1期食管SCC的独立预后因素,出现出芽者3年累积生存率为48.8%,明显低于无出芽的病例94.5%。何度等[10]发现仅有6.5%(3/46)浅表性食管SCC存在肿瘤出芽,他们认为由于病例数少的原因还不足以得出明确的结论。Teramoto等[3]发现T1期食管SCC的高度出芽率为36.7%(29/79)。Fuchinoue等[15]发现,14%(7/50)浅表食管SCC为高度出芽,18%(9/50)低度出芽,总出芽率32%。Nakagawa[16]发现,T1期食管SCC100%存在肿瘤出芽,其中52.7%(29/55)存在高度出芽,47.3%(26/55)为低度出芽。本研究发现T1期食管SCC肿瘤出芽率高达80%(24/30),共检出肿瘤出芽184灶,50%(15/30)为低度出芽,30%(9/30)为高度出芽,显著高于国内数据。研究显示T1期胃癌中出芽率为56.1%(92/164)[17],T1期结直肠癌出芽率为56.3%[18]。结合文献及本研究数据,我们认为肿瘤出芽在T1期食管SCC中是较为常见的病理现象,且发生率可能高于T1期结直肠、胃癌。
与肠、胃癌相似,肿瘤出芽提示T1期食管SCC具有更强的侵袭能力[17-18]。多项研究证实T1期食管SCC的肿瘤出芽率与浸润深度、淋巴结转移、临床分期、淋巴管及血管侵犯呈显著正相关[2, 15-16]。本研究显示T1b期SCC出芽率为91.7%,显著高于T1a期SCC 33.3%(P < 0.05);有淋巴结转移的病例出芽率为100%,显著高于无转移者64.7%(P < 0.05);ⅡB期的病例出芽率为100%,显著高于ⅠB期者64.7%(P < 0.05)。肿瘤出芽与年龄、性别、分化程度、脉管侵犯、肿瘤大小及Ki67均无相关性(P > 0.05)。本试验还研究了内镜分型与肿瘤出芽、年龄、性别、肿瘤大小、Ki67、分化程度、浸润深度、脉管侵犯、淋巴结转移及临床分期之间的关系,结果示内镜分型与以上参数均无相关性(P > 0.05)。有人还对浅表性食管SCC出芽与浸润模式进行了研究,发现浸润性生长者比膨胀性及介于两者之间的中间性者具有更高的淋巴结转移风险[14]。但国内研究发现,浅表性食管SCC以膨胀性生长最多见,占50%(23/46),浸润性者仅占13%(6/46),中间性约37%(17/46),三种浸润模式间出芽率无明显差别[10]。Nakagawa等[16]发现高度出芽的T1期食管癌E-cadherin低表达,5年生存率显著低于低度出芽者。Niwa等[19]也发现高度出芽者浸润更深、更易侵犯淋巴管、病理分期更高,5年生存率(25.9%)显著低于低出芽组(75.1%)。他们进一步通过基因和蛋白检测,发现高度出芽组低表达E-cadherin而高表达Vimentin,呈间质表型,而,低度出芽组则高表达E-cadherin而低表达Vimentin,呈上皮表型,说明高出芽组肿瘤细胞发生了上皮间质转化(epithelial-mesenchymal transition, EMT)。EMT是促使癌细胞像间质细胞一样更具侵袭性的一个病理过程,而肿瘤出芽则可以在形态上反映EMT的过程[19-20]。实际上,除食管鳞癌外,很多肿瘤(结直肠癌,舌鳞状细胞癌,胰腺癌,子宫内膜癌和乳腺癌)都已被证实存在肿瘤出芽与EMT之间的密切联系[19]。Niwa的结果表明食管鳞癌可通过EMT获得间质细胞表型,但肿瘤浸润前沿的出芽细胞在多大程度上发生了向间质细胞表型的转化,以及出芽与EMT之间的具体机制还有待进一步阐明。
本组病例标记EGFR后出芽率(80%)明显高于常规检出率(70%),可见EGFR在计数食管SCC肿瘤出芽时稳定可靠。本研究还发现如果有淋巴结转移,但肿瘤还局限于黏膜内的食管SCC,很可能经连续深切片后才能发现肿瘤出芽,这类食管SCC在计数出芽灶时最好先行免疫组化标记,以免遗漏少细胞性出芽灶。本组一名64岁男患者,食管SCC内镜下为黏膜小结节样隆起,内镜分型0-ⅡA型,显微镜下观察到黏膜内有6处表浅浸润灶,大小约0.1~0.4 cm,周边均为原位癌,总面积大小约4.5 cm×2.5 cm,5枚食管旁淋巴结转移一枚,pTNM分期为pT1aN1M0G1,临床分期ⅡB,第一次切片未发现出芽,连续深切片后在0.4 cm病灶周围发现少量小瘤巢,EGFR标记后找到一灶3个细胞组成的芽体。有人建议CK标记计数肿瘤出芽[21],但我们发现经EGFR标记的154例食管SCC组织中,均为细胞膜强阳性表达,周围炎性细胞、纤维及平滑肌组织均阴性,与文献报道一致[9]。由于EGFR在食管SCC主要着色于包膜,能清晰地勾画出每个细胞的轮廓,极大的提高了少细胞出芽灶的辨识度,尤其在炎性反应较重的情况下,值得在工作中推广应用。
随着内窥镜技术不断提高,T1期食管SCC的治疗已经取得了很大的进步,然而此类肿瘤包含着真正意义上的早期癌及一部分具有更高风险的浅表性癌,怎样将两者进行最大限度的筛选并进行合理的治疗是我们所面临的巨大挑战。本研究发现肿瘤出芽在T1期食管SCC中有较高比例的出现,亦是一个非常有价值的预后指标,因此,在T1期食管SCC诊疗过程中我们可以在一定程度上通过肿瘤出芽率的高低,综合其他指标得到更精准的评估结果,这样会更有利于我们预测仅侵犯黏膜肌层或黏膜下浅层的SCC患者的淋巴结受累情况,以便更加精准的实施EMR手术,同时对高肿瘤出芽率的患者追加更积极地治疗。
作者贡献
王康:设计与实施研究、收集与分析数据、撰写并修改论文
杨春:设计研究和审核论文
| [1] |
程娜, 李卫华, 薛丽燕. 食管鳞状细胞癌壁内转移的研究进展[J]. 肿瘤防治研究, 2021, 48(2): 191-195. [Cheng N, Li WH, Xue LY. Progress of Intramural Metastasis of Esophageal Squamous Cell Carcinoma[J]. Zhong Lui Fang Zhi Yan Jiu, 2021, 48(2): 191-195.] |
| [2] |
王宇. 糖皮质激素预防浅表性食管鳞癌内镜粘膜下剥离术后食管狭窄疗效观察[D]. 郑州: 郑州大学, 2019: 1-44. [Wang Y. Observation on the effect of glucocorticoids in preventing esophageal stenosis after endoscopic submucosal dissection of superficial esophageal squamous cell Carcmoma[D]. Zheng Zhou: Zheng Zhou Da Xue, 2019: 1-44.]
|
| [3] |
Teramoto H, Koike M, Tanaka C, et al. Tumor budding as a useful prognostic marker in T1-stage squamous cell carcinoma of the esophagus[J]. J Surg Oncol, 2013, 108(1): 42-46. DOI:10.1002/jso.23341 |
| [4] |
Ando N, Iizuka T, Ide H, et al. Surgery plus chemotherapy compared with surgery alone for localized squamous cell carcinoma of the thoracic esophagus: A Japan Clinical Oncology Group Study—JCOG9204[J]. J Clin Oncol, 2003, 21(24): 4592-4596. DOI:10.1200/JCO.2003.12.095 |
| [5] |
徐溢新, 刘佳, 刘广珍, 等. 肿瘤出芽与结直肠癌临床病理特征及预后的相关性分析[J]. 徐州医科大学学报, 2020, 40(12): 864-869. [Xu YX, Liu J, Liu GZ, et al. Association of tumor budding with the clinicopathological characteristics and prognosis of colorectal cancer[J]. Xu Zhou Yi Ke Da Xue Xue Bao, 2020, 40(12): 864-869. DOI:10.3969/j.issn.2096-3882.2020.12.002] |
| [6] |
Ueno H, Murphy J, Jass JR, et al. Tumour 'budding' as an index to estimate the potential of aggressiveness in rectal cancer[J]. Histopathology, 2002, 40(2): 127-132. DOI:10.1046/j.1365-2559.2002.01324.x |
| [7] |
Nakanishi Y, Ohara M, Doumen H, et al. Correlation between tumor budding and post-resection prognosis in patients with invasive squamous cell carcinoma of the thoracic esophagus[J]. World J Surg, 2011, 35(2): 349-356. DOI:10.1007/s00268-010-0880-y |
| [8] |
高娜, 姚宏. P53和Ki67在食管异型增生和早期食管癌中的表达及意义[J]. 中国药物与临床, 2020, 20(21): 3559-3561. [Gao N, Yao H. Expression and significance of P53 and Ki67 in esophageal dysplasia and early esophageal cancer[J]. Zhongguo Yao Wu Yu Lin Chuang, 2020, 20(21): 3559-3561.] |
| [9] |
朱勇军. ERCC1、EGFR及p53在食管癌组织中的表达及其临床意义[J]. 医学临床研究, 2018, 35(7): 1347-1350. [Zhu YJ. Expression and clinical significance of ERCC1, EGFR and p53 in esophageal carcinoma[J]. Yi Xue Lin Chuang Yan Jiu, 2018, 35(7): 1347-1350. DOI:10.3969/j.issn.1671-7171.2018.07.034] |
| [10] |
何度, 吴霞, 江丹, 等. 130例内镜下黏膜切除浅表型食管癌及食管上皮内肿瘤的病理学分析[J]. 四川大学学报(医学版), 2015, 46(6): 911-915. [He D, Wu X, Jiang D, et al. Superficial Esophageal Carcinoma and Esophageal Intraepithelial Neoplasia: a Pathological Study of 130 Cases[J]. Sichuan Da Xue Xue Bao(Yi Xue Ban), 2015, 46(6): 911-915.] |
| [11] |
袁勇, 陈龙奇. AJCC第八版食管癌分期系统更新解读[J]. 中华外科杂志, 2017, 55(2): 109-113. [Yuan Y, Chen LQ. Interpretation of update on The AJCC Esophageal Cancer Staging System, Eighth Edition[J]. Zhonghua Wai Ke Za Zhi, 2017, 55(2): 109-113. DOI:10.3760/cma.j.issn.0529-5815.2017.02.007] |
| [12] |
Watanabe T, Itabashi M, Shimada Y, et al. Japanese Society for Cancer of the Colon and Rectum. Japanese Society for Cancer of the Colon and Rectum (JSCCR) Guidelines 2014 for treatment of colorectal cancer[J]. Int J Clin Oncol, 2015, 20(2): 207-239. DOI:10.1007/s10147-015-0801-z |
| [13] |
Shinto E, Jass JR, Tsuda H, et al. Differential prognotic signifiance of morphologic invasive markers in colorectal cancer: tumour budding and cytoplasmic podia[J]. Dis Colon Rectum, 2006, 49(9): 1422-1430. DOI:10.1007/s10350-006-0595-1 |
| [14] |
Ito E, Ozawa S, Kijima H, et al. New invasive patterns as a prognostic factor for superficial esophageal cancer[J]. J Gastroenterol, 2012, 47(12): 1279-1289. DOI:10.1007/s00535-012-0587-y |
| [15] |
Fuchinoue K, Nemoto T, Shimada H, et al. Immunohistochemical analysis of tumor budding as predictor of lymph node metastasis from superficial esophageal squamous cell carcinoma[J]. Esophagus, 2020, 17(2): 168-174. DOI:10.1007/s10388-019-00698-5 |
| [16] |
Nakagawa Y, Ohira M, Kubo N, et al. Tumor budding and E-cadherin expression are useful predictors of nodal involvement in T1 esophageal squamous cell carcinoma[J]. Anticancer Res, 2013, 33(11): 5023-5029. |
| [17] |
姚高妍. 早期胃癌中肿瘤出芽的临床病理意义及预后价值[D]. 浙江: 宁波大学, 2018: 1-43. [Yao GY. Clinicopathological significance and prognostic value of tumor budding in early gastric cancer[D]. Zhejiang: Ning Bo Da Xue, 2018: 1-43.]
|
| [18] |
Lee SJ, Kim A, Kim YK, et al. The significance of tumor budding in T1 colorectal carcinoma: the most reliable predictor of lymph node metastasis especially in endoscopically resected T1 colorectal carcinoma[J]. Hum Pathol, 2018, 78: 8-17. DOI:10.1016/j.humpath.2018.02.001 |
| [19] |
Niwa Y, Yamada S, Koike M, et al. Epithelial to mesenchymal transition correlates with tumor budding and predicts prognosis in esophageal squamous cell carcinoma[J]. J Surg Oncol, 2014, 110(6): 764-769. DOI:10.1002/jso.23694 |
| [20] |
Xuefeng XF, Hou MX, Yang ZW, et al. Epithelial-mesenchymal transition and metastasis of colon cancer cells induced by the FAK pathway in cancer-associated fibroblasts[J]. J Int Med Res, 2020, 48(6): 300060520931242. |
| [21] |
杨路路, 苟思琪, 张前, 等. 结直肠腺癌中差分化细胞群和肿瘤出芽相关性及MUC1的表达[J]. 南京医科大学学报(自然科学版), 2019, 39(4): 539-543. [Yang LL, Gou SQ, Zhang Q, et al. Correlation of poorly differentiated clusters and tumor buddings and MUC1 expression in colorectal adenocarcinoma[J]. Nanjing Yi Ke Da Xue Xue Bao(Zi Ran Ke Xue Ban), 2019, 39(4): 539-543.] |
 2021, Vol. 48
2021, Vol. 48


