文章信息
- 基于SEER数据库构建肺肉瘤样癌的生存预测模型
- A Survival Prediction Model of Pulmonary Sarcomatoid Carcinoma Based on SEER Database
- 肿瘤防治研究, 2021, 48(9): 853-858
- Cancer Research on Prevention and Treatment, 2021, 48(9): 853-858
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.21.0259
- 收稿日期: 2021-03-05
- 修回日期: 2021-07-15
2. 225001 扬州,扬州大学临床医学院;
3. 225001 扬州,苏北人民医院呼吸与危重症医学科
2. Clinical Medical College of Yangzhou University, Yangzhou 225001, China;
3. Department of Respir-atory and Critical Care Medicine, Northern Jiangsu People's Hospital, Yangzhou 225001, China
肺肉瘤样癌(pulmonary sarcomatoid carcinoma, PSC)是一种罕见的、高度侵袭性的非小细胞肺癌(non-small cell lung cancer, NSCLC),由上皮癌成分和间质肉瘤或肉瘤样成分(梭形和(或)巨细胞)组成[1-4]。2004年世界卫生组织将PSC归类为肺恶性上皮肿瘤[5],包含5个亚型:多形性癌、梭形细胞癌、巨细胞癌、癌肉瘤及肺母细胞瘤。
由于PSC的发病率极低,临床关于PSC的报道较少,大多数都是病例报道或小型回顾性研究,对于个别PSC患者生存率预测通常是根据临床医生的个人经验。因此,通过构建列线图生存预测模型估计PSC患者预后情况,并将其结果可视化,有利于临床工作者对PSC患者的预后进行个体化评估。
1 资料与方法 1.1 数据来源本研究属于回顾性研究,所有病例资料均来自SEER数据库。
1.2 研究人群通过SEER*Stat软件提取1988—2015年组织学或病理学确诊的数据。收集以下临床资料:年龄、性别、种族、婚姻状况、组织学类型、原发灶部位、分化程度、肿瘤直径、浸润深度、淋巴结转移状况、远处转移状况、部位特异性因子-1和部位特异性因子-2、TNM分期、手术情况、放疗情况、化疗情况、随访时间、生存状态和死亡原因。
纳入标准:(1)诊断时间为1988—2015年; (2)原发肿瘤部位限于“肺和支气管”; (3)选择ICD-O-3病理证实的多形性癌、巨细胞癌、梭形细胞癌、肺母细胞瘤和癌肉瘤。
排除标准:(1)多原发性肿瘤; (2)非组织学或病理学确诊的数据; (3)外科手术信息未知; (4)无效的分期; (5)生存时间未知。
1.3 统计学方法本研究使用了三种软件对数据进行处理、分析及绘图。使用RStudio软件(版本1.3.1093)的“caret包”将数据按照7:3的比例分为建模组和验模组,使用SPSS25.0软件进行卡方检验用于评估两组间各个变量的差异。对建模组进行单因素和多因素Cox回归分析确定影响PSC患者预后的独立因素。单因素和多因素分析的结果显示为风险比(HR)和95%CI。基于建模组多因素分析的结果构建列线图预测模型,采用RStudio软件的“rms、foreign和survival包”建立列线图。列线图预测模型的结果分别在建模组和验模组进行验证。通过计算C-指数评估模型的准确度; 校准曲线用于比较预测生存率和实际生存率的一致性。P < 0.05为差异有统计学意义。
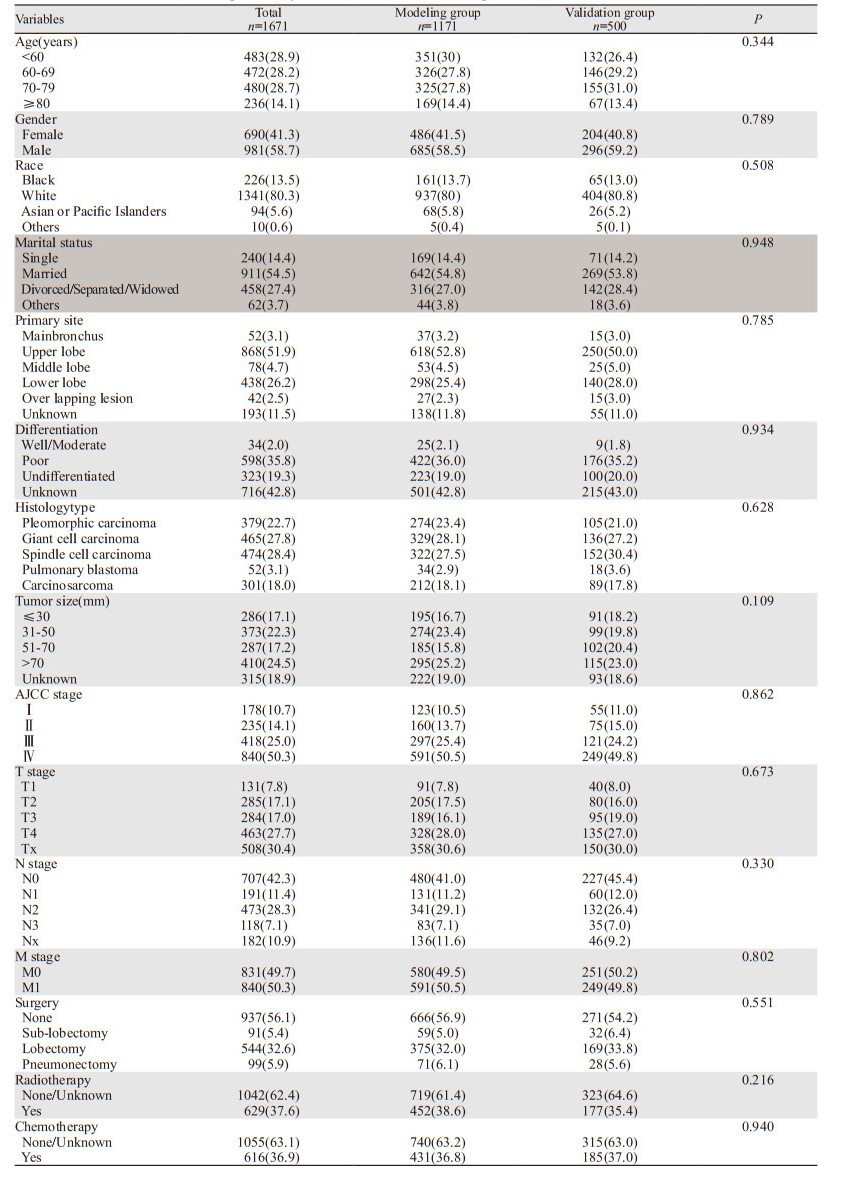
2 结果 2.1 PSC患者的临床特征SEER数据库中1988—2015年非小细胞肺癌共727488例,初步诊断为PSC的3152名患者,占0.43%。1671名符合条件的PSC患者纳入了这项研究,建模组和验模组患者比例7:3,见表 1。建模组和验模组各项临床特征间差异无统计学意义(P > 0.05),保证了模型的稳定性。
|
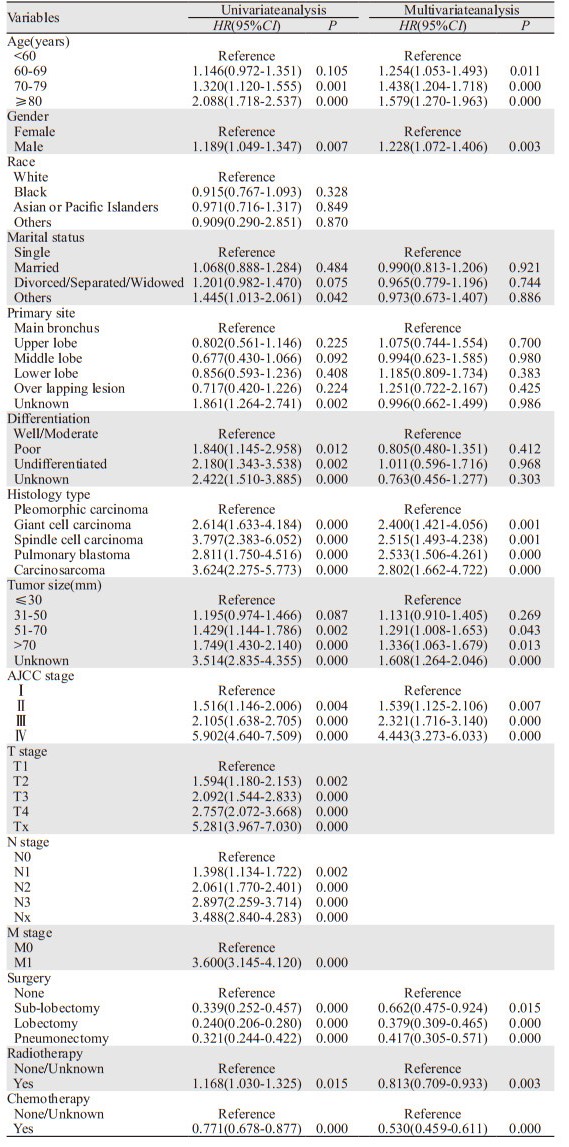
单因素分析显示,年龄、性别、婚姻状况、原发灶部位、病理分化程度、组织学类型、肿瘤直径、TNM分期、手术、放疗及化疗是影响患者OS的重要因素。将单因素分析中P < 0.05的变量纳入多因素分析。考虑到临床应用的便利性,TNM分期系统是临床医生应用最广泛的评估预后的工具,TNM分期Ⅰ~Ⅳ期包含T期、N期和M期的信息,并且Ⅳ期和M1期之间存在共线性,因此只将Ⅰ~Ⅳ期纳入多变量分析中。
建模组单因素与多因素分析结果表明年龄、性别、组织学类型、肿瘤直径 > 50 mm、TNM分期是PSC患者预后不良的独立危险因素,手术、放疗和化疗是PSC患者预后的独立保护因素,见表 2。
|
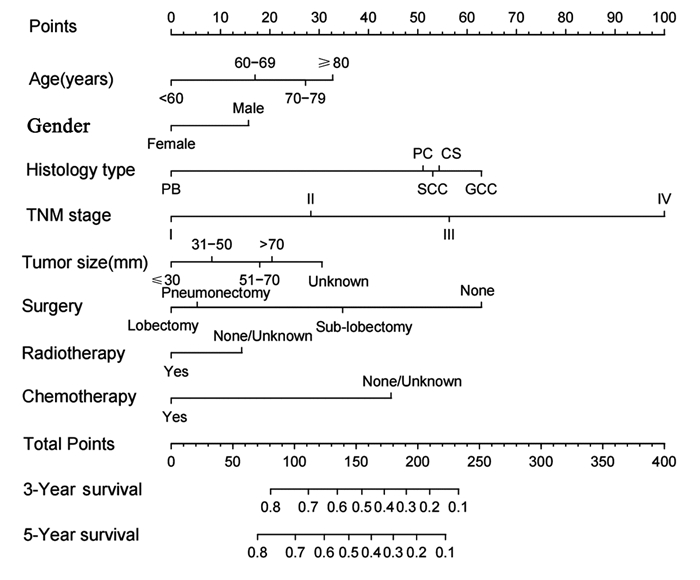
列线图根据多因素分析中各个变量对预后的影响程度,对每个变量进行赋值,最后相加得分从而对患者预后的评估进行可视化。建模组多因素分析结果显示年龄、性别、组织学类型、肿瘤直径 > 50 mm、TNM分期、手术、放疗和化疗是PSC患者预后的独立影响因素。以上述8个变量构建列线图生存预测模型,通过绘制列线图预测PSC患者3年、5年总体生存率,见图 1。
|
| PB: pulmonary blastoma; PC: pleomorphic carcinoma; SCC: spindle cell carcinoma; GCC: giant cell carcinoma; CS: carcinosarcoma. 图 1 PSC患者总生存率的列线图预测模型 Figure 1 Nomogram prediction model for overall survival of PSC patients |
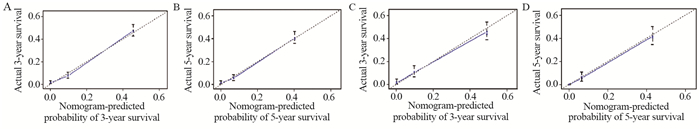
通过C指数、校准曲线对列线图预测的结果进行验证。建模组中,通过计算得出C指数为0.790(95%CI: 0.776~0.804)。验模组计算得出C指数为0.781(95%CI: 0.759~0.803),说明预测模型具有较高的准确度。建模组和验模组的列线图预测的3年和5年校准曲线都接近45°,说明预测生存率与实际生存率基本一致,说明列线图预测模型预测的生存率与患者实际的生存率接近,见图 2。
|
| 图 2 建模组(A, B)和验模组(C, D)3年和5年生存率的校准曲线 Figure 2 Calibration curves of 3- and 5-year survival rates of training cohort(A, B) and validation cohort(C, D) |
PSC是一种罕见的肺部恶性肿瘤,占NSCLC的0.1%~0.4%[6],我们在SEER数据库中发现PSC占NSCLC的0.43%。由于PSC发病率极低,目前临床上关于PSC的研究大多数是个案报道或小型回顾性研究,我们利用SEER数据库收集了PSC患者总共1671例。本研究发现,PSC多见于60岁以上的男性患者,白种人占多数,大多数病理分化程度差或者未分化,超过一半的患者确诊时已达Ⅳ期。建模组多因素分析显示性别、年龄、组织学类型、肿瘤直径 > 50 mm以及TNM分期是肺肉瘤样癌患者预后不良的独立危险因素,手术、放疗及化疗都是改善PSC患者预后的独立因素。通过建模组多因素分析的结果构建列线图,预测PSC患者的3年和5年总体生存率,通过C指数、ROC曲线及校准曲线在建模组和验模组进行验证,结果显示了列线图具有较好的预测能力,可为临床医生对PSC的预后进行个体化评估提供参考。
有研究表明PSC患者多数诊断年龄在60~70岁[7],除了肺母细胞瘤多数诊断年龄在40岁左右,年龄是影响预后的独立危险因素,与本结果一致。不同种族的PSC患者均有报道,但由于人数稀少,没有在不同种族群体中报告确切的发病率。与之前研究一致[8],种族差异对PSC患者的预后并无影响。
PSC最常见的部位是肺上叶,其次是肺下叶[8-11],我们无法确定其临床意义或任何潜在机制。与之前的研究一致,大多数PSC患者分化程度差或未分化,正如文献所言“PSC是分化程度差的NSCLC的一种亚型”[10]。本研究显示PSC最常见的病理类型是梭形细胞癌和巨细胞癌,其次是多形性癌、癌肉瘤和肺母细胞瘤。之前的研究发现多形性癌是最常见的PSC类型[12],这或许与PSC组织学上的异质性、多形性有关。此外,我们发现肿瘤直径 > 50 mm的PSC患者预后差且是影响PSC预后的独立危险因素,既往研究也发现肿瘤直径影响患者预后[13],这可能是肉瘤样癌组织成分与肿瘤直径相关,肿瘤直径越大,其肉瘤组织成分越多,故预后越差。本研究发现大多数患者在诊断PSC时已经Ⅳ期,预后极差,这是由于PSC的高度侵袭性、转移倾向以及临床症状不典型[1, 14]。
PSC侵袭性强,手术切除复发率高,所以目前PSC的治疗方式是以手术为主,放化疗为辅的综合治疗[15]。目前临床上关于手术联合放疗的PSC患者的研究很少,我们无法真正评估放疗是否有效。目前PSC患者的辅助或新辅助化疗有效性还存在争议。Maneenil等研究发现接受新辅助和(或)辅助化疗的PSC患者的中位生存期延长,手术加新辅助化疗或辅助化疗是影响生存的预后因素[16]。Lin等报告了33例接受辅助或新辅助化疗的PSC患者,这些患者没有显示出生存优势[17]。在一项87例PSC患者的报道中,接受术后辅助化疗的患者预后并无改善。Chaft等ⅠB~ⅡA期患者围手术期化疗没有显示好的疗效,病理分期为ⅡB~ⅢA的患者接受围手术期化疗后,无病存活率显著提高[18]。目前辅助化疗的作用差异,可能与PSC患者对化疗药物敏感度不同有关。总的来说,本研究发现手术、放疗及化疗都能改善PSC患者的预后,所以对于可切除的PSC患者,我们建议手术联合放化疗。
列线图目前已广泛作为临床肿瘤学的实用工具,在多种类型的癌症中已被证明较传统分期系统有优势[19],通过对重要的预后因素来量化风险,并在此基础上建立了模型,可以通过量化后的得分来计算任何个体患者特定结果的总体可能性[20]。我们通过列线图将影响PSC患者预后的因素进行可视化,同时在建模组和验模组评估列线图模型的预测能力。建模组和验模组C指数分别为0.790(95%CI: 0.776~0.804)和0.781(95%CI: 0.759~0.803),说明预测模型具有中等准确度。建模组和验模组的3年和5年校准曲线都提示预测和实际生存率基本一致,预测模型可靠。由于PSC的罕见性,目前国内尚无关于PSC预后预测模型的构建,临床医生对PSC患者生存率的评估常根据个人经验,主观性较强。通过列线图对影响PSC患者预后的独立因素进行量化打分,将其预后结果可视化,临床医生可参考本研究结果预测PSC患者的生存率。
本研究的优势在于SEER数据库中包括较多的PSC患者,较以往的小型回顾性结果更具可靠性,使临床工作者更好地了解影响PSC患者的预后因素; 此外,通过建立列线图生存预测模型可以一定程度上预测PSC患者的生存率。但本研究也存在一定局限性:(1)回顾性研究会导致选择偏倚; (2)SEER数据库没有提供吸烟史、临床症状、实验室检查、影像学检查甚至基因检测等数据; (3)SEER数据库中未记录患者术后复发情况,化疗信息只收录了是否化疗,放疗信息只有部位、部分技术; (4)由于PSC发病率极低,目前我们尚未对结果进行体外验证。
迄今为止,对于肺肉瘤样癌缺乏大型前瞻性多中心研究,其预后仍有待进一步研究。本列线图可预测PSC患者的生存率,但研究的样本量有限,仍需临床上收集大量样本进一步分析和验证。
作者贡献
刘颖:文献查阅、资料收集、数据统计分析及论文撰写
谢彬、王梦:文献查阅、数据统计分析
李一然、闫文锦:数据校正
徐兴祥、闵凌峰:研究方案制定、审阅及论文修改
| [1] |
Li X, Wu D, Liu H, et al. Pulmonary sarcomatoid carcinoma: progress, treatment and expectations[J]. Ther Adv Med Oncol, 2020, 12: 1758835920950207. |
| [2] |
Sim JK, Chung SM, Choi JH, et al. Clinical and molecular characteristics of pulmonary sarcomatoid carcinoma[J]. Korean J Intern Med, 2018, 33(4): 737-744. DOI:10.3904/kjim.2017.245 |
| [3] |
Franks TJ, Galvin JR. Sarcomatoid carcinoma of the lung: histologic criteria and common lesions in the differential diagnosis[J]. Arch Pathol Lab Med, 2010, 134(1): 49-54. DOI:10.5858/2008-0547-RAR.1 |
| [4] |
毛玉焕, 冀瑛瑛, 商映雪, 等. 79例肺肉瘤样癌的临床特征及预后分析[J]. 肿瘤防治研究, 2018, 45(5): 295-299. [Mao YH, Ji YY, Shang YX, et al. Clinical Features and Prognosis of 79 Cases of Pulmonary Sarcomatoid Carcinoma[J]. Zhong Liu Fang Zhi Yan Jiu, 2018, 45(5): 295-299. DOI:10.3971/j.issn.1000-8578.2018.17.1144] |
| [5] |
Beasley MB, Brambilla E, Travis WD. The 2004 World Health Organization classification of lung tumors[J]. Semin Roentgenol, 2005, 40(2): 90-97. DOI:10.1053/j.ro.2005.01.001 |
| [6] |
Avila MR, Marrón FC, Hermoso AF, et al. Primary pulmonary sarcomatoid carcinomas[J]. Arch Bronconeumol, 2013, 49(9): 405-407. DOI:10.1016/j.arbres.2012.12.002 |
| [7] |
Lantuéjoul S, Brambilla E. Quoi de neuf dans la classification des tumeurs pulmonaires selon l'OMS 2004?[J]. Rev Pneumol Clini, 2008, 64(4): 187-194. DOI:10.1016/j.pneumo.2008.07.006 |
| [8] |
Liang X, Cheng Y, Yuan Z, et al. Clinical, pathological and treatment factors associated with the survival of patients with pulmonary sarcomatoid carcinoma[J]. Oncol Lett, 2020, 19(6): 4031-4039. |
| [9] |
Rahouma M, Kamel M, Narula N, et al. Pulmonary sarcomatoid carcinoma: an analysis of a rare cancer from the Surveillance, Epidemiology, and End Results database[J]. Eur J Cardiothorac Surg, 2018, 53(4): 828-834. DOI:10.1093/ejcts/ezx417 |
| [10] |
Pelosi G, Sonzogni A, De Pas T, et al. Review article: pulmonary sarcomatoid carcinomas: a practical overview[J]. Int J Surg Pathol, 2010, 18(2): 103-120. DOI:10.1177/1066896908330049 |
| [11] |
周秀秀, 王良哲, 望云, 等. 原发性肺肉瘤样癌的影像诊断[J]. 医学影像学杂志, 2020, 30(7): 1311-1314. [Zhou XX, Wang LZ, Wang Y, et al. Imaging diagnosis of pulmonary sarcomatoid carcinoma[J]. Yi Xue Ying Xiang Xue Za Zhi, 2020, 30(7): 1311-1314.] |
| [12] |
Shum E, Stuart M, Borczuk A, et al. Recent advances in the management of pulmonary sarcomatoid carcinoma[J]. Expert Rev Respir Med, 2016, 10(4): 407-416. DOI:10.1586/17476348.2016.1157475 |
| [13] |
Zeng Q, Li J, Sun N, et al. Preoperative systemic immune-inflammation index predicts survival and recurrence in patients with resected primary pulmonary sarcomatoid carcinoma[J]. Transl Lung Cancer Res, 2021, 10(1): 18-31. DOI:10.21037/tlcr-20-960 |
| [14] |
Hou J, Xing L, Yuan Y. A clinical analysis of 114 cases of sarcomatoid carcinoma of the lung[J]. Clin Exp Med, 2018, 18(4): 555-562. DOI:10.1007/s10238-018-0517-2 |
| [15] |
李巧珍, 林炳棋, 张才金. 21例肺肉瘤样癌临床分析和靶向治疗探讨[J]. 临床肺科杂志, 2019, 24(8): 1474-1479. [Li QZ, Lin BQ, Zhang CJ. Molecular targeted therapy and clinical analysis of pulmonary sarcomatoid carcinoma in 21 cases[J]. Lin Chuang Fei Ke Za Zhi, 2019, 24(8): 1474-1479. DOI:10.3969/j.issn.1009-6663.2019.08.029] |
| [16] |
Maneenil K, Xue Z, Liu M, et al. Sarcomatoid Carcinoma of the Lung: The Mayo Clinic Experience in 127 Patients[J]. Clin Lung Cancer, 2018, 19(3): e323-e333. DOI:10.1016/j.cllc.2017.12.008 |
| [17] |
Lin Y, Yang H, Cai Q, et al. Characteristics and Prognostic Analysis of 69 Patients With Pulmonary Sarcomatoid Carcinoma[J]. Am J Clin Oncol, 2016, 39(3): 215-222. DOI:10.1097/COC.0000000000000101 |
| [18] |
Chaft JE, Sima CS, Ginsberg MS, et al. Clinical outcomes with perioperative chemotherapy in sarcomatoid carcinomas of the lung[J]. J Thorac Oncol, 2012, 7(9): 1400-1405. DOI:10.1097/JTO.0b013e3182614856 |
| [19] |
Diao JD, Wu CJ, Cui HX, et al. Nomogram predicting overall survival of rectal squamous cell carcinomas patients based on the SEER database: A population-based STROBE cohort study[J]. Medicine (Baltimore), 2019, 98(46): e17916. DOI:10.1097/MD.0000000000017916 |
| [20] |
Zhang J, Gong Z, Gong Y, et al. Development and validation of nomograms for prediction of overall survival and cancer-specific survival of patients with Stage Ⅳ colorectal cancer[J]. Jpn J Clin Oncol, 2019, 49(5): 438-446. DOI:10.1093/jjco/hyz035 |
 2021, Vol. 48
2021, Vol. 48


