文章信息
- 人工智能辅助诊断系统影像学微特征与磨玻璃结节样肺腺癌预后的关系
- Relation Between Imaging Microfeatures of Artificial Intelligence-assisted Diagnosis System and Prognosis of Lung Adenocarcinomas Presented as Ground-glass Nodules
- 肿瘤防治研究, 2021, 48(9): 877-882
- Cancer Research on Prevention and Treatment, 2021, 48(9): 877-882
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.21.0255
- 收稿日期: 2021-03-09
- 修回日期: 2021-05-13
2. 200433 上海,同济大学附属上海市肺科医院胸外科
2. Department of Thoracic Surgery, Shanghai Pulmonary Hospital, School of Medicine, Tongji University, Shanghai 200433, China
当前肺癌是我国乃至全世界发病与死亡率最高的恶性肿瘤[1]。近年来,随着低剂量螺旋CT筛查的普及,大量的早期肺癌被检测出来,并及时进行了手术干预[2]。其中,影像学特征为磨玻璃结节(ground-glass nodule, GGN)的检出与手术比例逐年上升。GGN为高分辨率计算机断层扫描发现的位于肺部的特异性改变,表现为形态模糊、肺密度增加,但不掩盖支气管及血管的改变,而混合型GGN则又称部分实性GGN(part-solid GGN),指既包含实性成分又包含磨玻璃成分的肺部结节,影像形态中多见边缘毛刺,微乳头病理成分多见,纯实比位于0~1之间[3]。已有研究发现多数GGN可进展为肺腺癌[4-5],因此肺GGN的及时检出对肺癌的预防与早期治疗具有重要的意义。随着人工智能(artificial intelligence, AI)肺结节辅助诊断的问世,GGN的检查率得到进一步提高,AI依托深度学习与记忆可准确提取肺结节中重要影响微特征,包括结节三维重建定位、标准长短径、结节最大与标准密度、标准体积、钙化程度、血管微血管集束等特征[6-8],从而实现辅助临床医师进行临床决策。本研究通过AI辅助诊断系统对GGN的影像学微特征进行提取与分析,探讨其与GGN型肺腺癌预后之间的关系,以进一步对GGN的早期精准诊治提供参考。
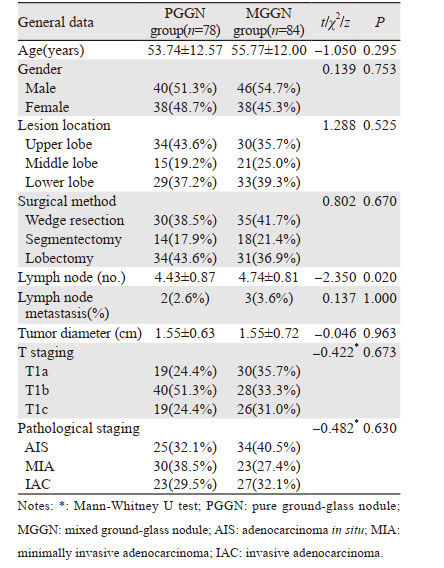
1 资料与方法 1.1 临床资料本研究共纳入2014年1月—2015年6月于兰州大学第一医院手术治疗的GGN型肺腺癌患者162例。其中影像学表现为纯磨玻璃结节(pure ground-glass nodule, PGGN)78例,混合型磨玻璃结节(mixed ground-glass nodule, MGGN)84例。纳入标准:(1)胸部CT及AI诊断系统明确为GGN的患者; (2)均行肺楔形切除、肺段切除或肺叶切除术,且术中或术后病检明确为腺癌; (3)AI辅助诊断系统可以识别的结节。排除标准:(1)临床或影像资料缺乏; (2)术前胸部CT为纯实性结节或不明确; (3)术后病检为鳞癌或其他类型肺癌或良性肿瘤; (4)随访资料缺失。患者的一般资料见表 1。
|
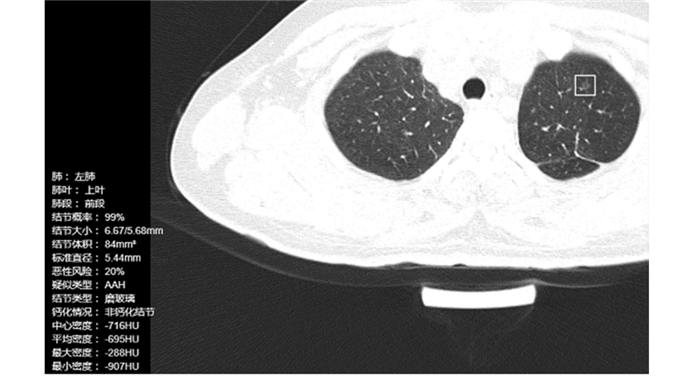
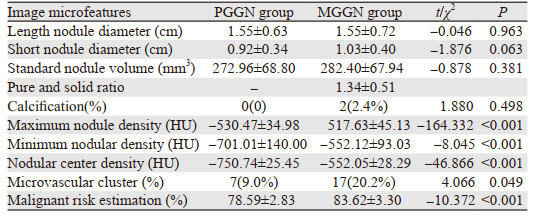
所有患者均完善术前常规检查,包括胸腹部CT、心肺功能、头颅MRI、全身骨扫描或PET-CT,依据患者结节位置、大小、病灶特征、术前穿刺或术中冰冻结果采取不同的手术方式,包括肺楔形切除、肺段切除和肺叶切除。肺楔形切除或肺段切除行淋巴结采样,肺叶切除行系统性淋巴结清扫。患者术后定期随访与复查,复查内容包括胸腹部CT、头颅MRI、全身骨扫描,以判断有无复发及转移,并记录患者生存情况。收集所有患者的胸部CT资料及临床资料,利用ScrynPro-肺小结节智能辅助筛查系统(点内生物科技有限公司)将所有GGN患者的CT数据以DICOM格式的形式导入系统并进行运算,测算出患者肺部GGN的影像微特征,包括结节部位、结节标准体积、结节标准长短径、纯实比、结节钙化情况、结节最大、最小及中心密度、微血管集束等,见图 1。患者影像学微特征见表 2。
|
| 图 1 AI智能诊断系统分析GGN特征 Figure 1 GGN characteristics analyzed by AI diagnostic system |
|
观察指标包括患者基本信息(年龄、性别、肿瘤直径、病灶位置、手术方式、病理类型、T分期、淋巴结采样/清扫个数、淋巴结转移情况)及患者远期生存情况,总生存率(OS)指从患者手术当日至患者死亡或最后一次随访的时间,无复发生存率(RFS)指手术当日直到患者死亡或者疾病转移/复发的时间,并统计AI诊断系统有关GGN的微特征情况。
1.4 统计学方法采用SPSS20.0软件进行统计学分析。符合正态分布的计量资料采用均值±标准差(x±s)表示,组间比较采用t检验,不符合正态分布的计量资料以中位数/四分位间距(MED(P25, P75))表示,组间比较采用Wilcoxon秩和检验,计数资料采用例(百分比)表示,组间比较采用χ2检验,等级资料采用非参数检验,利用GraphPad Prism5.0软件及Log rank法生存曲线分析OS及RFS,采用单因素及多因素Cox回归分析影响患者预后的独立危险因素,P < 0.05为差异有统计学意义。
2 结果 2.1 患者一般资料两组患者在年龄、性别、病灶位置、手术方式、淋巴结转移情况、肿瘤直径、肿瘤T分期及病理分期方面的差异均无统计学意义(均P > 0.05),而在淋巴结清扫/采样个数方面两组的差异有统计学意义(P < 0.05),见表 1。
2.2 人工智能系统提取GGN影像学微特征情况在人工智能提取影像学微特征方面,PGGN组的结节最大、最小及中心密度均低于MGGN组(均P < 0.05),此外,微血管集束征象及结节恶性风险预估值同样低于MGGN组(均P < 0.05),而两组在结节长短径、结节标准体积、结节钙化方面的差异无统计学意义(均P > 0.05),见表 2。
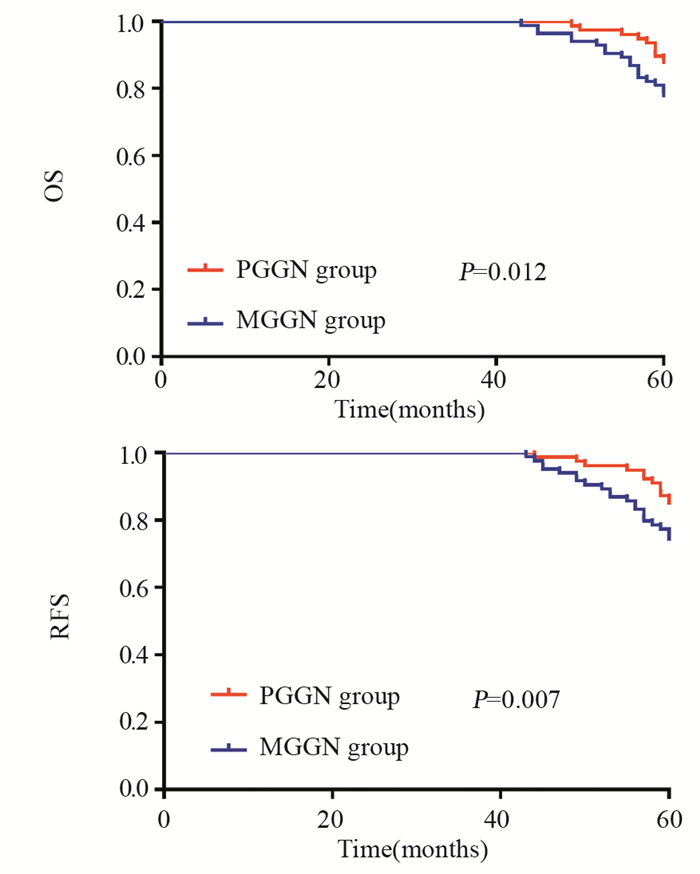
2.3 患者术后生存情况分析两组患者术后中位随访时间为60.5月,无删失患者。PGGN组术后5年OS为89.7%,RFS为88.5%; MGGN组术后5年OS为81.0%,RFS为79.0%。PGGN组术后5年OS及RFS均优于MGGN组,其差异有统计学意义(χ2=6.289/7.255, 均P < 0.05),见图 2; 而总体患者的5年不同病理分期及T分期的生存率差异无统计学意义(均P > 0.05),见图 3A~B、4A~B; 而在不同病理分期及T分期的术后生存率方面,PGGN组术后OS及RFS同样优于MGGN组,见图 3C~D、4C~D。
|
| OS: overall survival; RFS: recurrence-free survival. 图 2 两组肺腺癌患者的OS及RFS Figure 2 OS and RFS of two groups of lung adenocarcinoma patients |
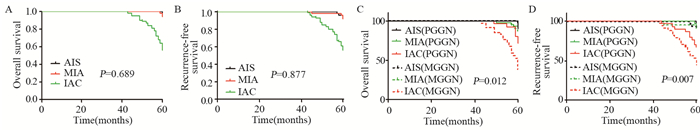
|
| 图 3 两组不同病理分期的肺腺癌患者OS(A, C)及RFS(B, D) Figure 3 OS(A, C) and RFS(B, D) of lung adenocarcinoma patients with different pathological stages |
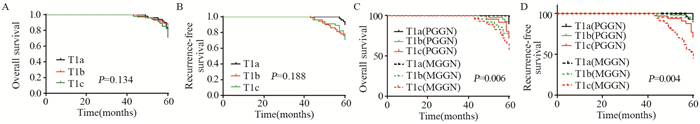
|
| 图 4 两组不同T分期的肺腺癌患者OS(A, C)及RFS(B, D) Figure 4 OS(A, C) and RFS(B, D) of lung adenocarcinoma patients with different T stages |
对患者术后OS及RFS的发生危险因素进行单因素分析,同时将P < 0.1的危险因素纳入多因素分析,结果显示,微血管集束(HR=4.332, 95%CI: 2.548~7.366, P < 0.001)、结节标准体积(HR=1.003, 95%CI: 1.001~1.005, P=0.013)及结节长径(HR=1.404, 95%CI: 1.243~1.670, P < 0.001)为术后OS的相关危险因素; 微血管集束、结节体积、结节长径、淋巴结转移、结节中心密度为RFS的发生危险因素(均P < 0.05),多因素分析显示,微血管集束、结节标准体积、结节长径、结节中心密度、淋巴结转移为患者术后RFS的相关危险因素(P < 0.05),见表 3~4、图 5。
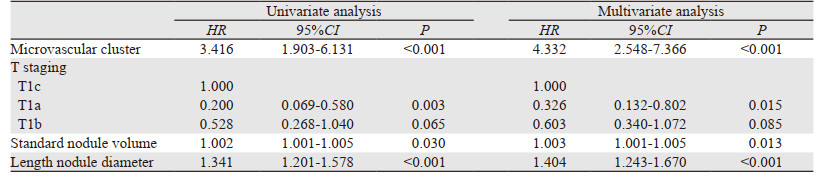
|
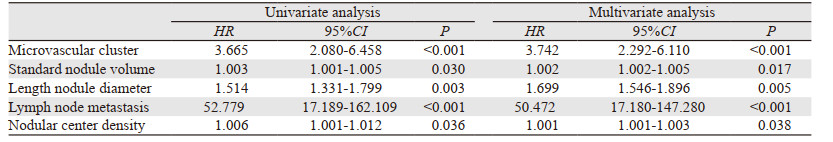
|
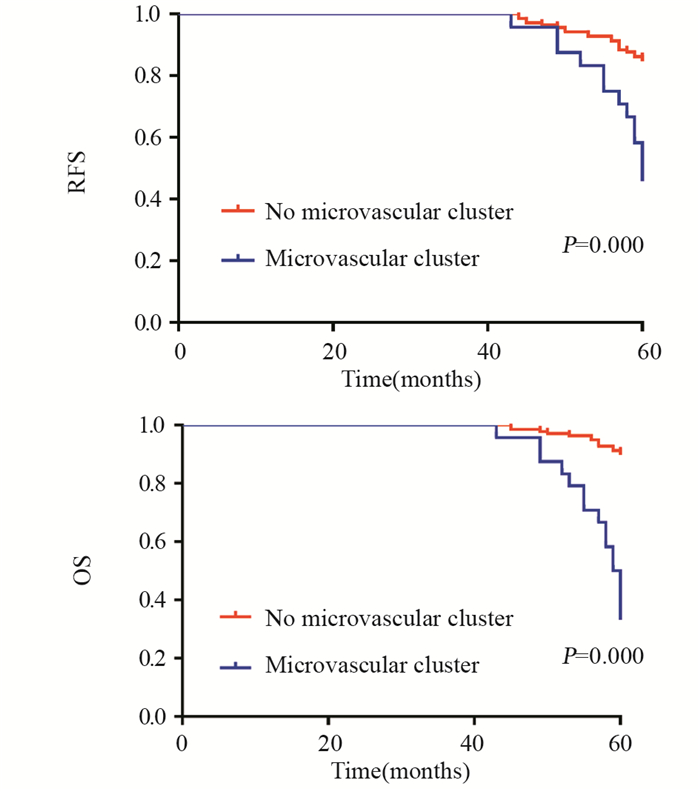
|
| 图 5 微血管集束与GGN肺腺癌患者术后RFS(A)和OS(B)的关系 Figure 5 Relation between microvascular cluster and postoperative RFS(A), OS(B) of GGN lung adenocarcinoma patients |
近年来,随着低剂量螺旋CT的筛查普及,肺部GGN的发病及检出率不断提高,同时有越来越多的临床研究开始关注到GGN的诊治过程。既往有学者发现,对于直径小于5 mm的结节有1%的概率成长为腺癌[3],且肉眼对该类结节的识别及测量能力十分有限,而利用AI系统评估GGN直径的准确性显著高于人工测量[9]。同样已有研究发现基于影像学特征可判断GGN的性质及腺癌的浸润程度[10],这对于指导临床决策具有重要意义。然而,当前AI辅助诊断系统有关GGN预后的相关临床研究尚不多见,GGN的临床诊治同样存在较多争议。
结节的体积与直径一般代表结节的生长状况,既往已有研究发现结节直径是GGN生长的独立危险因素,且结节内实性成分的多少与其预后相关[8-10],而本研究发现,PGGN组的5年OS及RFS均优于MGGN组,且结节的长径为影响患者术后总体生存率的独立危险因素,这与前述研究一致。与结节长径类似,本研究发现结节标准体积同样为影响患者预后的独立危险因素,结节标准体积越大,患者预后则越差,同样与之前学者研究[11]一致。一般认为结节中心密度越低,其内部非实性成分占比越高,Tamura等[12]研究发现易生长结节与惰性结节的平均密度分别为(–634.9±15.3)HU及(-712.0±14.1)HU,而代平等[13]研究发现侵袭性肿瘤其CT阈值为-557 HU,CT的密度均值可以反映其恶性程度,而本研究中PGGN与MGGN结节的中心密度分别为(-750.74±25.45)HU及(-552.05±28.29)HU,且术后病检均为腺癌,与前述成果较为接近。而在单因素及多因素分析中,结节中心密度也同样被证实为影响患者RFS的独立危险因素。
肺结节边缘的组织与形态被认为是识别结节性质的重要指标[8]。其中,恶性GGN边缘的小血管形成在CT表现被称为血管集束征,血管集束目前认为是由于肿瘤生长刺激周围血管而形成的纤维改变,而随着结节恶性程度的增加,血管集束的现象则更加明显[14]。有研究发现恶性GGN结节CT上出现血管集束的概率显著高于良性结节,且浸润性腺癌出现血管集束的概率更大,而肺静脉型血管集束征则有助于鉴别结节良恶性[14]。本研究发现,微血管集束的病例5年OS及RFS均低于无微血管集束的病例,多因素Cox回归显示,微血管集束均为影响患者术后OS及RFS的独立危险因素。PGGN组出现微血管集束征的概率低于MGGN组,这与两组的生存率分析结果一致,从而进一步证明了早期观察到微血管集束在预测肺部结节良恶性及预后中的作用。
本研究显示PGGN组的术后5年OS及RFS均优于MGGN组,但低于既往同类研究的结果[15-16]。影响肺癌患者预后的原因很多,目前已经被证实的有肿瘤分期、淋巴结转移、手术方式、肿瘤实性成分及病理分期等,而在本研究中也同样发现淋巴结转移为患者术后RFS的独立危险因素。Mao等[17]研究发现,对于表现为GGN的浸润性腺癌,T1期的5年OS为86.7%,RFS为77.1%,而肿瘤直径在1~2 cm及2~3 cm的5年OS则分别为80.0%及69.2%,本研究纳入的患者均经病理证实为腺癌,而浸润性腺癌的患者在PGGN及MGGN组分别占29.5%及32.1%,且肿瘤直径 > 1 cm的患者在PGGN及MGGN组分别占75.7%及64.3%,这可能影响到整体患者的术后生存率; 此外,另一项研究[18]表明,对于肿瘤直径 > 1 cm且术中冰冻诊断为不典型增生、原位腺癌及微浸润腺癌的患者,约有13.6%(272/2006)的患者术后最终病理分期较术中冰冻出现升级,且肿瘤直径 > 1 cm为其独立的危险因素,这增加了患者的复发及死亡率,本研究中肿瘤直径 > 1 cm的患者约占70%(113/162),且均为2014—2015年手术的患者,同期有关GGN的研究尚不够深入,术中冰冻及术后病检结果可靠性较目前亦不够明确,因此可能存在部分患者术后病理升级或切除范围不够,从而同样影响到患者整体生存率,该研究结果仍需得到广泛验证。
本研究发现,AI分析系统所提取到的肿瘤长径、肿瘤标准体积、微血管浸润、结节中心密度等因素均与GGN腺癌预后相关,其研究结果对于GGN临床诊疗及预后的评估具有一定指导意义,也进一步体现了人工智能领域应用于肺部结节诊治中的可行性。此外,AI智能分析系统能通过深度学习自主提取影像学特征,形成特定模型,从而判断结节恶性概率[19],本研究中同样得到体现,本研究发现在结节恶性风险预估中,MGGN组平均恶性风险高于PGGN组,且差异有统计学意义,该结果与两组术后生存率的差异一致。
本研究同样有一些不足之处。首先,本研究是一项单中心回顾性研究,且纳入的病例较少,病理中包括原位癌、微浸润癌与浸润癌,病理类型较多,手术方式也不够规范、统一,有可能影响到患者预后及研究结果的可靠性。其次,仅针对早期且影像学表现为GGN的腺癌,对于实性结节及中晚期腺癌,AI辅助诊断对于该类结节影像诊断结果的临床意义未做进一步探索,对于GGN患者的长期预后也未做进一步观察与随访,因此研究结果的准确性还有待进一步检验。另外,本研究的患者随访信息多数通过电话等远程方式,对患者具体死亡原因、具体死亡时间等信息可能存在描述或随访偏倚,影响生存结果的可靠性。因此,尚需大规模、多中心的随机对照研究进一步验证。
综上,通过分析AI辅助诊断系统GGN影像学微特征与患者预后的关系,发现MGGN型腺癌预后相比PGGN型腺癌更差,且结节长径、结节标准体积、微血管浸润、结节中心密度等影像学微特征为影响GGN型腺癌患者预后的独立危险因素。因此,初步认为,AI辅助诊断系统的影像学微特征可有效预测GGN型肺腺癌的预后,并对GGN的临床精准诊疗及早期肺癌防治有一定的参考价值,同样初步证实了人工智能领域应用于肺癌诊治的可行性前景。
作者贡献
魏宁:实验设计、数据收集及论文撰写
蔺瑞江:数据收集及校对
马敏杰:论文审查及复核
陈昶、韩彪:论文审核、修改
| [1] |
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2019[J]. CA Cancer J Clin, 2019, 69(1): 7-34. DOI:10.3322/caac.21551 |
| [2] |
张正华, 蔡雅倩, 韩丹, 等. 基于深度学习的肺结节筛检和定性诊断分析[J]. 肿瘤防治研究, 2020, 47(4): 283-287. [Zhang ZH, Cai YQ, Han D, et al. Pulmonary nodule screening and qualitative diagnosis based on deep learning[J]. Zhong Liu Fang Zhi Yan Jiu, 2020, 47(4): 283-287. DOI:10.3971/j.issn.1000-8578.2020.19.1107] |
| [3] |
范子文, 谢冬, 姜格宁, 等. 肺磨玻璃结节自然生长史研究进展[J]. 中国胸心血管外科临床杂志, 2019, 26(2): 175-179. [Fan ZY, Xie D, Jiang GN, et al. Research progress on natural growth history of ground glass pulmonary nodules[J]. Zhongguo Xiong Xin Xue Guan Wai Ke Lin Chuang Za Zhi, 2019, 26(2): 175-179.] |
| [4] |
Shi Z, Deng J, She Y, et al. Quantitative features can predict further growth of persistent pure ground-glass nodule[J]. Quant Imaging Med Surg, 2019, 9(2): 283-291. DOI:10.21037/qims.2019.01.04 |
| [5] |
赵蒙蒙, 汪洋, 邓家骏, 等. 人工智能卷积神经网络在全视野数字切片图像分析中的应用进展[J]. 中国胸心血管外科临床杂志, 2019, 26(11): 1063-1068. [Zhao MM, Wang Y, Deng JJ, et al. Advances in the application of artificial intelligence convolutional neural network in full-field digital slice image analysis[J]. Zhongguo Xiong Xin Xue Guan Wai Ke Lin Chuang Za Zhi, 2019, 26(12): 1161-1166.] |
| [6] |
中国医药教育协会胸外科专业委员会, 中国胸外科肺癌联盟, 浙江省医学会胸外科学分会, 等. 人工智能平台下肺结节的三维可视化定位与手术规划专家共识[J]. 中国胸心血管外科临床杂志, 2019, 26(12): 1161-1166. [Thoracic Surgery Professional Committee of China Medical Education Association, China Lung Cancer Union, Thoracic Surgery Branch of Zhejiang Medical Association, et al. Expert consensus on three-dimensional visualization localization and surgical planning of pulmonary nodules under artificial intelligence platform[J]. Zhongguo Xiong Xin Xue Guan Wai Ke Lin Chuang Za Zhi, 2019, 26(12): 1161-1166.] |
| [7] |
She Y, Jin Z, Wu J, et al. Development and Validation of a Deep Learning Model for Non-Small Cell Lung Cancer Survival[J]. JAMA Netw Open, 2020, 3(6): e205842. DOI:10.1001/jamanetworkopen.2020.5842 |
| [8] |
虞梁, 王俊, 李洪, 等. 肺磨玻璃结节CT影像征象鉴别诊断肺浸润性腺癌与微浸润腺癌[J]. 南京医科大学学报(自然科学版), 2020, 40(2): 248-251. [Yu L, Wang J, Li H, et al. Differential diagnosis of lung infiltrating adenocarcinoma and microinfiltrating adenocarcinoma with CT findings of lung ground glass nodules[J]. Nanjing Yi Ke Da Xue Xue Bao(Zi Ran Ke Xue Ban), 2020, 40(2): 248-251.] |
| [9] |
李宁, 苏乐廷, 傅昱, 等. CT定量分析预测肺纯磨玻璃结节侵袭性的价值[J]. 华北理工大学学报(医学版), 2021, 23(1): 59-62. [Li N, Su LT, Fu Y, et al. The value of CT quantitative analysis in predicting invasion of pure ground glass pulmonary nodules[J]. Hua Bei Li Gong Da Xue Xue Bao(Yi Xue Ban), 2021, 23(1): 59-62.] |
| [10] |
张正华, 周小君, 韩丹, 等. 基于AI对磨玻璃密度早期肺癌浸润相关因素Logistic回归分析[J]. 临床放射学杂志, 2020, 39(10): 2120-2123. [Zhang ZH, Zhou XJ, Han D, et al. Logistic regression analysis of factors related to early lung cancer infiltration in ground glass density based on AI[J]. Lin Chuang Fang She Xue Za Zhi, 2020, 39(10): 2120-2123.] |
| [11] |
闵旭红, 宋奇隆, 余永强, 等. 三维CT定量联合定性参数的logistic回归模型对纯磨玻璃结节侵袭程度的临床预测价值[J]. 中华放射学杂志, 2021, 55(1): 34-39. [Min XH, Song QL, Yu YQ, et al. Clinical predictive value of three-dimensional CT combined with logistic regression model of qualitative parameters for the invasion degree of pure ground glass nodules[J]. Zhonghua Fang She Xue Za Zhi, 2021, 55(1): 34-39. DOI:10.3760/cma.j.cn112149-20200318-00416] |
| [12] |
Tamura M, Shimizu Y, Yamamoto T, et al. Predictive value of onedimensional mean computed tomography value of ground-glass opacity on high-resolution images for the possibility of future change[J]. J Thorac Oncol, 2014, 9(4): 469-472. DOI:10.1097/JTO.0000000000000117 |
| [13] |
代平, 何其舟, 王思凯, 等. CT定量分析预测肺部肿瘤性磨玻璃结节病理侵袭性的价值[J]. 放射学实践, 2019, 34(10): 1108-1112. [Dai P, He QZ, Wang SK, et al. The value of CT quantitative analysis in predicting the pathologic invasivity of pulmonary neoplastic ground glass nodules[J]. Fang She Xue Shi Jian, 2019, 34(10): 1108-1112.] |
| [14] |
曹琪琪, 杨文洁, 严福华, 等. 血管集束征在肺磨玻璃结节定性诊断中的价值研究[J]. 诊断学理论与实践, 2018, 17(5): 521-525. [Cao QQ, Yang WJ, Yan FH, et al. The value of vascular cluster sign in the qualitative diagnosis of ground glass pulmonary nodules[J]. Zhen Duan Xue Li Lun Yu Shi Jian, 2018, 17(5): 521-525.] |
| [15] |
Chen D, Dai C, Kadeer X, et al. New horizons in surgical treatment of ground-glass nodules of the lung: experience and controversies[J]. Ther Clin Risk Manag, 2018, 14: 203-211. DOI:10.2147/TCRM.S152127 |
| [16] |
Ren Y, Huang S, Dai C, et al. Germline Predisposition and Copy Number Alteration in Pre-stage Lung Adenocarcinomas Presenting as Ground-Glass Nodules[J]. Front Oncol, 2019, 9: 288. DOI:10.3389/fonc.2019.00288 |
| [17] |
Mao R, She YL, Zhu EJ, et al. A Proposal for Restaging of Invasive Lung Adenocarcinoma Manifesting as Pure Ground Glass Nodule[J]. Ann Thorac Surg, 2019, 107(5): 1523-1531. DOI:10.1016/j.athoracsur.2018.11.039 |
| [18] |
Su H, Gu C, She YL, et al. Predictors of upstage and treatment strategies for stage IA lung cancers after sublobar resection for adenocarcinoma in situ and minimally invasive adenocarcinoma[J]. Transl Lung Cancer Res, 2021, 10(1): 32-44. DOI:10.21037/tlcr-20-828 |
| [19] |
Bi WL, Hosny A, Schabath MB, et al. Artificial intelligence in cancer imaging: Clinical challenges and applications[J]. CA Cancer J Clin, 2019, 69(2): 127-157. |
 2021, Vol. 48
2021, Vol. 48


