文章信息
- 基于TCGA数据库分析FOXO1在肝癌中的表达及预后意义
- Expression of FOXO1 in Liver Cancer and Its Prognostic Significance: An Analysis Based on TCGA
- 肿瘤防治研究, 2021, 48(8): 774-781
- Cancer Research on Prevention and Treatment, 2021, 48(8): 774-781
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.21.0221
- 收稿日期: 2021-02-26
- 修回日期: 2021-06-18
2. 650032 昆明,昆明医科大学第一附属医院放疗科;
3. 650032 昆明,云南省第一人民医院病理科
2. Department of Radiation Oncology, The First Affiliated Hospital of Kunming Medical University, Kunming 650032, China;
3. Department of Pathology, The First People's Hospital of Yunnan Province, Kunming 650032, China
肝癌是常见的恶性肿瘤之一,死亡率达8.3%,位于全球癌症死因第三位[1]。从1990年到2017,肝癌在我国前25位死因中排第五位[2]。手术、放化疗及靶向治疗是主要治疗手段,但其死亡率和复发率仍然很高[3]。肝癌的发生涉及基因异常表达并且存在肿瘤细胞异质性[4-6],从基因水平探讨肝癌的发生发展机制及其与预后的相关性,有利于发现新的分子诊断和治疗靶点。
FOXO1(叉头框转录因子O1),也称FKHR,在细胞增殖和癌症生物学中起着重要作用[7]。FOXO1基因异常表达与多种肿瘤发生有关[8],如过表达与横纹肌肉瘤[9]、乳腺癌[10]及卵巢癌[11]等有关,低表达与结肠癌[12]和前列腺癌[13]有关。目前多数研究是关于FOXO1与肝癌(hepatocellular carcinoma, HCC)的机制和预后关系的小样本研究,而关于FOXO1与肝胆管癌(hepatocholangiocarcinoma, HCC-CC)及肝纤维板层癌(fibrolamellar carcinoma, FL-Ca)的发生发展机制及预后关系的研究未见报道。因此,本研究采用TCGA数据库结合HPA数据库从大样本层面分析FOXO1在三种主要病理类型的肝癌中的转录水平、蛋白质表达情况及与预后的关系。
1 资料与方法 1.1 临床资料获取从TCGA数据库(https://portal.gdc.cancer.gov/)获得407例肝癌和58例癌旁组织的mRNA表达水平及患者临床信息。肝癌患者相关临床信息包括年龄、性别、生存时间、死亡状态、病理组织类型、肿瘤分级及TNM分期。
1.2 分析TCGA数据库中FOXO1在肝癌和癌旁组织中的表达差异采用非参秩检验(Wilcox Test)和R软件(4.0.2版)Beeswarm包分析从TCGA数据库中获得的FOXO1 mRNA在肝癌和癌旁组织中的表达差异。P < 0.05为差异有统计学意义。
1.3 临床相关性分析采用R包ggpubr分析FOXO1基因与肝癌的临床病理特征的相关性。
1.4 分析TCGA数据库中FOXO1表达与肝癌患者预后关系根据病理组织类型,从TCGA数据库中获取到3类肝癌,分别为HCC、FL-Ca及HCC-CC。按FOXO1 mRNA表达水平的中位数将所有肝癌病例分为高、低表达组,R包survival和survminer利用Kaplan-Meier曲线进行生存分析。首先,分析FOXO1基因表达与所有肝癌病例预后的关系,得到截尾数据为OS的Kaplan-Meier生存曲线。进一步按病理组织类型进行3个亚组(HCC、FL-Ca和HCC-CC)的生存分析,Log rank检验进行不同组间生存率的比较。P < 0.05为差异有统计学意义。
1.5 与生存相关的独立预后分析分别采用单因素和多因素Cox分析,评估FOXO1基因、患者年龄、肿瘤组织学类型、性别、肿瘤分级和TNM分期与患者预后的关系,结果以森林图显示。
1.6 FOXO1与肝癌肿瘤微环境中肿瘤浸润免疫细胞(tumor-infiltrating immune cells, TIICs)的关系通过CIBERSORT分析工具(https://cibersort.stanford.edu/)分析TIICs在肝癌FOXO1高表达组和低表达组的表达差异,以小提琴图显示,并分析TIICs与FOXO1表达水平的相关性。
1.7 KEGG信号通路富集分析下载C2.cp.kegg.v7.1.symbols.gmt数据,利用GSEA软件(4.1.0版)对FOXO1基因在肝癌中的潜在功能进行KEGG信号通路富集分析,寻找显著富集在FOXO1高表达组和低表达组的相关通路。设置过滤条件为错误发现率 < 0.25且P < 0.05。
1.8 FOXO1在人类不同正常组织及不同肿瘤组织中的蛋白表达差异从HPA数据库(www.proteinatlas.org)分别获取FOXO1基因在人类不同正常组织和不同癌组织中的表达差异。
1.9 统计学方法肝癌和癌旁组织之间FOXO1基因表达差异采用非参秩检验(Wilcox Test)。FOXO1基因表达与肝癌患者预后的关系采用Kaplan-Meier曲线表示,组间生存率比较采用Log rank检验,检验水准α=0.05,P < 0.05为差异有统计学意义。
2 结果 2.1 TCGA数据库中FOXO1在肝癌组织和癌旁组织中的表达差异及临床相关性分析TCGA数据库中,与癌旁组织相比较,FOXO1在肝癌组织中低表达,差异有统计学意义(P=1.321E-15)。
FOXO1表达与患者年龄、性别、肿瘤组织学类型、肿瘤分级和TNM分期等临床特征无明显相关性,见图 1。
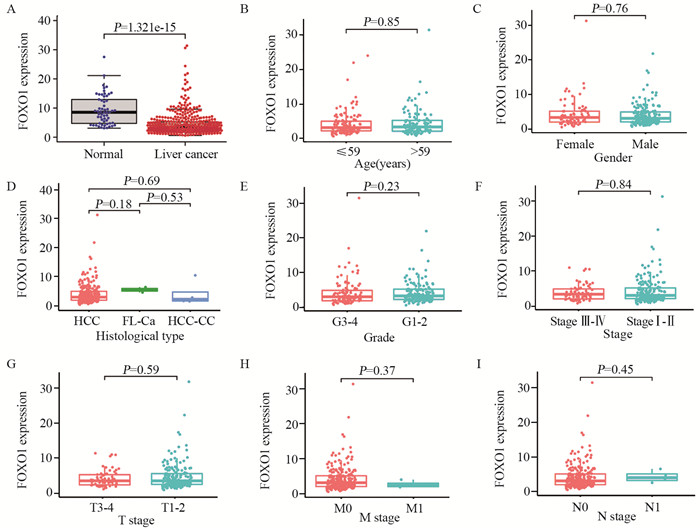
|
| 图 1 FOXO1在肝癌和癌旁组织中的表达差异(A)及与临床病理特征(B~I)的关系 Figure 1 Difference of FOXO1 expression between tumor and adjacent tissues(A) and its correlation with clinical features(B-I) |
与FOXO1低表达组相比,高表达组肝癌患者的总生存时间显著延长(P=0.014)。进一步亚组分析发现,FOXO1表达水平对肝细胞肝癌患者预后有显著影响(P=0.019),而在肝纤维板层癌(P=0.713)及肝胆管癌(P=0.811)中,其表达水平对预后无显著影响,见图 2A~D。
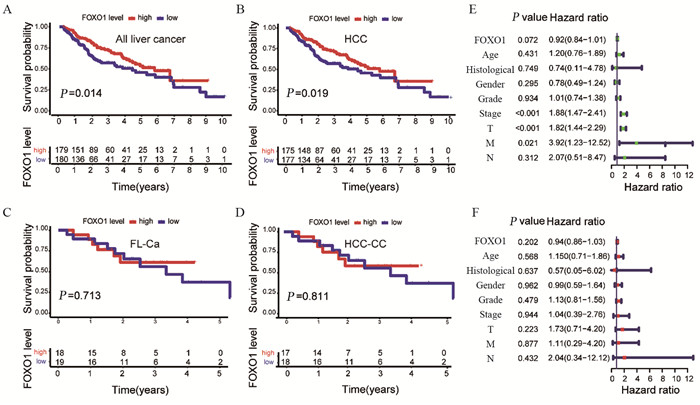
|
| A-D: the correlation between FOXO1 expression and the prognosis of all liver cancer, HCC, FL-Ca, and HCC-CC patients; E: the prognostic factors of liver cancer via univariate analysis; F: the prognostic factors of liver cancer via multivariate analysis. 图 2 FOXO1与肝癌患者预后的关系及肝癌预后因子 Figure 2 Correlation between FOXO1 and survival of liver cancer patients and prognostic factors of liver cancer |
单因素Cox分析显示临床分期、T、M分期可作为预后分析指标,见图 2E;多因素Cox分析显示FOXO1不能作为肝癌独立预后影响因子,见图 2F。
2.4 FOXO1与肝癌TME中TIICs的关系与肝癌FOXO1低表达组相比,在肝癌FOXO1高表达组中:幼稚B细胞(P=0.005)密度增加,巨噬细胞M2密度降低(P=0.026),见图 3A。肝癌TME中有4种肿瘤浸润免疫细胞与FOXO1表达水平有关:幼稚B细胞(P < 0.001)和静息CD4记忆性T细胞(P=0.030)与其正相关;巨噬细胞M2型(P=0.018)和活化的CD4记忆性T细胞(P=0.028)与其负相关,见图 3B~E。

|
| 图 3 肝癌FOXO1高和低表达组肿瘤浸润免疫表达差异(A)及其与FOXO1表达的相关性(B-E) Figure 3 Distribution of TIICs in liver cancer patients with high and low FOXO1 expression(A) and relation between TIICs and FOXO1 expression(B-E) |
分析了18条最显著富集在FOXO1高表达组及8条最显著富集在FOXO1低表达组的KEGG信号通路,见表 1;发现10条肿瘤相关信号通路,见图 4,数条与信号转导、细胞周期及内分泌系统相关的KEGG信号通路显著富集在FOXO1高表达组。
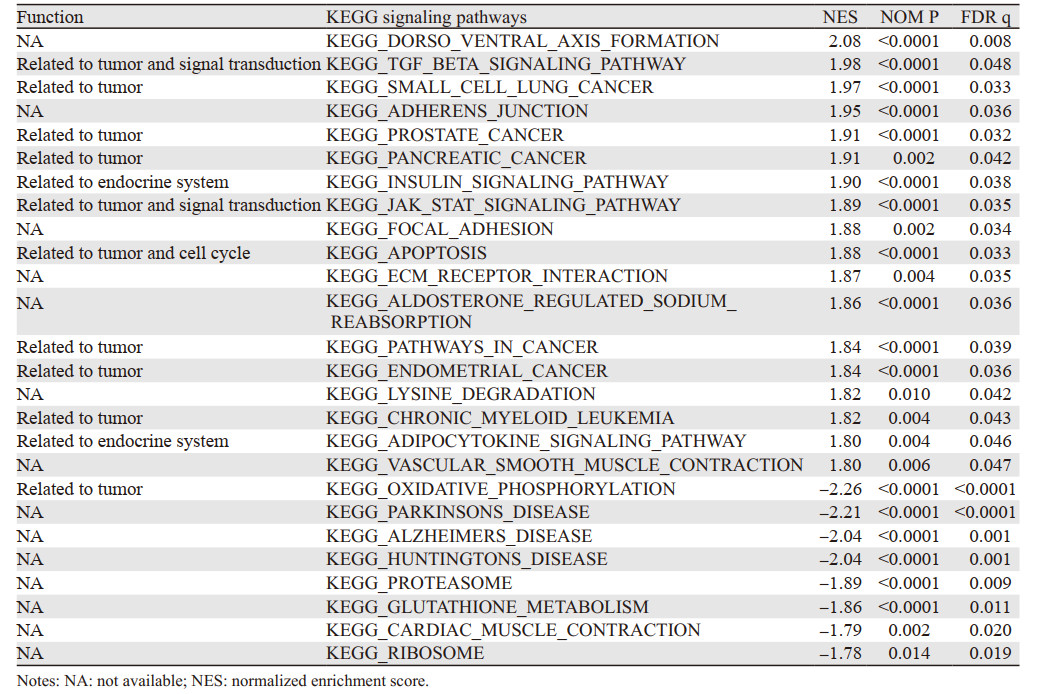
|
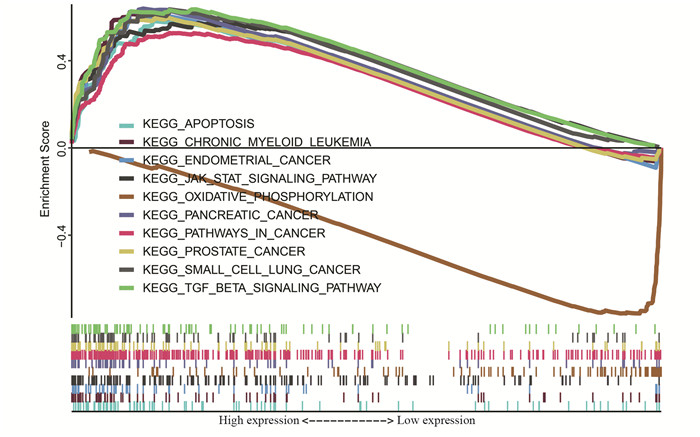
|
| 图 4 10条肿瘤相关KEGG通路富集图 Figure 4 Enrichment plots of 10 tumor-related KEGG pathways |
从HPA数据库获取FOXO1基因在人体不同的正常组织和不同肿瘤组织中的蛋白水平表达差异,见图 5。FOXO1蛋白在肝脏等多数组织中低表达,在约60%的肝癌患者中可检测到其表达。
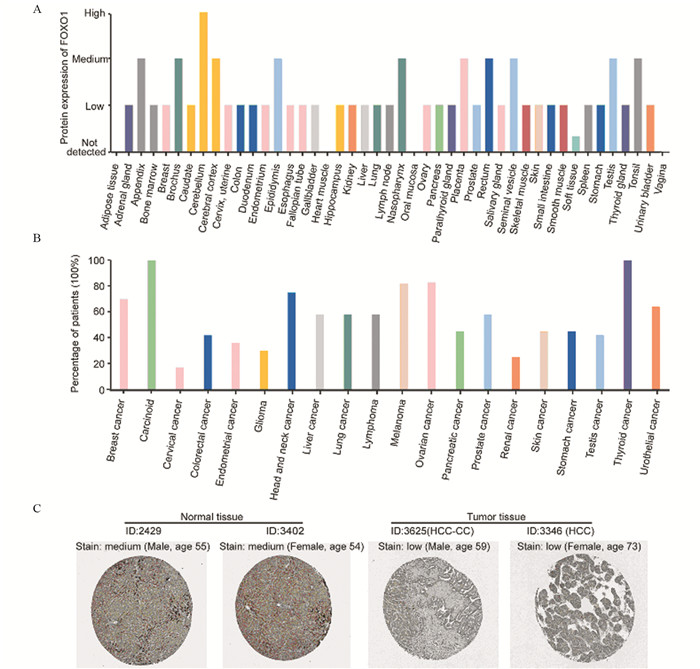
|
| A: different protein expressions of FOXO1 in human normal tissues; The blank bar referred the protein expression level of FOXO1 was low or cannot be detected; B: percentage of patients with positive expression of FOXO1 in different cancer types; C: immunohistochemistry images of FOXO1 in normal tissues, HCC-CC and HCC detected in the HPA database, respectively. 图 5 FOXO1在人体正常组织及肿瘤组织中的蛋白表达水平 Figure 5 Protein expression of FOXO1 in normal and cancer tissues |
肝癌近十多年来呈现出年轻化趋势[14],手术和系统性化疗仍是目前主要的治疗手段。尽管作为里程碑式的靶向治疗药物索拉菲尼极大地改善了晚期肝细胞肝癌患者的预后,但是仅约25%的肿瘤含有驱动基因[15],高死亡率和复发率是亟待解决的问题[3]。肝癌基因异常表达和肿瘤细胞的异质性提示,寻找相关的重要基因不仅利于肝癌的早期诊断和预后判断,而且有望发现新的治疗靶点,加深对其发生发展机制的认识。
FOXO1编码的蛋白质是重要的细胞增殖[16]和细胞死亡的调控因子,在细胞凋亡、转移、代谢和癌症生物学中也起着重要作用[7],且促进肝细胞糖异生[17],尤其是在长期进食或饥饿及氧化应激时靶向胰岛素信号通路以维持内环境平衡。研究[8]表明FOXO1表达上调抑制HCC进展;其表达下调促进HCC发生和进展,导致不良预后。此外,Chi等[18]发现FOXO1介导促凋亡蛋白Bim的表达导致HCC化疗耐药及远处转移。Calvisi等[19]发现FOXO1泛素化可促进HCC进展,且FOXO1表达高的HCC患者预后更好。Jiang等[20]发现抑癌基因PTEN(phosphate and tensin homology)促进FOXO1核转位,PTEN-蛋白酶体轴是治疗PTEN缺陷型胆管癌的潜在靶点。Frampton等[21]发现原颗粒蛋白PGRN在胆管癌中过表达,导致FOXO1在胆管细胞内积聚,刺激小鼠胆管癌细胞增殖。肝癌具有高度异质性及不同的病理组织类型,发生发展机制复杂。
我们基于TCGA数据库挖掘FOXO1基因在肝癌中的表达情况,发现FOXO1在肝癌组织中低表达。按FOXO1 mRNA表达水平将肝癌病例分为高、低表达组后,生存分析显示:高表达FOXO1的肝癌患者总生存率高于低表达者。按肝癌病理组织类型进行亚组分析显示,高表达FOXO1的HCC患者预后更好,与已有研究结果一致[8, 19]。FOXO1的表达与肝纤维板层癌及肝胆管癌预后无关。多因素Cox分析显示FOXO1不能作为独立预后指标。我们采用HPA数据库评估FOXO1基因在人体不同正常组织及不同肿瘤组织中的蛋白表达差异,60%的肝癌患者中(包括肝细胞肝癌、肝纤维板层癌及肝胆管癌)可检测到FOXO1蛋白低到中等程度表达。
FOXO1蛋白对调节细胞因子和趋化因子的分泌至关重要[22]。随着免疫治疗的应用,一系列研究正在揭示FOXO1在肿瘤微环境中的功能。Wang等[22]发现在食管鳞癌TME中,巨噬细胞M2浸润的FOXO1依赖性机制,即FOXO1上调并通过转录调控趋化因子配体20和集落刺激因子-1,促进TME中巨噬细胞M0向巨噬细胞M2极化并募集巨噬细胞M2,导致ESCC患者预后较差;且发现FOXO1(+)肿瘤诱导的M2巨噬细胞通过FAK-PI3K-AKT途径促进肿瘤增殖,PI3K抑制剂能有效地抑制肿瘤的进展。Zheng等[23]对肝癌患者的肿瘤、癌旁及外周血进行单细胞测序,发现T细胞与肝癌免疫有关。Zhang等[24]证实肿瘤微环境中高密度肿瘤浸润幼稚B细胞肝癌患者预后更好,且幼稚B细胞可作为其独立预后因子。有研究表明肿瘤浸润淋巴细胞及其分级是黑色素瘤患者生存期和前哨淋巴结状态的独立预测因子,且肿瘤浸润淋巴细胞密度高的患者预后更好[25]。为探索FOXO1相关的肝癌病理进展机制,本研究基于TCGA数据库从免疫细胞与肝癌微环境的关系,利用CIBERSORT进行22种TIICs在肝癌TME的表达差异分析及TIICs与FOXO1表达水平相关性分析,发现幼稚B细胞在肝癌FOXO1高表达组中浸润密度增加,且其与FOXO1表达水平成正相关关系;巨噬细胞M2在肝癌FOXO1高表达组中浸润密度降低,且其与FOXO1表达水平成负相关关系。结合本研究的生存分析结果:在预后更好的FOXO1高表达组中,FOXO1表达水平越高,幼稚B细胞浸润密度越大而巨噬细胞M2浸润密度越低,分别与Zhang[24]及Wang[22]等研究结果一致。因此,我们推测高表达FOXO1的肝癌患者预后更好的可能原因:一方面FOXO1促进肿瘤微环境中幼稚B细胞浸润调节免疫;另一方面FOXO1抑制巨噬细胞M2浸润从而抑制血管生成和肿瘤侵袭。此外,我们发现在肝癌肿瘤微环境中,静息CD4记忆性T细胞也与FOXO1表达水平成正相关关系;活化的CD4记忆性T细胞与其呈负相关。在肝癌高和低FOXO1表达组中,具有免疫调控作用的调节性T细胞无表达差异,且与FOXO1表达水平无相关性。Rohr-Udilova等[26]发现与正常肝组织比较,肝细胞肝癌中幼稚B细胞及静息CD4记忆性T细胞增加,但并未进一步研究其与预后的关系。静息CD4 T细胞是HIV-1感染的重要早期靶标,Trinité等[27]推测HIV-1抑制FOXO1活性可能促进静息CD4 T细胞复制。该研究证实静息CD4 T细胞与FOXO1相关。Cafri等[28]的研究表明在上皮源性癌症患者外周血中可检测到靶向KRASG12D突变的CD4记忆性T细胞。上述研究虽未明确揭示CD4 T细胞在肿瘤发展机制中的作用,但提示CD4 T细胞确实跟FOXO1活性有关,CD4记忆性T细胞存在于肿瘤微环境中。为了进一步探索FOXO1与肝癌微环境的关系,本研究分析了18条最显著富集在FOXO1高表达组及8条最显著富集在FOXO1低表达组的KEGG信号通路,发现10条肿瘤相关通路,但未发现重要的免疫相关通路。
综上所述,本研究通过TCGA数据库,挖掘肝癌组织中FOXO1mRNA表达水平的信息,发现FOXO1基因在肝癌中低表达,且与肝癌总体生存期有关。FOXO1高表达的肝癌患者较低表达者总体生存期延长,进一步就肝癌组织病理类型进行亚组分析发现,与FOXO1基因低表达组相比,FOXO1高表达的肝细胞肝癌的总生存期延长。本研究为深入研究肝癌的发生发展机制、诊断标志物及治疗靶点提供了理论依据。本研究存在一定的缺陷和局限性在于单纯地利用TCGA数据库,未来需要进一步的体内外实验证明FOXO1在肝癌发生发展中的具体作用机制。
作者贡献:
杨廷芳:选题、方法学及初稿撰写
王丽:论文修改及基金支持
张勇:论文审阅及基金支持
| [1] |
Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
Zhou M, Wang H, Zeng X, et al. Mortality, morbidity, and risk factors in China and its provinces, 1990-2017: a systematic analysis for the Global Burden of Disease Study 2017[J]. Lancet, 2019, 394(10204): 1145-1158. DOI:10.1016/S0140-6736(19)30427-1 |
| [3] |
Llovet JM, Montal R, Villanueva A. Randomized trials and endpoints in advanced HCC: Role of PFS as a surrogate of survival[J]. J Hepatol, 2019, 70(6): 1262-1277. DOI:10.1016/j.jhep.2019.01.028 |
| [4] |
Khemlina G, Ikeda S, Kurzrock R. The biology of hepatocellular carcinoma: implications for genomic and immune therapies[J]. Mol Cancer, 2017, 16(1): 149. DOI:10.1186/s12943-017-0712-x |
| [5] |
Sia D, Villanueva A, Friedman SL, et al. Liver Cancer Cell of Origin, Molecular Class, and Effects on Patient Prognosis[J]. Gastroenterology, 2017, 152(4): 745-761. DOI:10.1053/j.gastro.2016.11.048 |
| [6] |
Qiu Z, Li H, Zhang Z, et al. A Pharmacogenomic Landscape in Human Liver Cancers[J]. Cancer Cell, 2019, 36(2): 179-193. DOI:10.1016/j.ccell.2019.07.001 |
| [7] |
Kim CG, Lee H, Gupta N, et al. Role of Forkhead Box Class O proteins in cancer progression and metastasis[J]. Semin Cancer Biol, 2018, 50: 142-151. DOI:10.1016/j.semcancer.2017.07.007 |
| [8] |
Shi F, Li T, Liu Z, et al. FOXO1: Another avenue for treating digestive malignancy?[J]. Semin Cancer Biol, 2018, 50: 124-131. DOI:10.1016/j.semcancer.2017.09.009 |
| [9] |
Gryder BE, Yohe ME, Chou HC, et al. PAX3-FOXO1 Establishes Myogenic Super Enhancers and Confers BET Bromodomain Vulnerability[J]. Cancer Discov, 2017, 7(8): 884-899. DOI:10.1158/2159-8290.CD-16-1297 |
| [10] |
Yu JM, Sun W, Wang ZH, et al. TRIB3 supports breast cancer stemness by suppressing FOXO1 degradation and enhancing SOX2 transcription[J]. Nat Commun, 2019, 10(1): 5720. DOI:10.1038/s41467-019-13700-6 |
| [11] |
Han GH, Chay DB, Nam S, et al. Prognostic implications of forkhead box protein O1 (FOXO1) and paired box 3 (PAX3) in epithelial ovarian cancer[J]. BMC Cancer, 2019, 19(1): 1202. DOI:10.1186/s12885-019-6406-6 |
| [12] |
Chae YC, Kim JY, Park JW, et al. FOXO1 degradation via G9a-mediated methylation promotes cell proliferation in colon cancer[J]. Nucleic Acids Res, 2019, 47(4): 1692-1705. DOI:10.1093/nar/gky1230 |
| [13] |
Zhang H, Pan Y, Zheng L, et al. FOXO1 inhibits Runx2 transcriptional activity and prostate cancer cell migration and invasion[J]. Cancer Res, 2011, 71(9): 3257-3267. DOI:10.1158/0008-5472.CAN-10-2603 |
| [14] |
汤庆. 原发性肝癌发病年轻化的原因分析[J]. 世界最新医学信息文摘, 2015, 15(53): 95. [Tang Q. Analysis of the causes of the younger trend incidence of primary liver cancer[J]. Shijie Zui Xin Yi Xue Xin Xi Wen Zhai, 2015, 15(53): 95. DOI:10.3969/j.issn.1671-3141.2015.53.079] |
| [15] |
Llovet JM, Montal R, Sia D, et al. Molecular therapies and precision medicine for hepatocellular carcinoma[J]. Nat Rev Clin Oncol, 2018, 15(10): 599-616. DOI:10.1038/s41571-018-0073-4 |
| [16] |
Alharbi MA, Zhang C, Lu C, et al. FOXO1 Deletion Reverses the Effect of Diabetic-Induced Impaired Fracture Healing[J]. Diabetes, 2018, 67(12): 2682-2694. DOI:10.2337/db18-0340 |
| [17] |
Puigserver P, Rhee J, Donovan J, et al. Insulin-regulated hepatic gluconeogenesis through FOXO1-PGC-1alpha interaction[J]. Nature, 2003, 423(6939): 550-555. DOI:10.1038/nature01667 |
| [18] |
Chi HC, Chen SL, Cheng YH, et al. Chemotherapy resistance and metastasis-promoting effects of thyroid hormone in hepatocarcinoma cells are mediated by suppression of FOXO1 and Bim pathway[J]. Cell Death Dis, 2016, 7(8): e2324. DOI:10.1038/cddis.2016.227 |
| [19] |
Calvisi DF, Ladu S, Pinna F, et al. SKP2 and CKS1 promote degradation of cell cycle regulators and are associated with hepatocellular carcinoma prognosis[J]. Gastroenterology, 2009, 137(5): 1816-1826. DOI:10.1053/j.gastro.2009.08.005 |
| [20] |
Jiang TY, Pan YF, Wan ZH, et al. PTEN status determines chemosensitivity to proteasome inhibition in cholangiocarcinoma[J]. Sci Transl Med, 2020, 12(562): eaay0152. DOI:10.1126/scitranslmed.aay0152 |
| [21] |
Frampton G, Ueno Y, Quinn M, et al. The novel growth factor, progranulin, stimulates mouse cholangiocyte proliferation via sirtuin-1-mediated inactivation of FOXO1[J]. Am J Physiol Gastrointest Liver Physiol, 2012, 303(11): G1202-G1211. DOI:10.1152/ajpgi.00104.2012 |
| [22] |
Wang Y, Lyu Z, Qin Y, et al. FOXO1 promotes tumor progression by increased M2 macrophage infiltration in esophageal squamous cell carcinoma[J]. Theranostics, 2020, 10(25): 11535-11548. DOI:10.7150/thno.45261 |
| [23] |
Zheng CH, Zheng, L T, Yoo JK, et al. Landscape of Infiltrating T Cells in Liver Cancer Revealed by Single-Cell Sequencing[J]. Cell, 2017, 169(7): 1342-1356. DOI:10.1016/j.cell.2017.05.035 |
| [24] |
Zhang Z, Ma L, Goswami S, et al. Landscape of infiltrating B cells and their clinical significance in human hepatocellular carcinoma[J]. Oncoimmunology, 2019, 8(4): e1571388. DOI:10.1080/2162402X.2019.1571388 |
| [25] |
Azimi F, Scolyer RA, Rumcheva P, et al. Tumor-infiltrating lymphocyte grade is an independent predictor of sentinel lymph node status and survival in patients with cutaneous melanoma[J]. J Clin Oncol, 2012, 30(21): 2678-2683. DOI:10.1200/JCO.2011.37.8539 |
| [26] |
Rohr-Udilova N, Klinglmüller F, Schulte-Hermann R, et al. Deviations of the immune cell landscape between healthy liver and hepatocellular carcinoma[J]. Sci Rep, 2018, 8(1): 6220. DOI:10.1038/s41598-018-24437-5 |
| [27] |
Trinité B, Chan CN, Lee CS, et al. Suppression of Foxo1 activity and down-modulation of CD62L (L-selectin) in HIV-1 infected resting CD4 T cells[J]. PLoS One, 2014, 9(10): e110719. DOI:10.1371/journal.pone.0110719 |
| [28] |
Cafri G, Yossef R, Pasetto A, et al. Memory T cells targeting oncogenic mutations detected in peripheral blood of epithelial cancer patients[J]. Nat Commun, 2019, 10(1): 449. DOI:10.1038/s41467-019-08304-z |
 2021, Vol. 48
2021, Vol. 48


