文章信息
- 尼妥珠单抗联合多西他赛和顺铂一线治疗复发或转移性头颈部鳞癌疗效观察
- Clinical Observation of Nimotuzumab Combined with Docetaxel and Cisplatin in First-line Treatment of Recurrent or Metastatic Head and Neck Squamous Cell Carcinoma
- 肿瘤防治研究, 2021, 48(6): 631-634
- Cancer Research on Prevention and Treatment, 2021, 48(6): 631-634
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.21.0184
- 收稿日期: 2021-02-20
- 修回日期: 2021-03-15
头颈部恶性肿瘤是全球第六大恶性肿瘤[1],90%以上的病理类型为鳞状细胞癌。大多数头颈部鳞状细胞癌(head and neck squamous cell carcinoma, HNSCC)发现时已处于局部晚期,尽管接受了标准的治疗,但还是会出现复发或转移[2-3]。对于复发或转移性的HNSCC,铂类联合5-氟尿嘧啶(5-Fu)或联合紫杉醇类药物是常用的一线化疗方案,但效果仍不理想[4],中位总生存期不足1年[5]。90%以上的HNSCC存在表皮生长因子受体(epidermal growth factor receptor, EGFR)的高表达,与不良预后相关,包括生存率下降、放疗抵抗、局部治疗失败和转移潜能增加[6]。尼妥珠单抗是一种抗EGFR的人源化单克隆抗体,可以阻止EGFR的活化,同时特异性高,不良反应低[7]。目前已经有很多研究证实尼妥珠单抗联合放化疗在治疗局部晚期HNSCC中取得了很好的疗效[8-10],但是针对复发转移的HNSCC的临床研究相对较少。本研究主要探讨尼妥珠单抗联合多西他赛和顺铂一线治疗复发或转移性HNSCC的疗效和安全性。
1 资料与方法 1.1 研究对象回顾性分析从2017年1月到2020年1月于中国医科大学附属盛京医院就诊的58例复发或转移性头颈部鳞癌患者,纳入标准:(1)病理结果确诊为头颈部鳞癌;(2)复发或转移性头颈部鳞癌,具有可测量病灶,不适合行局部治疗,发现复发转移后未经系统治疗;(3)年龄18岁以上;(4)KPS评分≥70分;排除标准:(1)既往接受过抗EGFR药物治疗;(2)未控的脑转移;(3)严重心肺功能障碍;(4)严重肝肾功能或骨髓造血功能异常。按照是否采用尼妥珠单抗分为观察组和对照组。其中观察组男20例、女8例;平均年龄(53.2±3.4)岁;原发部位:口腔13例、口咽8例、喉2例、下咽5例;局部复发18例、远处转移10例。对照组男21例、女9例;平均年龄(56.5±4.8)岁;原发部位:口腔16例、口咽6例、喉1例、下咽7例;局部复发19例、远处转移11例。两组患者一般资料差异无统计学意义(P > 0.05),具有可比性。
1.2 治疗方法 1.2.1 对照组化疗采用多西他赛+顺铂(DP)方案:多西他赛(20毫克/支,齐鲁制药有限公司) 75 mg/m2,d1,顺铂(10毫克/支,齐鲁制药有限公司)75 mg/m2分成3天给药,每3周一次,静脉滴注。
1.2.2 观察组在DP方案化疗基础上联合应用尼妥珠单抗(50毫克/支,百泰生物药业有限公司):尼妥珠单抗200 mg,d1、8、15,每3周一次,静脉滴注。
1.3 观察指标及疗效判定标准 1.3.1 疗效评价治疗期间每2周期复查一次,治疗结束后2年内每3月复查一次,2年以上每半年复查一次。参照RECIST1.1标准评价疗效,分为完全缓解(complete remission, CR)、部分缓解(partial remission, PR)、稳定(stabilization of disease, SD)以及进展(progressive disease, PD)。客观有效率(objective response rate, ORR)为CR+PR的比例,疾病控制率(disease control rate, DCR)为CR+PR+SD的比例。统计患者无进展生存期(progression-free survival, PFS)和总生存期(overall survival, OS)评价远期疗效。
1.3.2 随访采用门诊、电话形式随访,随访截止时间为2020年6月30日,无失访病例。
1.3.3 不良反应评价依据美国国家癌症研究所常见不良反应评价标准CTCAE4.0评价不良反应。
1.4 统计学方法采用SPSS23.0软件对数据进行分析。计量资料比较采用t检验,计数资料比较采用χ2检验,生存分析采用Kaplan-Meier法并行Log rank检验。P < 0.05为差异有统计学意义。
2 结果 2.1 近期疗效评价观察组ORR及DCR均高于对照组,差异有统计学意义(P < 0.05),见表 1。
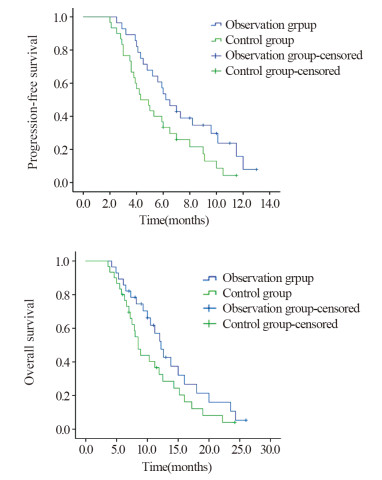
观察组和对照组中位PFS分别为6.2月和4.3月,差异有统计学意义(p=0.040),观察组和对照组中位OS分别为12.2月和8.5月,差异无统计学意义(p=0.114),见图 1。截止随访时间,观察组22例发生进展,其中局部病灶复发13例,新发远处转移9例;对照组27例发生进展,其中局部病灶复发16例,新发远处转移11例;无因不良反应中断治疗而导致疾病进展的病例。在治疗失败的患者中,二线治疗方案的选择上,观察组患者主要选择以吉西他滨为主的化疗及PD-1免疫治疗;对照组患者主要选择以吉西他滨为主的化疗、西妥昔单抗靶向治疗及PD-1免疫治疗。
|
| 图 1 两组患者PFS和OS曲线 Figure 1 PFS and OS curves of patients in observation and control groups |
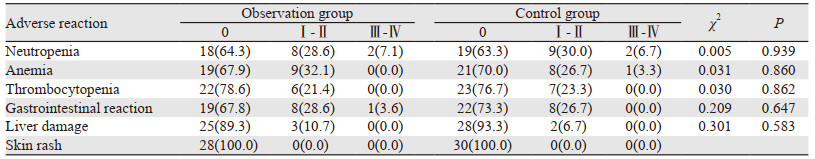
两组常见的不良反应主要为与化疗药物相关的骨髓抑制和胃肠道反应等,多为Ⅰ~Ⅱ级,Ⅲ级以上的不良反应发生率低,无皮疹病例。两组不良反应发生率差异无统计学意义(P > 0.05),见表 2。
|
复发或转移性的HNSCC患者预后不良,解救手术或再程放疗的可能有限,化疗仍是大部分患者的治疗手段,但效果仍不理想[4]。随着生物技术的发展,肿瘤的基因靶点引起人们的关注。表皮生长因子受体是由胞外结构域、跨膜区域及胞内结构域组成的跨膜受体[11],细胞外结构域与受体特异性配体结合,导致胞质中酪氨酸激酶磷酸化,激活下游通路,进而促进肿瘤的增殖、分化、侵袭和迁移[12]。EGFR在头颈部鳞癌中高表达,同时也是头颈部鳞癌重要的预后因素和治疗靶点[6]。西妥昔单抗是一种人鼠嵌合型抗EGFR单克隆抗体,已被美国食品和药物管理局(FDA)批准用于治疗头颈部鳞癌[13],研究证实其联合化疗一线治疗复发或转移性头颈部鳞癌能提高患者无进展生存期及总生存期[14-15]。但由于其严重的皮肤毒性、输液反应和胃肠道不良事件,安全性受到质疑[14, 16]。尼妥珠单抗是一种人源化抗EGFR单抗,可以特异性结合到EGFR的细胞外结构域,从而阻断受体依赖的信号转导通路,发挥抗肿瘤作用。尼妥珠单抗与其他抗EGFR抗体不同,具有独特的低毒性特性,需要双价结合以稳定附着,可以选择性结合过度表达EGFR的肿瘤细胞。当EGFR表达较低时,如在正常组织中,尼妥珠单抗的单价相互作用是短暂的,因此不影响正常组织,并避免了严重的毒性[17]。因此,尼妥珠单抗作为标准治疗的补充可能是复发转移性HNSCC的一种有效的选择。在本研究中,与单纯化疗相比,尼妥珠单抗与多西他赛和顺铂化疗联合应用能提高ORR、DCR以及PFS,尽管在OS上差异无统计学意义,但有延长的趋势,且患者耐受性良好,治疗期间观察到的常见不良反应主要为骨髓抑制、胃肠道反应等,未观察到典型的抗EGFR相关毒性,如严重皮疹、输液反应,因此尼妥珠单抗联合化疗安全有效,不增加治疗的毒性。
综上所述,尼妥珠单抗联合多西他赛和顺铂作为一线方案治疗复发或转移性头颈部鳞癌,不仅能够提高近期临床疗效及无进展生存期,而且不会增加患者的不良反应,可作为复发或转移性HNSCC患者新的治疗选择。但本研究样本量较小且为回顾性研究,后续需要前瞻性大样本量的研究进一步观察临床效果。
作者贡献:
朱秋霞:病例筛选和随访、数据整理、论文撰写
张振勇:把握研究方向、论文指导及修改
| [1] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
Jacob LA, Chaudhuri T, Lakshmaiah KC, et al. Current status of systemic therapy for recurrent and/or metastatic squamous cell carcinoma of the head and neck[J]. Indian J Cancer, 2016, 53(4): 471-477. DOI:10.4103/0019-509X.204786 |
| [3] |
Tuljapurkar V, Dhar H, Mishra A, et al. The Indian scenario of head and neck oncology-Challenging the dogmas[J]. South Asian J Cancer, 2016, 5(3): 105-110. DOI:10.4103/2278-330X.187573 |
| [4] |
Colevas AD, Yom SS, Pfister DG, et al. NCCN Guidelines Insights: Head and Neck Cancers, Version 1.2018[J]. J Natl Compr Canc Netw, 2018, 16(5): 479-490. DOI:10.6004/jnccn.2018.0026 |
| [5] |
Alsahafi E, Begg K, Amelio I, et al. Clinical update on head and neck cancer: molecular biology and ongoing challenges[J]. Cell Death Dis, 2019, 10(8): 540. |
| [6] |
Kimi BJ, Jeong JH, Kim HS, et al. The role of anti-EGFR agents in patients with locoregionally advanced head and neck cancer: a meta-analysis of randomized trials[J]. Oncotarget, 2017, 8(60): 102371-102380. DOI:10.18632/oncotarget.21987 |
| [7] |
Berger MD, Lenz HJ. The safety of monoclonal antibodies for treatment of colorectal cancer[J]. Expert Opin Drug Saf, 2016, 15(6): 799-780. DOI:10.1517/14740338.2016.1167186 |
| [8] |
Patil VM, Noronha V, Joshi A, et al. A randomized phase 3 trial comparing nimotuzumab plus cisplatin chemoradiotherapy versus cisplatin chemoradiotherapy alone in locally advanced head and neck cancer[J]. Cancer, 2019, 125(18): 3184-3197. DOI:10.1002/cncr.32179 |
| [9] |
Noronha V, Patil VM, Joshi A, et al. Nimotuzumab-cisplatin-radiation versus cisplatin-radiation in HPV negative oropharyngeal cancer[J]. Oncotarget, 2020, 11(4): 399-408. DOI:10.18632/oncotarget.27443 |
| [10] |
Thai Hoa NT, Huy HQ. Combined Nimotuzumab with Chemoradiotherapy for Locally Advanced Head and Neck Squamous Cell Carcinoma[J]. Cureus, 2020, 12(5): e8105. |
| [11] |
Wang Z. ErbB receptors and cancer[J]. Methods Mol Biol, 2017, 1652: 3-35. |
| [12] |
Xu MJ, Jonhson DE, Grandis JR. EGFR-targeted therapies in the post-genomic era[J]. Cancer Metastasis Rev, 2017, 36(3): 463-473. DOI:10.1007/s10555-017-9687-8 |
| [13] |
Vermorken JB, Specenier P. Optimal treatment for recurrent/ metastatic head and neck cancer[J]. Ann Oncol, 2010, 21(Suppl 7): vii252-vii261. |
| [14] |
Concu R, Cordeiro MNDS. Cetuximab and the Head and Neck Squamous Cell Cancer[J]. Curr Top Med Chem, 2018, 18(3): 192-198. DOI:10.2174/1568026618666180112162412 |
| [15] |
Guigay J, Fayette J, Dillies AF, et al. Cetuximab, docetaxel, and cisplatin as first-line treatment in patients with recurrent or metastatic head and neck squamous cell carcinoma: a multicenter, phase Ⅱ GORTEC study[J]. Ann Oncol, 2015, 26(9): 1941-1947. |
| [16] |
Guan M, Zhou YP, Sun JL, et al. Adverse events of monoclonal antibodies used for cancer therapy[J]. Biomed Res Int, 2015, 2015: 428169. |
| [17] |
Garrido G, Tikhomirov IA, Rabasa A, et al. Bivalent binding by intermediate affinity of nimotuzumab: A contribution to explain antibody clinical profile[J]. Cancer Biol Ther, 2011, 11(4): 373-382. |
 2021, Vol. 48
2021, Vol. 48



