文章信息
- Ⅱ~Ⅳa期鼻咽癌根治性放化疗—2021年CSCO/ASCO国际循证指南解读
- An Interpretation of CSCO/ASCO International Guideline of Chemotherapy in Combination with Radiotherapy for Definitive-intent Treatment of Stage Ⅱ-Ⅳa Nasopharyngeal Carcinoma in 2021
- 肿瘤防治研究, 2021, 48(5): 553-562
- Cancer Research on Prevention and Treatment, 2021, 48(5): 553-562
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.21.0163
- 收稿日期: 2021-02-10
- 修回日期: 2021-03-09
鼻咽癌(hasopharyngeal carcinoma, NPC)是一种生物学特性较为独特的头颈部恶性肿瘤,全球发病率极不均衡。尽管在很多地区十分罕见,但鼻咽癌在东亚及东南亚仍是一个重大的公共卫生问题,2018年全球约有129 000例新诊断鼻咽癌病例,其中流行区域的病例占70%以上[1]。在鼻咽癌流行地区,非角化型病理亚型占比超过95%,且该亚型与EB病毒(EBV)高度相关。对于大多数鼻咽癌病例,特别是Ⅱ~Ⅳa(T1N1-3M0、T2-4NxM0)期患者,放化综合治疗是其根治性治疗手段。精确的放疗靶区勾画、计划和实施以及放疗和化疗的有机结合对于实现该患者群体的最佳疗效至关重要。
现有鼻咽癌临床指南指明了各分期的鼻咽癌诊疗原则,但对于放化疗如何具体实施大多阐述较为笼统,为详细说明Ⅱ~Ⅳa期鼻咽癌治疗中突出且重要的临床问题,中美临床肿瘤学会(CSCO、ASCO)基于已经发表的文献和专家小组共识,共同提出了相应治疗方案,形成国际循证指南性文献[2],近日发表于医学杂志《Journal of Clinical Oncology》。本文就该项鼻咽癌国际循证指南进行初步解读,以便国内临床机构根据各自临床实践,尽量统一放化疗实施方案,使局部晚期鼻咽癌患者获得最为合理的治疗。
1 Ⅱ~Ⅳa期鼻咽癌国际循证指南制定基础及拟解决的临床问题中美临床肿瘤学会(CSCO、ASCO)召集了放射肿瘤学、肿瘤内科学和外科学专家以及代表成立了专家组。文献检索1990—2020年间发表的系统综述、荟萃分析和随机对照临床试验。纳入研究的终点包括生存率、远处和局部疾病控制以及生活质量。经过质量评估及入排筛查,最终纳入为指南提供依据的108项相关研究,包括42篇系统综述和66项随机对照研究。指南引用的临床研究多使用美国癌症联合委员会(AJCC)第6版或第7版分期系统,而本指南建议涉及的分期均基于第8版AJCC分期系统。
该指南共讨论了五个重要的临床问题:(1)Ⅱ~Ⅳa期鼻咽癌推荐的放疗技术和分割方案;(2)Ⅱ~Ⅳa期鼻咽癌在放疗中加入化疗的推荐时机;(3)同步放化疗推荐的化疗方案;(4)诱导化疗推荐的化疗方案;(5)辅助化疗推荐的化疗方案,见图 1。
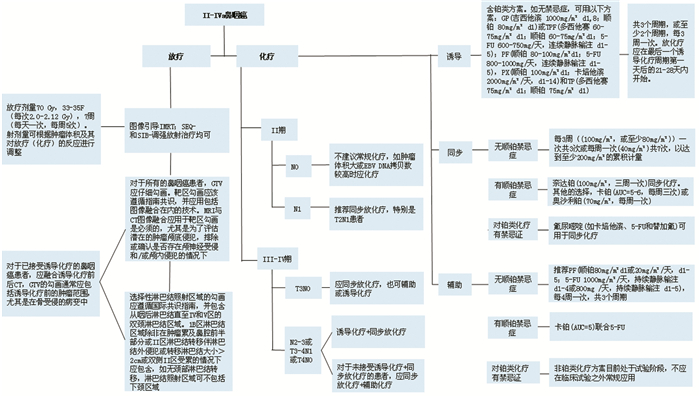
|
| 图 1 Ⅱ~Ⅳa期鼻咽癌治疗方案 Figure 1 Treatment of stage Ⅱ-Ⅳa nasopharyngeal carcinoma |
对于所有Ⅱ~Ⅳa期鼻咽癌患者,应给予调强放疗(IMRT)和每日图像引导。如果无条件应用IMRT,则应将患者尽可能转诊到能够实施IMRT的机构(推荐类型:基于循证;利大于弊;证据质量:高;推荐力度:强)。
2.1.2对于所有Ⅱ~Ⅳa期鼻咽癌患者,应进行序贯增量放疗或同步增量(SIB)放疗(推荐类型:基于循证;利大于弊;证据质量:中等;推荐强度:中等)。
与传统的二维(2D)或三维(3D)放射治疗相比,IMRT能使射线剂量呈不规则形状分布,从而在保护邻近重要结构的同时,安全地提高了肿瘤照射剂量。在3个随机对照研究和多个荟萃分析中证实了IMRT可降低有关治疗毒性,如神经毒性、口干、牙关紧闭症和吞咽困难等[3-5]。一项随机对照研究[3]和多个荟萃分析也表明IMRT可提高鼻咽癌患者的疾病控制和生存率[6-8]。在高度精确的放射治疗过程中应实施日常图像引导,以最大限度地减少每次放疗之间的误差。每日图像引导还可以为计划靶区(PTV)进行自定义的边界调整并监测放疗过程中的几何和剂量学变化。调强放射治疗可采用序贯增量或同步增量(SIB)技术。
2.1.3对于所有Ⅱ~Ⅳa期鼻咽癌患者,建议处方剂量及方案为:70 Gy,33~35 F(每次2.0~2.12 Gy),共7周(每天一次,每周5次)。放射剂量可根据肿瘤体积及对放化疗的反应进行调整(推荐类型:基于循证;利大于弊;证据质量:高;推荐强度:强)。
目前鼻咽癌患者的预后已有明显改善,但患者常常承受着严重的不良反应。放疗的分割剂量是不良反应的主要决定因素之一。INT 0099[9]和RTOG 0225[10]研究中使用了2.0~2.12 Gy的分割剂量,每周5次,总处方剂量为70 Gy/33~35次,显示出良好的疗效和可接受的不良反应。在放疗结束时磁共振发现肿瘤残留的患者预后较差,对于这部分患者可考虑在治疗结束时补充照射2~4 Gy/1~2次。对于治疗反应非常敏感的小原发灶,可考虑稍微降低总剂量(如66~68 Gy)。考虑到大分割放疗不良反应大且疗效尚不明确,应避免更大的分割剂量(尤其在与化疗联合使用时)。香港NPC-9902[5]和NPC-0501[11]研究未能显示出每周6次的中等加速分割放疗相比传统分割放疗具有临床获益。每日两次分割的超分割放疗,保持总放疗时长不变的同时增加了总剂量,由于临床试验结果相互矛盾,未显示出确切的临床价值。
2.1.4对所有Ⅱ~Ⅳa期鼻咽癌患者,GTV应仔细勾画。靶区勾画应该遵循指南共识,并应用包括图像融合在内的技术。MRI与CT图像融合应用于靶区勾画是必须的,尤其是为了评估潜在的肿瘤颅底侵犯、排除或确认是否存在颅神经受侵和(或)颅内侵犯的情况下(推荐类型:非正式共识;利大于弊;证据质量:中等;推荐力度:强)。
MRI可提高对颅底受侵、神经受侵、骨髓浸润、副鼻窦、眼眶以及咽后淋巴结侵犯的检出率,而CT可提高对颈部肿瘤和骨皮质受侵的检出率。专家小组建议遵循国际对于鼻咽癌靶区、危及器官勾画及IMRT计划的共识,这些指南和共识强调了MRI和CT图像融合在勾画肿瘤靶区中的重要性,并提供了临床靶区(CTV)勾画、剂量优先顺序及IMRT计划的可接受标准。鼓励肿瘤放疗医师与放射科医生共同审阅CT或MRI明确疾病的侵犯范围,并在条件允许的情况下共同判断肿瘤对诱导化疗的反应,尤其是当病变范围难以确定时。
2.1.5对于接受诱导化疗的Ⅱ~Ⅳa期鼻咽癌患者,诱导化疗前应行CT定位,并与诱导化疗后CT定位扫描图像融合,以显示病变治疗前的侵犯范围。GTV的勾画通常应包括诱导化疗前的肿瘤范围,尤其是在骨受侵的病变中(推荐类型:非正式共识;利大于弊;证据质量:中等;推荐强度:中等)。
国际共识指南建议,无论对诱导化疗的反应如何,在不超过关键危及器官的最大耐受剂量的同时,治疗剂量应覆盖诱导化疗前的全部肿瘤范围。这一点在颅底病变中尤其重要,因为在骨解剖结构中很难充分明确疾病的侵犯范围,骨受侵治疗失败后缺乏有效的挽救措施,且诱导化疗后骨受侵退缩的程度也难以确定。一项Ⅲ期随机对照研究[12]纳入了212例局部晚期鼻咽癌患者,研究通过磁共振确定诱导化疗前后的肿瘤体积,A组患者根据诱导前肿瘤范围确定肿瘤靶区并且剂量达到70 Gy,B组患者诱导后残余的肿瘤范围达到70 Gy,而诱导化疗前已退缩的肿瘤范围(颅底病变除外)需达到64 Gy,结果显示,两组患者的疾病控制和生存率无差异,4级晚期毒性发生率也相似,但B组患者(即诱导化疗前已退缩范围只接受较低剂量)有更好的口干评分和认知功能,研究提示,诱导化疗后肿瘤已退缩的部分如果能够至少被中等强度剂量完全覆盖的情况下,按诱导化疗后肿瘤范围仔细剪裁确定肿瘤靶区是可行的。
2.1.6选择性淋巴结照射区域的勾画应遵循国际共识指南,并包含从咽后淋巴结直至Ⅳ和Ⅴ区的双颈淋巴结区域。Ⅰb区淋巴结区域的照射条件包括:肿瘤累及鼻腔前半部分;Ⅱ区淋巴结转移伴淋巴结包膜外侵犯;Ⅱ区转移淋巴结大小 > 2 cm;双侧Ⅱ区受累。如无颈部淋巴结转移,淋巴结照射区域可不包括下颈区域(推荐类型:非正式共识;利大于弊;证据质量:中等;推荐强度:中等)。
鼻咽癌具有在鼻咽黏膜内高度浸润性的特征。临床靶区CTV的勾画应遵循国际共识的指导方针,并注意到任何可能的侵犯路径。为了降低治疗毒性,临床研究和回顾性队列研究对既往选择性淋巴结照射区域进行优化,如避免Ib区淋巴结区域或同侧淋巴结未受累时的下颈区域的照射。两项回顾性研究[13-14]表明,除了在Ⅱa区淋巴结大于2 cm和(或)淋巴结包膜外侵犯、N2患者或肿瘤侵犯可通过淋巴首站引流至Ⅰb区的部位等情况下,避免Ⅰb区淋巴结区域照射的调强放射治疗是安全可行的。一项荟萃分析[15]、一项针对N0患者的小型随机对照研究[16]和几项回顾性研究中[17-19],证实了在同侧未受累的情况下避免下颈区域照射的安全性。
2.2 Ⅱ~Ⅳa期鼻咽癌患者,在放疗中加入化疗的推荐时机 2.2.1T2N0鼻咽癌患者不建议常规联合化疗,但如果存在不良临床特征,如肿瘤体积较大或EBV DNA拷贝数较高的情况下则可联合化疗(推荐类型:基于循证;弊大于利;证据质量:中等;建议强度:中等)。
2.2.2T1-2N1鼻咽癌患者推荐同步放化疗,尤其是T2N1患者(推荐类型:基于循证;利大于弊;证据质量:中等;推荐强度:中等)。
在传统2D-RT时代,一项随机[20]研究表明对于Ⅱ期鼻咽癌,同步放化疗相较于单纯放疗患者5年OS和PFS的显著改善。与单纯放疗相比,同步化疗局部控制无明显改善但减少了远处转移率。然而,值得注意的是,该研究使用了中国1992年的分期系统,如果根据第7版国际抗癌联盟/美国癌症联合委员会(UICC/AJCC)TNM分类标准,13%的患者将被重新分类为N2/Ⅲ期。该研究的10年结果与之前的报告一致,但提示同步放化疗所带来的生存益处主要体现在T2N1患者中。目前IMRT已成为一种常规的选择,鉴于IMRT时代尚缺乏随机研究数据,同步化疗在Ⅱ期鼻咽癌中的作用并不确切。一些荟萃分析[21-23](主要包括回顾性研究)表明,与同步放化疗相比,应用IMRT单独放疗Ⅱ期鼻咽癌可获得同等的治疗效果。最近一项包含84例Ⅱ期鼻咽癌患者的Ⅱ期随机研究[24]结果显示,在平均75月的随访中,他们观察到患者在5年OS(94% vs. 100%;P=0.25)和PFS(87% vs. 90%; P=0.72)中,同步放化疗组并不优于单纯IMRT。考虑到Ⅱ期患者包括三个亚组(T2N0和T1~2N1),N1患者有更高的远处转移风险,正在进行的大规模随机对照研究(NCT02633202)试图评估调强放射治疗联合同步化疗,有望阐明该亚组患者的更佳治疗选择。结合血浆EBV-DNA等其他预测因子,可以对Ⅱ期鼻咽癌患者进行风险分层,并对高危亚群使用优化的联合化疗。
2.2.3Ⅲ~Ⅳa期(T3N0除外)鼻咽癌患者,除同步放化疗外,还应进行诱导化疗(推荐类型:基于循证;利大于弊;证据质量:高;推荐强度:强)。
2.2.4Ⅲ~Ⅳa期(T3N0除外)鼻咽癌同步放化疗前未接受诱导化疗的患者,应给予同步放化疗加辅助化疗(推荐类型:基于循证;利大于弊;证据质量:中等;推荐强度:中等)。
2.2.5T3N0鼻咽癌患者,应行同步放化疗,也可提供辅助或诱导化疗(推荐类型:基于循证;利大于弊;证据质量:中等;推荐强度:中等)。
具有里程碑意义的Intergroup 0099研究[9]中同步放化疗加辅助化疗的生存终点优于单纯放疗,确立了放化综合治疗为局部晚期(Ⅱ~Ⅳa期)鼻咽癌的标准治疗方式。随后来自鼻咽癌流行地区的随机研究证实[25-26],同步放化疗加或不加辅助化疗与单纯放疗相比对局部晚期鼻咽癌均有生存益处。纳入了19个随机对照研究的基于个体病例数据(IPD)荟萃分析[27]表明,在放疗中加入化疗最显著的OS获益来自于同步放化疗。相比之下,如果不进行同步化疗、辅助化疗或诱导化疗联合放疗与单独放疗相比,不会产生显著的生存益处。因此,同步放化疗被认为是治疗局部晚期鼻咽癌的主要手段。
值得注意的是,Intergroup 0099研究是在传统放疗时代进行的,传统2D放疗时代局部区域失败是治疗失败的主要原因。但在IMRT时代,鼻咽癌的治疗失败模式已经改变,肿瘤局部控制已经比较满意,因此目前在同步放化疗后加入辅助化疗的治疗方式引发了争议。一项Ⅲ期随机研究[28]的初步结果显示,在局部区域晚期鼻咽癌患者中,单纯同步放化疗与同步放化疗加辅助化疗治疗在所有结局参数上没有显著差异。在另一个Ⅲ期研究[29]中,104例患者放疗后可检测到血浆EBV-DNA的高危鼻咽癌患者被随机分配到GP方案辅助化疗组或观察组,这项研究是鼻咽癌中第一个基于生物标志物驱动的随机对照研究,结果显示,补充辅助化疗后,患者OS和PFS均无改善(5年发生率OS: 64% vs. 68%; P=0.79; PFS: 49% vs. 55%; P=0.75)。根治性放疗后进行辅助化疗患者耐受性相对较差,仅有50%~76%的患者能够完成计划,这可能是目前鼻咽癌患者补充辅助化疗未能观察到获益的原因。一项根据放疗后EBV-DNA水平来选择辅助化疗方案的随机对照试验(NCT02135042)正在进行中。另一项使用卡培他滨作为辅助化疗的Ⅲ期随机对照研究也正在进行中(NCT02958111)。
与辅助化疗相比,诱导化疗具有一些潜在的优点,如较早缓解患者症状及消除微转移,较好耐受性,减小肿瘤照射体积以保护更多的危及器官。然而,前期比较同步放化疗加或不加诱导化疗的随机研究[30-32]并没有得出诱导化疗能够获益的一致结果,其原因可能是研究中所采用的诱导方案不同或样本量不足。近年来,3个来自广州的大规模多中心随机对照研究分别采用多西紫杉醇、顺铂和5-Fu(TPF)[33-34]、顺铂和5-Fu(PF)[35-36]以及吉西他滨和顺铂(GP)[37]的诱导化疗方案,结果都证实在OS、PFS和远处无失败生存率方面,诱导化疗加同步放化疗优于仅行同步放化疗,而局部无失败生存率仅在TPF方案得到改善。纳入了上述临床研究的IPD汇总分析[38]表明,诱导化疗联合同步放化疗显著提高了OS(危险比(HR=0.75, 95%CI: 0.57~0.99;5年绝对受益率为6%)和PFS(HR=0.70, 95%CI: 0.56~0.86;5年绝对受益率为9%),生存获益主要来自远处转移的降低(HR=0.68, 95%CI: 0.51~0.90;绝对降低7%)。一项来自突尼斯和法国的小规模随机研究[39]纳入了83例局部晚期鼻咽癌患者,同时也显示加入TPF方案的诱导化疗患者PFS有所提高并对OS有显著影响。因此,在IMRT时代,除了同步放化疗外,诱导化疗在局部晚期鼻咽癌的治疗中起着重要的作用。然而,大多数评估局部晚期鼻咽癌同步放化疗基础上进行诱导化疗的临床研究是在流行地区进行的,因此,诱导化疗在非流行区域鼻咽癌患者中的适用性值得进一步研究。
由于缺乏直接比较诱导+同步和同步+辅助两种方案的前瞻性随机试验数据,目前尚不确定哪种化疗方案在治疗中会表现更好。通过以仅同步放化疗作为对照的临床研究推断比较,在同步放化疗的基础上,诱导化疗似乎在减少局部晚期鼻咽癌患者的远处转移方面优于辅助化疗。未来诱导化疗加同步放化疗和同步放化疗加辅助化疗的头对头比较研究是必要的。与其他分期相比,T3N0鼻咽癌患者治疗失败的风险相对较低。因此,该亚组在研究诱导或辅助化疗的随机对照研究常被排除在外。由于缺乏随机试验数据,专家小组建议应详细讨论T3N0患者同步放化疗加诱导化疗或辅助化疗的利弊。
3 对于接受同步放化疗的鼻咽癌患者,推荐的化疗方案 3.1 同步化疗药物及剂量推荐除患者有相关禁忌证外,放疗同时应进行每周(40 mg/m2)或每三周(100 mg/m2,或至少80 mg/m2)的顺铂治疗(推荐类型:基于循证;利大于弊;证据质量:高;推荐强度:强)。
3.2 同步化疗剂量强度推荐同步化疗时,应尝试每三周共3次或每周一次共7次的顺铂治疗,以达到顺铂至少200 mg/m2的累积剂量(推荐类型:非正式共识;利大于弊;证据质量:中等;推荐强度:中等)。
3.3 有顺铂禁忌证的同步放化疗鼻咽癌患者给予奈达铂(100 mg/m2,三周一次)的同步化疗方案,可选其他药物包括卡铂(AUC 5~6每三周一次)或奥沙利铂(70 mg/m2,每周一次)(推荐类型:基于循证;利大于弊;证据质量:中等;推荐强度:强)。
3.4 有铂类化疗禁忌证的鼻咽癌患者可同步给予氟尿嘧啶类药物(如卡培他滨、5-Fu和替加氟)(推荐类型:基于循证;利大于弊;证据质量:低;推荐强度:弱)。
放疗同步联合顺铂治疗(三周一次100 mg/m2或每周一次40 mg/m2)的建议证据来自于一些早期的临床研究,目前已有研究对两种顺铂同步方案进行了头对头比较,Lee等[40]进行的一项小型随机Ⅱ期研究显示,顺铂每周一次(40 mg/m2)和每三周一次(100 mg/m2)的治疗方案在疗效和不良反应方面无显著差异,每周顺铂治疗方案似乎可改善患者生活质量。大规模的Ⅲ期随机对照临床研究(ChiCTR-TRC-12001979)[41]纳入了526例局部晚期鼻咽癌患者,初步结果表明两种治疗方案患者生存率无差异,但每周方案(40 mg/m2×6次)与三周方案(100 mg/m2×2次)相比,患者白细胞减少(27.3% vs.16.2%)和血小板下降(4.8% vs. 1.2%)的发生率增加。需要注意的是,相比于顺铂每周方案(顺铂共240 mg/m2),该研究中三周方案的顺铂总剂量较低(共200 mg/m2)。有证据表明,同步放化疗中顺铂的累积剂量可能比顺铂的给药方案更为重要。Ⅲ期研究[42-44]分析表明,顺铂累积剂量阈值达到200 mg/m2才能满足同步化疗的疗效要求。如果在同步放化疗的基础上加用诱导化疗,回顾性数据显示同步放化疗阶段所需的顺铂累积剂量通常为160 mg/m2。对于有顺铂治疗禁忌证的患者,其他可选择的同步用药方案包括卡铂、奥沙利铂和奈达铂。如果对铂类药物有禁忌,还可选择氟尿嘧啶类药物进行同步化疗。
4 对于接受诱导化疗的鼻咽癌患者推荐的诱导化疗方案 4.1对于所有接受诱导化疗的鼻咽癌患者,应使用含铂类的诱导方案。
在没有禁忌证的情况下,可以使用以下方案:GP(吉西他滨:1000 mg/m2 d1、d8;顺铂80 mg/m2 d1)或TPF(多西他赛60~75 mg/m2 d1;顺铂60~75 mg/m2 d1;5-Fu每天600~750 mg/m2,连续静脉输注d1~5);其他方案如PF(顺铂80~100 mg/m2 d1;5-Fu每天800~1000 mg/m2,连续静脉输注d1~5),PX(顺铂100 mg/m2 d1;卡培他滨每天2000 mg/m2,d1~14),TP(多西他赛75 mg/m2 d1;顺铂75 mg/m2 d1)(推荐类型:基于循证,利大于弊;证据质量:中等;推荐强度:强)。
一项2009年发表的Ⅱ期随机临床研究[32]发现在鼻咽癌同步放化疗之前进行2周期多西他赛(75 mg/m2)和顺铂(75 mg/m2)诱导化疗,患者3年OS从68%提高到94%(HR=0.24, 95%CI: 0.08~0.73)。随后两个大规模的Ⅲ期随机病例对照研究[33-34, 37]证实了局部晚期鼻咽癌(T3-4N0除外)患者中诱导化疗TPF方案(多西他赛60 mg/m2,顺铂60 mg/m2,5-Fu 600 mg/m2持续泵入120 h;每3周一次,共3个周期)和GP方案(吉西他滨1000 mg/m2 d1、d8,顺铂80 mg/m2,每3周一次,共3个周期)的有效性。在TPF方案研究中,诱导化疗+同步放化疗组5年OS(HR=0.65, 95%CI: 0.43~0.98),PFS(HR=0.65, 95%CI: 0.43~0.98),LRFS(HR=0.58, 95%CI: 0.34~0.99)明显高于单纯同步放化疗组。在另一项研究[37]中,GP方案诱导化疗患者组3年OS(HR=0.43, 95%CI: 0.24~0.77)、PFS(HR=0.51, 95%CI: 0.34~0.77)和DFS(HR=0.43, 95%CI: 0.25~0.73),局部控制率无明显改善,但患者耐受性较好,3级或4级中性粒细胞减少、白细胞减少和腹泻的发生率分别为21%、11%和0.4%。其他推荐的诱导化疗方案包括PF方案(顺铂80 mg/m2,5-Fu 800~1 000 mg/m2持续泵入120 h)和PX方案(顺铂80 mg/m2,卡培他滨750 mg/m2 d1~14)。
直接比较诱导化疗方案的数据较为少见。一项Meta分析[45]发现不同的诱导化疗方案(如TPF、TP和PF)之间没有显著性差异,而另一项包含了8 214例患者共28项研究、基于个体病例数据的网状Meta分析[46]表明,含紫杉类的诱导化疗方案疗效在OS上优于不含紫杉类的诱导化疗。因此,临床上可以根据患者的具体情况选择诱导化疗方案。目前亦有临床研究进行评估,在诱导化疗阶段,是否可以使用其他铂类药物如洛铂或奈达铂代替顺铂或用卡培他滨替换5-Fu以达到在保证疗效的基础上提高患者的生活质量(ChiCTR-TRC-13003285、NCT0350313)。
4.2 鼻咽癌患者的诱导化疗应每3周一次,共进行3个或至少2个周期(推荐类型:基于循证,利大于弊;证据质量:中等;推荐强度:强)。
4.3 对于接受诱导化疗鼻咽癌患者的治疗应在最后一个诱导化疗周期第一天起的21~28天内开始同步放化疗(推荐类型:非正式共识;利大于弊;证据质量:中等;推荐强度:中等)。
尽管没有对比不同诱导化疗周期数疗效差异的随机研究数据,推荐使用2到3个周期,3个周期更为常用。一项回顾性研究[47]表明,多于2个周期的诱导化疗,并不能提高鼻咽癌患者疗效。在诱导化疗期间,EBV-DNA水平变化的实时监测可以用于评估疗效,但有待进一步的前瞻性研究证实。由于目前缺乏探讨诱导化疗和放疗间隔时间对鼻咽癌患者生存影响的前瞻性研究,专家组建议应在最后一周期的诱导化疗的第一天起,3~4周内开始放化疗,以尽量降低治疗失败的风险。一项回顾性研究[38]支持该观点,并指出诱导化疗与放疗间隔时间大于30天与患者预后欠佳有关。
5 对于接受辅助化疗的鼻咽癌患者推荐的辅助化疗方案 5.1对于所有接受辅助化疗的鼻咽癌患者推荐应用PF方案(顺铂80 mg/m2 d1或20 mg/m2 d1~5;5-Fu每天1000 mg/m2,持续静脉泵入96 h,或每天800 mg/m2,持续静脉泵入120 h),每4周一次,共3周期(推荐类型:基于循证,利大于弊;证据质量:高;推荐强度:强)。
Intergroup 0099研究[9]结果确立了在同步放化疗后给予3周期PF辅助化疗(顺铂80 mg/m2 d1和5-Fu每天1000 mg/m2,持续泵入96 h,q4w)的标准治疗模式。几项大型随机研究[48-50]证实同步放化疗+辅助化疗的疗效优于单纯放疗。为减少药物急性不良反应,顺铂和5-Fu都可以在不改变剂量强度的情况下进行调整,如新加坡报道[51]的顺铂80 mg/m2 d1被替换为20 mg/m2 d1~4,广州报道[49, 52]5-Fu 1000 mg/m2静脉泵入(civ)96 h被替换为800 mg/m2,civ 120 h。值得提出的是,在其他头颈肿瘤的新辅助化疗中,最初研究中应用的PF方案剂量为:顺铂100 mg/m2 d1+5-Fu每天1000 mg/m2,civ 120 h,q3w。考虑同步放化疗后鼻咽癌患者对辅助治疗耐受性差,Intergroup 0099研究应用该方案时辅助化疗药物剂量被降低了20%,治疗周期由每3周改为每4周一次。尽管做了这些调整,在Intergroup 0099[9]中只有55%的患者能够完成计划的3周期辅助化疗,其他研究[48-50, 52-53]报道的辅助化疗完成率为46%~78%。香港NPC-9901/NPC-9902研究[10]多因素分析表明441例局部晚期鼻咽癌患者辅助化疗中5-Fu的总剂量与无远处转移率显著相关。因此,目前的证据建议需辅助化疗的鼻咽癌患者应完成3周期PF方案化疗。
5.2对于需要辅助化疗的鼻咽癌患者,如有顺铂禁忌证,可用卡铂(AUC=5)联合5-Fu方案。(推荐类型:基于循证,利大于弊;证据质量:中等;推荐强度:中等)。
如果顺铂有禁忌证,辅助化疗中可用卡铂代替顺铂。一项单中心随机、非劣效性研究[54]比较了上述两种方案,该研究在206例鼻咽癌患者中,采用卡铂100 mg/m2同步放疗,并使用卡铂(AUC=5)联合5-Fu(每天100 mg/m2,civ 96 h)的辅助化疗,对照组使用Intergroup 0099中的顺铂同步放疗及顺铂联合5-Fu辅助化疗方案,研究结果表明,顺铂组3周期的辅助化疗完成率为42%,而卡铂组辅助化疗完成率为73%。不良反应方面,肾毒性、白细胞减少和贫血在顺铂组更常见,血小板减少在卡铂组发生率更高。另外一项多中心随机研究[55],试验组175例T2N0-T4N2M0(UICC/AJCC第7版)鼻咽癌患者接受卡铂同步化疗与卡铂和5-Fu辅助化疗,结果表明卡铂+5-Fu辅助治疗组可明显改善2年DFS。
5.3对于所有接受辅助化疗且有铂类化疗药物禁忌证的鼻咽癌患者,非铂类化疗方案目前仍处于试验阶段,不推荐在临床试验之外常规应用。(推荐类型:基于循证,利大于弊;证据质量:中等;推荐强度:强)。
同步放化疗+辅助化疗仍然是局部晚期鼻咽癌患者的一个治疗选择。诱导化疗提高了远处转移控制率,但诱导化疗因延迟了放疗,有潜在加速局部肿瘤增殖的可能性,同步放化疗+辅助化疗具有更优的局部控制率。在NPC-0501研究[11, 47]中,尽管诱导化疗时PF使用剂量和剂量强度更高、患者耐受性更好,PF诱导化疗与PF辅助化疗疗效无显著性差异。几项回顾性研究[56-59]报道在辅助诱导化疗中顺铂联合节拍性口服氟尿嘧啶类药物显著提高了患者的OS。节拍化疗是指长时间定期使用低剂量化疗药物。节拍化疗的高依从性和低不良反应使其成为鼻咽癌同步放化疗后辅助化疗有吸引力的方案。一项探索卡培他滨节拍化疗的多中心Ⅲ期临床试已经完成入组(NCT02958111),另一项应用UFT的研究(NCT02363400)正在进行。如前所述,辅助化疗的主要争议是患者的治疗耐受性,节拍性口服氟尿嘧啶类药物或其他药物可能可以解决这个问题,这也为其他头颈肿瘤患者在不适用铂类治疗时提供了替代治疗方案,但是非铂类药物方案在鼻咽癌的同步化疗中的应用目前仍处在研究中,不推荐常规应用。
6 小结大部分恶性肿瘤的临床指南由国际权威的美国国立综合癌症网络(NCCN)制定,既往鼻咽癌也不例外。然而,鼻咽癌具有极强的地域性[1],主要高发于以我国为主的东亚和东南亚地区,且不同地区之间药物的使用及诊疗手段也存在差异,包括NCCN指南在内的鼻咽癌临床指南大多只是给出治疗路径的指引,而2021年初由CSCO牵头制定的鼻咽癌国际循证指南更加注重细节并给予不同治疗阶段的详细用药建议。之前的临床指南均倾向于将占鼻咽癌患者中95%的Ⅱ~Ⅳa期患者都归为一组,而新的国际指南将这部分患者细分为不同亚组,并给出相应的具体的治疗建议。新的国际指南中每一条建议均从证据质量的高低、推荐的强弱、以及获益风险比三个维度进行注释,使医生和患者对每一项治疗决策均有全面了解。该指南还客观的提出,不熟悉鼻咽癌诊疗的临床医生或缺乏相应资源的医疗机构,鼓励寻求专业的指导或患者转诊至具备精准放化疗资质的医疗机构,并充分考虑到患者在获取医疗资源存在不均等性,提出医疗照护人员应尽力为这些弱势群体提供最高水平的肿瘤疗护。此外,因临床试验的纳入标准通常已经排除合并多种慢性内科疾病的患者,指南提出临床医生应审查对于合并多种慢性病的鼻咽癌,并在制定治疗和随访计划时考虑这些问题。
该指南聚焦于临床上最为关注的Ⅱ~Ⅳa期鼻咽癌的根治性放化疗。综观指南及我们的临床实际应用,局部晚期(Ⅲ~Ⅳa)期鼻咽癌的标准治疗是以同步放化疗为基础的放化综合治疗,相比于同步放化疗后辅助化疗的低耐受性,诱导化疗能及早杀灭亚临床转移灶,减轻肿瘤负荷,因此很多临床医师易于接受诱导化疗后同步放化疗的治疗选择。调强放疗时代,多项研究已表明诱导化疗具有降低远处转移的优势,但降低远处转移风险是否能进而提高生存率仍存争议,利用EBV-DNA水平等方法筛选诱导化疗潜在获益的高危患者可能是一个可行办法。目前诱导化疗方案多采用TPF、GP及PF等,但不同的诱导化疗方案(如TPF、GP和PF)之间尚无头对头的比较,为了减少紫杉醇类及氟尿嘧啶类药物的心脏毒性,湖北省肿瘤医院在Ⅱ期临床研究[60]中评估雷替曲塞联合顺铂诱导化疗后联合同步放化疗治疗局部晚期鼻咽癌的有效性和安全性,结果显示雷替曲塞联合顺铂方案诱导及同步治疗方案,疗效不劣于既往报道的一线治疗方案,且不良反应发生率低。另外还需要提出的是,诱导化疗推迟了根治性放疗的时间,有导致肿瘤加速再增殖的风险,新指南在诱导化疗后进行放疗的时间间隔也进行了推荐。
由于指南的功能需求,该指南侧重于明确局部晚期鼻咽癌患者的具体治疗方案选择,对于具体的靶区勾画未在指南中过多阐述。鼻咽癌的放射治疗几乎决定着治疗的成败,临床医生在学习和应用该国际指南的同时,还应参考2018年发表的鼻咽癌靶区勾画的国际共识[61]、中国临床肿瘤学会《CSCO鼻咽癌诊疗指南》[62]、2020李晔雄教授主编的《肿瘤放射治疗学(第五版)》,结合患者的实际情况,选择合适治疗方案,注意用药细节,重视靶区勾画的精准性,最终为患者提供更为科学合理的治疗。此外,调强放射治疗时代,仍有评估鼻咽癌放疗联合化疗具体实施的临床研究正在进行中,指南仍需适时更新。
(本文文献解读部分的临床研究均来自于指南所引用的文献,具体内容及文献请参考指南原文DOI:10.1200/JCO.20.03237)
作者贡献
周亚娟、牟艳花:指南的学习与解读、资料收集及论文撰写
胡德胜:参与指南的学习与解读、文章修改与补充
| [1] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
Chen YP, Ismaila N, Chua MLK, et al. Chemotherapy in Combination With Radiotherapy for Definitive-Intent Treatment of Stage Ⅱ-IVA Nasopharyngeal Carcinoma: CSCO and ASCO Guideline[J]. J Clin Oncol, 2021, 39(7): 840-859. DOI:10.1200/JCO.20.03237 |
| [3] |
Peng G, Wang T, Yang KY, et al. A prospective, randomized study comparing outcomes and toxicities of intensity-modulated radiotherapy vs. conventional twodimensional radiotherapy for the treatment of nasopharyngeal carcinoma[J]. Radiother Oncol, 2012, 104(3): 286-293. DOI:10.1016/j.radonc.2012.08.013 |
| [4] |
Kam MK, Leung SF, Zee B, et al. Prospective randomized study of intensity-modulated radiotherapy on salivary gland function in early-stage nasopharyngeal carcinoma patients[J]. J Clin Oncol, 2007, 25(31): 4873-4879. DOI:10.1200/JCO.2007.11.5501 |
| [5] |
Pow EH, Kwong DL, McMillan AS, et al. Xerostomia and quality of life after intensity-modulated radiotherapy vs. conventional radiotherapy for early-stage nasopharyngeal carcinoma: Initial report on a randomized controlled clinical trial[J]. Int J Radiat Oncol Biol Phys, 2006, 66(4): 981-991. DOI:10.1016/j.ijrobp.2006.06.013 |
| [6] |
Luo MS, Huang GJ, Liu HB. Oncologic outcomes of IMRT versus CRT for nasopharyngeal carcinoma: Ameta-analysis[J]. Medicine (Baltimore), 2019, 98(24): e15951. DOI:10.1097/MD.0000000000015951 |
| [7] |
Du T, Xiao J, Qiu Z, et al. The effectiveness of intensity-modulated radiation therapy versus 2D-RT for the treatment of nasopharyngeal carcinoma: A systematic review and meta-analysis[J]. PLoS One, 2019, 14(7): e0219611. DOI:10.1371/journal.pone.0219611 |
| [8] |
Co J, Mejia MB, Dizon JM. Evidence on effectiveness of intensity-modulated radiotherapy versus 2-dimensional radiotherapy in the treatment of nasopharyngeal carcinoma: Meta-analysis and a systematic review of the literature[J]. Head Neck, 2016, 38(suppl 1): E2130-E2142. |
| [9] |
Al-Sarraf M, LeBlanc M, Giri PG, et al. Chemoradiotherapy versus radiotherapy in patients with advanced nasopharyngeal cancer: Phase Ⅲ randomized Intergroup study 0099[J]. J Clin Oncol, 1998, 16(4): 1310-1317. DOI:10.1200/JCO.1998.16.4.1310 |
| [10] |
Lee N, Harris J, Garden AS, et al. Intensity-modulated radiation therapy with or without chemotherapy for nasopharyngeal carcinoma: Radiation Therapy Oncology Group Phase Ⅱ trial 0225[J]. J Clin Oncol, 2009, 27(22): 3684-3690. DOI:10.1200/JCO.2008.19.9109 |
| [11] |
Lee AW, Ngan RK, Tung SY, et al. Preliminary results of trial NPC-0501 evaluating the therapeutic gain by changing from concurrent-adjuvant to inductionconcurrent chemoradiotherapy, changing from fluorouracil to capecitabine, and changing from conventional to accelerated radiotherapy fractionation in patients with locoregionally advanced nasopharyngeal carcinoma[J]. Cancer, 2015, 121(8): 1328-1338. DOI:10.1002/cncr.29208 |
| [12] |
Yang H, Chen X, Lin S, et al. Treatment outcomes after reduction of the target volume of intensity-modulated radiotherapy following induction chemotherapy in patients with locoregionally advanced nasopharyngeal carcinoma: A prospective, multi-center, randomized clinical trial[J]. Radiother Oncol, 2018, 126(1): 37-42. DOI:10.1016/j.radonc.2017.07.020 |
| [13] |
Ou X, Miao Y, Wang X, et al. The feasibility analysis of omission of elective irradiation to level IB lymph nodes in low-risk nasopharyngeal carcinoma based on the 2013 updated consensus guideline for neck nodal levels[J]. Radiat Oncol, 2017, 12(1): 137. DOI:10.1186/s13014-017-0869-x |
| [14] |
Zhang F, Cheng YK, Li WF, et al. Investigation of the feasibility of elective irradiation to neck level Ib using intensity-modulated radiotherapy for patients with nasopharyngeal carcinoma: A retrospective analysis[J]. BMC Cancer, 2015, 15: 709. DOI:10.1186/s12885-015-1669-z |
| [15] |
Co JL, Mejia MBA, Dizon JMR. Evidence on effectiveness of upper neck irradiation versus whole neck irradiation as elective neck irradiation in node-negative nasopharyngeal cancer: A meta-analysis[J]. J Glob Oncol, 2018, 4: 1-11. |
| [16] |
Li JG, Yuan X, Zhang LL, et al. A randomized clinical trial comparing prophylactic upper versus whole-neck irradiation in the treatment of patients with nodenegative nasopharyngeal carcinoma[J]. Cancer, 2013, 119(17): 3170-3176. DOI:10.1002/cncr.28201 |
| [17] |
Gao Y, Zhu G, Lu J, et al. Is elective irradiation to the lower neck necessary for N0 nasopharyngeal carcinoma[J]. Int J Radiat Oncol Biol Phys, 2010, 77(5): 1397-1402. DOI:10.1016/j.ijrobp.2009.06.062 |
| [18] |
Tang LL, Tang XR, Li WF, et al. The feasibility of contralateral lower neck sparing intensity modulation radiated therapy for nasopharyngeal carcinoma patients with unilateral cervical lymph node involvement[J]. Oral Oncol, 2017, 69: 68-73. DOI:10.1016/j.oraloncology.2017.03.010 |
| [19] |
Xiao F, Dou S, Li Y, et al. Omitting the lower neck and sparing the glottic larynx in node-negative nasopharyngeal carcinoma was safe and feasible, and improved patient-reported voice outcomes[J]. Clin Transl Oncol, 2019, 21(6): 781-789. DOI:10.1007/s12094-018-1988-z |
| [20] |
Chen QY, Wen YF, Guo L, et al. Concurrent chemoradiotherapy vs radiotherapy alone in stage Ⅱ nasopharyngeal carcinoma: Phase Ⅲ randomized trial[J]. J Natl Cancer Inst, 2011, 103(23): 1761-1770. DOI:10.1093/jnci/djr432 |
| [21] |
Wang S, Li S, Shen L. Combined chemoradiation vs radiation therapy alone in stage-Ⅱ nasopharyngeal carcinoma: A meta-analysis of the published literature[J]. Curr Probl Cancer, 2018, 42(3): 302-318. DOI:10.1016/j.currproblcancer.2018.03.004 |
| [22] |
Liu F, Jin T, Liu L, et al. The role of concurrent chemotherapy for stageⅡ nasopharyngeal carcinoma in the intensity-modulated radiotherapy era: A systematic review and meta-analysis[J]. PLoS One, 2018, 13(3): e0194733. DOI:10.1371/journal.pone.0194733 |
| [23] |
Xu C, Zhang LH, Chen YP, et al. Chemoradiotherapy versus radiotherapy alone in stageⅡ nasopharyngeal carcinoma: A systemic review and meta-analysis of 2138 patients[J]. J Cancer, 2017, 8(2): 287-297. DOI:10.7150/jca.17317 |
| [24] |
Huang X, Chen X, Zhao C, et al. Adding concurrent chemotherapy to intensity-modulated radiotherapy does not improve treatment outcomes for stageⅡ nasopharyngeal carcinoma: A phase 2 multicenter clinical trial[J]. Front Oncol, 2020, 10: 1314. DOI:10.3389/fonc.2020.01314 |
| [25] |
Tang C, Wu F, Wang R, et al. Comparison between nedaplatin and cisplatin plus docetaxel combined with intensity-modulated radiotherapy for locoregionally advanced nasopharyngeal carcinoma: A multicenter randomized phaseⅡ clinical trial[J]. Am J Cancer Res, 2016, 6(9): 2064-2075. |
| [26] |
Wu X, Huang PY, Peng PJ, et al. Long-term follow-up of a phase Ⅲ study comparing radiotherapy with or without weekly oxaliplatin for locoregionally advanced nasopharyngeal carcinoma[J]. Ann Oncol, 2013, 24(8): 2131-2136. DOI:10.1093/annonc/mdt163 |
| [27] |
Blanchard P, Lee A, Marguet S, et al. Chemotherapy and radiotherapy in nasopharyngeal carcinoma: An update of the MAC-NPC meta-analysis[J]. Lancet Oncol, 2015, 16(6): 645-655. DOI:10.1016/S1470-2045(15)70126-9 |
| [28] |
Chen L, Hu CS, Chen XZ, et al. Adjuvant chemotherapy in patients with locoregionally advanced nasopharyngeal carcinoma: Long-term results of a phase 3 multicentre randomised controlled trial[J]. Eur J Cancer, 2017, 75: 150-158. DOI:10.1016/j.ejca.2017.01.002 |
| [29] |
Chan ATC, Hui EP, Ngan RKC, et al. Analysis of plasma Epstein-Barr virus DNA in nasopharyngeal cancer after chemoradiation to identify high-risk patients for adjuvant chemotherapy: A randomized controlled trial[J]. J Clin Oncol, 2018, 31: 3091-3100. |
| [30] |
Tan T, Lim WT, Fong KW, et al. Concurrent chemo-radiation with or without induction gemcitabine, Carboplatin, and Paclitaxel: A randomized, phase 2/3 trial in locally advanced nasopharyngeal carcinoma[J]. Int J Radiat Oncol Biol Phys, 2015, 91(5): 952-960. DOI:10.1016/j.ijrobp.2015.01.002 |
| [31] |
Fountzilas G, Ciuleanu E, Bobos M, et al. Induction chemotherapy followed by concomitant radiotherapy and weekly cisplatin versus the same concomitant chemoradiotherapy in patients with nasopharyngeal carcinoma: A randomized phaseⅡ study conducted by the Hellenic Cooperative Oncology Group (HeCOG) with biomarker evaluation[J]. Ann Oncol, 2012, 23(2): 427-435. DOI:10.1093/annonc/mdr116 |
| [32] |
Hui EP, Ma BB, Leung SF, et al. Randomized phaseⅡ trial of concurrent cisplatin-radiotherapy with or without neoadjuvant docetaxel and cisplatin in advanced nasopharyngeal carcinoma[J]. J Clin Oncol, 2009, 27(2): 242-249. DOI:10.1200/JCO.2008.18.1545 |
| [33] |
Li WF, Chen NY, Zhang N, et al. Concurrent chemoradiotherapy with/without induction chemotherapy in locoregionally advanced nasopharyngeal carcinoma: Long-term results of phase 3 randomized controlled trial[J]. Int J Cancer, 2019, 145(1): 295-305. DOI:10.1002/ijc.32099 |
| [34] |
Sun Y, Li WF, Chen NY, et al. Induction chemotherapy plus concurrent chemoradiotherapy versus concurrent chemoradiotherapy alone in locoregionally advanced nasopharyngeal carcinoma: A phase 3, multicentre, randomised controlled trial[J]. Lancet Oncol, 2016, 17(11): 1509-1520. DOI:10.1016/S1470-2045(16)30410-7 |
| [35] |
Yang Q, Cao SM, Guo L, et al. Induction chemotherapy followed by concurrent chemoradiotherapy versus concurrent chemoradiotherapy alone in locoregionally advanced nasopharyngeal carcinoma: Long-term results of a phase Ⅲ multicentre randomised controlled trial[J]. Eur J Cancer, 2019, 119: 87-96. DOI:10.1016/j.ejca.2019.07.007 |
| [36] |
Cao SM, Yang Q, Guo L, et al. Neoadjuvant chemotherapy followed by concurrent chemoradiotherapy versus concurrent chemoradiotherapy alone in locoregionally advanced nasopharyngeal carcinoma: A phase Ⅲ multicentre randomised controlled trial[J]. Eur J Cancer, 2017, 75: 14-23. DOI:10.1016/j.ejca.2016.12.039 |
| [37] |
Zhang Y, Chen L, Hu GQ, et al. Gemcitabine and cisplatin induction chemotherapy in nasopharyngeal carcinoma[J]. N Engl J Med, 2019, 381(12): 1124-1135. DOI:10.1056/NEJMoa1905287 |
| [38] |
Tan TH, Soon YY, Cheo T, et al. Induction chemotherapy for locally advanced nasopharyngeal carcinoma treated with concurrent chemoradiation: A systematic review and meta-analysis[J]. Radiother Oncol, 2018, 129(1): 10-17. DOI:10.1016/j.radonc.2018.02.027 |
| [39] |
Frikha M, Auperin A, Tao Y, et al. A randomized trial of induction docetaxel-cisplatin-5FU followed by concomitant cisplatin-RT versus concomitant cisplatin-RT in nasopharyngeal carcinoma (GORTEC 2006-02)[J]. Ann Oncol, 2018, 29(3): 731-736. DOI:10.1093/annonc/mdx770 |
| [40] |
Lee JY, Sun JM, Oh DR, et al. Comparison of weekly versus triweekly cisplatin delivered concurrently with radiation therapy in patients with locally advanced nasopharyngeal cancer: A multicenter randomized phaseⅡ trial (KCSG-HN10-02)[J]. Radiother Oncol, 2016, 118(2): 244-250. DOI:10.1016/j.radonc.2015.11.030 |
| [41] |
Liang H, Li WX, Lv X, et al. Concurrent chemoradiotherapy with 3-weekly versus weekly cisplatin in patients with locoregionally advanced nasopharyngeal carcinoma: A phase 3 multicentre randomised controlled trial (ChiCTR-TRC-12001979)[J]. J Clin Oncol, 2017, 35: 6006. DOI:10.1200/JCO.2017.35.15_suppl.6006 |
| [42] |
Ng WT, Tung SY, Lee V, et al. Concurrent-adjuvant chemoradiation therapy for stage Ⅲ-ⅣB nasopharyngeal carcinoma-exploration for achieving optimal 10-year therapeutic ratio[J]. Int J Radiat Oncol Biol Phys, 2018, 101(5): 1078-1086. DOI:10.1016/j.ijrobp.2018.04.069 |
| [43] |
Lee AW, Tung SY, Ngan RK, et al. Factors contributing to the efficacy of concurrent-adjuvant chemotherapy for locoregionally advanced nasopharyngeal carcinoma: Combined analyses of NPC-9901 and NPC-9902 trials[J]. Eur J Cancer, 2011, 47(5): 656-666. DOI:10.1016/j.ejca.2010.10.026 |
| [44] |
Peng H, Chen L, Zhang Y, et al. Prognostic value of the cumulative cisplatin dose during concurrent chemoradiotherapy in locoregionally advanced nasopharyngeal carcinoma: A secondary analysis of a prospective phase Ⅲ clinical trial[J]. Oncologist, 2016, 21(11): 1369-1376. DOI:10.1634/theoncologist.2016-0105 |
| [45] |
Chen YP, Tang LL, Yang Q, et al. Induction chemotherapy plus concurrent chemoradiotherapy in endemic nasopharyngeal carcinoma: Individual patient data pooled analysis of four randomized trials[J]. Clin Cancer Res, 2018, 24(8): 1824-1833. DOI:10.1158/1078-0432.CCR-17-2656 |
| [46] |
Petit C, Lee AWM, Carmel A, et al. Network-meta-analysis of chemotherapy in nasopharyngeal carcinoma (MAC-NPC): An update on 8, 221 patients[J]. J Clin Oncol, 2020, 38: 6523. DOI:10.1200/JCO.2020.38.15_suppl.6523 |
| [47] |
Lee AWM, Ngan RKC, Ng WT, et al. NPC-0501 trial on the value of changing chemoradiotherapy sequence, replacing 5-fluorouracil with capecitabine, and altering fractionation for patients with advanced nasopharyngeal carcinoma[J]. Cancer, 2020, 126(16): 3674-3688. DOI:10.1002/cncr.32972 |
| [48] |
Lee AWM, Tung SY, Ng WT, et al. A multicenter, phase 3, randomized trial of concurrent chemoradiotherapy plus adjuvant chemotherapy versus radiotherapy alone in patients with regionally advanced nasopharyngeal carcinoma: 10-year outcomes for efficacy and toxicity[J]. Cancer, 2017, 123(21): 4147-4157. DOI:10.1002/cncr.30850 |
| [49] |
Chen Y, Sun Y, Liang SB, et al. Progress report of a randomized trial comparing long-term survival and late toxicity of concurrent chemoradiotherapy with adjuvant chemotherapy versus radiotherapy alone in patients with stage Ⅲ to IVB nasopharyngeal carcinoma from endemic regions of China[J]. Cancer, 2013, 119(12): 2230-2238. DOI:10.1002/cncr.28049 |
| [50] |
Lee AW, Tung SY, Chan AT, et al. A randomized trial on addition of concurrent-adjuvant chemotherapy and/or accelerated fractionation for locally-advanced nasopharyngeal carcinoma[J]. Radiother Oncol, 2011, 98(1): 15-22. DOI:10.1016/j.radonc.2010.09.023 |
| [51] |
Chen YP, Chan ATC, Le QT, et al. Nasopharyngeal carcinoma[J]. Lancet, 2019, 394(10192): 64-80. DOI:10.1016/S0140-6736(19)30956-0 |
| [52] |
Chen L, Hu CS, Chen XZ, et al. Concurrent chemoradiotherapy plus adjuvant chemotherapy versus concurrent chemoradiotherapy alone in patients with locoregionally advanced nasopharyngeal carcinoma: A phase 3 multicentre randomised controlled trial[J]. Lancet Oncol, 2012, 13(2): 163-171. DOI:10.1016/S1470-2045(11)70320-5 |
| [53] |
Wee J, Tan EH, Tai BC, et al. Randomized trial of radiotherapy versus concurrent chemoradiotherapy followed by adjuvant chemotherapy in patients with American Joint Committee on Cancer/International Union against cancer stage Ⅲ and Ⅳ nasopharyngeal cancer of the endemic variety[J]. J Clin Oncol, 2005, 23(27): 6730-6738. DOI:10.1200/JCO.2005.16.790 |
| [54] |
Chitapanarux I, Lorvidhaya V, Kamnerdsupaphon P, et al. Chemoradiation comparing cisplatin versus carboplatin in locally advanced nasopharyngeal cancer: Randomised, non-inferiority, open trial[J]. Eur J Cancer, 2007, 43(9): 1399-1406. DOI:10.1016/j.ejca.2007.03.022 |
| [55] |
Chitapanarux I, Kittichest R, Tungkasamit T, et al. Two-year outcome of concurrent chemoradiation with carboplatin with or without adjuvant carboplatin/ fluorouracil in nasopharyngeal cancer: A multicenter randomized trial[J]. Curr Probl Cancer, 2021, 45(1): 100620. DOI:10.1016/j.currproblcancer.2020.100620 |
| [56] |
Twu CW, Wang WY, Chen CC, et al. Metronomic adjuvant chemotherapy improves treatment outcome in nasopharyngeal carcinoma patients with postradiation persistently detectable plasma Epstein-Barr virus deoxyribonucleic acid[J]. Int J Radiat Oncol Biol Phys, 2014, 89(1): 21-29. DOI:10.1016/j.ijrobp.2014.01.052 |
| [57] |
Liu YC, Wang WY, Twu CW, et al. Prognostic impact of adjuvant chemotherapy in high-risk nasopharyngeal carcinoma patients[J]. Oral Oncol, 2017, 64: 15-21. DOI:10.1016/j.oraloncology.2016.11.008 |
| [58] |
Chen JH, Huang WY, Ho CL, et al. Evaluation of oral tegafur-uracil as metronomic therapy following concurrent chemoradiotherapy in patients with non-distant metastatic TNM stage Ⅳ nasopharyngeal carcinoma[J]. Head Neck, 2019, 41(11): 3775-3782. DOI:10.1002/hed.25904 |
| [59] |
Wang WY, Lin TY, Twu CW, et al. Long-term clinical outcome in nasopharyngeal carcinoma patients with post-radiation persistently detectable plasma EBV DNA[J]. Oncotarget, 2016, 7(27): 42608-42616. |
| [60] |
Wu Y, Wei XY, Yuan ZL, et al. Phase Ⅱ study of induction chemotherapy followed by concurrent chemoradiotherapy with raltitrexed and cisplatin in locally advanced nasopharyngeal carcinoma[J]. Chin J Cancer Res, 2020, 32(5): 665-672. |
| [61] |
Lee AW, Ng WT, Pan JJ, et al. International guideline for the delineation of the clinical target volumes (CTV) for nasopharyngeal carcinoma[J]. Radiother Oncol, 2018, 126(1): 25-36. DOI:10.1016/j.radonc.2017.10.032 |
| [62] |
中国临床肿瘤学会《CSCO鼻咽癌诊疗指南》[M]. 北京: 人民卫生出版社, 2020: 20-34. [Chinese society of Clinical Oncology《CSCO guidelines for diagnosis and treatment of nasopharyngeal carcinoma》[M]. Beijing: People's Medical Publishing House, 2020: 20-34.]
|
 2021, Vol. 48
2021, Vol. 48


