文章信息
- PDA介导的温和光热联合自噬抑制剂杀伤乳腺癌细胞
- PDA-mediated Mild Photothermal Therapy Combined with Autophagy Inhibitors Kill Breast Cancer Cells
- 肿瘤防治研究, 2021, 48(7): 659-666
- Cancer Research on Prevention and Treatment, 2021, 48(7): 659-666
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.21.0142
- 收稿日期: 2021-02-04
- 修回日期: 2021-04-15
光热疗法(photothermal therapy, PTT)的基本原理是在近红外激光照射下,光敏剂吸收光能后,处于激发单线态的能量通过内部转换和电子振动弛豫等无辐射跃迁途径传递,以热的形式释放,产生的高热使肿瘤组织温度逐渐升高,当温度达到41.5℃时会对肿瘤细胞产生毒性作用,当温度继续上升超过43.5℃时会破坏肿瘤组织内部的血管,即PTT治疗[1]。虽然光热疗法能有效地抑制肿瘤,但也存在热分布不均、肿瘤根除不完全和可能引起严重的健康组织损伤等缺点[2]。据报道,肿瘤细胞目前存在不同程度的抗光热作用,导致肿瘤的无效消融。这种抵抗力主要来源于细胞内的“自噬”机制[3]。由加热引起的细胞损伤可通过自噬过程进行修复和逆转,导致细胞坏死不完整[4]。为了克服这种治疗抵抗力,在光热治疗过程中只能选择更苛刻的条件(如更高的温度或更长时间的照射),但是这种方法会对周围正常组织造成更大的损害[5-6]。聚乳酸-羟基乙酸共聚物(poly(lactic-co-glycolic acid), PLGA)是由乳酸和羟基乙酸两种单体随机聚合而成的可降解的高分子有机化合物,降解终产物为CO2和H2O,不会在体内产生毒副作用,且易通过化学修饰掌控纳米复合物的粒径和性能,是目前公认的性质优良的纳米载体之一[7-8]。聚多巴胺(polydopamine, PDA)是由多巴胺氧化形成的黑色素样衍生物,具有生物相容性高、可降解性强、在生物材料表面可自发沉积形成PDA膜[9]等优点,可用于肿瘤的光热治疗[10-11]。基于此,本研究将自噬抑制剂氯喹(chloroquine, CQ)包载在PLGA内,同时在PLGA表面包覆PDA,制备纳米粒子(CQ@PLGA@PDA NPs),用于肿瘤的温和光热治疗。
1 材料与方法 1.1 材料与设备PLGA(50: 50,MW: 10000)购自德国Evonik公司;聚乙烯醇(PVA)、香豆素-6、4’,6-二氨基-2-苯基吲哚(DAPI)、CQ和盐酸多巴胺(dopamlne hydrochlorlde, DA)购自美国Sigma-Aldrich有限责任公司;细胞计数试剂盒(CCK-8)购自中国Melone有限公司;LC3B抗体、P62抗体和β-actin抗体购自中国Proteintech公司。
磁力搅拌器(79HW-1),上海围诚仪器有限公司;电子天平(FA2204B),上海精密科学仪器有限公司;透射电子显微镜(Tecnai G2 F20),美国FEI公司;纳米粒度分析仪(Nano ZS90),英国马尔文仪器公司;紫外/可见光/近红外分光光度计(UH4150),中国天美科学仪器公司;高速冷冻离心机,美国Thermo公司;傅里叶变换红外光谱(FT-IR, NEXUS-670型),美国Nicolet公司;真空冷冻干燥机(FD-2B-80),中国继谱电子科技有限公司;天能化学发光凝胶成像系统(Tanon-5200 Multi);实验用水由实验室自制,采用净水系统(Milli-QPlus 185型)纯化。
1.2 实验方法 1.2.1 CQ@PLGA NPs的制备采用双乳化法制备CQ@PLGA NPs。称取20 mg PLGA,将其溶解在1 ml二氯甲烷(DCM)中,将CQ水溶液(0.2 ml, 0.5 mg)加入上述溶液中,对混合物进行超声处理30 s,得到水/油初乳液(W1/O)。随后将上述W1/O乳液倒入5 ml PVA溶液(4%)中,继续使用20%的振幅超声处理3 min,得到水/油/水复乳液(W1/O/W2)。将所得复乳液加入15 ml的去离子水中,放置在磁力搅拌器上室温搅拌过夜,蒸发剩余的DCM。去离子水洗涤、离心3次后,弃上清液,冷冻干燥成粉末,将上述材料放在4℃的冰箱中保存备用。
1.2.2 CQ@PLGA@PDA NPs纳米探针的制备将上述制备的纳米粒子溶于10 ml Tris缓冲液(10 mm, pH8.5)中,加入1 mg DA,缓慢搅拌2 h后,去离子水洗涤、离心3次后,弃上清液,得到黑色CQ@PLGA@PDA NPs溶液,将上述溶液放在4℃的冰箱中保存备用。
1.3 观察材料表征透射电子显微镜(Transmission electron microscope, TEM)观察CQ@PLGA@PDA NPs的形貌和结构;马尔文粒径仪分析CQ@PLGA NPs和CQ@PLGA@PDA NPs的粒径大小及电位;紫外-可见光(UV-vis)吸收光谱检测CQ@PLGA@PDA NPs中CQ的吸收峰,并计算CQ的标准曲线,根据标准曲线来计算CQ@PLGA NPs中CQ的包封率;分别对CQ@PLGA NPs、CQ@PLGA@PDA NPs进行傅立叶红外光谱(FT-IR)测试。
1.4 光热性能检测设超纯水为对照组,将CQ@PLGA@PDA NPs配制成150、300、450和600 µg/ml的溶液,取1 ml。使用功率为1.0 W/cm2的近红外808 nm激光照射10 min,各组温度的变化使用红外热成像仪监测。
1.5 体外细胞毒性研究采用细胞计数试剂盒(CCK-8)法检测CQ@PLGA@PDA NPs的细胞毒性。取对数生长期的乳腺癌细胞MDA-MB-231和小鼠胚胎成纤维细胞NIH-3T3(来自中国科学院上海生命科学研究院)经胰酶消化后离心洗涤,接种于96孔板中,细胞密度约为1×104个/孔,孵育12 h。每孔加入100 µl含有CQ@PLGA@PDA NPs的培养基(浓度梯度为0、150、300、450、600 µg/ml),每个浓度设置5组平行实验,与细胞共孵育24 h。去除培养基后,在100 µl L-15(含10%FBS)培养基中加入10 µl CCK-8,37℃恒温培养2 h后测定450 nm波长处吸光度值,参比波长为600 nm。
1.6 乳腺癌细胞MDA-MB-231对CQ@PLGA@PDA NPs的摄入将乳腺癌细胞MDA-MB-231接种到预先放有无菌玻片的六孔板中,过夜贴壁后,加入450 µg/ml的载香豆素-6的CQ@PLGA@PDA NPs,分别培养0、1、2、3 h后,PBS洗涤3次,用4%多聚甲醛溶液固定15 min,PBS洗涤3次,然后用DAPI染细胞核10 min,PBS洗涤3次,采用倒置荧光显微镜观察细胞对纳米粒子的摄取情况,蓝色通道激发波长为340 nm,绿色通道激发波长为485 nm。
1.7 抑制细胞自噬增敏光热杀伤效果将密度约为1×104个/孔的MDA-MB-231乳腺癌细胞接种于96孔板中,于37℃、5%CO2条件下培养12 h。将CQ(30.3 µg/ml)、PLGA@PDA NPs(450 µg/ml)和CQ@PLGA@PDA NPs(PLGA@PDA为450 µg/ml、CQ为30.3 µg/ml)加入细胞中,孵育4 h后,对其进行808 nm激光照射(1.0 W/cm2, 10 min)。用CCK-8测定细胞活性。
为了进一步探讨体外自噬抑制增敏光热治疗的效果,将密度约为1×104个/孔的MDA-MB-231乳腺癌细胞接种于96孔板中,随后,PLGA@PDA NPs和CQ@PLGA@PDA NPs的溶液分别在不同浓度(0、150、300、450 µg/ml的PLGA@PDA、0、10.1、20.2、30.3 µg/ml的CQ)下与细胞孵育4 h,然后进行808 nm激光照射(1.0 W/cm2, 10 min)。CCK-8试剂检测细胞活性。
为了进一步证实CQ@PLGA@PDA NPs对MDA-MB-231细胞的治疗作用,采用活-死细胞染色法定性考察光热效果。材料与细胞孵育4 h后,分为四组,不同条件处理后,分别用钙黄绿素-AM(Calcein-AM)和碘化丙啶(propidium Iodide, PI)处理细胞。
1.8 蛋白质印迹分析MDA-MB-231细胞接种于6孔板中,密度为每孔4×105个细胞。MDA-MB-231细胞与空白对照、CQ、PLGA@PDA NPs和CQ@PLGA@PDA NPs孵育6 h,然后采用808 nm激光照射(1.0 W/cm2, 10 min)。细胞用裂解缓冲液裂解,离心后取上清液,加入SDS缓冲液后,将样品煮沸8 min。在12%SDS-PAGE中分离,将分离好的蛋白低温45 min转移到NC膜上。随后封闭液封闭2 h,根据指示蛋白裁剪相应的条带,4℃过夜孵育一抗,之后用洗膜液洗去未结合的一抗,接着加入二抗,室温孵育1 h后,洗膜液清洗未结合的二抗,用化学发光凝胶成像系统对条带进行拍摄。
1.9 统计学方法数据分析采用SPSS24.0软件,实验数据以(x±s)表示,两组间比较采用t检验。检验水准α=0.05。
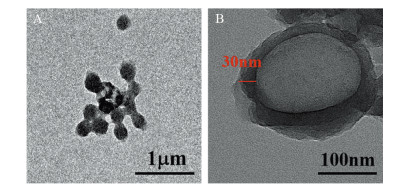
2 结果 2.1 TEM分析CQ@PLGA@PDA NPs的基本性质CQ@PLGA@PDA纳米粒子具有明显的核/壳结构,表面有一层黑色涂层,证实PDA成功包覆在PLGA的表面,见图 1。
|
| A: TEM image of CQ@PLGA@PDA nanoparticles; B: TEM image of a single CQ@PLGA@PDA nanoparticle. 图 1 CQ@PLGA@PDA NPs的透射电子显微镜图 Figure 1 CQ@PLGA@PDA NPs observed by transmission electron microscope |
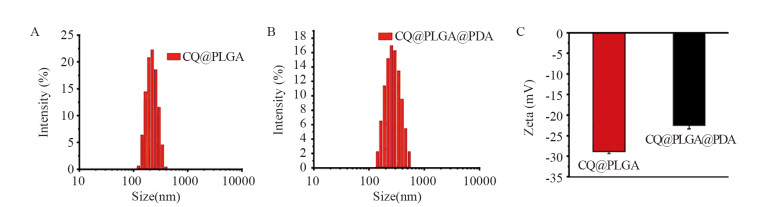
CQ@PLGA NPs和CQ@PLGA@PDA NPs的尺寸分别为(201.10±2.66)nm和(253.10±2.39)nm,见图 2A~B,Zeta电位分别为(-28.86±0.45)mV和(-22.57±0.80)mV,见图 2C。CQ@PLGA@PDA NPs的粒径明显增大,表明PDA成功包覆在CQ@PLGA NPs的表面。粒径仪所测水合粒径大于TEM图中所示纳米粒子的平均粒径,推测其原因,可能是由于PIFC NPs分散于水溶液中时其表面会形成一层水合壳层,导致水合粒径略大于TEM图。
|
| A: DLS measurements of CQ@PLGA NPs in water; B: DLS measurements of CQ@PLGA@PDA NPs in water; C: Zeta-potential analysis of CQ@PLGA NPs and CQ@PLGA@PDA NPs. 图 2 CQ@PLGA@PDA NPs的粒径和Zeta电位图 Figure 2 CQ@PLGA@PDA NPs particle size and Zeta-potential diagram |
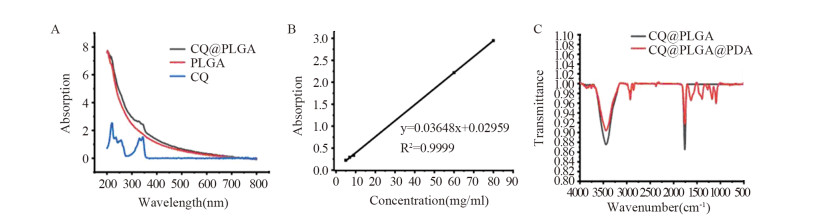
CQ、PLGA NPs及CQ@PLGA NPs的紫外吸收光谱结果显示,CQ水溶液紫外吸收峰位于344 nm,PLGA NPs在200~800 nm处无相应的紫外吸收峰,而CQ@PLGA NPs在344 nm处出现同CQ水溶液相同的紫外吸收峰,证明PLGA成功包载CQ,见图 3A。通过紫外吸收光谱确定CQ标准曲线为y=0.03648x+0.02959(r2=0.9999),见图 3B,在此基础上计算CQ的平均包封率为(40.38±0.34)%。傅立叶红外变换光谱图可见,CQ@PLGA NPs分别在3 500 cm-1和在1 700 cm-1处有代表PLGA的-OH峰和有羰基峰,由于PDA酰胺键的剪切和苯骨架的振动,CQ@PLGA@PDA NPs在1 091 cm-1、1 176 cm-1、1 267 cm-1、1 392 cm-1和1 625 cm-1处出现了新的吸收峰信号,见图 3C。
|
| A: UV-VIS absorption spectra of CQ, PLGA NPs and CQ@PLGA NPs; B: standard curve of CQ; C: FT-IR analysis of CQ@PLGA NPs and CQ@PLGA@PDA NPs. 图 3 CQ@PLGA@PDA NPs的紫外-可见吸收光谱和傅立叶红外分析 Figure 3 UV-VIS absorption spectra and FT-IR analysis of CQ@PLGA@PDA NPs |
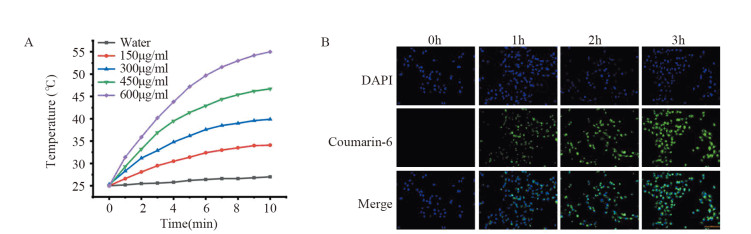
浓度为150、300、450、600 µg/ml的CQ@PLGA@PDA NPs溶液的温度经辐照10 min后分别增加了9.1℃、14.6℃、21.7℃、30℃,但纯水仅仅升高了2℃,表明CQ@PLGA@PDA NPs溶液可以快速有效地将光转化为热能,见图 4A。
|
| A: temperature of pure water and CQ@PLGA@PDA NPs solutions with different concentrations irradiated by an 808 nm laser (1.0W/cm2, 10min) for prolonged time; B: the uptake of CQ@PLGA@PDA NPs by MDA-MB-231 cells (×20). 图 4 CQ@PLGA@PDA NPs的体外光热性能和细胞摄取 Figure 4 Photothermal performance and cellular uptake of CQ@PLGA@PDA NPs |
MDA-MB-231细胞中出现了CQ@PLGA@PDA NPs的绿色荧光,且随着时间的延长,荧光亮度越来越强,表明CQ@PLGA@PDA NPs能够被细胞大量摄取,见图 4B。
2.5 体外细胞毒性和治疗效果CCK-8实验结果显示,CQ@PLGA@PDA NPs浓度为600 µg/ml时,MDA-MB-231和NIH-3T3细胞的存活率均在95%以上,差异无统计学意义(P > 0.05),见图 5A。CQ@PLGA@PDA NPs治疗结果显示,无激光照射时,各组细胞活性无明显减低,当PLGA@PDA NPs溶液(450 µg/ml)经NIR照射(1.0 W/cm2,10 min)后,细胞活力在24 h内降低了(45.73±0.49)%,相同照射条件下,负载了CQ的CQ@PLGA@PDA NPs在24 h内细胞死亡率达到(79.15±0.51)%,见图 5B。此外,不同浓度(0、150、300、450 µg/ml)PLGA@PDA NPs和CQ@PLGA@PDA NPs溶液经照射后,与同浓度和同照射条件下的PLGA@PDA NPs相比,CQ@PLGA@PDA NPs浓度越高,细胞存活率越低,见图 5C。活-死细胞染色结果表明,Ctr组和CQ@PLGA@PDA NPs组对细胞无明显杀伤作用,而PLGA@PDA NPs联合近红外激光照射组,近一半细胞死亡,负载了CQ的CQ@PLGA@PDA NPs组,视野内观察到大量死细胞。说明温和光热条件下,CQ@PLGA@PDA NPs具有良好的肿瘤细胞杀伤能力,见图 5D。
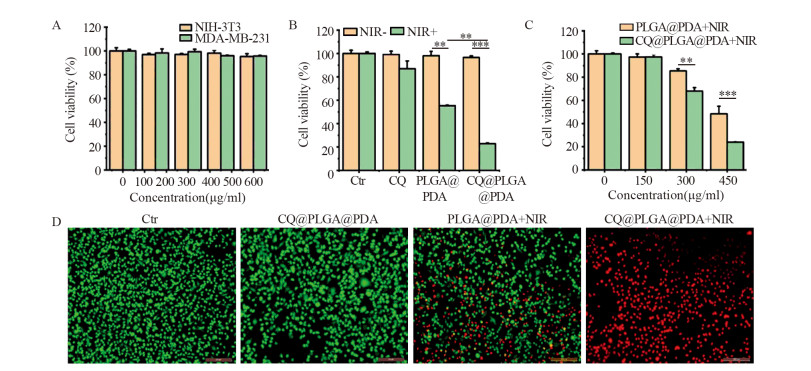
|
| A: In vitro viability of MDA-MB-231 cells incubated with CQ@PLGA@PDA NPs at 37℃ for 24h at different concentrations; B: Viability of MDA-MB-231 cells incubated with Ctr, CQ, PLGA@PDA NPs and CQ@PLGA@PDA NPs samples with and without irradiation by 808 nm laser (1.0W/cm2, 10min); C: Viability of MDA-MB-231 cells incubated with PLGA@PDA NPs and CQ@PLGA@PDA NPs solutions at different concentration after irradiation by 808 nm laser (1.0W/cm2, 10min); D: Fluorescence images of MDA-MB-231 cells stained with calcein-AM (green, live cells) and propidium iodide (red, dead cells) after different treatments. **: P < 0.01, ***: P < 0.001 analyzed by student's t-test. 图 5 CQ@PLGA@PDA NPs的细胞毒性和治疗效果检测 Figure 5 Cytotoxicity and treatment effect of CQ@PLGA@PDA NPs |
LC3-Ⅱ蛋白质免疫印迹结果表明,与Ctr组(LC3-Ⅱ/β-actin为0.38±0.02)相比,PLGA@PDA NPs处理的MDA-MB-231细胞经808 nm激光照射后,LC3-Ⅱ蛋白在细胞中明显增加,其相对于β-actin的表达量为(0.94±0.13),在NIR照射下,用CQ和CQ@PLGA@PDA NPs处理的两个细胞组均表现出LC3-Ⅱ蛋白的高表达,相对蛋白表达量分别为(1.11±0.01)、(1.01±0.01),见图 6A~B。这是由于CQ抑制了溶酶体的功能,阻止了自噬溶酶体的降解,而CQ组表达量比CQ@PLG@PDA略高,则是由于CQ组CQ直接作用于细胞,而CQ@PLGA@PDA组中的CQ要从材料中缓慢释放。
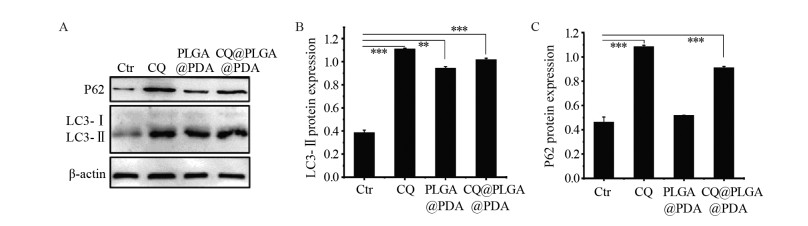
|
| A: Western blot analysis of LC3-Ⅰ, LC3-Ⅱ and P62; MDA-MB-231 cells were incubated with the Ctr, CQ, PLGA@PDA NPs, CQ@PLGA@PDA NPs solutions and 808 nm irradiation (1.0W/cm2, 10min); B: the expression of LC3-Ⅱ relative to β-actin; C: the expression of P62 relative to β-actin. **: P < 0.01, ***: P < 0.001 analyzed by student's t-test. 图 6 自噬相关蛋白LC3和P62的蛋白质免疫印迹分析 Figure 6 Western blot analysis of autophagy-related proteins LC3 and P62 |
P62蛋白质免疫印迹实验结果表明,Ctr组和PLGA@PDA NPs组P62蛋白含量较低,其相对蛋白表达量分别为(0.46±0.04)和(0.52±0.00),差异无统计学意义(P > 0.05),表明自噬通路未受抑制;相比Ctr组和PLGA@PDA NPs组,CQ和CQ@PLGA@PDA NPs处理的细胞,P62含量均显著增加,其相对蛋白表达量分别为(1.08±0.01)和(0.91±0.01),表明CQ使自噬通路受到抑制,见图 6A、C。
3 讨论虽然光热治疗展现出广阔的应用前景,但在实际治疗过程中仍有许多问题需要解决。目前光热治疗大多应用于浅表肿瘤,治疗温度需达到50℃以上才能有效杀伤肿瘤组织,而过高的温度会对皮肤造成严重灼伤,进而引起机体产生一系列自我防御反应(如炎症因子的释放),这些防御反应会进一步增加肿瘤转移和复发的风险。因此,如果能用较低的温度实现肿瘤的光热治疗,会更加符合临床的实际应用,但是较低温度下的光热治疗不能有效抑制肿瘤生长[12-13]。基于此,温和光热治疗与化疗、基因治疗、免疫治疗等多种治疗方式联合治疗已成为近年来的研究热点[14-15]。多项研究表明,温和光热治疗与化疗结合,可以有效解决化疗药物的耐药问题,增强肿瘤治疗效果[16]。Tang和Zhang等[17-18]通过抑制细胞内的热休克蛋白(HSP),在温和的光热条件下实现了有效的肿瘤消融。温和光热疗法联合免疫治疗可以解决二者单独治疗时的缺陷,Huang等[19]提出了局部共生温和光热敏免疫疗法(SMPAI),即将温和光热疗法和免疫检查点抑制剂疗法相结合,该疗法能够改善“冷肿瘤”的免疫应答,增强抗PD-L1疗法的治疗效果。通过可控的治疗释放起到长期抗肿瘤作用,并且可以根据罹患癌症个体的各种需求来实现所需的预编程剂量方案。
自噬是细胞利用溶酶体清除细胞代谢产物、受损细胞器和蛋白质,实现细胞原料的循环再利用,同时也是细胞重要的防御与应激调控机制,在肿瘤、炎性反应、神经退行性疾病中具有十分重要的作用[3, 20-21]。自噬能够使肿瘤细胞抵御外部刺激,增加细胞耐药性。药物抑制自噬或敲除自噬相关基因可提高癌细胞对化疗药物的敏感度[22-23]。自噬抑制剂氯喹可以抑制细胞的保护性自噬,增强肿瘤细胞光动力学治疗的效果[24]。随着研究的深入,调控细胞自噬通路已经成为肿瘤治疗的新方向[25]。LC3全称为微管相关蛋白1A/1B-轻链3(MAP1LC3),它是一种分子量约为17 kDa的可溶性蛋白,普遍存在于哺乳动物组织和细胞中,被认为是自噬(尤其是自噬体)形成过程的特异性标志物,其中LC3-Ⅱ蛋白被认为是检测自噬的金标准[26]。自噬发生过程中,LC3蛋白合成后立即在其羧基端被Atg4剪切,产生细胞浆定位的LC3-Ⅰ,随后,LC3-Ⅰ会被包括Atg7和Atg3在内的泛素样体系修饰和加工,产生分子量为14 kDa的LC3-Ⅱ,并定位到自噬小体中。自噬小体中存在的LC3-Ⅰ和LC3-Ⅱ被当作细胞发生自噬的分子标志,并且LC3-Ⅱ的含量和发生自噬的程度成正比,一般情况,LC3-Ⅱ条带的深浅可以表明自噬程度的高低,通过扫描蛋白条带的灰度值,可以计算LC3-Ⅱ/LC3-Ⅰ的比值,进行半定量分析,但由于LC3-Ⅰ条带较浅,LC3-Ⅱ/LC3-Ⅰ的比值存在较大的误差,因此目前常用LC3-Ⅱ与内参(β-actin)的比值进行半定量分析,综合考察LC3-Ⅱ/β-actin比值的大小可估计自噬水平的高低[27]。
自噬的发生需要经过以下四个阶段:(1)细胞内货物被吞噬形成一种双膜结构;(2)自噬体的形成;(3)自噬体与溶酶体融合产生自噬溶酶体;(4)自噬溶酶体降解。LC3-Ⅱ用来检测自噬的发生。本研究激光照射后,PLGA@PDA NPs处理的细胞组,自噬蛋白LC3-Ⅱ/β-actin的比值升高,表明光热导致细胞产生自噬,而CQ和CQ@PLGA@PDA NPs组在抑制自噬后,LC3-Ⅱ蛋白含量不减反增,这是由于LC3-Ⅰ向LC3-Ⅱ的转变发生在自噬的前两个阶段,而自噬抑制剂CQ作用于自噬的最后一个阶段,用于阻止自噬溶酶体的降解,但不会影响LC3-Ⅰ向LC3-Ⅱ的转化,因此,由CQ@PLGA@PDA NPs传递的CQ分子并没有影响LC3-Ⅰ向LC3-Ⅱ的转化,但显著抑制了溶酶体对自噬溶酶体的降解现象,使细胞内自噬小泡积累。为了进一步证明LC3-Ⅱ相对蛋白表达量的增多是由CQ抑制细胞自噬引起的,本研究检测了另一种自噬相关蛋白P62,P62是一种泛素结合蛋白,与蛋白质的泛素化密切相关,它参与多种细胞信号转导调控及自噬过程。自噬过程中,P62与泛素化的蛋白质结合,再与定位于自噬小体内膜上的LC3-Ⅱ蛋白形成复合物,一同在自噬溶酶体内降解。因此,出现自噬时,细胞质中P62蛋白不断被降解,P62蛋白含量减少;当自噬活性减弱、自噬功能缺陷或被抑制时,P62蛋白会在细胞质中不断累积,P62蛋白含量增多。P62蛋白含量间接反映自噬通路的阻断或流通[28-29]。P62蛋白免疫印迹实验结果表明,与Ctr组相比,CQ和CQ@PLGA@PDA NPs处理的细胞P62蛋白含量均显著增加,说明CQ@PLGA@PDA NPs中释放的CQ分子有效阻断了细胞的自噬通路。
本研究所制备的CQ@PLGA@PDA NPs可通过实体瘤的高通透性和滞留效应聚集到肿瘤部位[30]。CQ分子通过CQ@PLGA@PDA NPs在细胞内传递,显著减弱肿瘤细胞内自噬溶酶体的降解,有效抑制自噬对光热受损细胞的修复,从而在温和近红外光照射下,增强对肿瘤细胞的杀伤效果。本研究以调控细胞自噬为切入点,通过抑制自噬,减少光热治疗过程中细胞产生的热抵抗,提高肿瘤细胞的光热治疗效果,这将为今后的癌症治疗研究提供一种新思路。但本研究也存在一些不足之处,本研究所制备的纳米粒子是利用EPR效应聚集于肿瘤区域,在后续的研究中,将尝试在其表面修饰靶向物质,如适配体、多肽等,增强其靶向性,实现更精准的治疗。
作者贡献:
刘雅文:实验设计、实验操作及论文撰写
卢佳慧、倪晨、黄洁:实验操作及数据分析
黄天濠、沈楠、董玉霖:实验操作
胡俊峰、时梅林:实验指导
| [1] |
Yoon HJ, Lee HS, Jung JH, et al. Photothermally Amplified Therapeutic Liposomes for Effective Combination Treatment of Cancer[J]. ACS Appl Mater Interfaces, 2018, 10(7): 6118-6123. DOI:10.1021/acsami.7b15996 |
| [2] |
Xue KH, Wei F, Lin JY, et al. Tumor acidity-responsive carrier-free nanodrugs based on targeting activation via ICG-templated assembly for NIR-Ⅱ imaging-guided photothermal-chemotherapy[J]. Biomaterials Science, 2021, 9(3): 1008-1019. DOI:10.1039/D0BM01864C |
| [3] |
Ashrafizadeh M, Mohammadinejad R, Tavakol S, et al. New Insight into Triple-Negative Breast Cancer Therapy: The Potential Roles of Endoplasmic Reticulum Stress and Autophagy Mechanisms[J]. Anticancer Agents Med Chem, 2021, 21(6): 679-691. DOI:10.2174/1871520620666200619180716 |
| [4] |
Maiti A, Hait NC. Autophagy-mediated tumor cell survival and progression of breast cancer metastasis to the brain[J]. J Cancer, 2021, 12(4): 954-964. DOI:10.7150/jca.50137 |
| [5] |
Li XZ, Fang F, Sun B, et al. Near-infrared small molecule coupled with rigidness and flexibility for high-performance multimodal imaging-guided photodynamic and photothermal synergistic therapy[J]. Nanoscale Horiz, 2021, 6(2): 177-185. DOI:10.1039/D0NH00672F |
| [6] |
Tan YL, Du XS, Du ZL, et al. Form-stable phase change composites based on nanofibrillated cellulose/polydopamine hybrid aerogels with extremely high energy storage density and improved photothermal conversion efficiency[J]. Rsc Adv, 2021, 11(10): 5712-5721. DOI:10.1039/D0RA10485J |
| [7] |
Yin Y, Wang J, Yang M, et al. Penetration of the blood-brain barrier and the anti-tumour effect of a novel PLGA-lysoGM1/DOX micelle drug delivery system[J]. Nanoscale, 2020, 12(5): 2946-2960. DOI:10.1039/C9NR08741A |
| [8] |
Mao JS, Tang SS, Hong D, et al. Therapeutic efficacy of novel microwave-sensitized mPEG-PLGA@ZrO2@(DOX+ILS) drug-loaded microspheres in rabbit VX2 liver tumours[J]. Nanoscale, 2017, 9(10): 3429-3439. DOI:10.1039/C6NR09862B |
| [9] |
Xi JQ, Da LY, Yang CS, et al. Mn2+-coordinated PDA@DOX/PLGA nanoparticles as a smart theranostic agent for synergistic chemo-photothermal tumor therapy[J]. Int J Nanomedicine, 2017, 12: 3331-3345. DOI:10.2147/IJN.S132270 |
| [10] |
Kong MZ, Huang YL, Yu RL, et al. Coordination bonding-based Fe3O4@PDA-Zn2+-doxorubicin nanoparticles for tumor chemo-photothermal therapy[J]. J Drug Deliv Sci Tech, 2019, 51: 185-193. DOI:10.1016/j.jddst.2019.02.030 |
| [11] |
Wang JJ, Wang XY, Lu SY, et al. Integration of cascade delivery and tumor hypoxia modulating capacities in core-releasable satellite nanovehicles to enhance tumor chemotherapy[J]. Biomaterials, 2019, 223: 119465. DOI:10.1016/j.biomaterials.2019.119465 |
| [12] |
Suo XM, Zhang JC, Zhang Y, et al. A nano-based thermotherapy for cancer stem cell-targeted therapy[J]. J Mater Chem B, 2020, 8(18): 3985-4001. DOI:10.1039/D0TB00311E |
| [13] |
Chen LZ, Meng XY, Liu M, et al. Biodegradable Mesoporous Organosilica Nanosheets for Chemotherapy/Mild Thermotherapy of Cancer: Fast Internalization, High Cellular Uptake, and High Drug Loading[J]. ACS Appl Mater Interfaces, 2020, 12(27): 30234-30246. DOI:10.1021/acsami.0c09735 |
| [14] |
Wang S, Weng J, Fu X, et al. Black Phosphorus Nanosheets for Mild Hyperthermia-Enhanced Chemotherapy and Chemo-Photothermal Combination Therapy[J]. Nanotheranostics, 2017, 1(2): 208-216. DOI:10.7150/ntno.18767 |
| [15] |
Jung BK, Lee YK, Hong JW, et al. Mild Hyperthermia Induced by Gold Nanorod-Mediated Plasmonic Photothermal Therapy Enhances Transduction and Replication of Oncolytic Adenoviral Gene Delivery[J]. Acs Nano, 2016, 10(11): 10533-10543. DOI:10.1021/acsnano.6b06530 |
| [16] |
Guo XL, Li D, Sun K, et al. Inhibition of autophagy enhances anticancer effects of bevacizumab in hepatocarcinoma[J]. J Mol Med (Berl), 2013, 91(4): 473-483. DOI:10.1007/s00109-012-0966-0 |
| [17] |
Tang XC, Tan LW, Shi K, et al. Gold nanorods together with HSP inhibitor-VER-155008 micelles for colon cancer mild-temperature photothermal therapy[J]. Acta Pharm Sin B, 2018, 8(4): 587-601. DOI:10.1016/j.apsb.2018.05.011 |
| [18] |
Zhang T, Wu B, Akakuru OU, et al. Hsp90 inhibitor-loaded IR780 micelles for mitochondria-targeted mild-temperature photothermal therapy in xenograft models of human breast cancer[J]. Cancer Lett, 2021, 500: 41-50. DOI:10.1016/j.canlet.2020.12.028 |
| [19] |
Huang L, Li Y, Du Y, et al. Mild photothermal therapy potentiates anti-PD-L1 treatment for immunologically cold tumors via an all-in-one and all-in-control strategy[J]. Nat Commun, 2019, 10(1): 4871-4885. DOI:10.1038/s41467-019-12771-9 |
| [20] |
Askari FS, Mohebbi A, Moradi A, et al. The Role of Vesicular Stomatitis Virus Matrix Protein in Autophagy in the Breast Cancer[J]. Asian Pac J Cancer Prev, 2021, 22(1): 249-255. DOI:10.31557/APJCP.2021.22.1.249 |
| [21] |
Zhou Q, Cui F, Lei C, et al. ATG7-mediated autophagy involves in miR-138-5p regulated self-renewal and invasion of lung cancer stem-like cells derived from A549 cells[J]. Anticancer Drugs, 2021, 32(4): 376-385. DOI:10.1097/CAD.0000000000000979 |
| [22] |
Gasiorkiewicz BM, Koczurkiewicz-Adamczyk P, Piska K, et al. Autophagy modulating agents as chemosensitizers for cisplatin therapy in cancer[J]. Invest New Drugs, 2021, 39(2): 538-563. DOI:10.1007/s10637-020-01032-y |
| [23] |
Chen XL, Liu P, Zhu WL, et al. DCZ5248, a novel dual inhibitor of Hsp90 and autophagy, exerts antitumor activity against colon cancer[J]. Acta Pharmacol Sin, 2021, 42(1): 132-141. DOI:10.1038/s41401-020-0398-2 |
| [24] |
Zhu B, Li S, Yu L, et al. Inhibition of Autophagy with Chloroquine Enhanced Sinoporphyrin Sodium Mediated Photodynamic Therapy-induced Apoptosis in Human Colorectal Cancer Cells[J]. Int J Biol Sci, 2019, 15(1): 12-23. DOI:10.7150/ijbs.27156 |
| [25] |
You J, Zhang G, Li C. Exceptionally high payload of doxorubicin in hollow gold nanospheres for near-infrared light-triggered drug release[J]. ACS Nano, 2010, 4(2): 1033-1041. DOI:10.1021/nn901181c |
| [26] |
Johansen T, Lamark T. Selective Autophagy: ATG8 Family Proteins, LIR Motifs and Cargo Receptors[J]. J Mol Biol, 2020, 432(1): 80-103. DOI:10.1016/j.jmb.2019.07.016 |
| [27] |
Turco E, Fracchiolla D, Martens S. Recruitment and Activation of the ULK1/Atg1 Kinase Complex in Selective Autophagy[J]. J Mol Biol, 2020, 432(1): 123-134. DOI:10.1016/j.jmb.2019.07.027 |
| [28] |
Farhan M, Silva M, Li S, et al. The role of FOXOs and autophagy in cancer and metastasis-Implications in therapeutic development[J]. Med Res Rev, 2020, 40(6): 2089-2113. DOI:10.1002/med.21695 |
| [29] |
Lee M, Nam HY, Kang HB, et al. Epigenetic regulation of p62/SQSTM1 overcomes the radioresistance of head and neck cancer cells via autophagy-dependent senescence induction[J]. Cell Death Dis, 2021, 12(3): 250-259. DOI:10.1038/s41419-021-03539-5 |
| [30] |
Fang J, Nakamura H, Maeda H. The EPR effect: Unique features of tumor blood vessels for drug delivery, factors involved, and limitations and augmentation of the effect[J]. Adv Drug Deliv Rev, 2011, 63(3): 136-151. DOI:10.1016/j.addr.2010.04.009 |
 2021, Vol. 48
2021, Vol. 48


