文章信息
- 结直肠癌肝转移灶中PD-L1基因阳性患者肝切除后的预后相关因素
- Prognosis-related Factors of Colorectal Cancer Patients with Positive PD-L1 Expression in Liver Metastases After Hepatectomy
- 肿瘤防治研究, 2021, 48(8): 782-787
- Cancer Research on Prevention and Treatment, 2021, 48(8): 782-787
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.21.0124
- 收稿日期: 2021-02-01
- 修回日期: 2021-04-27
2. 572000 三亚,海南省第三人民医院肿瘤内科;
3. 100191 北京,北京大学第三医院肿瘤放疗科
2. Department of Oncology, Sanya Central Hospital (The Third People's Hospital of Hainan Province), Sanya 572000, China;
3. Department of Radiation Oncology, Peking University Third Hospital, Beijing 100191, China
结直肠癌是全球最常见消化道恶性肿瘤之一,其中肝转移在晚期大肠癌中的发生率非常高,程序性死亡分子配体1(programmed death ligand-1, PD-L1)高表达的患者,肿瘤分化程度低、更易发生肝转移,肿瘤分期晚、预后较差。有研究表明PD-L1在部分晚期结直肠癌肝脏转移灶中表达高于其在原发灶中的表达,表明转移灶肿瘤微环境可能存在更强的免疫抑制效应,故尽管原发灶PD-L1检测为阴性,但手术、靶向、免疫治疗等治疗效果较差[1-2];目前结直肠癌肝脏转移的治疗策略主要包括评估初始是否可切除、是否复发高风险,而进入是否需要术前转化治疗、新辅助治疗或直接手术,后决定同期还是二期手术以及术后辅助治疗[3]。肝脏转移灶治疗主要包括手术或配合射频消融、立体定向放射治疗(stereotactic body radiation therapy, SBRT)、并根据RAS/BRAF、MMR/MSI基因状态选择术前转化治疗、新辅助治疗以及辅助治疗的个体化治疗方案等多种方法以及多学科综合治疗模式的开展[4]。肝脏转移灶中PD-L1基因阳性结直肠癌肝转移患者目前根据个体的不同情况有多种可选择的治疗方案,但有效的治疗手段尚比较少。为进一步探讨此种特殊类型直肠癌肝转移的有效治疗模式,本研究通过对68例直肠癌肝转移灶中PD-L1基因阳性患者采用个体化治疗,并观察了远期疗效后,搜集的临床资料进行回顾性分析,现将结果报告如下。
1 资料与方法 1.1 病例选择2015年9月—2020年6月东方市人民医院外科、三亚中心医院(海南省第三人民医院)以及北京大学第三医院收治经病理确诊为结直肠癌肝转移,且通过免疫组织化学方法检测肝脏转移灶PD-L1基因表达检测阳性患者68例,行结直肠癌切除手术且切缘阴性,肝转移灶手术时无腹腔内及其他脏器远端转移,肝功能能耐受手术治疗,无手术禁忌证。排除:合并肝外转移,原发灶非根治性切除、二次及二次以上肝切除、肝转移瘤非R0/R1切除。本研究经我院医学伦理委员会批准(批号:医伦(2020)第36号)。因本研究为回顾性分析,仅采集患者临床病理资料,不涉及干预患者治疗方案,不会对患者生理带来任何风险,且最终数据不会泄露任何个人隐私,已获得入组所有患者的知情同意。
1.2 治疗方法手术前所有患者均行包括肿瘤内科、放疗科、介入科、影像科及功能科等多学科诊疗(multi-disciplinary treatment, MDT)。所有患者均行包括DNA错配修复缺陷(deficient mismatch repair, dMMR)免疫组织化学法检测和RAS基因检测。是否直接手术抑或术前行新辅助放化疗或转化治疗均由个体化MDT决定。原发灶和肝转移灶的切除需保证切除所有可见病灶,无肉眼残留, 争取R0/R1切除。切除肝转移灶时仔细核对术前CT、MRI所示肝脏病灶、血管的位置及大小。如有必要则联合术中消融局部治疗。1例患者接受半肝及半肝以上切除。术后出血、感染、肝功能受损、胆瘘等为主要术后并发症,并发症分级根据Clavien-Dindo分级标准。
1.3 研究指标及随访术后采用微信、电话、患者住院复查及门诊复诊进行随访,每三月行全腹+盆腔增强CT或MRI检查以及胃肠道肿瘤标志物复查,评估手术效果及有无复发,若发现可能为复发病灶即行穿刺活检以确定是否为肿瘤复发或进展。随访截至2020年12月31日。
1.4 统计学方法采用SPSS19.0软件进行统计分析。采用Cox回归分析法进行多因素分析。P < 0.05为差异有统计学意义。
2 结果 2.1 疗效评价所有患者均完成结直肠肿瘤根治性切除术以及肝脏转移瘤切除手术,41例患者为结直肠原发灶和肝转移灶同期切除,27例患者为二期切除。68例患者均获得随访,随访6~64月,中位随访时间30月。所有患者的生存期为33.5~69.1月, 中位生存期为53月。
2.2 单因素分析结果直肠癌肝转移灶中PD-L1基因阳性患者经手术治疗远期疗效单因素中,年龄、性别、是否腹腔镜手术、糖类抗原19-9、有无辅助化疗、初诊CEA水平、肝转移瘤数量、手术联合局部治疗差异均无统计学意义(P > 0.05),而无放疗、N分期、RAS基因突变状态、T分期为T0~1期、MMR表达缺失(dMMR)和Duck分期、肝转移灶最长径以及肝转移间隔 < 1年差异有统计学意义(P < 0.05),见表 1。
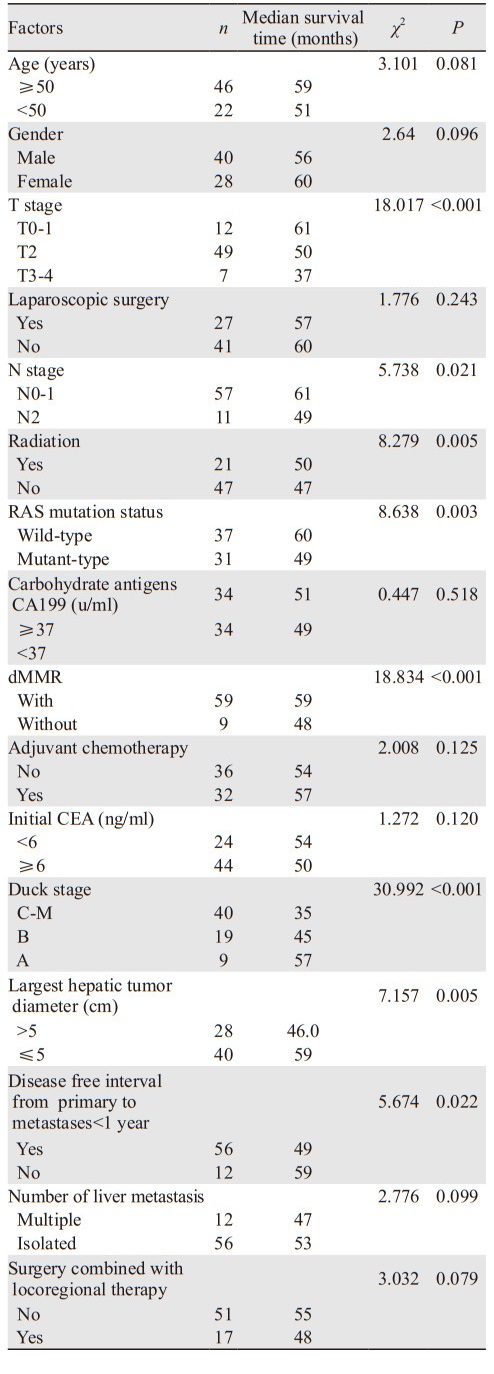
|
将有无放疗、N分期、RAS基因突变状态、T分期为T0~1期、dMMR和Duck分期、肝转移灶最长径及肝转移间隔 < 1年以上单因素分析中有统计学意义的单因素导入Cox多因素回归模型进行统计学分析,结果表明:无dMMR(P=0.012)、Duck分期A(P=0.000)、肝转移间隔 > 1年(P=0.020)及肝转移灶最长径≤5 cm(P=0.006)为影响直肠癌肝转移灶中PD-L1基因阳性患者综合治疗后远期疗效的保护因素,见表 2。

|
目前,结直肠癌肝脏转移患者手术治疗策略仍以同期切除肝脏病灶和结直肠原发病灶为主流,也有一期切除结直肠原发病灶后化疗,二期行肝脏切除或肝脏优先(或化疗优先),或者一期肝切除后行辅助化疗,二期行结直肠病灶切除术等策略,手术前后管理辅以MDT多学科诊疗、转化治疗、新辅助治疗、辅助治疗等个体化治疗[5]。一般认为微卫星高频不稳定(high-level microsatellite instability, MSI-H)或dMMR的晚期结直肠癌预后较差,且对5-Fu化疗药物为基础的治疗耐药,而有研究表明:晚期结直肠癌患者PD-L1表达率与dMMR/MSI-H正相关,原因可能是dMMR/MSI-H结直肠癌会选择性高度上调多种免疫检查点的表达,如PD-L1、PD-1和IDO等,来抑制免疫激活的肿瘤微环境,进而使包括外科手术、转化治疗、新辅助治疗以及辅助治疗在内的个体化治疗对肝脏转移灶中PD-L1基因阳性结直肠癌肝转移患者的总生存改善并不显著[6-8]。本研究中,所有患者均完成结直肠肿瘤根治性切除术以及肝脏转移瘤切除手术,41例患者为结直肠原发灶和肝转移灶同期切除,27例患者为二期切除。所有患者的生存期为33.5~69.1月, 中位生存期为53月。有报道结直肠癌肝脏转移行肝切除患者的中位生存时间为57月,RAS基因野生型结直肠癌肝脏转移行肝切除患者的中位生存时间则高达74月[9],其中本研究经手术为主的个体化综合治疗肝脏转移灶中PD-L1基因阳性结直肠癌肝转移患者中位生存期与文献报道的结果相仿。原因可能与RAS基因突变患者PD-L1阳性表达率明显高于RAS基因野生型患者,RAS基因突变型患者预后普遍较野生型差相关[1],印证了国内外学者提出的RAS基因突变与PD-L1阳性表达率正相关和RAS基因突变结直肠癌肝脏转移行肝切除患者预后差于RAS基因野生型患者的结论。
本研究单因素分析结果表明:RAS基因突变的肝脏转移灶中PD-L1基因阳性结直肠癌肝转移患者手术为主的个体化综合治疗预后较差,RAS基因主要为KRAS基因突变,通过损伤RAS三磷酸鸟苷酸功能,引起细胞异常增殖和恶性转化,且有研究显示KRAS基因突变是表皮生长因子受体单克隆抗体治疗耐药的预测因素和结直肠癌肝转移预后相关[10],该研究结果与国外学者的研究结果类似,但更多研究表明KRAS突变状态作为结直肠癌肝转移预后标记物在学界未能达成共识[11],KRAS突变是否与结直肠癌肝转移预后相关尚需更多证据佐证。放疗为结直肠癌肝脏转移多学科个体化综合治疗的重要组成部分,均有报道放疗对结直肠癌肝脏转移患者病情缓解以及预后有积极作用[12],本研究中单因素分析无放疗却是患者的保护因子之一,这可能与PD-L1基因阳性结直肠癌肝转移患者既往或同步接受了全身化疗等其他治疗相关,也可能与原发肿瘤组织学、病灶体积和剂量分割方案等均存在差异相关以及可能与本研究中接受放疗的患者均为肝脏转移灶中PD-L1基因阳性结直肠癌肝转移接受以手术为主的综合治疗晚期患者,肝脏具有相对放射敏感性而放疗耐受性较低,预后较差相关,所以并未体现出放疗为结直肠癌肝转移患者的保护因子。一般认为,T、N分期即原发灶的侵犯深度、原发灶获取阳性淋巴结数量均为进展期肠癌最显著预后因素[13],本研究单因素分析显示较早的T、N分期均为肝脏转移灶中PD-L1基因阳性结直肠癌肝转移接受以手术为主的综合治疗后预后保护因子,有更多研究显示:在直肠癌患者中,已知新辅助的长程放疗或放化疗对淋巴结获取有负面影响。与直肠癌相反,结肠癌患者接受新辅助化疗后淋巴结数目减少与放疗无关。因此N分期是否为结直肠癌肝转移预后影响因子尚有分歧[14]。另外在肝转移灶方面,有临床研究证实:肝转移灶最长径 > 5 cm(HR=1.717, 95%CI: 1.102~2.637)以及肝转移间隔 < 1年(HR=1.673, 95%CI: 1.016~2.637)均是结直肠癌肝转移患者手术切除后生存的独立危险因素,有研究将这两项列入了临床危险评分体系[9]。本研究中,肝脏转移灶中PD-L1基因阳性结直肠癌肝转移患者手术为主的个体化综合治疗预后危险因素也为肝转移灶最长径及肝转移间隔 < 1年。也有研究指出:包含肝转移灶最长径以及肝转移间隔 < 1年等因素在内的临床危险评分体系有效性尚未得到广泛验证,且随着现代手术及药物治疗水平的发展,该评分体系已经不能满足临床需要[14]。本研究提示dMMR是肝脏转移灶中PD-L1基因阳性结直肠癌肝转移患者手术为主的个体化综合治疗预后危险因素之一,dMMR是晚期结直肠癌预后不良的指标,在早中期结直肠癌中结果却相反,已有大量的研究数据表明,dMMR/MSI-H是其预后良好的标志,也是术后接受5-Fu类单药辅助化疗不良预后的预测指标[15]。有研究显示:对于不同的原发灶Duck分期,结直肠癌肝转移手术切除治疗的总体生存率存在差异,另外较早的原发灶Duck分期是结直肠癌肝转移手术切除治疗预后的独立保护因素[16],本研究也证实了较早的原发灶Duck分期A为肝脏转移灶中PD-L1基因阳性结直肠癌肝转移患者手术为主的个体化综合治疗预后的保护因素之一。
本研究多因素分析中,Duck分期A为肝脏转移灶中PD-L1基因阳性结直肠癌肝转移患者手术为主的个体化综合治疗的保护性因子之一,原因可能是A期癌肿浸润深度限于直肠壁内,未穿出深肌层,且无淋巴结转移,大部分原发灶手术切除治疗效果较好,所以对预后的影响相对较小,另外有研究显示结直肠癌肝转移手术切除切除转移灶总体生存率在结直肠癌原发灶Duck不同等级分期中存在差异,原发灶Duck分期较早患者生存期较原发灶Duck分期较晚的患者长[16]。但有报道在结直肠肝转移患者中,新辅助治疗或转化治疗后,手术获取阳性淋巴结减少甚至获取淋巴结阴性,进而对原发灶Duck分期有影响,故原发灶Duck分期是否为肝脏转移灶中PD-L1基因阳性结直肠癌预后影响因子需更多证据支持[17]。国内有研究提示:结直肠癌肝转移手术患者的危险因素为肝转移灶最长径[14, 16],但对于肝转移灶最长径 > 5 cm还是3 cm才是结直肠癌肝转移手术患者的危险因素,并无更多研究说明。本研究中肝转移灶最长径 > 5 cm为肝脏转移灶中PD-L1基因阳性结直肠癌预后危险因子,佐证了较大的肝转移灶最长径的肝脏转移灶中PD-L1基因阳性结直肠癌患者预后较差。本研究中无dMMR患者预后较好,由于MSI-H结直肠癌具有高体细胞突变、低分化的黏液组织学特征、显著的周围及瘤内淋巴细胞浸润以及突出的克罗恩样淋巴反应特征,这些特征可以使肿瘤细胞易于被人体免疫系统识别,但是dMMR/MSI-H结直肠癌通过正向调节PD-L1表达,下调机体对肿瘤的免疫攻击,使肝脏转移灶中PD-L1基因阳性结直肠癌以手术为主的综合治疗的治疗效果降低[17-19],故无dMMR患者以手术为主的综合治疗效果较合并dMMR患者好,因而预后较好。另外,本研究中,以手术为主的综合疗法治疗肝转移间隔 < 1年的肝脏转移灶中PD-L1基因阳性结直肠癌患者预后均较肝转移间隔 > 1年患者差,而欧洲肿瘤学会(European Society for Medical Oncology, ESMO)专家指南指出:肝转移间隔 < 1年是结直肠癌肝转移高危因素,常规推荐先行新辅助治疗后再手术切除[20],本研究结果多因素分析提示肝转移间隔 > 1年是肝脏转移灶中PD-L1基因阳性结直肠癌患者预后的保护因素,进一步佐证了手术为主的综合疗法仍是治疗肝脏转移灶中PD-L1基因阳性结直肠癌患者有潜力的个体化治疗选择之一。研究表明:右半结肠较左半结肠的预后有所不同,右半结肠多见女性,易出现RAS、BRAF基因突变,有分层研究结果均表明,左半结肠癌总生存期和无进展生存期均优于右半结肠癌患者[21],本研究仅纳入有限的影响因素,并未进一步将左右半结肠解剖位置分层纳入研究,故以上相关预后影响因子对肝脏转移灶中PD-L1基因阳性左右半结肠癌患者预后有何影响,尚需进一步研究来验证。
综上所述,肝脏转移灶中PD-L1基因阳性结直肠癌患者的治疗仍是以手术为主的个体化综合治疗。无dMMR、Duck分期A、肝转移间隔 > 1年及肝转移灶最长径≤5 cm的肝脏转移灶中PD-L1基因阳性结直肠癌治疗效果较好,临床可推广应用;本研究仅分析肝脏转移灶中PD-L1基因阳性结直肠癌患者疗效及预后有限的影响因素,其他未涉及的对肝脏转移灶中PD-L1基因阳性结直肠癌患者的生存时间的影响因素仍需进一步研究。
作者贡献:
赵正强:选题设计,病例资料及数据收集,文章撰写和修改
陈珑:指导选题与设计
刘宇杰:病例资料及数据收集
田素青:病例资料收集
| [1] |
熊振芳. PD-L1调控结直肠癌增殖及侵袭转移机制的研究[D]. 南昌: 南昌大学, 2017. [Xiong ZF. Study on the mechanism of PD-L1 regulating the proliferation and metastasis of colorectal carcinoma[D]. Nanchang: Nanchang University, 2017.]
|
| [2] |
冯昌银, 郑巧灵, 黄建平, 等. 结直肠癌肿瘤原发灶与肝脏转移灶中PD-L1表达的差异性[J]. 临床与实验病理学杂志, 2018, 34(12): 1340-1344. [Feng CY, Zheng QL, Huang JP, et al. Diffrential expression of PD-L1 between primary and hepatic metastases of colorectal cancer[J]. Lin Chuang Yu Shi Yan Bing Li Xue Za Zhi, 2018, 34(12): 1340-1344.] |
| [3] |
宋天强. 同时性结直肠癌肝转移的治疗策略[J]. 中华肝胆外科杂志, 2020, 26(10): 725-729. [Song TQ. Treatment strategy of synchronous colorectal cancer liver metastases[J]. Zhonghua Gan Dan Wai Ke Za Zhi, 2020, 26(10): 725-729. DOI:10.3760/cma.j.cn113884-20200716-00374] |
| [4] |
王飞, 武健. 同时性结直肠癌肝转移的治疗进展[J]. 沈阳医学院学报, 2018, 20(2): 166-169. [Wang F, Wu J. Research Progress in the Treatment of Synchronous Colorectal Liver Metastasis[J]. Shenyang Yi Xue Yuan Xue Bao, 2018, 20(2): 166-169.] |
| [5] |
Ihnát P, Vávra P, Zonča P. Treatment strategies for colorectal carcinoma with synchronous liver metastases: Which way to go?[J]. World J Gastroenterol, 2015, 21(22): 7014-7021. DOI:10.3748/wjg.v21.i22.7014 |
| [6] |
Venderbosch S, Nagtegaal ID, Maughan TS, et al. Mismatch repair status and BRAF mutation status in metastatic colorectal cancer patients: A pooled analysis of the CAIRO, CAIRO2, COIN, and FOCUS studies[J]. Clin Cancer Res, 2014, 20(20): 5322-5330. DOI:10.1158/1078-0432.CCR-14-0332 |
| [7] |
Valentini AM, Di Pinto F, Cariola F, et a1. PD-L1 expression in colorectal cancer defines three subsets of tumor immune microenvironments[J]. Oncotarget, 2018, 1(9): 8584-8596. |
| [8] |
Llosa NJ, Cruise M, Tam A, et al. The vigorous immune microenvironment of microsatellite instable colon cancer is balanced by multiple counter-inhibitory checkpoints[J]. Cancer Discov, 2015, 5(1): 43-51. |
| [9] |
刘佳明, 刘伟, 徐达, 等. RAS基因突变对结直肠癌肝转移患者肝切除术后预后的影响[J]. 中华肝胆外科杂志, 2020, 26(1): 1-5. [Liu JM, Liu W, Xu D, et al. Impact of mutant RAS on prognosis of patients after hepatic resection for colorectal cancer liver metastases[J]. Zhonghua Gan Dan Wai Ke Za Zhi, 2020, 26(1): 1-5. DOI:10.3760/cma.j.issn.1007-8118.2020.01.001] |
| [10] |
Vauthey JN, Zimmitti G, Kopetz SE, et al. RAS mutation status predicts survival and patterns of recurrence in patients undergoing hepatectomy for colorectal liver metastases[J]. Ann Surg, 2013, 258(4): 619-627. DOI:10.1097/SLA.0b013e3182a5025a |
| [11] |
Schirripa M, Bergamo F, Cremolini C, et al. BRAF and RAS mutations as prognostic factors in metastatic colorectal cancer patients undergoing liver resection[J]. Br J Cancer, 2015, 112(12): 1921-1928. DOI:10.1038/bjc.2015.142 |
| [12] |
Méndez Romero A, Keskin-Cambay F, van Os RM, et al. Institutional experience in the treatment of colorectal livermetastases with stereotactic body radiation therapy[J]. Rep Pract Oncol Radiother, 2017, 22(2): 126-131. DOI:10.1016/j.rpor.2016.10.003 |
| [13] |
罗德庆. 淋巴结转移率与Ⅲ期结肠癌患者预后的关系[D]. 广州: 广州医科大学, 2018. [Luo DQ. Lymph node ratio with prognosis of stage Ⅲ colon cancer[D]. Guangzhou: Guangzhou Medical University, 2018.]
|
| [14] |
闫晓峦, 王崑, 包全, 等. 结直肠癌肝转移手术治疗预后及影响因素分析[J]. 中华肝胆外科杂志, 2020, 26(7): 508-513. [Yan XL, Wang K, Bao Q, et al. Prognosis and risk factors after surgical treatment for colorectal cancer liver metastases[J]. Zhonghua Gan Dan Wai Ke Za Zhi, 2020, 26(7): 508-513. DOI:10.3760/cma.j.cn113884-20200421-00216] |
| [15] |
解彤彤, 胡静, 杨觅, 等. PD-1/PD-L1在dMMR/MSI-H结直肠癌患者临床试验中的研究进展[J]. 现代肿瘤医学, 2019, 27(5): 885-888. [Xie TT, Hu J, Yang M, et al. Progression of the research on PD-1/PD-L1 in dMMR/MSI-H colorectal cancer[J]. Xian Dai Zhong Liu Yi Xue, 2019, 27(5): 885-888. DOI:10.3969/j.issn.1672-4992.2019.05.042] |
| [16] |
黄哲, 李开艳, 周萍萍, 等. 结直肠癌肝转移超声引导下经皮微波消融与手术切除疗效的对比分析[J]. 中华医学杂志, 2020, 100(9): 696-701. [Huang Z, Li KY, Zhou PP, et al. Comparative study of ultrasound-guided percutaneous microwave ablation and surgical resection for colorectal cancer with liver metastasis[J]. Zhonghua Yi Xue Za Zhi, 2020, 100(9): 696-701. DOI:10.3760/cma.j.issn.0376-2491.2020.09.010] |
| [17] |
Gatalica Z, Vranic S, Xiu J, et al. High microsatellite instability(MSI-H) colorectal carcinoma: A brief review of predictive biomarkers in the era of personalized medicine[J]. Fam Cancer, 2016, 15(3): 405-412. DOI:10.1007/s10689-016-9884-6 |
| [18] |
Llosa NJ, Cruise M, Tam A, et al. The vigorous immune microenvironment of microsatellite instable colon cancer is balanced by multiple counter inhibitory checkpoints[J]. Cancer Discov, 2015, 5(1): 43-51. |
| [19] |
蒋微琴, 陈功. 初始可切除的结直肠癌肝转移新辅助治疗的价值[J]. 肝胆胰外科杂志, 2019, 31(4): 203-207. [Jiang WQ, Chen G. The value of neoadjuvant therapy for initial resectablecolorectal cancer with liver metastasis[J]. Gan Dan Yi Wai Ke Za Zhi, 2019, 31(4): 203-207.] |
| [20] |
曹奇华, 许燕波, 徐栋. 结直肠癌免疫检查点治疗的研究进展[J]. 肿瘤防治研究, 2021, 48(3): 229-233. [Cao QH, Xu YB, Xu D. Research progress of immune checkpoint therapy on colorectal cancer[J]. Zhong Liu Fang Zhi Yan Jiu, 2021, 48(3): 229-233. DOI:10.3971/j.issn.1000-8578.2021.20.1060] |
| [21] |
Tejpar S, Stintzing S, Ciardiello F, et al. Prognostic and predictive relevance of primary tumor location in patients with RAS wildtype metastatic colorectal cancer: retrospective analyses of the CRYSTAL and TIRE-3 trials[J]. JAMA Oncol, 2017, 3(2): 194-201. DOI:10.1001/jamaoncol.2016.3797 |
 2021, Vol. 48
2021, Vol. 48


