文章信息
- 安罗替尼联合紫杉醇和顺铂一线治疗晚期食管鳞癌的疗效分析
- Clinical Efficacy of Anlotinib Combined with Paclitaxel and Cisplatin as First-line Treatment of Advanced Esophageal Squamous Cell Carcinoma
- 肿瘤防治研究, 2021, 48(7): 719-722
- Cancer Research on Prevention and Treatment, 2021, 48(7): 719-722
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.21.0095
- 收稿日期: 2021-01-25
- 修回日期: 2021-04-24
食管癌是常见的恶性肿瘤,根据2018年全球癌症统计数据显示,其发病率和死亡率分别排在第七位和第六位;中国是食管癌高发地,其发病率和死亡率分别居中国第五位和第四位[1]。早期食管癌临床症状不明显,且多发生在经济欠发达地区,体检普及率及就诊率低,发现时多为晚期,无局部治疗机会,自然病程仅6~8月。晚期食管癌的治疗主要以化疗为主,目前临床上常用紫杉醇类药物联合顺铂用于食管鳞癌一线化疗,但预后较差,因此亟待探索更有效的治疗方案。安罗替尼是我国本土自主研发的一种口服小分子抗血管生成药物,通过抑制血管内皮生长因子受体(vascular endothelial growth factor receptor, VEGFR)、成纤维细胞生长因子受体(fibroblast growth factor receptor, FGFR)1-4、血小板衍生生长因子受体(platelet derived growth factor receptors, PDGFR)α/β、c-Kit等多个靶点,发挥抗肿瘤血管生成及抑制肿瘤生长的双重作用[2]。有研究显示安罗替尼单药二线治疗晚期食管鳞癌延长mPFS达1.61月,并且不良反应可耐受[3]。目前国内多个临床研究均探索在一线化疗的基础上联合免疫检查点抑制剂或者小分子靶向药物治疗晚期食管鳞癌,结果目前尚未公布。本文回顾性分析了应用安罗替尼联合紫杉醇和顺铂方案对比单纯化疗治疗50例晚期食管鳞癌患者的临床疗效及不良反应,现报道如下。
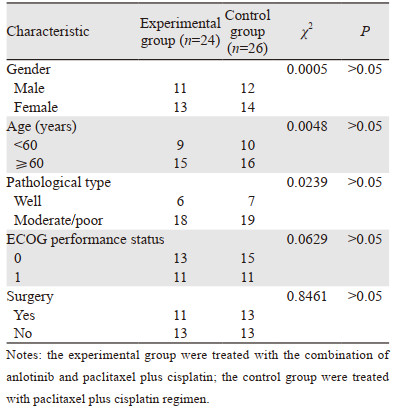
1 资料与方法 1.1 病例资料及分组收集2019年1月—2020年3月安阳市肿瘤医院内科收治的50例明确病理诊断为晚期食管鳞状细胞癌患者资料,年龄为48~75岁,中位年龄为65岁,其中男23例、女27例。患者PS评分均在0~2分,治疗前血、尿、粪常规、生化、心电图、血压、凝血功能均无明显异常,内镜下均无活动性出血及溃疡形成,预计生存期在3月以上,1月内无外伤、手术史、脑转移、大血管侵犯和不可控的高血压;并且有影像学(CT或者MRI)可测量或可评价的病灶(食管等空腔脏器不能为靶病灶)。50例患者中,24例患者接受安罗替尼联合紫杉醇和顺铂方案治疗(研究组);26例患者接受紫杉醇和顺铂单纯化疗(对照组)。两组基线资料差异无统计学意义(P > 0.05),见表 1。末次随访时间为2020年11月15日,中位随访时间为12月。
|
研究组方案:盐酸安罗替尼胶囊10 mg、口服、1次/日、d1~d14,紫杉醇注射液135 mg/m2、d1、用药前给予激素预处理,顺铂60~75 mg/m2、静脉滴注、d1~d3。化疗期间进展,则进入二线治疗,若6周期后评价为CR、PR或SD,则进入安罗替尼维持治疗,剂量同前,病情进展或患者不能耐受则停药。对照组方案:紫杉醇注射液150~175 mg/m2,顺铂75 mg/m2,使用方法同研究组。21天为一周期。
1.3 疗效评价标准 1.3.1 近期疗效根据WHO提供的实体瘤疗效评价标准(RECICIST1.1)分为:所有靶病灶消失为完全缓解(CR)、靶病灶直径之和比基线水平减少至少30%为部分缓解(PR)、靶病灶改变的程度介于PR与PD两者之间为病变稳定(SD)、所有测量的靶病灶直径之和相对增加至少20%,绝对值增加至少5 mm为疾病进展(PD);以CR+PR为客观有效率(ORR);以CR+PR+SD为疾病控制率(DCR);化疗每2周期评价一次,病灶采用CT、MRI和彩超进行测量,以评价疗效。
1.3.2 远期疗效通过电话、门诊及住院病历的方式随访,末次随访时间为2020年11月15日,统计患者的无进展生存时间(PFS)及总生存期(OS)。PFS为从开始治疗到全身任何部位肿瘤进展的时间;OS为从开始化疗至患者任何原因死亡的时间。
1.4 毒性反应评价根据WHO抗癌药物急性和亚急性毒性反应标准(0~Ⅳ度)评估毒性反应。
1.5 统计学方法采用IBM SPSS26.0统计软件进行数据分析,组间差异比较采用χ2检验,PFS及OS运用Kaplan-Meier法绘制生存曲线,应用Log rank检验计算,不良反应采用Fisher精确检验,以P < 0.05为差异有统计学意义。
2 结果 2.1 近期疗效全组50例患者,其中对照组1例因5周期化疗期间出现疾病进展而停止用药,余患者均完成6周期化疗,均可评价疗效,其中研究组CR 2例、PR 18例、SD 4例、无PD患者,对照组无CR患者、PR 14例、SD 11例、PD 1例,研究组客观有效率(20/24, 83.33%)和疾病控制率(24/24, 100%)均高于对照组(14/26, 53.84%)和(25/26, 96.15%),两组客观有效率差异有统计学意义(χ2=4.986, P < 0.05),疾病控制率差异无统计学意义(χ2=4.607, P > 0.05)。
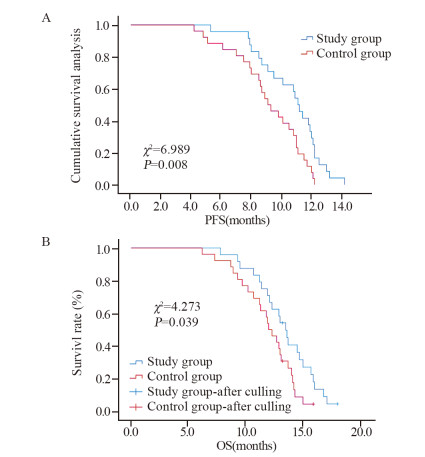
2.2 远期疗效Kaplan-Meier法和Log rank检验结果显示:研究组中位PFS 10.6月(95%CI: 10.3~11.8月)明显长于对照组的9.13月(95%CI: 7.7~10.4月),差异有统计学意义(χ2=6.989, P=0.008);研究组中位OS 13.4月(95%CI: 12.590~14.41月)明显优于对照组的11.8月(95%CI: 10.876~13.124月),差异有统计学意义(χ2=4.273, P=0.039),见图 1。
|
| 图 1 研究组与对照组患者PFS(A)和OS(B)的比较 Figure 1 Comparison of PFS(A) and OS(B) between experimental group and control group |
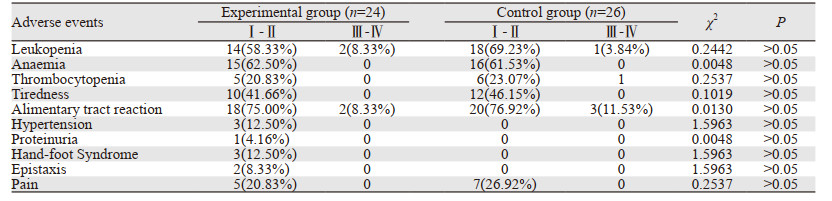
两组主要不良反应为血液毒性和消化道反应,其中研究组中有2例出现Ⅳ度白细胞降低,对照组出现1例粒缺性发热,给予粒细胞集落刺激因子及抗生素等对症治疗后均接受紫杉醇和顺铂减量20%的化疗,安罗替尼未减量,消化道反应考虑和顺铂有关,给予三联止吐药后均可继续治疗。研究组较对照组增加的不良反应有:高血压(2例1级,1例2级),服用降血压药物后,血压均能控制,并能进行后续正常治疗;手足综合征(3例,均为1级),用尿素软膏后好转;鼻出血(2例1级),表现为偶发鼻血,未经临床治疗自行缓解;蛋白尿(1例1级),应用百令胶囊后继续治疗。两组不良反应差异无统计学意义(P > 0.05),见表 2。
|
日本的一项研究显示:食管鳞癌化疗药物单药应答率为15%~50%,其中铂类(52%)、紫杉醇(44%)单药活性较高,双药应答率为36%~55%,较单药高。目前NCCN及CSCO食管鳞癌治疗指南均推荐紫杉醇联合铂类为一线治疗,但疗效不满意。近年来,免疫检查点抑制剂和分子靶向治疗的研究及应用为食管鳞癌患者带来了新的治疗选择。2019年FDA批准帕博丽珠单抗用于治疗转移性食管鳞癌的二线治疗,2019年CSCO食管癌诊疗指南更新了复发转移性食管鳞癌二线及以上治疗策略,安罗替尼为Ⅱ级推荐,这为晚期食管鳞癌患者带来了一线希望。本研究探索一线治疗中安罗替尼联合化疗的安全性和疗效,希望能给晚期食管鳞癌患者带来更多生存获益。
目前针对食管癌的靶向治疗药物有:抗EGFR通路、抗HER-2、VEGF及VEGFR通路、抗PD-1及PD-L1的药物。其中抗EGFR通路药物有西妥昔单抗、帕尼单抗、尼妥珠单抗、厄洛替尼、吉非替尼和埃克替尼,虽然都有一定的作用,但疗效欠佳,需要更多的生物标记来预测其疗效。抗HER-2的药物有曲妥珠单抗和拉帕替尼,主要在食管胃结合处腺癌的治疗中有获益。抗VEGF及VEGFR通路的药物有贝伐珠单抗、舒尼替尼和索拉非尼,研究较多的仍在食管胃结合部腺癌方面。我国食管癌病理类型有别于西方国家,90%以上为食管鳞癌[4],国外报道较少,我国自主研发的抗VEGFR通路药物有阿帕替尼和安罗替尼,在食管鳞癌研究中均显示出对晚期食管鳞癌具有良好的疗效。
目前认为与肿瘤血管生成关系最为密切的是VEGFR-2所介导的信号通路,故目前上市的抗血管生成药物多以VEGFR-2作为主要靶点[5-9]。相比于其他抗血管生成药物,安罗替尼对VEGFR-2、VEGFR-3的抑制活性最强,同时,安罗替尼还能有效地抑制PDGFR、FGFR和干细胞生长因子受体等激酶,具有强烈的抗肿瘤血管生成和抑制肿瘤生长的双重作用[10-11]。
本研究应用安罗替尼联合紫杉醇和顺铂旨在提高患者的肿瘤缓解深度和远期生存率,改善患者预后,结果2例获得CR,研究组DCR和ORR分别为100%和83.33%;对照组DCR和ORR分别为96.15%和53.84%,ORR差异有统计学意义,DCR差异无统计学意义。研究组PFS(10.6月)比对照组(9.13月)延长了近1.5月,研究组OS(13.4月)比对照组(11.8月)延长了1.6月,提示安罗替尼联合组远期疗效均优于单纯化疗组。化疗组不良反应主要为轻度消化道反应和骨髓抑制,重度较少见,研究组常见不良事件及其发生率为:手足综合征(12.5%)、高血压(12.5%)、鼻出血(8.33%)、蛋白尿(4.16%),较对照组明显增多,但均为Ⅰ~Ⅱ级,经积极对症处理后可继续用药。本研究结果表明安罗替尼联合紫杉醇和顺铂方案一线治疗晚期食管鳞癌疗效肯定,耐受性好,提示安罗替尼为食管鳞癌患者提供了治疗上的新选择。
随着新药和新方法的出现,食管癌治疗策略也在发生着变化,这使得临床医生能够在循证医学的基础上为患者更好地选择精准化和个体化的治疗方案。对于靶向治疗,怎样筛选出优势人群,寻求更能预测疗效和预后的生物标志物是未来研究的方向。
作者贡献:
杨晓利:资料收集及论文撰写
王彩玲:数据的统计分析及随访
夏金:论文修改
王俊生:论文指导
| [1] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
Syed YY. Anlotinib: First Global Approval[J]. Drugs, 2018, 78(10): 1057-1062. DOI:10.1007/s40265-018-0939-x |
| [3] |
Huang J, Xiao JX, Fang WT, et al. Anlotinib in chemotherapy-refractory metastatic esophageal squamous cell carcinoma (ESCC): a randomized, double-blind, multicenter phase Ⅱ trial[J]. J Clin Oncol, 2019, 37(4_suppl): 95. DOI:10.1200/JCO.2019.37.4_suppl.95 |
| [4] |
Thrumurthy SG, Chaudry MA, Thrumurthy SSD, et al. Oesophageal cancer: risks, prevention, and diagnosis[J]. BMJ, 2019, 366: l4373. |
| [5] |
Li J, Qin S, Xu J, et al. Apatinib for chemotherapy-refractory advanced metastatic gastric cancer: results from a randomized, placebo-controlled, parallel-arm, phase Ⅱ trial[J]. J Clin Oncol, 2013, 31(26): 3219-3225. DOI:10.1200/JCO.2013.48.8585 |
| [6] |
Ding J, Chen X, Dai X, et al. Simultaneous determination of apatinib and its four major metabolites in human plasma using liquid chromatography-tandem mass spectrometry and its application to a pharmacokinetic study[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2012, 895-896: 108-115. DOI:10.1016/j.jchromb.2012.03.027 |
| [7] |
Roviello G, Ravelli A, Polom K, et al. Apatinib: a novel receptor tyrosine kinase inhibitor for the treatment of gastric cancer[J]. Cancer Lett, 2016, 372(2): 187-191. DOI:10.1016/j.canlet.2016.01.014 |
| [8] |
Koch S, Tugues S, Li X, et al. Signal transduction by vascular endothelial growth factor receptors[J]. Biochem J, 2011, 437(2): 169-183. DOI:10.1042/BJ20110301 |
| [9] |
Scott AJ, Messersmith WA, Jimeno A. Apatinib: a promis-ing oral antiangiogenic agent in the treatment of multiple solid tumors[J]. Drugs Today (Barc), 2015, 51(4): 223-229. DOI:10.1358/dot.2015.51.4.2320599 |
| [10] |
Xie C, Wan X, Quan H, et al. Preclinical characterization of anlotinib, a highly potent and selective vascular endothelial growth factor receptor-2 inhibitor[J]. Cancer Sci, 2018, 109(4): 1207-1219. DOI:10.1111/cas.13536 |
| [11] |
Taurin S, Yang CH, Reyes M, et al. Abstract 3244: treatment of endometrial cancer cells with a new small tyrosine kinase inhibitor targeting mutated fibroblast growth factor receptor-2[C]. Washington: AACR Annual Meeting 2017, 2017.
|
 2021, Vol. 48
2021, Vol. 48
