文章信息
- 骨肉瘤软组织肿块骨化程度与患者临床病理特征的相关性
- Association Between Osteogenic Differentiation in Soft Tissue Lump and Clinicopathological Characteristics of Osteosarcoma Patients
- 肿瘤防治研究, 2021, 48(9): 859-863
- Cancer Research on Prevention and Treatment, 2021, 48(9): 859-863
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.21.0082
- 收稿日期: 2021-01-21
- 修回日期: 2021-07-10
2. 350005 福州,福建医科大学附属第一医院病理科
2. Department of Pathology, The First Affiliated Hospital of Fujian Medical University, Fuzhou 350005, China
骨肉瘤(Osteosarcoma)是临床最常见的原发性恶性骨肿瘤,其中普通型骨肉瘤占所有骨肉瘤的80%以上[1]。化疗结合手术治疗是目前普通型骨肉瘤的标准治疗模式,患者的5年生存率从不足20%提高到60%~70%,但复发或远处转移的骨肉瘤患者5年生存率仍较差,化疗耐药是影响骨肉瘤预后的关键因素[2]。因此,预测骨肉瘤患者化疗效果和预后有助于临床采用更积极有效的治疗方案,从而提高生存率。本研究通过回顾性分析,探究化疗前骨肉瘤软组织肿块内成骨与临床病理特征的相关性,为骨肉瘤患者最佳治疗方案选择提供参考依据。
1 资料与方法 1.1 一般资料收集2000年5月—2015年5月期间于本院手术治疗的258例骨肉瘤患者临床病理资料。纳入标准:年龄小于40岁,发病部位在长骨,有明显软组织肿块,病理学诊断(术前穿刺活检和术后病理均证实)为骨肉瘤,接受了规范化疗(阿霉素、顺铂、甲氨蝶呤、异环磷酰胺)和手术,定期随访并有完整临床资料。临床资料包括肿瘤Enneking分期、局部X线、HE染色和免疫组织化学染色、化疗后肿瘤坏死率、复发和转移情况、总生存时间和转移后生存时间。由于不规则骨病变解剖结构复杂、预后较差,且其X线无法显示清楚软组织成骨情况,所以本研究排除了不规则骨来源的病例。
1.2 评估方法 1.2.1 影像学评估在标准X线片上,由两位影像科医师独立对软组织肿块进行肿瘤性成骨评估,仅少量钙化(面积≤5%)的为无成骨型,部分钙化(5% < 面积≤50%)的为部分成骨型,软组织内明显钙化(面积 > 50%)的为成骨型。
1.2.2 病理学评估(1) 穿刺组织成骨程度分级:化疗前软组织穿刺活检标本通过HE染色观察其中骨组织形态,并用尼康数码显微镜摄像头拍摄图像,结合图像分析软件计算骨样组织在每个视野(100×)的面积(面积=长×宽/106 mm2),见图 1A。肿瘤细胞标志物SATB2免疫组织化学染色后,寻找成骨区域骨肉瘤细胞最密集的地方,拍照计数高倍视野(400×)肿瘤细胞数量,每张切片取3个典型区域拍照计数后求平均值,见图 1B,以SATB2阳性细胞数/骨样组织面积作为最终数值,应用x-Tile软件确定骨肉瘤软组织病变成骨程度最佳截断值(cutoff value),将成骨程度分为Ⅰ级(≥100)、Ⅱ级(30~100)和Ⅲ级(0~30)。以上评估由两位病理医师独立完成。(2)肿瘤坏死率:按照HUVOS标准[3]对接受新辅助化疗的样本进行肿瘤坏死率评估。基于化疗前MRI结果对术中切除肿瘤最大切面取材,计算每个切片残存肿瘤细胞百分比,最后以平均值作为每个样本的最终结果,使用X-tile软件依据肿瘤细胞总体生存情况对肿瘤化疗反应敏感度进行分组(敏感组:残存肿瘤细胞≤10%; 不敏感组:残存肿瘤细胞 > 10%)。以上评估由两位病理医师独立完成。

|
| A: the osteoid matrix area was (length×width/106)mm2 (HE ×100); B: SATB2 positive cells (IHC ×400). 图 1 骨肉瘤软组织成骨程度分级 Figure 1 Ossification grade in soft tissue lump of osteosarcoma |
穿刺活检组织病理确诊后进行临床分期并接受新辅助化疗,方案为:阿霉素75 mg/m2、顺铂100 mg/m2,间隔异环磷酰胺10 g/m2,每三周一个化疗周期。两个周期后进行手术治疗,根据影像学设计的外科边界选择保肢或截肢。术后评估肿瘤坏死率,残存肿瘤细胞≤10%时,继续原方案进行术后辅助化疗四个周期,残存肿瘤细胞 > 10%时,加用大剂量甲氨蝶呤10 g/m2。
1.4 随访住院化疗期间,每6周行肺部CT和局部X线片检查。辅助化疗结束后,前两年每3月随访1次,第3~5年每6月随访1次,第6年起每年随访1次。随访时间截至2020年6月30日。如发现复发或转移,记录肿瘤复发和转移时间。如患者死亡,记录患者死亡时间和原因。
1.5 统计学方法使用SPSS19.0软件进行统计学分析。计数资料采用χ2检验或Fisher精确检验。影像学成骨情况与病理学成骨分级的相关性采用Kendall’s tau-b相关分析。用Kaplan-Meier曲线及Log rank检验进行预后单因素分析并比较组间差异显著性。P < 0.05为差异具有统计学意义。
2 结果 2.1 骨肉瘤患者临床资料本研究共纳入258例患者,符合入组条件的为189例。患者基本临床资料见表 1。
X线显示无成骨型43例,部分成骨型114例,成骨型32例,相对应的病理形态学分级为Ⅰ级41例,Ⅱ级116例,Ⅲ级32例,有2例X线表现为无成骨型的患者病理形态学为Ⅱ级。Kendall’s tau-b相关分析结果表明,影像学软组织成骨情况与病理学成骨分级高度一致(相关系数=0.98, P < 0.001),见图 2。
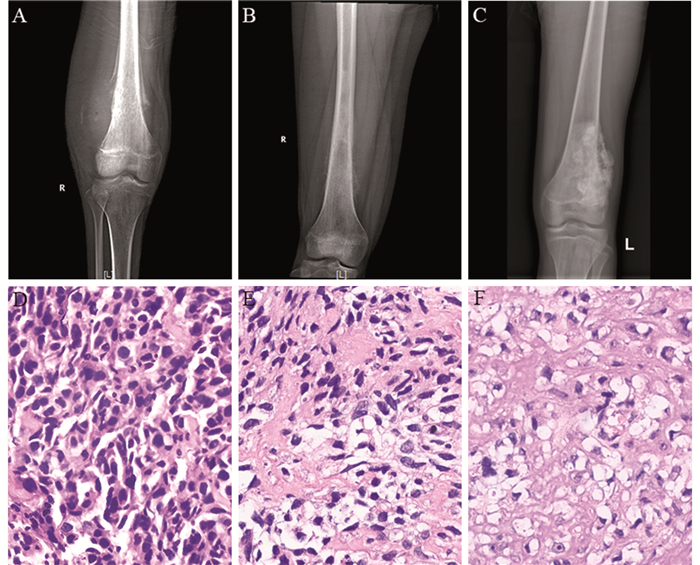
|
| Local X-ray before chemotherapy showed non-osteoblastic type (A), partially osteoblastic type (B) and osteoblastic type (C) in soft tissue lump of osteosarcoma. HE staining (400×) showed gradeⅠ(D), grade Ⅱ (E) and grade Ⅲ (F) osteogenesis, respectively. 图 2 骨肉瘤软组织内影像学成骨与病理学成骨分级的相关性 Figure 2 Correlation between imaging osteogenesis and pathological osteogenesis grade in soft tissue lump of osteosarcoma |
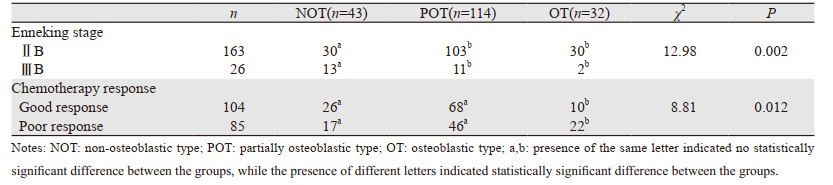
ⅢB期患者中无成骨型占30.2%(13/43),部分成骨型占9.6%(11/114),成骨型6.3%(2/32),三组比较差异有统计学意义(P=0.002),见表 2。进一步分析显示无成骨型患者ⅢB期占比显著高于部分成骨型(P=0.001)和成骨型(P=0.010)患者。以上结果表明,无成骨型骨肉瘤更具有转移潜能。
|
无成骨型与部分成骨型患者化疗敏感率分别为60.5%(26/43)和59.6%(68/114),成骨型的化疗敏感者比例为31.3%(10/32),三组比较差异有统计学意义(P=0.012),见表 2。进一步分析显示成骨型患者化疗敏感度明显低于无成骨型(P=0.012)或部分成骨型(P=0.004),差异有统计学意义。
2.5 成骨情况与患者预后的相关性单因素分析结果显示,与无成骨型组相比,部分成骨型(P=0.009)及成骨型(P=0.001)骨肉瘤患者的总生存期均较长,差异有统计学意义。部分成骨型与成骨型骨肉瘤患者总生存期差异无统计学意义(P=0.080)。除此之外,发生远处转移后,成骨型骨肉瘤患者带瘤生存期长于无成骨型骨肉瘤患者,虽然差异无统计学意义(P=0.078)。而部分成骨型与无成骨型(P=0.662)或成骨型(P=0.109)组发生转移后的生存期差异无统计学意义,见图 3。

|
| 图 3 骨肉瘤不同成骨分型患者总生存期(A)及转移后生存期(B)差异分析 Figure 3 Overall survival(A) and post-metastatic survival (B) of osteosarcoma patients with different osteoblastic types |
肿瘤复发转移和化疗耐药是影响骨肉瘤患者疗效的主要原因[4]。无效化疗不仅使患者承受不良反应,还有可能延误手术时机,使保肢困难甚至形成远处转移,因此化疗效果的预测具有重要意义。马焕等通过观察化疗前后动态增强MRI定量参数变化评估骨肉瘤新辅助化疗疗效,结果表明,化疗反应良好者动态增强磁共振定量参数在化疗前、后存在较明显的变化[5]; 陈海妹等发现基于T1WI影像组学列线图是骨肉瘤患者1年内复发的独立预测因子,在治疗前即可预测骨肉瘤术后1年内的复发风险[6]。本研究通过回顾性分析189例骨肉瘤患者化疗前局部X线,将骨肉瘤分成无成骨型、部分成骨型和成骨型。无成骨型或部分成骨型骨肉瘤化疗敏感度高于成骨型患者。尽管化疗敏感度较高,无成骨型骨肉瘤患者总生存期仍短于部分成骨型和成骨型患者,提示化疗前骨肉瘤软组织肿瘤性成骨情况对患者化疗敏感度和预后判断有重要意义。
骨肉瘤的特征性表现是恶性梭形肿瘤细胞产生骨样基质。骨样基质的量和成熟程度在影像学上表现为不同程度的成骨,但是骨肉瘤的骨膜反应性成骨或骨质被肿瘤破坏后,机体启动的修复性成骨在影像学上与肿瘤性成骨难以区分。因此,本研究选择软组织肿块作为研究对象,避开骨膜成骨和反应性成骨的干扰,其可直接代表肿瘤性成骨情况。超微结构分析显示,细胞外骨样基质的数量与肿瘤细胞分化程度有关,骨样基质越成熟,分化程度越高,成骨现象越明显[7]。本研究结果同样证实,在骨肉瘤患者中,影像学上软组织骨化程度和病理学对肿瘤性成骨的评估高度一致。
骨肉瘤成骨分化程度与肿瘤恶性程度相关。从低度恶性的骨肉瘤进展为高度恶性的骨肉瘤过程中,成骨分化相关标志基因表达降低[8-9],而成骨分化程度在临床表现为X线上的骨化程度。本研究结果显示,软组织肿块无明显成骨的骨肉瘤患者虽然化疗效果更好,但远处转移率更高,一旦耐药进展或转移,病情进展迅速,生存时间短。而软组织肿块成骨的骨肉瘤患者,化疗相对不敏感,但转移率低,即使转移,生存期也较长,表现出类似高分化骨肉瘤的临床特点。部分成骨的普通型骨肉瘤占大部分,影像学和临床表现更复杂,提示这类骨肉瘤患者的肿瘤具有更大的异质性,其软组织肿块中既有不成骨的高度恶性肿瘤成分,又有成骨的高分化肿瘤成分。肿瘤的高度恶性部分决定其生物学行为,所以在本研究中,部分成骨的骨肉瘤在化疗敏感度与无成骨型更一致。
骨肉瘤的新辅助化疗明显提高了保肢率,但并未进一步提高骨肉瘤的总生存率[10]。2020版中国临床肿瘤学会经典型骨肉瘤诊疗指南也提出,为了避免术前化疗期间肿瘤进展,对于ⅡA期和没有保肢条件的ⅡB期患者,部分有经验的医师会推荐不行术前化疗,直接手术[11]。本研究结果也表明,成骨明显的骨肉瘤化疗敏感度较差。因此,对于成骨明显的骨肉瘤,在肿瘤外科边界允许、远处转移风险低的情况下可以考虑直接手术,术后进行辅助化疗,在理论上对部分患者可能具有更好的临床获益,但仍需更多的病例和临床研究来证实。
作者贡献
吴朝阳、王生淋:临床数据分析、文章撰写
沈荣凯、陈飞:收集研究数据
林建华、朱夏:患者随访、数据分析
张真真:研究方案设计、病理实验、论文修改
| [1] |
Hirose K, Okura M, Sato S, et al. Gnathic giant-cell-rich conventional osteosarcoma with MDM2 and CDK4 gene amplification[J]. Histopathology, 2017, 70(7): 1171-1173. DOI:10.1111/his.13141 |
| [2] |
Scotlandi K, Picci P, Kovar H. Targeted therapies in bone sarcomas[J]. Curr Cancer Drug Targets, 2009, 9(7): 843-853. DOI:10.2174/156800909789760410 |
| [3] |
Rosen G, Marcove RC, Caparros B, et al. Primary osteogenic sarcoma: the rationale for preoperative chemotherapy and delayed surgery[J]. Cancer, 1979, 43(6): 2163-2177. DOI:10.1002/1097-0142(197906)43:6<2163::AID-CNCR2820430602>3.0.CO;2-S |
| [4] |
Wang SN, Luo S, Liu C, et al. miR-491 Inhibits Osteosarcoma Lung Metastasis and Chemoresistance by Targeting αB-crystallin[J]. Mol Ther, 2017, 25(9): 2140-2149. DOI:10.1016/j.ymthe.2017.05.018 |
| [5] |
马焕, 李振辉, 李鹍, 等. 动态增强MRI定量参数评估骨肉瘤新辅助化疗疗效价值[J]. 中华肿瘤防治杂志, 2019, 26(6): 421-426. [Ma H, Li ZH, Li K, et al. Quantitative dynamic contrast enhanced MRI for assessment of osteosarcoma response to neoadjuvant chemotherapy[J]. Zhonghua Zhong Liu Fang Zhi Za Zhi, 2019, 26(6): 421-426.] |
| [6] |
陈海妹, 刘金, 程梓轩, 等. 基于多中心T1WI影像组学列线图治疗前预测骨肉瘤一年内复发的价值[J]. 中华放射学杂志, 2020, 54(9): 874-881. [Chen HM, Liu J, Cheng ZX, et al. Value of radiomics nomogram based on T1WI for pretreatment prediction of relapse within 1 year in osteosarcoma: a multicenter study[J]. Zhonghua Fang She Xue Za Zhi, 2020, 54(9): 874-881. DOI:10.3760/cma.j.cn112149-20200512-00675] |
| [7] |
王国红, 郭直岳, 石松林, 等. 肉桂酸对人骨肉瘤MG-63细胞增殖和分化的影响[J]. 中国药理学通报, 2012, 28(9): 1262-1266. [Wang GH, Guo ZY, Shi SL, et al. Effect of cinnamic acid on proliferation and differentiation of human osteosarcoma MG-63 cells[J]. Zhongguo Yao Li Xue Tong Bao, 2012, 28(9): 1262-1266. DOI:10.3969/j.issn.1001-1978.2012.09.018] |
| [8] |
Ying M, Liu G, Shimada H, et al. Human osteosarcoma CD49f(-) CD133(+) cells: impaired in osteogenic fate while gain of tumorigenicity[J]. Oncogene, 2013, 32(36): 4252-4263. DOI:10.1038/onc.2012.438 |
| [9] |
Eliseev RA, Dong YF, Sampson E, et al. Runx2-mediated activation of the Bax gene increases osteosarcoma cell sensitivity to apoptosis[J]. Oncogene, 2008, 27(25): 3605-3614. DOI:10.1038/sj.onc.1211020 |
| [10] |
Hasei J, Sasaki T, Tazawa H, et al. Dual programmed cell death pathways induced by p53 transactivation overcome resistance to oncolytic adenovirus in human osteosarcoma cells[J]. Mol Cancer Ther, 2013, 12(3): 314-325. DOI:10.1158/1535-7163.MCT-12-0869 |
| [11] |
牛晓辉. 中国临床肿瘤学会(CSCO)经典型骨肉瘤诊疗指南[M]//赫捷, 李进, 马军, 等. 中国临床肿瘤学会(CSCO)常见恶性肿瘤诊疗指南2020. 北京: 人民卫生出版社, 2020: 454. [Niu XH. Guidelines of Chinese Society of Clinical Oncology (CSCO) conventional osteosarcoma[M]//He J, Li J, Ma J, et al. Guidelines of Chinese Society of Clinical Oncology (CSCO) common malignant tumor 2020. Beijing: People Health Publishing House, 2020: 454.]
|
 2021, Vol. 48
2021, Vol. 48



