文章信息
- 三维重建在单操作孔胸腔镜肺段切除术治疗早期非小细胞肺癌中的应用:一项倾向性评分匹配研究
- Application of Three-dimensional Reconstruction in Single Utility-port Thoracoscopic Segmentectomy for Early Stage Non-small Cell Lung Cancer: A Propensity Score-matched Analysis
- 肿瘤防治研究, 2021, 48(4): 387-392
- Cancer Research on Prevention and Treatment, 2021, 48(4): 387-392
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.21.0072
- 收稿日期: 2021-01-19
- 修回日期: 2021-03-11
早期非小细胞肺癌(non-small cell lung cancer, NSCLC)患者行肺段切除具有与肺叶切除相似的肿瘤学效果,并且可保留更多的肺功能从而提高生活质量[1-2]。电视辅助胸腔镜手术(video-assisted thoracic surgery, VATS)的发展使早期肺癌肺段切除易于推广,其中单操作孔胸腔镜技术学习曲线较短且切口较少,可作为治疗早期NSCLC的优先选择。美国国立综合癌症网络(National Comprehensive Cancer Network, NCCN)制定的NSCLC临床实践指南(5.2017版)中已将微创肺段切除术作为肺癌推荐术式之一[3]。基于CT影像的三维重建技术(three-dimensional computed tomography bronchography and angiography, 3D-CTBA)是通过软件将输入的CT断层二维影像资料转化成三维立体几何图像[4]。本研究旨在运用倾向性评分匹配(propensity score matching, PSM)原理模拟随机对照试验(randomized controlled trial, RCT)研究术前三维重建技术在单操作孔胸腔镜解剖性肺段切除术治疗早期NSCLC中的临床应用价值。
1 资料与方法 1.1 一般资料与分组回顾性收集2018年11月至2020年11月于福建省立医院胸外科单治疗组行单操作孔VATS肺段切除术的150例NSCLC患者的临床资料。纳入标准:(1)胸部CT提示肺部单发或多发磨玻璃结节,病变范围直径≤2 cm,磨玻璃成分≥50%,倍增时间≥400 d;(2)术前临床分期T1a~T1b、N0、M0;(3)术后病理为恶性肿瘤。排除标准:(1)心肺功能差不能耐受单肺通气;(2)合并严重肝肾功能不全及心脑血管病;(3)右肺中叶结节和术中淋巴结采样冰冻阳性需行扩大肺叶切除者;(4)术前行新辅助放化疗。按术前是否自愿完成三维重建分为重建组(58例)和非重建组(92例)。本研究获福建省立医院伦理委员会批准(批准号为2020-015-01)。
1.2 术前三维重建术前均完成肺部结节薄层增强或平扫CT扫描,按《2018肺部结节诊治中国专家共识》[5]推荐参数和扫描范围,扫描层厚≤1.5 mm,扫描成像和患者解剖学靶区需对齐,使用传统屏气技术。拷贝CT图像DICOM格式数据,导入Mimics 21.0(Materialise's interactive medical image control system 21.0)软件进行3D-CTBA,重建支气管、肺动静脉、肺结节并用不同颜色标记区分,作出距肺结节表面2 cm或距肺结节表面不小于结节直径的切缘球,根据病变位置手动设计切割平面和切除区域,确保从肺实质切除边缘到肿瘤边缘的最短距离≥2 cm或肿瘤最大径,术者根据三维重建图像模拟手术并制定最佳方案。非重建组常规完成肺部结节薄层CT增强或平扫扫描,术者根据二维CT图像制定手术方案。拟切除肺段分为简单肺段和复杂肺段,简单肺段定义为仅切除1个段间平面(包括LS1+2+3、LS4+5、LS6、LS8+9+10、RS6、RS7+8+9+10),复杂肺段定义为切除两个或更多段间平面(除简单肺段以外的肺段)。
1.3 单操作孔胸腔镜手术方法两组患者均采用全身麻醉,双腔气管插管,单肺通气,健侧90度卧位。观察孔取腋中线第7或8肋间,切口1.5 cm;操作孔取腋前线第4或5肋间,切口3~4 cm。对于重建组,将电脑3D重建图像放置在手术室胸腔镜屏幕旁,台下助手按术者需求转动、显示或隐藏三维重建图像,使术者可以实时参照进行手术,见图 1;对于非重建组,术者参照二维CT图像脑海重建立体图像进行手术,对处于肺实质深部或肺段交界难以判断靶段归属的肺结节,术前用弹簧圈或亚甲蓝辅助定位。以支气管为核心,动脉先行,弱化段间静脉处理,游离解剖病灶肺段支气管、动静脉至足够远,切割闭合器夹闭病灶肺段支气管后纯氧鼓肺,确认靶段支气管辨认正确后将其切断,病灶肺段所在肺叶膨胀后单肺通气,萎陷与膨胀的肺组织形成界限,沿此界限使用直线切割闭合器切除病灶,送检冰冻病理,对于原位腺癌或微浸润性腺癌进行N1、N2站淋巴结采样,对其他类型进行系统性淋巴结清扫,淋巴结冰冻病理阳性者改为肺叶切除术并行系统性淋巴结清扫。于观察孔留置胸管1根,于患侧腋后线第9肋间留置细的纵隔管1根,逐层关胸。
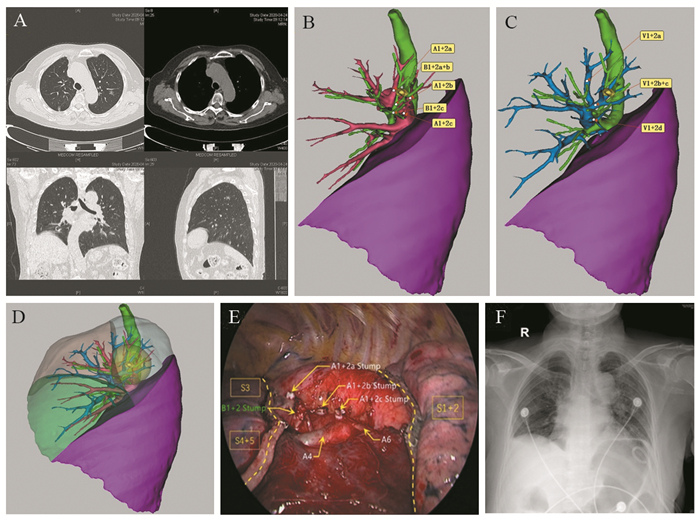
|
| A: the contrast-enhanced CT of a 74-year-old female patient, showed a mixed ground-glass nodule with a maximum diameter of 1.0 cm in the left upper lobe; B: three-dimensional reconstruction imaging showed the positional relation among the nodule, bronchi and pulmonary arteries; C: the reconstructed image showed the positional relation among the nodule, bronchi and pulmonary veins; D: a translucent margin sphere 2.0 cm from the surface of the nodule was reconstructed, a S1+2 segmentectomy of the left upper lobe was indicated; E: the operation proceeded as planned, the operation time was 90 min, the intraoperative blood loss was 10 ml and the histological type was invasive adenocarcinoma (lepidic predominant); F: the chest X-ray at day 1 post-surgery showed good expansion of the left lung. 图 1 复杂肺段术前三维重建1例 Figure 1 A case of preoperative three-dimensional reconstruction of complex segmentectomy |
IBM SPSS26.0统计软件进行PSM等统计学分析,1:1配对,卡钳值0.02,匹配因素包括:年龄、性别、吸烟史、BMI、CT肿瘤最大径、肿瘤位置、%FEV1、拟切除肺段类型共8个混杂因素。正态分布的计量资料以均值±标准差(x±s)表示,组间比较采样t检验;非正态分布的计量资料以中位数及四分位数(IQR)表示,组间比较采用Wilcoxon秩和检验;计数资料以百分比(%)表示,组间比较采用χ2检验或Fisher精确检验。P < 0.05为差异有统计学意义。
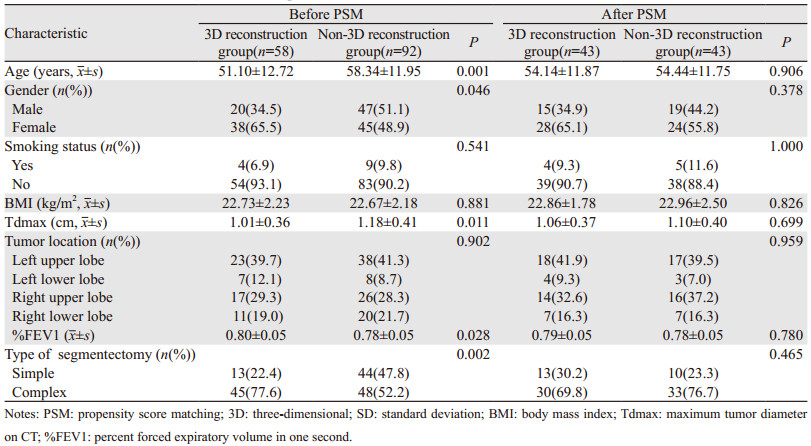
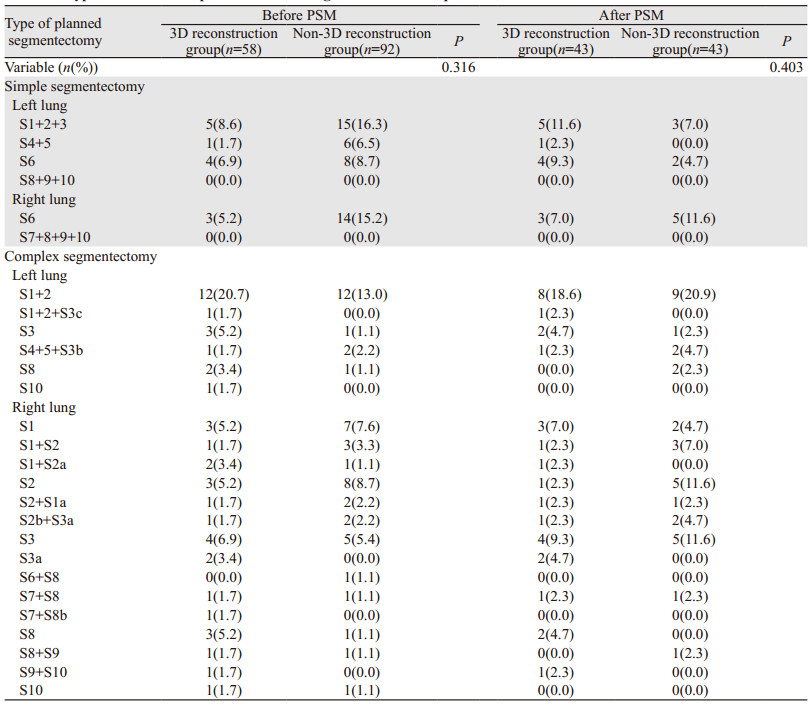
2 结果 2.1 倾向性评分匹配58例重建组和92例非重建组经过PSM后,最终43例重建组患者和43例非重建组患者成功匹配。匹配前,两组患者基线特征不平衡,在年龄、性别、CT肿瘤最大径、%FEV1、拟切除肺段类型方面差异有统计学意义(均P < 0.05),匹配后,8个混杂因素在两组间的差异均无统计学意义(均P > 0.05),患者基线特征平衡,见表 1。拟切除肺段类型的具体分布,见表 2。
|
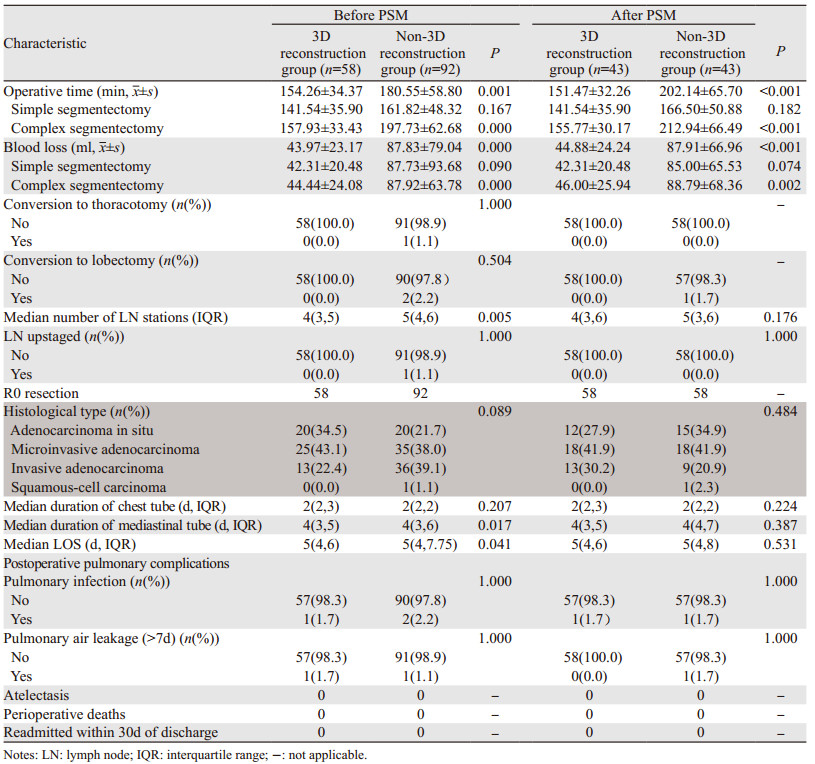
(1) 重建组匹配后:手术时间151.47±32.26 min,其中简单肺段141.54±35.90 min,复杂肺段155.77±30.17 min;术中出血量44.88±24.24 ml,其中简单肺段42.31±20.48 ml,复杂肺段46.00±25.94 ml;无转开胸、转肺叶切除手术患者,淋巴结切除站数4(3,6),无淋巴结升期患者,43例均完成R0切除,留置胸管时间2(2,3)天,留置纵隔管时间4(3,5)天,术后住院时间5(4,6)天,术后肺部感染1例,无肺漏气(> 7天)、肺不张、围手术期死亡或术后30天再入院患者,见表 3。(2)非重建组匹配后:手术时间202.14±65.70 min,其中简单肺段166.50±50.88 min,复杂肺段212.94±66.49 min;术中出血87.91±66.96 ml,其中简单肺段85.00±65.53 min,复杂肺段88.79±68.36 min,无转开胸患者,1例患者因切缘宽度不足转肺叶切除,淋巴结切除站数5(3,6),无淋巴结升期患者,43例均完成R0切除,术后组织学类型1例鳞癌,留置胸管时间2(2,2)天,留置纵隔管时间4(4,7)天,术后住院时间5(4,8)天,1例患者出现肺漏气(> 7天),无肺部感染、肺不张、围术期死亡或术后30天再入院患者,见表 3。(3)两组患者匹配前在手术时间、复杂肺段手术时间、术中出血量、复杂肺段术中出血量、淋巴结切除站数、留置纵隔管时间、术后住院天数差异有统计学意义(均P < 0.05),其余指标差异无统计学意义;而匹配后两组患者手术时间、复杂肺段手术时间、术中出血量、复杂肺段术中出血量差异有统计学意义(均P < 0.05),但切除淋巴结站数、留置纵隔管时间、术后住院天数等观察指标差异无统计学意义(均P > 0.05),见表 3。
既往研究发现肺段切除术治疗早期肺癌的疗效和肺叶切除术相似,并可以减少并发症和死亡率,有利于保护术后肺功能,VATS解剖性肺段切除术已广泛应用于ⅠA期NSCLC的手术治疗[6-9]。在拥有相似的远期生存时间以及复发率的前提下,VATS肺段切除术相比开胸肺段切除术创伤小,而达芬奇机器人肺段手术因费用高、设备要求高、学习曲线长等原因未能普及,因此,VATS已成为主流的肺段切除手术方式。随着数字化医学影像技术的发展,三维重建技术已广泛应用于胸腔镜精准肺段切除的术前评估、模拟手术方案、术中指导支气管和肺血管的识别、术中肺结节定位等多方面,在强调个体化治疗的医学时代,术前三维重建图像可通过360度视角,从多层次、多角度观察判断,快速直观地识别个体解剖模式,是精准肺段切除的重要保障。三维重建软件如Mimics、OsiriX、DeepInsight等的出现使3D-CTBA技术变得简单易学且可靠,已有研究报道三维重建准确率在95%以上[6, 10],而相比于3D打印模型,三维重建图像成本低廉、患者易于接受。与此同时,三维重建指导手术亦存在局限性,比如术前进行胸部CT扫描的肺已膨胀并处于正常位置,而VATS手术中的手术侧肺塌陷并缩回,因此在两种不同情况下肺段支气管和血管的行进路径有所差异,这需要积累经验以准确识别。
本研究表明,与非重建组相比,重建组在复杂肺段手术的手术时间更短、术中出血量更少,差异有统计学意义,而对于简单肺段手术,两组的手术时间和术中出血量差异无统计学意义,这与既往回顾性研究结果一致[11]。我们分析两组围手术期结果差异的产生可能有以下原因:(1)肺段的解剖结构存在很多变异。Subotich等[12]报告,有16.4%的患者存在肺血管变异,其中47.8%的患者发生在左肺。三维重建图像可直观立体地显示个体化的支气管、肺血管变异,术中实时对照,提高手术准确性从而缩短手术时间,减少术中游离肺血管过程的失误从而减少出血;(2)三维重建段间结节定位的优势。有研究表明大约30%的Ⅰ期NSCLC的肿瘤处于段间[13]。为了保证安全切缘,对此类结节常需扩大段切除术范围从相邻肺段切除部分肺组织或行联合亚段切除。三维重建可虚拟安全的球形边缘,术前即可明确切除靶段的准确范围[14],从而减少术中失误;(3)简单肺段的手术切除技术较成熟、较少涉及亚段支气管、肺血管的解剖分离,故两组的结果相似,但重建组均值小于非重建组,需要更大样本量的多中心研究进一步探讨。
本研究结果显示,重建组和非重建组在中转开胸率、中转肺叶率、淋巴结切除站数、淋巴结升期、组织学类型、留置胸管时间、留置纵隔管时间、术后住院时间、术后常见肺部并发症发生率差异无统计学意义,这与既往研究结果一致[11]。而另外一项研究表明,重建组中转肺叶率小于非重建组[15]。出现这种差异的原因可能是本中心开展单操作孔肺段手术约有10年之久,术者具有较丰富操作经验且本研究入组患者术前基础情况较好,两组患者出现术中意外情况少,导致该观察指标的统计效能下降,需进一步研究阐明。
本研究的亮点是采用PSM的统计学方法较大程度地消除了相关混杂因素对围手术期结果的影响,并统一了单操作孔胸腔镜手术方式从而使研究设计更加严谨,同时为了避免不同术者以及学习曲线对手术效果造成的影响,本研究在术者前期已积累大量手术经验基础上,选取了单治疗组病例。本研究也存在一些不足:(1)单中心、小样本量的回顾性研究,难以避免选择性偏倚,因此需要多中心、大样本量的RCT研究进一步验证本研究的结果;(2)关注的是围手术期短期临床结果,尚需进一步长期随访复查,对比分析两组患者的远期临床结果差异。
综上所述,在早期NSCLC的微创手术治疗中,术前三维重建有助于提高单操作孔胸腔镜复杂肺段手术效率并减少术中出血,三维重建配合单操作孔胸腔镜肺段手术,将给更多早期肺癌患者的手术治疗提供安全保障,值得推广应用。
作者贡献:
尤培林:试验实施、数据整理与分析、论文设计及撰写
陈文树:试验实施、论文审阅与修改
赵力澜:论文指导与统计分析
郭天兴:论文审阅
朱立桓:试验实施、论文指导
涂鹏杰:试验实施、协助数据收集
黄建源:试验实施
潘小杰:指导试验实施、研究选题与设计、论文审阅与修改
| [1] |
Suzuki K, Saji H, Aokage K, et al. Comparison of pulmonary segmentectomy and lobectomy: safety results of a randomized trial[J]. J Thorac Cardiovasc Surg, 2019, 158(3): 895-907. DOI:10.1016/j.jtcvs.2019.03.090 |
| [2] |
Su H, Xie H, Dai C, et al. Procedure-specific prognostic impact of micropapillary subtype may guide resection strategy in small-sized lung adenocarcinomas: a multicenter study[J]. Ther Adv Med Oncol, 2020, 12: 1758835920937893. |
| [3] |
Ettinger DS, Wood DE, Aisner DL, et al. Non-small cell lung cancer, version 5.2017, NCCN clinical practice guidelines in oncology[J]. J Natl Compr Canc Netw, 2017, 15(4): 504-535. DOI:10.6004/jnccn.2017.0050 |
| [4] |
叶春林, 喻本桐. 三维CT支气管血管成像技术在精准肺段切除中应用的研究进展[J]. 中国医师杂志, 2019, 21(11): 1601-1604. [Ye CL, Yu BT. Application progress of 3D-CTBA technique in precise segmentatomy[J]. Zhongguo Yi Shi Za Zhi, 2019, 21(11): 1601-1604. DOI:10.3760/cma.j.issn.1008-1372.2019.11.001] |
| [5] |
中华医学会呼吸病学分会肺癌学组, 中国肺癌防治联盟专家组. 肺结节诊治中国专家共识(2018年版)[J]. 中华结核和呼吸杂志, 2018, 41(10): 763-771. [Lung Cancer Group of Chinese Respiratory Diseases Association, Expert Group of Chinese Lung Cancer Prevention and Control League. Chinese expert consensus on diagnosis and treatment of pulmonary nodules (2018 Edition)[J]. Zhonghua Jie He He Hu Xi Za Zhi, 2018, 41(10): 763-771. DOI:10.3760/cma.j.issn.1001-0939.2018.10.004] |
| [6] |
Ghaly G, Kamel M, Nasar A, et al. Video-assisted thoracoscopic surgery is a safe and effective alternative to thoracotomy for anatomical segmentectomy in patients with clinical stageⅠnon-small cell lung cancer[J]. Ann Thorac Surg, 2016, 101(2): 465-472. DOI:10.1016/j.athoracsur.2015.06.112 |
| [7] |
D'andrilli A, Rendina EA. Point: Should segmentectomy rather than lobectomy be the operation of choice for early-stage non-small cell lung cancer? Yes[J]. Chest, 2018, 153(3): 590-592. DOI:10.1016/j.chest.2017.10.038 |
| [8] |
Charloux A, Quoix E. Lung segmentectomy: does it offer a real functional benefit over lobectomy?[J]. Eur Respir Rev, 2017, 26(146): 170079. DOI:10.1183/16000617.0079-2017 |
| [9] |
Zhao ZR, Situ DR, Lau RWH, et al. Comparison of segmentectomy and lobectomy in stage IA adenocarcinomas[J]. J Thorac Oncol, 2017, 12(5): 890-896. DOI:10.1016/j.jtho.2017.01.012 |
| [10] |
Hagiwara M, Shimada Y, Kato Y, et al. High-quality 3-dimensional image simulation for pulmonary lobectomy and segmentectomy: results of preoperative assessment of pulmonary vessels and short-term surgical outcomes in consecutive patients undergoing video-assisted thoracic surgery[J]. Eur J Cardiothorac Surg, 2014, 46(6): e120-e126. DOI:10.1093/ejcts/ezu375 |
| [11] |
Qiu B, Ji Y, He H, et al. Three-dimensional reconstruction/personalized three-dimensional printed model for thoracoscopic anatomical partial-lobectomy in stageⅠlung cancer: a retrospective study[J]. Transl Lung Cancer Res, 2020, 9(4): 1235-1246. DOI:10.21037/tlcr-20-571 |
| [12] |
Subotich D, Mandarich D, Milisavljevich M, et al. Variations of pulmonary vessels: some practical implications for lung resections[J]. Clin Anat, 2009, 22(6): 698-705. DOI:10.1002/ca.20834 |
| [13] |
Horinouchi H, Nomori H, Nakayama T, et al. How many pathological T1N0M0 non-small cell lung cancers can be completely resected in one segment? Special reference to high-resolution computed tomography findings[J]. Surg Today, 2011, 41(8): 1062-1066. DOI:10.1007/s00595-010-4428-4 |
| [14] |
Kato H, Oizumi H, Suzuki J, et al. Thoracoscopic anatomical lung segmentectomy using 3D computed tomography simulation without tumour markings for non-palpable and non-visualized small lung nodules[J]. Interact Cardiovasc Thorac Surg, 2017, 25(3): 434-441. DOI:10.1093/icvts/ivx113 |
| [15] |
陶绍霖, 康珀铭, 李青元, 等. 三维CT支气管血管成像在机器人肺段切除术中的临床应用[J]. 中国胸心血管外科临床杂志, 2020, 27(10): 1155-1160. [Tao SL, Kang PM, Li QY, et al. Clinical application of three-dimensional computed tomography bronchography and angiography in robotic lung segmentectomy[J]. Zhongguo Xiong Xin Xue Guan Wai Ke Lin Chuang Za Zhi, 2020, 27(10): 1155-1160.] |
 2021, Vol. 48
2021, Vol. 48