文章信息
- 横纹肌肉瘤组织中JMJD2B和HIF-1α的表达及其对预后的意义
- Expression of JMJD2B and HIF-1α in Rhabdomyosarcoma Tissues and Their Prognostic Significance
- 肿瘤防治研究, 2021, 48(7): 699-703
- Cancer Research on Prevention and Treatment, 2021, 48(7): 699-703
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.21.0030
- 收稿日期: 2021-01-11
- 修回日期: 2021-05-12
横纹肌肉瘤(rhabdomyosarcoma, RMS)是一种来源于骨骼肌肉的高度侵袭性的软组织肉瘤,在儿童及青少年中多见[1]。尽管包括手术、化疗和放疗在内的综合治疗使中、低度风险RMS患者的5年生存率增加至约60%,但高风险RMS患者的预后仍不乐观[2],迫切需要更好的预后指标和治疗靶点。乏氧诱导因子-1α(hypoxia-inducible factor-1α, HIF-1α)在各种细胞中普遍表达,是正常和癌组织中缺氧反应的关键调节因子,其特定的负性转变机制正逐渐被阐明,并且作为潜在的抗癌药物靶点已经引起越来越多的关注[3]。组蛋白去甲基化酶JMJD2B是HIF-1α的下游靶点,其特征在于催化JmjC结构域[4],研究显示高表达的JMJD2B在肿瘤细胞的增殖、侵袭与迁移中发挥着重要作用[5]。本研究通过检测JMJD2B和HIF-1α在RMS组织中的表达情况,探讨JMJD2B和HIF-1α在RMS患者预后中的临床意义。
1 资料与方法 1.1 临床资料收集河北医科大学第四医院病理科2012年1月—2014年12月确诊的RMS石蜡组织标本78例。同时收集患者的性别、年龄、肿瘤大小、病理类型、危险度、治疗方案、肿瘤转移、肿瘤分期等临床病理资料。本研究获得患者的知情同意。
1.2 方法 1.2.1 免疫组织化学法所有标本经3.7%中性甲醛液固定,石蜡包埋,以4 µm厚度连续切片,HE染色。切片脱蜡水化后高压修复15 min滴加一抗,置4℃冰箱孵育过夜,PBS冲洗后滴加二抗,室温孵育20 min。显色3~5 min,HE对比染色,固定。所用抗体包括兔抗人HIF-1α(Abcam公司,抗体编号ABP51513,稀释度1:100),兔抗人JMJD2B抗体(Abcam公司,抗体编号A301-478A,稀释度1:100)。
1.2.2 免疫组织化学法结果判定所有病理切片由2位资深病理科专家分别判读。于每张切片中挑选染色均匀5个不相邻高倍视野(×400)测定免疫阳性细胞百分比。阳性标记为棕黄色颗粒,且JMJD2B和HIF-1α阳性表达均定位于细胞核。根据染色程度评价染色强度:染色阴性计0分,轻度染色计1分,中度染色计2分,强染色计3分;根据切片中阳性细胞百分比评分:无阳性细胞计0分,≤25%计1分,25%~50%计2分,> 50%~100%计3分。最后总评分=阳性强度评分×阳性百分比评分。0~3分为阴性(-);4~9为阳性(+++)[6]。
1.2.3 实时定量PCR将已切片的标本组织,置入2.0 ml消毒离心管中;经脱蜡水化后加入细胞裂解液和蛋白酶K,55℃过夜,待组织溶解完全后用TRIzol试剂(美国Invitrogen公司)提取RNA。我们设计了GAPDH和JMJD2B的特异性引物,见表 1。按照制造商的说明,使用LightCycler 480系统进行PCR实验。不添加UNG的50%SYBR GREEN通用PCR预混液(Applied Biosystems公司),正向和反向转录引物各50 nmol/L,反转录cDNA 2 μl。并设置扩增条件为95℃下5 min,然后进行45个循环,每个循环包括95℃下10 s,55℃下1 min和72℃下10 s。将反应物在95℃加热15 s,在65℃加热1 min以绘制熔解曲线,冷却至50℃持续10 s。
所有病例采用定期门诊或电话随访。总生存期(overall survival, OS)定义为从确诊RMS至死亡或末次随访日期的时间间隔。随访截至2020年1月。
1.3 统计学方法所有数据均采用SPSS21.0软件进行分析。组间比较采用独立样本t检验和χ2检验,相关性验证采用Spearman相关分析,生存分析采用Kaplan-Meier生存曲线、Log rank检验及Cox回归分析。P < 0.05为差异有统计学意义。
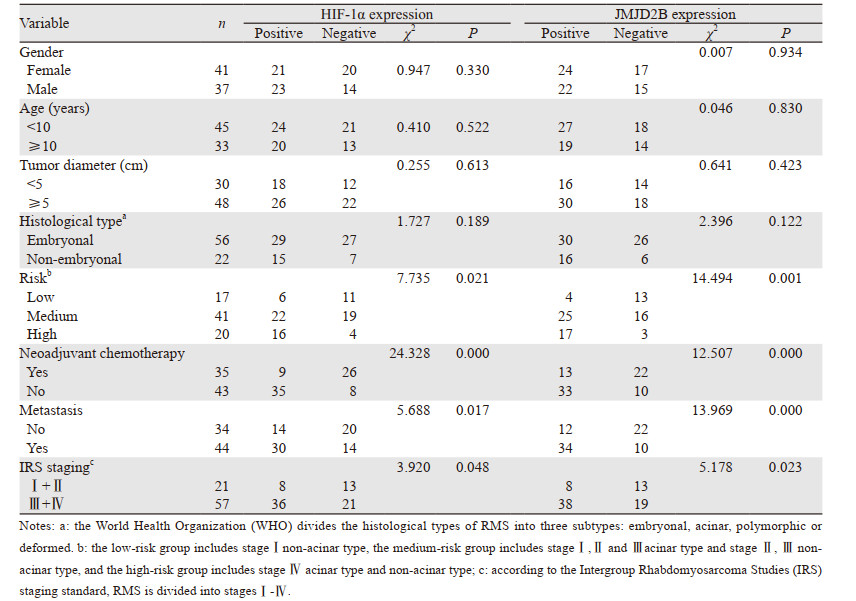
2 结果 2.1 临床病理特征78例RMS患者中女性41例,男性37例。年龄范围5~45岁,中位年龄8岁。生存时间范围6~95月,中位生存时间61月。死亡32例,死亡原因均为肿瘤。具体各临床病理参数见表 2。
|
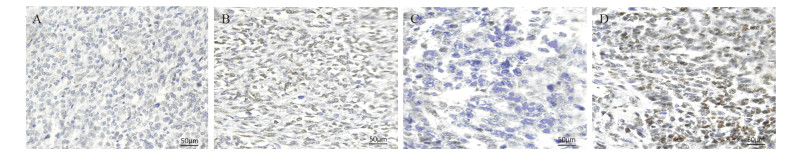
78例RMS患者JMJD2B和HIF-1α表达阳性例数分别为46例(59.0%)和44例(56.4%),二者在RMS患者组织中的表达均高于阴性对照组(均P < 0.05),见图 1。统计学显示JMJD2B和HIF-1α的表达水平与危险度级别、是否接受新辅助化疗、有无远处转移、肿瘤分期有关(均P < 0.05),而与患者性别、年龄、肿瘤直径、组织学分型无关(均P > 0.05),见表 2。
|
| A, C: negative expression; B, D: positive expression. 图 1 免疫组织化学法分析HIF-1α(A, B)和JMJD2B(C, D)在横纹肌肉瘤组织中的表达(IHC ×400) Figure 1 HIF-1α(A, B) and JMJD2B(C, D) expression levels in RMS tissues (IHC ×400) |
Spearman相关性分析显示JMJD2B和HIF-1α表达呈显著正相关(P < 0.001, r=0.518),见表 3。

|
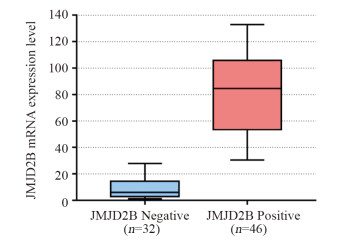
实时定量PCR实验显示蛋白表达阳性组的JMJD2B mRNA表达水平显著高于阴性组(P < 0.001),见图 2。
|
| 图 2 实时定量PCR验证横纹肌肉瘤组织样本中JMJD2B mRNA表达水平 Figure 2 mRNA expression level of JMJD2B in rhabdom yosarcoma samples validated by quantitative real-time PCR |
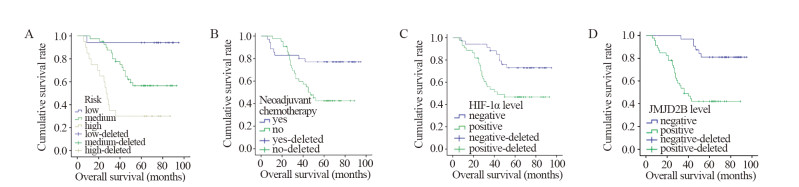
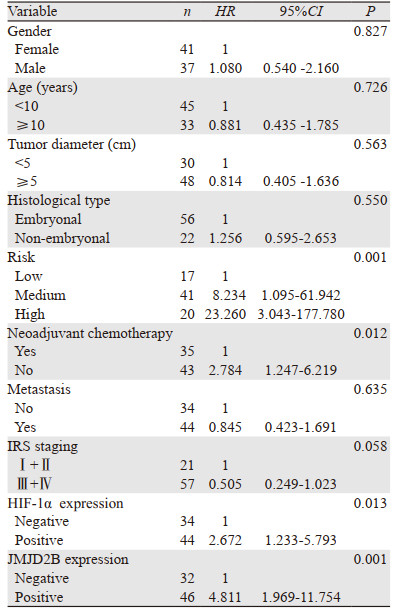
Kaplan-Meier生存曲线显示较高的危险度(P < 0.001)、未接受新辅助化疗(P=0.009)、HIF-1α(P=0.009)和JMJD2B(P < 0.001)的高表达与较短的OS显著相关,见图 3。单因素Cox回归显示危险度的级别、新辅助化疗的有无、HIF-1α和JMJD2B表达水平的高低可以影响RMS患者的临床预后(均P < 0.05),见表 4。进一步采用多因素Cox回归显示JMJD2B和危险度可作为RMS独立的预后因素,见表 5。JMJD2B高表达的RMS患者死亡风险增加。
|
| 图 3 横纹肌肉瘤患者的Kaplan-Meier生存曲线 Figure 3 Kaplan-Meier survival curves of RMS patients |
|

|
缺氧是实体瘤的常见特征,不仅在肿瘤发生中具有重要作用,还与转移风险增加及不良临床预后相关[7]。而作为缺氧反应的关键因子,HIF-1α通过调节糖酵解及相关辅助基因,帮助细胞适应缺氧环境并促进其恶性转变[8]。在本研究中,我们证实了HIF-1α在RMS组织中高表达并与低OS显著相关,这与先前的发现一致,即HIF-1α在其他类型癌症中的高表达会促进肿瘤恶化,与患者的不良预后相关[9]。这一作用可能与HIF-1α参与包括Akt、NF-κB、Wnt在内的多条信号通路有关,同时也为HIF-1α成为癌症患者潜在新型预后检测及治疗靶点提供了有力证据[10-11]。
作为HIF-1α下游靶点,JMJD2B被发现启动子序列中含有HIF-1α结合位点[12]。本试验也证实了HIF-1α和JMJD2B表达的正相关性。国外已有研究证明JMJD2B在癌症中高表达并导致不良临床预后[13-14],相关作用机制正被逐渐揭示。最新研究显示,JMJD2B的外源表达以p53依赖的方式增强了结肠癌细胞的皮下肿瘤生长[15]。此外在骨肉瘤中,JMJD2B可能通过上调成纤维细胞生长因子2的表达水平,促进肿瘤细胞的增殖、迁移和侵袭[16]。本研究发现JMJD2B和HIF-1α的高表达与高危组别、未接受新辅助化疗、肿瘤远处转移和高级别分期等不良临床病理变量显著相关。同时,JMJD2B和HIF-1α的高表达与OS的缩短显著相关,但经多因素Cox回归分析,只有JMJD2B是独立的预后指标。这些表明了JMJD2B和HIF-1α可能是RMS病程中影响预后的重要因素。JMJD2B可能是一种新的RMS预后标志物。然而JMJD2B和HIF-1α在RMS中的具体调控机制仍有待阐明。
本研究具有局限性。首先,免疫组织化学分析是半定量的,进一步探讨需要完善定量实验方法。其次,样本量较小,我们的结论应该在更大的样本中得到验证。
综上所述,JMJD2B和HIF-1α在RMS组织中高表达,并与不良临床病理特征和不良预后有关。JMJD2B可作为RMS患者临床预后的新指标。
作者贡献:
吴宏增:研究设计和操作、论文撰写
赵嘉政:研究操作、统计分析
赵祎、马晓伟:数据汇总、文献查阅
冯和林:研究设计和操作过程中的指导
| [1] |
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2020[J]. CA Cancer J Clin, 2020, 70(1): 7-30. DOI:10.3322/caac.21590 |
| [2] |
王佳楠, 张倩, 李芮冰, 等. 低剂量全氟辛酸对人横纹肌肉瘤细胞增殖和迁移及侵袭的影响[J]. 中华医学杂志, 2019, 99(11): 850-856. [Wang JN, Zhang Q, Li RB, et al. Influence of low dose perfluorooctanoate acid exposure to the cell proliferation, migration and invasion of the human muscle rhabdomyosarcoma cell line[J]. Zhonghua Yi Xue Za Zhi, 2019, 99(11): 850-856.] |
| [3] |
Jahangiri A, Dadmanesh M, Ghorban K. Suppression of STAT3 by S31-201 to reduce the production of immunoinhibitory cytokines in a HIF1-α-dependent manner: a study on the MCF-7 cell line[J]. In Vitro Cell Dev Biol Anim, 2018, 54(10): 743-748. DOI:10.1007/s11626-018-0299-6 |
| [4] |
Xu F, Li CH, Wong CH, et al. Genome-Wide Screening and Functional Analysis Identifies Tumor Suppressor Long Noncoding RNAs Epigenetically Silenced in Hepatocellular Carcinoma[J]. Cancer Res, 2019, 79(7): 1305-1317. DOI:10.1158/0008-5472.CAN-18-1659 |
| [5] |
Zhang J, Ren J, Hao S, et al. MiRNA-491-5p inhibits cell proliferation, invasion and migration via targeting JMJD2B and serves as a potential biomarker in gastric cancer[J]. Am J Transl Res, 2018, 10(2): 525-534. |
| [6] |
Huang C, Li Y, Li Z, et al. LIMS1 Promotes Pancreatic Cancer Cell Survival Under Oxygen-Glucose Deprivation Conditions by Enhancing HIF1A Protein Translation[J]. Clin Cancer Res, 2019, 25(13): 4091-4103. DOI:10.1158/1078-0432.CCR-18-3533 |
| [7] |
Bossler F, Kuhn BJ, Günther T, et al. Repression of Human Papillomavirus Oncogene Expression under Hypoxia Is Mediated by PI3K/mTORC2/AKT Signaling[J]. mBio, 2019, 10(1): e02323-18. |
| [8] |
Valli A, Morotti M, Zois CE, et al. Adaptation to HIF1α deletion in hypoxic cancer cells by upregulation of GLUT14 and creatine metabolism[J]. Mol Cancer Res, 2019, 17(7): 1531-1544. DOI:10.1158/1541-7786.MCR-18-0315 |
| [9] |
李钦, 邱建武. 基因干预后胶质瘤A172细胞中HIF-1α和VEGF的表达[J]. 肿瘤防治研究, 2019, 46(6): 509-514. [Li Q, Qiu JW. Expression of HIF-1α and VEGF in glioma A172 cells after gene intervention[J]. Zhong Liu Fang Zhi Yan Jiu, 2019, 46(6): 509-514. DOI:10.3971/j.issn.1000-8578.2019.18.1401] |
| [10] |
Zhang Z, Yao L, Yang J, et al. PI3K/Akt and HIF-1 signaling pathway in hypoxia-ischemia (Review)[J]. Mol Med Rep, 2018, 18(4): 3547-3554. |
| [11] |
Wen YA, Xiong X, Scott T, et al. The mitochondrial retrograde signaling regulates Wnt signaling to promote tumorigenesis in colon cancer[J]. Cell Death Differ, 2019, 26(10): 1955-1969. DOI:10.1038/s41418-018-0265-6 |
| [12] |
Liu X, Zhang Q, Zhao Y, et al. Association of JMJD2B and Hypoxia-Inducible Factor 1 Expressions with Poor Prognosis in Osteosarcoma[J]. Anal Cell Pathol (Amst), 2020, 2020: 2563208. |
| [13] |
Zhang H, Wang Z, Wang F, et al. IL-6 and IL-8 are involved in JMJD2A-regulated malignancy of ovarian cancer cells[J]. Arch Biochem Biophys, 2020, 684: 108334. DOI:10.1016/j.abb.2020.108334 |
| [14] |
Duan L, Perez RE, Chastain PD 2nd, et al. JMJD2 promotes acquired cisplatin resistance in non-small cell lung carcinoma cells[J]. Oncogene, 2019, 38(28): 5643-5657. DOI:10.1038/s41388-019-0814-6 |
| [15] |
Glaser SF, Heumüller AW, Tombor L, et al. The histone demethylase JMJD2B regulates endothelial-to-mesenchymal transition[J]. Proc Natl Acad Sci U S A, 2020, 117(8): 4180-4187. DOI:10.1073/pnas.1913481117 |
| [16] |
Li X, Dong S. Histone demethylase JMJD2B and JMJD2C induce fibroblast growth factor 2: mediated tumorigenesis of osteosarcoma[J]. Med Oncol, 2015, 32(3): 53. DOI:10.1007/s12032-015-0503-4 |
 2021, Vol. 48
2021, Vol. 48



