文章信息
- 白花丹醌通过E-cadherin增强替莫唑胺对人脑胶质瘤U251细胞迁移和侵袭的抑制作用
- Plumbagin Enhanced Inhibitory Effect of Temozolomide on Migration and Invasion of Human Glioma U251 Cells Through E-cadherin
- 肿瘤防治研究, 2021, 48(6): 576-580
- Cancer Research on Prevention and Treatment, 2021, 48(6): 576-580
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.21.0027
- 收稿日期: 2021-01-11
- 修回日期: 2021-03-02
胶质瘤(glioma)是颅内最常见的恶性肿瘤,目前的治疗手段包括手术、放疗、化疗、免疫治疗等,但平均生存期仍只有10~12月[1-2]。胶质瘤极强的侵袭性是导致胶质瘤术后复发率高的主要原因之一[3]。替莫唑胺(temozolomide, TMZ)是目前胶质瘤术后化疗的一线药物,临床试验已经证明其可以延长胶质瘤患者的生存期,但是因为化学耐药的存在,使其在胶质瘤的临床应用上进展不尽人意[4-5]。所以如何提高TMZ对胶质瘤细胞的杀伤作用成为我们关注的重点。E-cadherin已经在多种肿瘤中展现抑制肿瘤转移的作用[6-7]。其表达降低或缺失将破坏细胞间的连接,使肿瘤细胞间的黏附作用减弱,脱离原发病灶,从而发生侵袭和转移[8-9]。
白花丹醌(plumbagin, PL)是白花丹的主要活性成分[10]。白花丹醌作为一种民族药材,用药历史悠久,常用治跌打损伤等[11]。越来越多的证据表明,其在多种肿瘤细胞系中表现出抑制肿瘤生长的作用,尤其是抑制胶质瘤细胞增殖、迁移及侵袭的能力[12-13]。为此本研究对白花丹醌联合替莫唑胺对人脑胶质瘤U251细胞的迁移和侵袭作用及其机制进行探讨。
1 材料与方法 1.1 材料U251细胞系购自中国科学院上海细胞库;鼠抗E-cadherin单克隆抗体购自美国Abcam公司;白花丹醌购自中国上海纯优生物科技有限公司;Temozolomide(NSC 362856)购自美国MCE公司。鼠抗β-actin单克隆抗体购自中国Chemicon公司;CCK-8试剂盒购自中国碧云天生物公司;DMSO二甲基亚砜采购自上海生工(进口分装);胎牛血清、DMEM培养基采购自美国Gibco公司;基质胶购自美国Corning Biocoat(货号356234)。
1.2 方法 1.2.1 细胞培养人脑胶质瘤细胞用含10%的小牛血清的DMEM培养基,37℃、5%CO2、相对湿度90%的培养箱培养。细胞呈贴壁生长,待细胞长满瓶底后,弃掉培养液,用0.25%胰蛋白酶消化, 2~3天分瓶传代培养, 取对数生长期细胞用于实验。
1.2.2 CCK-8法检测胶质瘤细胞增殖按照说明书,常规消化细胞,分组制备单细胞悬液,平行接种于96孔培养板,每孔培养基总量100 µl,设3个平行孔,贴壁后实验组加入不同浓度药物(PL、TMZ、PL+TMZ),对照组加入相应DMSO,混合均匀;37℃、5%CO2培养箱中培养48 h后,每孔中加入10 µl CCK8液,继续培养3 h;酶标仪检测各孔OD值。
1.2.3 细胞划痕法检测胶质瘤细胞迁移能力取对数期U251细胞铺板,待细胞在六孔板内培养至基本融合,用200 µl微量移液枪头垂直划痕,PBS液冲洗3次后加入无血清培养基继续培养,按照分组加入DMSO、PL、TMZ和PL+TMZ,混合均匀,显微镜下观察48 h细胞体外迁移能力。
1.2.4 Transwell实验检测胶质瘤细胞侵袭能力取对数期U251细胞铺板,长满后用胰酶消化细胞,终止消化后,用含1%BSA的无血清培养基重悬细胞,调整细胞浓度至4×105个/毫升,实验组和对照组分别加上PL、TMZ、PL+TMZ联合用药和DMSO混匀处理。冰上操作用无血清DMEM培养基2:1稀释Matrigel,浓度为50 µg/ml,Transwell小室微孔膜上表面铺满Matrigel稀释液(每孔50 µl),然后将小室静置于37℃环境下,使Matrigel聚合成凝胶;取200 µl细胞悬液接种于Transwell小室的上室,轻轻摇晃使之均匀铺开,下室加入含10%FBS的DMEM完全培养基500 µl,继续培养48 h,取出上室用棉签轻擦去膜上方的细胞,多聚甲醛室温固定30 min,0.1%结晶紫染色20 min,PBS漂洗两次。每个上室随机取5个100倍视野拍照并计数细胞数,取平均值进行统计学分析。
1.2.5 蛋白质印迹检测蛋白表达变化应用0.1%DMSO, 1.25 μmol/L PL, 200 μmol/L TMZ, 1.25 μmol/L PL+200 μmol/L TMZ处理细胞48 h,用裂解液冰上裂解细胞30 min,收集蛋白,用BCA法测定蛋白浓度。经过转膜等操作后,用软件处理不同的条带,测量目标蛋白的含量。
1.3 统计学方法采用SPSS21.0软件处理数据,两样本间比较采用独立样本t检验,多组样本间比较采用单因素方差分析,P < 0.05为差异有统计学意义。
2 结果 2.1 白花丹醌可以增强替莫唑胺抑制胶质瘤U251细胞的增殖能力CCK-8结果显示分别应用0.1%DMSO、10 μmol/L TMZ、50 μmol/L TMZ、100 μmol/L TMZ、200 μmol/L TMZ和400 μmol/L TMZ处理U251细胞48 h后,细胞存活率下降,增殖抑制率分别为(0.87±0.18)%、(3.5±1.28)%、(5.69±2.39)%、(21.6±4.32)%、(60.7±2.58)%和(67.23±3.98)%;从中我们可以发现替莫唑胺浓度超过200 μmol/L后,再升高其浓度,U251细胞抑制率升高不明显,故联合用药选择浓度200 μmol/L。分别应用0.1%DMSO、1.25 μmol/L PL、2.5 μmol/L PL、5 μmol/L PL、10 μmol/L PL和20 μmol/L PL处理U251细胞48 h,细胞增殖抑制率为(0.79±0.22)%、(21.6±1.82)%、(27.1±1.54)%、(43.75±4.71)%、(61.08±3.28)%和(96.23±4.53)%。1.25 μmol/L为设置浓度梯度中最小值,故联合用药中百花丹醌选用此浓度。联合用药处理48 h后,U251细胞增殖抑制率为(75.69±2.35)%,明显高于单独应用白花丹醌(P=0.012)或替莫唑胺组(P=0.034),见图 1。
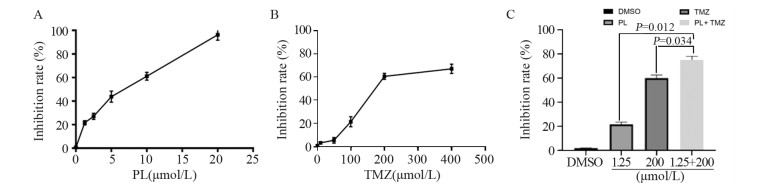
|
| PL: plumbagin; TMZ: temozolomide. 图 1 CCK-8检测PL(A)、TMZ(B)和PL+TMZ(C)处理后U251细胞增殖抑制率 Figure 1 Proliferation inhibition rate of U251 cells treated with PL(A), TMZ(B) and PL+TMZ(C) detected by CCK-8 |
细胞划痕实验结果显示,1.25 μmol/L白花丹醌联合替莫唑胺可以明显增强替莫唑胺抑制胶质瘤细胞迁移的能力(P=0.023),见图 2。
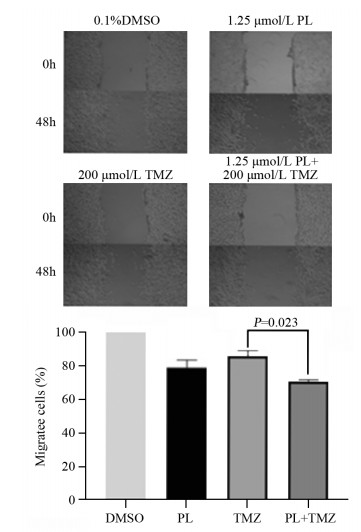
|
| 图 2 不同药物处理后U251细胞迁移能力的变化 Figure 2 Migration abilities of U251 cells treated with different drugs |
Transwell实验结果显示,联合用药后U251细胞的侵袭能力明显降低(P < 0.05),见图 3。
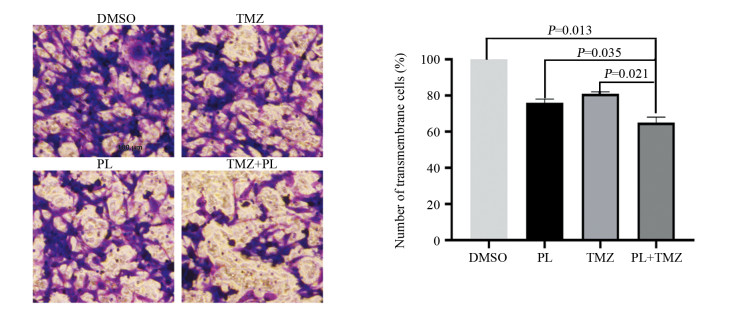
|
| 图 3 不同药物作用后U251细胞侵袭能力的变化 Figure 3 Invasion abilities of U251 cells after different drug treatments |
Western blot结果显示,和联合用药相比,DMSO对照组、TMZ组、PL组E-cadherin蛋白的表达明显减少(均P < 0.05),见图 4。
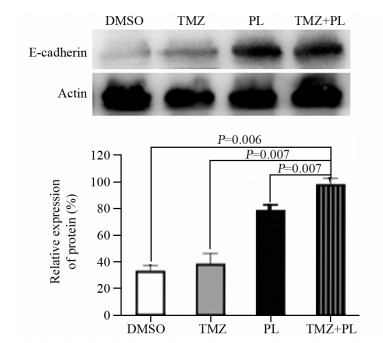
|
| 图 4 不同药物处理后U251细胞E-cadherin的表达情况 Figure 4 Expression of E-cadherin in U251 cells after different drug treatments |
由于胶质瘤单纯手术治疗效果不佳,自20世纪80年底以来,化疗成为脑胶质瘤重要的辅助治疗手段,而TMZ作为一线化疗药物易产生耐药[14]。提高胶质瘤细胞对替莫唑胺的敏感度成为人们关注的重点。部分研究表明一些化合物及化学药物可以增加替莫唑胺的耐药性,崔勇等[15]研究发现RNA干扰AKT2的表达可以提高胶质瘤裸鼠移植瘤替莫唑胺的敏感度;张春丽等[16]研究发现七氟醚可以降低人脑胶质瘤U251细胞替莫唑胺抵抗,从而提高替莫唑胺对胶质瘤细胞的杀伤能力;王新等[17]研究发现替莫唑胺联合放射治疗诱导人脑胶质瘤U251细胞自噬,从而增加替莫唑胺对胶质瘤的杀伤作用;还有研究表明地昔帕明[18]、二甲双胍[19]可以提高替莫唑胺对胶质瘤细胞的杀伤作用。本研究通过CCK-8法证明白花丹根茎中提取的中药单体白花丹醌可以提高替莫唑胺对胶质瘤细胞的增殖抑制作用、细胞划痕实验表明小剂量的白花丹醌可以提高替莫唑胺抑制胶质瘤细胞的迁移能力,蛋白免疫印迹实验证明联合用药后U251细胞E-cadherin蛋白的表达升高。E-cadherin属于钙黏素家族成员,有研究表明其和多种肿瘤的恶性行为相关。E-cadherin的升高表明肿瘤细胞迁移和侵袭能力下降[20],从而降低远处转移能力。有研究表明TMZ的耐药机制还包括以下几个方面:(1)DNA损伤修复。目前认为,TMZ耐药是O6-甲基鸟嘌呤DNA甲基转移酶(O6-methyl-guanine-DNA-methytransferase, MGMT)、错配修复(mismatch repair, MMR)、碱基切除修复(base excision repair, BER)等DNA损伤修复系统以及自噬、肿瘤干细胞等共同作用的结果;(2)肿瘤细胞的自噬。目前大量研究证实,自噬可能是肿瘤细胞面对治疗压力时的促生存反应,可促进肿瘤细胞的密集增殖以帮助肿瘤细胞抵御多种不利的环境因素(如化疗药物、放射线等),从而使肿瘤细胞在某些治疗中存活;(3)对于胶质母细胞瘤干细胞(GSCs)与胶质母细胞瘤(GBM)耐药性的关系,学界普遍认为GSCs的存在使GBM细胞对TMZ等药物治疗产生了耐药性,从而导致治疗效果不佳[4]。关于联合用药作用是否可以通过其他机制作用,将成为我们以后研究的重点。
作者贡献:
蔡卫:实验设计、数据处理及分析、论文撰写与修改
陈宏璘:指导实验设计、审核数据及统计分析结果、指导论文撰写与修改
张建永、杨远维、王洁、彭康:实验技术支持,收集数据,论文修改
| [1] |
Areeb Z, Stuart SF, West AJ, et al. Reduced EGFR and increased miR-221 is associated with increased resistance to temozolomide and radiotherapy in glioblastoma[J]. Sci Rep, 2020, 10(1): 17768. DOI:10.1038/s41598-020-74746-x |
| [2] |
Kundu M, Das S, Dhara D, et al. Prospect of natural products in glioma: A novel avenue in glioma management[J]. Phytother Res, 2019, 33(10): 2571-2584. DOI:10.1002/ptr.6426 |
| [3] |
汪超甲. 脑胶质瘤化疗现状及耐药机制的研究进展[J]. 中国临床神经外科杂志, 2017, 22(11): 791-794. [Wang CJ. Advances in the research of chemotherapy status and drug resistance mechanism of brain glioma[J]. Zhongguo Lin Chuang Shen Jing Wai Ke Za Zhi, 2017, 22(11): 791-794.] |
| [4] |
李成婧, 吴晓明. 神经胶质瘤对替莫唑胺耐药机制的研究[J]. 当代医药论丛, 2019, 17(7): 51-52. [Li CJ, Wu XM. Study on the mechanism of glioma resistance to temozolomide[J]. Dang Dai Yi Yao Lun Cong, 2019, 17(7): 51-52. DOI:10.3969/j.issn.2095-7629.2019.07.032] |
| [5] |
Chen X, Zhang M, Gan H, et al. A novel enhancer regulates MGMT expression and promotes temozolomide resistance in glioblastoma[J]. Nat Commun, 2018, 9(1): 2949. DOI:10.1038/s41467-018-05373-4 |
| [6] |
Corso G, Figueiredo J, De Angelis SP, et al. E-cadherin deregulation in breast cancer[J]. J Cell Mol Med, 2020, 24(11): 5930-5936. DOI:10.1111/jcmm.15140 |
| [7] |
Biswas KH. Molecular Mobility-Mediated Regulation of E-Cadherin Adhesion[J]. Trends Biochem Sci, 2020, 45(2): 163-173. DOI:10.1016/j.tibs.2019.10.012 |
| [8] |
Fearon ER. Cancer: Context Is Key for E-cadherin in Invasion and Metastasis[J]. Curr Biol, 2019, 29(21): R1140-R1142. DOI:10.1016/j.cub.2019.09.054 |
| [9] |
Iyer KV, Piscitello-Gómez R, Paijmans J, et al. Epithelial Viscoelasticity Is Regulated by Mechanosensitive E-cadherin Turnover[J]. Curr Biol, 2019, 29(4): 578-591. DOI:10.1016/j.cub.2019.01.021 |
| [10] |
Roy A. Plumbagin: A potential anti-cancer compound[J]. Mini Rev Med Chem, 2020. [Online adhead of print. ]
|
| [11] |
Suchaichit N, Suchaichit NP, Kanokmedhakul K, et al. A new cytotoxic plumbagin derivative from roots of Diospyros undulata[J]. Nat Prod Res, 2019, 1-8. |
| [12] |
Niu M, Cai W, Liu H, et al. Plumbagin inhibits growth of gliomas in vivo via suppression of FOXM1 expression[J]. J Pharmacol Sci, 2015, 128(3): 131-136. DOI:10.1016/j.jphs.2015.06.005 |
| [13] |
Sumsakul W, Plengsuriyakarn T, Na-Bangchang K. Pharmacokinetics, toxicity, and cytochrome P450 modulatory activity of plumbagin[J]. BMC Pharmacol Toxicol, 2016, 17(1): 50. DOI:10.1186/s40360-016-0094-5 |
| [14] |
Lee SY. Temozolomide resistance in glioblastoma multiforme[J]. Gene Dis, 2016, 3(3): 198-210. DOI:10.1016/j.gendis.2016.04.007 |
| [15] |
崔勇, 张风林, 鲍晶, 等. RNA干扰AKT2的表达对胶质瘤裸鼠移植瘤替莫唑胺敏感性的影响[J]. 中华神经外科疾病研究杂志, 2016, 15(5): 393-396. [Cui Y, Zhang FL, Bao J, et al. AKT2-shRNA affects the sensitivity of human glioma cell line U251 xenograft in nude mice to TMZ[J]. Zhonghua Shen Jing Wai Ke Ji Bing Yan Jiu Za Zhi, 2016, 15(5): 393-396.] |
| [16] |
张春丽, 张彩彩. 不同浓度七氟醚对人脑胶质瘤细胞U251替莫唑胺抵抗的影响及机制初探[J]. 广东药科大学学报, 2017, 33(5): 659-663. [Zhang CL, Zhang CC. Effect of different concentrations of sevoflurane on the resistance of human glioma cell U251 to temozolomide and the related mechanisms[J]. Guangdong Yao Ke Da Xue Xue Bao, 2017, 33(5): 659-663.] |
| [17] |
王新, 董培, 张洁. 替莫唑胺联合放射治疗诱导人脑胶质瘤U251细胞自噬的研究[J]. 国际生物医学工程杂志, 2018, 41(6): 504-508. [Wang X, Dong P, Zhang J. Autophagy induced by temozolomide combined with radiotherapy in human glioma U251 cells[J]. Guo Ji Sheng Wu Yi Xue Gong Cheng Za Zhi, 2018, 41(6): 504-508. DOI:10.3760/cma.j.issn.1673-4181.2018.06.008] |
| [18] |
马健, 杨艳茹, 刘景景, 等. 地昔帕明逆转人脑胶质瘤耐药细胞U251/TR对替莫唑胺的耐药作用[J]. 中国药理学与毒理学杂志, 2016, 30(6): 620-626. [Ma J, Yang YR, Liu JJ, et al. Reversal effects of desipramine on resistance of U251/TR cells to temozolomide[J]. Zhongguo Yao Li Xue Yu Du Li Xue Za Zhi, 2016, 30(6): 620-626. DOI:10.3867/j.issn.1000-3002.2016.06.002] |
| [19] |
Gerthofer V, Kreutz M, Renner K, et al. Combined Modulation of Tumor Metabolism by Metformin and Diclofenac in Glioma[J]. Int J Mol Sci, 2018, 19(9): 2586. DOI:10.3390/ijms19092586 |
| [20] |
李锡清, 赵尊兰, 刘冬玲, 等. HOTAIR通过E-cadherin对胶质瘤侵袭和转移的影响研究[J]. 中国实用神经疾病杂志, 2017, 20(13): 1-4. [Li XQ, Zhao ZL, Liu DL, et al. Study of HOTAIR effect invasion and metastasis of glioma by E-cadherin[J]. Zhongguo Shi Yong Shen Jing Ji Bing Za Zhi, 2017, 20(13): 1-4. DOI:10.3969/j.issn.1673-5110.2017.13.001] |
 2021, Vol. 48
2021, Vol. 48


