文章信息
- Panx1调控ATP/IP3通路促进顺铂诱导A549细胞的凋亡
- Panx1 Promotes Cisplatin-induced Apoptosis of A549 Cells by Regulating ATP/IP3 Pathway
- 肿瘤防治研究, 2021, 48(7): 674-678
- Cancer Research on Prevention and Treatment, 2021, 48(7): 674-678
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.20.1546
- 收稿日期: 2021-01-04
- 修回日期: 2021-03-17
2. 116021 大连,大连大学附属新华医院肿瘤科
2. Department of Oncology, Affiliated Xinhua Hospital of Dalian University, Dalian 116021, China
肺癌是全球最常见的癌症相关死亡原因之一,以高发病率和高死亡率居于首位,其中非小细胞肺癌(non-small cell lung cancer, NSCLC)患者约占所有肺癌患者人数的85%[1]。除手术治疗外,肺癌已成为分子靶向治疗实体瘤成功的范例。基因检测技术的改进和普及使分子靶向治疗变得更精准、更有成效,例如肺癌ERBB2、MET、RET、NTRK1和EGFR的联合检测和治疗[2-4]。对于错过最佳手术治疗阶段的晚期NSCLC患者,以铂类为主的多药联合化疗方式是主要治疗手段。顺铂(DDP)是目前临床Ⅱ~Ⅲ期完全手术切除肿瘤的NSCLC患者的主要治疗辅助手段[5]。迄今为止,铂类化疗药物对癌细胞的毒性作用仍未完全阐明。研究表明顺铂与DNA的结合效率只有5%~10%[6]。Panx1是Pannexin家族中的一员。Pannexin家族有三个成员,分别是Panx1、Panx2和Panx3。与传统缝隙连接蛋白通道不同的是,Panx蛋白并不形成具有细胞与细胞间进行物质交换功能的缝隙连接通道,而是只形成同一细胞本体的胞内到胞外形式的单个膜通道[7]。近来研究表明,Panx1通道参与顺铂诱导睾丸癌Ⅰ-10细胞的凋亡,而Panx1在顺铂诱导A549凋亡过程中的作用至今仍未见报道。本研究探讨Panx1通道在顺铂诱导A549细胞凋亡的作用。
1 材料与方法 1.1 材料人非小细胞肺癌细胞株(A549)购自中国科学院上海生命科学研究院细胞资源中心,RPMI 1640细胞培养基、含EDTA的胰酶和胎牛血清均购自美国Gibco公司,不含EDTA的胰酶购自大连索莱宝生物公司,PBS购自美国HyClone公司,Annexin V/PI细胞凋亡检测试剂盒购自上海诩圣生物公司,增强型ATP检测试剂盒购自上海碧云天生物公司,IP3检测试剂盒购自武汉华美生物公司,MTT和DMSO购自美国Sigma公司。
1.2 方法 1.2.1 细胞培养人肺腺癌A549细胞在含有10%胎牛血清的RPMI1640培养基中培养,置于37℃、5%CO2的细胞培养箱中培养。48 h换液1次,72 h传代1次。
1.2.2 MTT法检测细胞生存率取10 cm培养皿中生长至50%左右融合度的A549细胞,胰酶消化、计数,调整细胞的密度为1×105个/毫升,将细胞悬浮液铺至96孔板,10列×6行,每孔100 μl。24 h后更换药物培养基。实验共分10组,每组设置6个复孔。Control组不作处理,CBX组:100 μmol/L甘珀酸(CBX);DDP组:0、2、4、6、8 μg/ml DDP;CBX+DDP组:0、2、4、6、8 μg/ml DDP+100 μmol/L CBX。其中CBX+DDP组提前1 h加入CBX,让CBX充分发挥对Panx1的抑制作用。24 h后更换成含浓度为5 mg/ml MTT的培养基,避光操作。继续培养1 h。去除培养基,每孔加入100 μl DMSO,490 nm下读取每孔吸光度值。
1.2.3 AnnexinV/PI双染法检测细胞凋亡率将细胞以1×105个/毫升的密度铺至6孔板,每孔2 ml,培养24 h后,更换药物培养基继续培养24 h。PBS洗涤细胞,1500 r/min,4℃,离心5 min,重复2次。采用100 μl 1×Binding Buffer重悬细胞。加入5 μl Annexin V-FITC和10 μl PI Staining Solution,轻缓混匀。室温、避光下反应15 min。加入400 μl 1×Binding Buffer,流式细胞仪检测。
1.2.4 化学发光法检测胞外ATP释放浓度将细胞以1×105个/毫升的密度接种于12孔板。分为4组:对照组、DDP组、CBX组和CBX+DDP组,每组三个复孔,不作处理细胞为对照组,DDP浓度为8 μg/ml,CBX浓度为100 μmol/L。18 h后取细胞外培养基作为检测样品,4℃条件下12 000 g离心,离心5 min。将各个样品装入黑色96孔板,每孔先加入100 μl按照1:4稀释好的ATP检测工作液和20 μl样品,迅速混匀,将多功能酶标仪调至luminometer检测模式,避光检测。
1.2.5 ELISA法检测胞内IP3浓度细胞接种、药物处理及分组与1.2.4步骤一致。药物处理18 h后,预冷PBS洗涤一次,置入-20℃冰箱。两次冻融后,4℃条件下5 000 g离心,离心5 min。取上清液作为检测样品。取50 μl样品,加入50 μl酶标试剂,再加入50 μl抗体,混匀,37℃,避光孵育1 h。倒掉液体,每孔加入200 μl洗涤液进行清洗,静置10 s,重复3次。每孔加入50 μl显色液A和50 μl显色液B,混匀,37℃,避光孵育15 min。加入50 μl终止液,混匀后置于酶标仪下,450 nm波长下读取每孔吸光度值。
1.3 统计学方法采用SPSS20.0软件对数据进行分析,结果以均数±标准差表示。组内比较采用One-way ANOVA分析,组间比较采用配对样本t检验,P < 0.05认为差异有统计学意义。
2 结果 2.1 CBX与DDP合用对细胞生存的影响结果显示,对照组细胞生存率为0.9941±0.0042,CBX组的细胞生存率为0.9905±0.0089,与对照组比较差异无统计学意义(P=0.557),表明CBX不会对A549细胞的生存产生影响;2、4、6、8 μg/ml DDP组细胞生存率分别为(0.9267±0.0252、0.8253±0.0393、0.7445±0.0696、0.6782±0.0365),与对照组比较,DDP组细胞生存率降低(P=5.34×10-6、8.80×10-10、1.85×10-11、1.79×10-12);应用CBX(100 μmol/L)抑制Panx1通道后,CBX+DDP(2、4、6、8 μg/ml)组的细胞生存率分别为(0.9692±0.0122、0.9074±0.0109、0.8562±0.0214、0.8129±0.0301),与DDP组比较差异有统计学意义(均P < 0.001),见图 1。
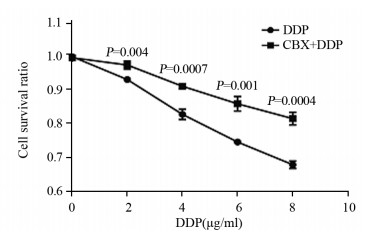
|
| P: CBX+DDP group compared with DDP group. 图 1 甘珀酸与顺铂合用对A549细胞生存的影响 Figure 1 Effect of carbenoxolone (CBX) combined with cisplatin (DDP) on survival of A549 cells |
对照组的细胞凋亡率为(6.07±0.25)%,单用CBX(100 μmol/L)组的细胞凋亡率为(6.00±0.05)%,与对照组比较差异无统计学意义(P=0.815)。结果证实CBX不会对A549细胞的凋亡产生影响。单用DDP组(2、4、6和8 μg/ml),细胞凋亡率分别为(7.48±0.23)%、(13.38±0.21)%、(20.37±0.30)%和(34.75±0.36)%,与对照组比较凋亡率升高(P=0.528、0.007、5.81×10-5、1.10×10-7)。而应用CBX(100 μmol/L)抑制Panx1通道的功能后,CBX+DDP(2、4、6、8 μg/ml)组的细胞凋亡率分别为(6.71±0.11)%、(8.34±0.25)%、(13.77±0.26)%、(26.02±0.46)%,与DDP组比较差异有统计学意义(P=0.035、0.006、0.012、0.040),见图 2。
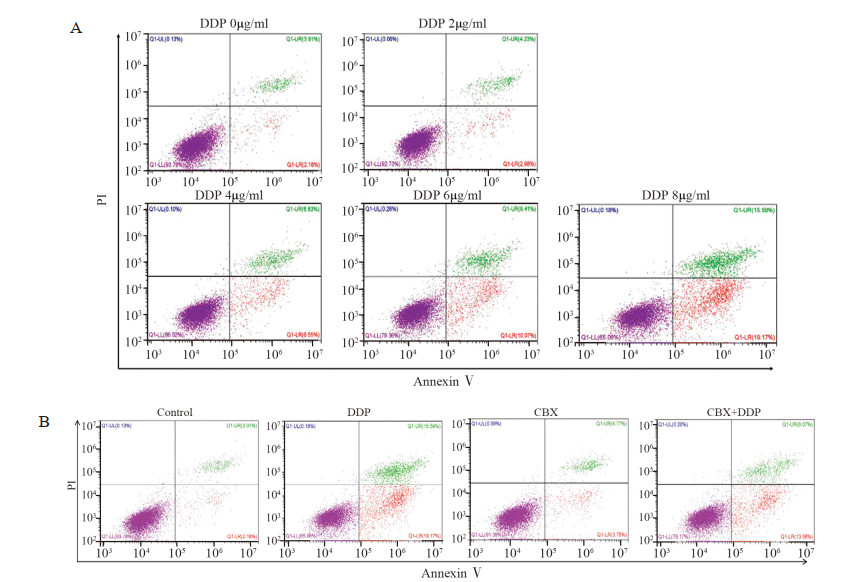
|
| 图 2 顺铂单用(A)以及与甘珀酸联合(B)对A549细胞凋亡的影响 Figure 2 Effect of cisplatin alone(A) and CBX+DDP(B) on apoptosis of A549 cells |
对照组细胞外ATP释放浓度为1±0.0183,CBX组和DDP组的胞外ATP释放浓度分别为0.6539±0.0556和1.8828±0.0497,与对照组比较,CBX组细胞外ATP浓度降低,DDP组细胞外ATP浓度升高;CBX+DDP组的胞外ATP释放浓度为1.1969±0.0319,与DDP组比较差异均有统计学意义,见图 3。
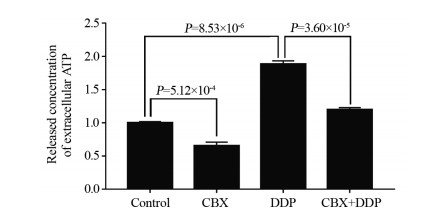
|
| 图 3 甘珀酸与顺铂联合对A549细胞胞外ATP释放浓度的影响 Figure 3 Effect of CBX+DDP on extracellular ATP release of A549 cells |
对照组的胞内IP3浓度为1±0.0287,CBX组的胞内IP3浓度为0.9981±0.0020,与对照组比较差异无统计学意义(P=0.178),表明CBX不会对A549细胞的胞内IP3浓度产生影响;DDP组的胞内IP3浓度为1.3202±0.0429,与对照组比较,DDP组的胞内IP3浓度升高;CBX+DDP组的胞内IP3浓度为1.0143±0.0255,与DDP组比较差异均有统计学意义,见图 4。
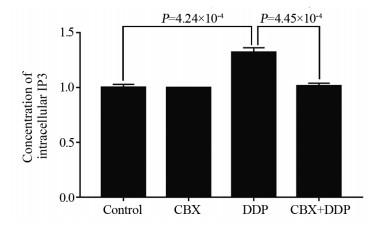
|
| 图 4 CBX与DDP合用对A549细胞胞内IP3释放浓度的影响 Figure 4 Effect of CBX+DDP on intracellular IP3 release of A549 cells |
肺癌的治疗是精准医学时代的巨大挑战,大多数NSCLC患者常在手术后出现转移或复发,反映了这类癌症的侵袭性和患者的预后不良。对于多数NSCLC患者,铂类化疗仍然是一种标准治疗方法。此外,对于晚期NSCLC患者和需要诱导/辅助治疗的早期疾病患者,铂类中又以顺铂用途最为广泛。顺铂进入细胞后,与胞内DNA结合成化合物进而抑制细胞的增殖。然而,在绝大多数情况下,暴露于顺铂的恶性肿瘤细胞能够激活适应性抗性机制。因此,大部分接受顺铂治疗的患者都遇到治疗失败和肿瘤复发的困扰。
Panchin等[8]发现,Panx1通道是在人体多器官中表达的由糖蛋白形成的一种半通道。Jalaleddine等[9]研究证实Panx1通道的抑制剂或基因缺失可降低乳腺癌的转移效率。Shi等[10]研究发现Panx1的高表达与肝癌的预后不良相关,并可促进肝癌的生长、转移和侵袭。Liu等[11]研究发现用shRNA敲除Panx1之后,睾丸癌细胞(Ⅰ-10)系的迁移和侵袭能力减弱。这些研究证实在某些肿瘤细胞中Panx1的表达上调,并且可以增加某些肿瘤细胞的转移能力。因此,选择性抑制Panx1的表达和功能可能为某些肿瘤的治疗带来新思路。
Panx1是绝大多数细胞类型中ATP流出的主要途径[12]。Panx1是嘌呤能信号转导中的多功能调节伙伴,因为它参与了嘌呤能信号多种生理和病理作用的过程。Panx1的这些作用很大程度上归因于它们释放ATP或其他核苷酸的能力,这些核苷酸以自分泌或旁分泌的方式支持嘌呤能信号的转导[13]。ATP可以通过多种途径参与肿瘤代谢过程,其中一种重要的机制是在肿瘤细胞缺氧条件下葡萄糖摄取和糖酵解的增加从而引起ATP水平的变化[14]。
本研究中,在应用顺铂的前提下,Panx1通道被CBX高选择性抑制后,相对于单用顺铂的分组,A549细胞的生存增加,早期凋亡和晚期凋亡减少。可能是由于Panx1通道被抑制导致顺铂诱导A549细胞凋亡过程中的一个重要途径被阻断所致。相对于单用DDP组,CBX+DDP组的胞外ATP释放浓度下降,证明Panx1通道是顺铂引起A549细胞凋亡进程中ATP释放的关键途径。CBX与顺铂合用后,A549细胞内的IP3的浓度下降。可能是由于Panx1通道被抑制,胞内ATP逸出到细胞外的重要途径被切断,导致胞外ATP浓度降低,进而使胞内IP3的相对浓度减少。
综上所述,Panx1通道介导的ATP/IP3通路在顺铂诱导A549细胞凋亡过程中起重要作用。Panx1通道通过调控ATP/IP3信号通路增加顺铂对肺腺癌细胞的敏感度,为改善NSCLC患者的顺铂化疗敏感度提供了一定的帮助。
作者贡献:
龙文清:数据统计分析、文章撰写
张晖力、谢海娟、王毓兴、张丽君:提供建议并进行技术指导与原因分析
俞红女:提供主要参考方案、指导实验及论文撰写
王林:指导研究设计与实施
| [1] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
Tan L, Hu Y, Tao Y, et al. Expression and copy number gains of the RET gene in 631 early and mid stage non-small cell lung cancer cases[J]. Thoracic Cancer, 2018, 9(4): 445-451. DOI:10.1111/1759-7714.12603 |
| [3] |
Castellanos-Rizaldos E, Grimm DG, Tadigotla V, et al. Exosome-Based Detection of EGFR T790M in Plasma from Non-Small Cell Lung Cancer Patients[J]. Clin Cancer Res, 2018, 24(12): 2944-2950. DOI:10.1158/1078-0432.CCR-17-3369 |
| [4] |
Freeman TJ, Sayedyahossein S, Johnston D, et al. Inhibition of Pannexin 1 Reduces the Tumorigenic Properties of Human Melanoma Cells[J]. Cancers(Basel), 2019, 11(1): 102. |
| [5] |
Milone MR, Lombardi R, Roca MS, et al. Novel pathways involved in cisplatin resistance identified by a proteomics approach in non-small-cell lung cancer cells[J]. J Cell Physiol, 2019, 234(6): 9077-9092. DOI:10.1002/jcp.27585 |
| [6] |
Wu D, Wu J, Liu H, et al. Role of Pannexin1 channels in the resistance of Ⅰ-10 testicular cancer cells to cisplatin mediated by ATP/IP3 pathway[J]. Biomed Pharmacother, 2017, 94: 514-522. DOI:10.1016/j.biopha.2017.07.144 |
| [7] |
Slivko-Koltchik GA, Kuznetsov VP, Panchin YV. Are there gap junctions without connexins or pannexins?[J]. BMC Evol Biol, 2019, 19(Suppl1): 46. DOI:10.1186/s12862-019-1369-4/fulltext.html |
| [8] |
Panchin Y, Kelmanson I, Matz M, et al. A ubiquitous family of putative gap junction molecules[J]. Curr Biol, 2000, 10(13): R473-R474. DOI:10.1016/S0960-9822(00)00576-5 |
| [9] |
Jalaleddine N, El-Hajjar L, Dakik H, et al. Pannexin1 Is Associated with Enhanced Epithelial-To-Mesenchymal Transition in Human Patient Breast Cancer Tissues and in Breast Cancer Cell Lines[J]. Cancers (Basel), 2019, 11(12): 1967. DOI:10.3390/cancers11121967 |
| [10] |
Shi G, Liu C, Yang Y, et al. Panx1 promotes invasion-metastasis cascade in hepatocellular carcinoma[J]. J Cancer, 2019, 10(23): 5681-5688. DOI:10.7150/jca.32986 |
| [11] |
Liu H, Yuan M, Yao Y, et al. In vitro effect of Pannexin 1 channel on the invasion and migration of Ⅰ-10 testicular cancer cells via ERK1/2 signaling pathway[J]. Biomed Pharmacother, 2019, 117: 109090. DOI:10.1016/j.biopha.2019.109090 |
| [12] |
Dahl G. The Pannexin1 membrane channel: distinct conformations and functions[J]. FEBS Lett, 2018, 592(19): 3201-3209. DOI:10.1002/1873-3468.13115 |
| [13] |
Chiu YH, Schappe MS, Desai BN, et al. Revisiting multimodal activation and channel properties of Pannexin 1[J]. J Gen Physiol, 2018, 150(1): 19-39. DOI:10.1085/jgp.201711888 |
| [14] |
Murthy D, Vernucci E, Goode G, et al. Evaluating the Metabolic Impact of Hypoxia on Pancreatic Cancer Cells[J]. Methods Mol Biol, 2018, 1742: 81-93. |
 2021, Vol. 48
2021, Vol. 48


