文章信息
- 乏氧条件下HIF-1α通过上调PD-L1促进鼻咽癌恶性发展的机制
- Mechanism of HIF-1α Promoting Malignant Development of Nasopharyngeal Carcinoma by Upregulating PD-L1 Under Hypoxic Conditions
- 肿瘤防治研究, 2021, 48(6): 570-575
- Cancer Research on Prevention and Treatment, 2021, 48(6): 570-575
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.20.1543
- 收稿日期: 2021-01-04
- 修回日期: 2021-03-04
2. 430079 武汉,湖北省肿瘤医院(华中科技大学同济医学院附属湖北肿瘤医院)放疗中心
2. Department of Radiotherapy, Hubei Cancer Hospital, Tongji Medical College, Huazhong University of Science and Technolgy, Wuhan 430079, China
鼻咽癌(nasopharyngeal carcinoma, NPC)是我国以及东南亚地区常见的头颈部恶性肿瘤之一,死亡率约为1.74/100 000[1]。鼻咽癌治疗后复发病例占治疗失败病例的30%,复发的鼻咽癌往往具有肿瘤乏氧[2]、肿瘤侵袭能力增强、治疗前贫血[3]等更加恶劣的病理学表现,从而加大复发后的治疗难度。研究表明,鼻咽癌复发患者5年内生存率仅为30%[4]。乏氧诱导因子-1α(hypoxia induce factor-1α, HIF-1α)是机体应对乏氧的主要效应因子,已经被证实与肿瘤缺氧、侵袭能力增强等细胞生物学行为密切相关[5]。程序死亡受体-配体1(programmed death ligand 1, PD-L1)是程序性死亡受体1(programmed death 1, PD-1)的配体之一,可以抑制T细胞的活化,诱导肿瘤患者体内T细胞凋亡从而导致肿瘤细胞免疫逃逸[6]。临床研究表明在口腔癌和肺癌中PD-L1的表达与HIF-1α有关[7-8]。因此,乏氧诱导的鼻咽癌恶化很可能与HIF-1α调节PD-L1的表达相关,但具体调控机制尚未明确。本实验以鼻咽癌细胞为研究对象,通过在乏氧条件下沉默HIF-1α基因,检测细胞增殖和细胞凋亡率,研究了乏氧条件下鼻咽癌中HIF-1α对于鼻咽癌细胞生物学行为的影响,并且初步探讨鼻咽癌细胞中HIF-1α通过上调PD-L1促进鼻咽癌恶性发展的相关分子机制。
1 材料与方法 1.1 细胞株人类鼻咽癌细胞系CNE2(低分化癌),由中山肿瘤防治中心赠予。
1.2 主要试剂RPMI 1640培养基购自美国Hyclone公司,胎牛血清(Fetal bovine serum, FBS)、青霉素-链霉素双抗浓缩液(×100)、无血清培养基Opti-MEM、胰酶(Trypsin-EDTA)购自美国Gibco公司;核糖核酸酶抑制剂、MTT细胞增殖检测剂购自美国Sigma公司;Triton-X 100购自北京中杉金桥生物技术有限公司;HIF-1α小鼠单克隆抗体(93kD)、STAT3兔单克隆抗体(88kD)、PSTAT3兔单克隆抗体(88kD)、PD-L1兔单克隆抗体(40~45kD)、兔多抗GAPDH(37kD)均购自英国Abcam公司;RNA提取试剂TRIzol reagent、LipofectamineTM 2000购自美国Invitrogen公司;反转录试剂盒、PCR Master Mix试剂盒购自加拿大Fermentas公司;siRNA及PCR目标基因引物的合成由北京擎科新业生物技术有限公司提供。
1.3 细胞培养与转染采用10%FBS、1%青霉素和链霉素的RPMI 1640培养基培养细胞。取对数生长期、生长状态良好的CNE2细胞,进行细胞计数,并以每孔2×105个细胞接种于6孔板,37℃、5%CO2培养箱中培养。设常氧组、乏氧组、HIF-1α-siRNA+乏氧组、NC-siRNA+乏氧组四组进行实验。常氧组的细胞在20%O2中培养,乏氧组在1%O2中培养,HIF-1α-siRNA+乏氧组的细胞在1%O2中培养并转染HIF-1α-siRNA,NC-siRNA+乏氧组在1%O2中培养并转染NC-siRNA。按照脂质体LipofectamineTM2000转染试剂说明书进行细胞转染,将根据HIF-1α序列设计筛选的HIF-1α-siRNA转染至CNE2细胞,同时另设一组CNE2细胞转染无意义的干扰序列NC-siRNA作为对照。培养48 h后进行后续实验,转染序列见表 1。
按照不同的条件处理细胞以后,弃去培养基停止培养,加入TRIzol提取总RNA,按照反转录试剂盒说明书将RNA反转录成cDNA,PCR产物通过1.2%琼脂糖凝胶电泳分离,于凝胶成像仪中成像。同时按照荧光定量PCR试剂盒说明书检测mRNA水平。反应条件为:50℃ 2 min,95℃ 10 min;95℃ 30 s,60℃ 30 s,40个循环。引物序列见表 2。最终数据采用2-ΔΔCt方法进行分析(检测siRNA敲低效率)。通过RT-PCR检测HIF-1α、PD-L1及STAT3分子的mRNA表达水平。
将各组细胞按照不同条件处理后,弃去培养基终止培养后,用0.25%的胰酶消化,按照每孔5×104个/毫升接种至96孔板,按照不同条件培养过夜后,每孔加入10 μl MTT,37℃孵育4 h后,加入150 μl DMSO,最后用酶标仪测量568 nm波长处的OD值,细胞存活率(%)=(实验组OD均值/对照组OD均值)×100%。
1.6 流式细胞术检测细胞凋亡率将各组不同细胞按不同条件处理后,48 h收集各组细胞,按AnnexinV-APC/7-AAD细胞凋亡检测试剂盒说明书进行检测,加入Bind Buffer混匀,反应15 min后加入Annexin-APC检测试剂混匀,最后上流式细胞仪检测。
1.7 Western blot法检测蛋白表达按照不同条件处理细胞各组细胞后,弃去培养基终止培养,每皿加入100 μl细胞裂解液(PMSF: 裂解液=1:100)裂解细胞,冰上裂解30 min后收集裂解的细胞,按照BSA试剂盒测量提取的蛋白浓度。将提取的蛋白用5×蛋白上样缓冲液混合后,在沸水中煮沸变性。样品用10%分离胶或者8%分离胶以及5%浓缩胶进行电泳分离,电转、封闭之后,4℃孵育一抗过夜(GADPH: 1:1 000,STAT3: 1:1 500, PSTAT3: 1:200 000, HIF-1α: 1:1 000, PD-L1: 1:1 000),第二日用HRP标记羊抗兔二抗室温孵育2 h,最后用凝胶成像仪成像,BandScan5.0分析胶片灰度值。
1.8 统计学方法数据应用均数±标准差(x±s)表示,组间比较采用单因素方差分析。实验数据采用SPSS17.0软件进行分析;双侧检验P < 0.05为差异有统计学意义。
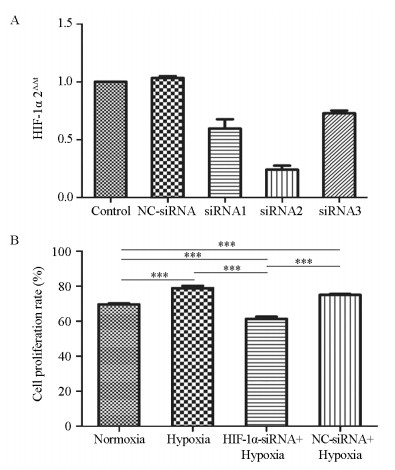
2 结果 2.1 乏氧条件下及沉默HIF-1α基因后CNE2细胞的增殖变化我们针对HIF-1α设计合成了三条不同的siRNA序列,筛选出其中敲低效率最高的一条,即HIF-1α-siRNA-2进行后续实验,见图 1A。MTT实验结果显示乏氧条件下细胞增殖率显著大于常氧组(均P=0.000),见图 1B。与常氧组相比,HIF-1α-siRNA+乏氧显著降低了细胞增殖率(P=0.000);与NC-siRNA+乏氧组相比,HIF-1α-siRNA+乏氧也显著降低了细胞增殖(P=0.000)。由此可得,乏氧条件下HIF-1α在CNE2的细胞增殖中发挥了重要作用。
|
| ***: P < 0.001. 图 1 转染HIF-1α-siRNA后CNE2细胞对HIF-1α基因的沉默效率(A)和MTT检测不同处理条件下CNE2细胞的增殖水平(B) Figure 1 Silencing efficiency of HIF-1α in CNE2 cells(A) and proliferation of CNE2 cells under different treatment conditions detected by MTT(B) |
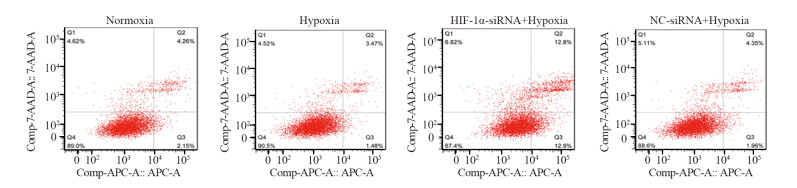
流式细胞术显示,乏氧条件下细胞凋亡率与常氧培养条件下细胞凋亡率无明显差异。相比于乏氧组的细胞,乏氧条件下转染HIF-1α-siRNA后显著增加了细胞凋亡率(P=0.000)。此外,HIF-1α-siRNA+乏氧组的细胞凋亡率也明显大于NC-siRNA+乏氧组(P=0.001),见图 2。实验结果提示靶向沉默HIF-1α基因能够促进人鼻咽癌细胞CNE2的凋亡。
|
| 图 2 流式细胞术检测不同处理条件下CNE2细胞的凋亡水平 Figure 2 Apoptosis of CNE2 cells under different treatment conditions detected by flow cytometry |
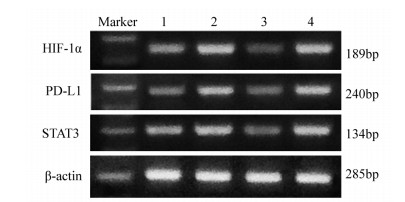
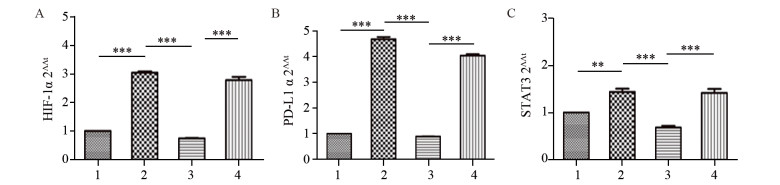
RT-PCR检测显示,乏氧组的HIF-1α mRNA水平显著高于常氧组(P=0.004),HIF-1α-siRNA转染后CNE2细胞HIF-1α mRNA水平显著下降,显著低于乏氧组(P=0.000)和NC-siRNA+乏氧组(P=0.000),显示转染成功,见图 3。HIF-1α-siRNA+乏氧组的PD-L1 mRNA水平显著低于乏氧组(P=0.000)和NC-siRNA+乏氧组(P=0.000),显示HIF-1α mRNA水平与PD-L1 mRNA水平呈正比。此外,乏氧组的STAT3 mRNA表达水平相比常氧组显著上升(P=0.009),HIF-1α-siRNA+乏氧组的STAT3 mRNA水平显著低于乏氧组(P=0.001)和NC-siRNA+乏氧组(P=0.001),见图 4。结果表明HIF-1α mRNA水平与PD-L1 mRNA水平成正相关,且STAT3可能是HIF-1α正性调控PD-L1的关键信号因子。
|
| 1: Normoxia; 2: Hypoxia; 3: HIF-1α-siRNA+Hypoxia; 4: NC-siRNA+Hypoxia. 图 3 RT-PCR检测CNE2细胞中HIF-1α、PD-L1及STAT3的表达 Figure 3 HIF-1α, PD-L1 and STAT3 expression in CNE2 cells detected by RT-PCR |
|
| **: P < 0.01; ***: P < 0.001; 1: Normoxia; 2: Hypoxia; 3: HIF-1α-siRNA+Hypoxia; 4: NC-siRNA+Hypoxia. 图 4 不同条件下CNE2细胞中HIF-1α(A)、PD-L1(B)及STAT3(C)mRNA表达水平的变化 Figure 4 HIF-1α(A), PD-L1(B) and STAT3(C) mRNA expression in CNE2 cells under different conditions |
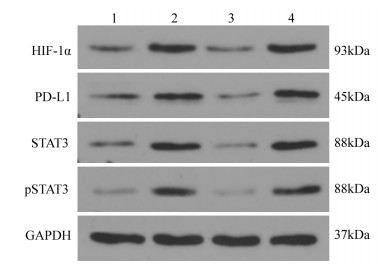
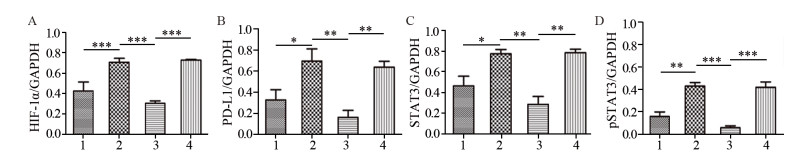
Western blot检测结果显示,乏氧组的HIF-1α蛋白水平显著高于常氧组(P=0.004),HIF-1α-siRNA转染后的CNE2细胞HIF-1α分子蛋白水平显著下降,显著低于乏氧组(P=0.001)和NC-siRNA+乏氧组(P=0.001)。同时,HIF-1α-siRNA+乏氧组的PD-L1蛋白水平显著低于乏氧组(P=0.017)和NC-siRNA+乏氧组(P=0.0017),显示HIF-1α分子蛋白水平与PD-L1蛋白水平成正比。此外,相比常氧组,乏氧组的STAT3和pSTAT3蛋白表达水平均显著上升(P=0.011),HIF-1α-siRNA+乏氧组的STAT3蛋白水平显著低于乏氧组(P=0.009)和NC-siRNA+乏氧组(P=0.001),HIF-1α-siRNA+乏氧组的pSTAT3蛋白水平显著低于乏氧组和NC-siRNA+乏氧组(均P < 0.001),见图 5~6。实验结果表明,乏氧条件下,随着HIF-1α诱导PD-L1的高表达,STAT3磷酸化水平也增加。反之,HIF-1α的靶向沉默抑制了PD-L1的表达和STAT3磷酸化水平。我们认为HIF-1α诱导PD-L1表达上调可能通过活化STAT3实现。
|
| 1: Normoxia; 2: Hypoxia; 3: HIF-1α-siRNA+Hypoxia; 4: NC-siRNA+Hypoxia. 图 5 Western blot检测CNE2细胞中HIF-1α, PD-L1, STAT3及pSTAT3蛋白的表达 Figure 5 HIF-1α, PD-L1, STAT3 and pSTAT3 protein expression in CNE2 cells detected by Western blot |
|
| *: P < 0.05; **: P < 0.01; ***: P < 0.001; 1: Normoxia; 2: Hypoxia; 3: HIF-1α-siRNA+Hypoxia; 4: NC-siRNA+Hypoxia. 图 6 不同条件下CNE2细胞中HIF-1α(A)、PD-L1(B)、STAT3(C)及pSTAT3(D)蛋白表达水平的变化 Figure 6 HIF-1α(A), PD-L1(B), STAT3(C) and pSTAT3(D) proteins expression in CNE2 cells under different conditions |
鼻咽癌是我国最常见的头颈部恶性肿瘤之一,传统的治疗方法难以根治。乏氧在肿瘤微环境中非常常见,且能影响恶性肿瘤的生理状况。HIF-1α是乏氧环境下调控基因的重要转录因子[8]。研究表明,HIF-1α在包括乳腺癌[9]、鼻咽癌及结肠癌等多种人类肿瘤中过度表达,且HIF-1α高表达往往与恶性肿瘤患者的不良预后有关。有研究证明原花青素可以通过降低HIF-1α从而抑制鼻咽癌细胞生长[10]。然而,HIF-1α在鼻咽癌中的具体机制尚不明确。本研究发现,乏氧组HIF-1α高表达下的高增殖率和低凋亡率可被siRNA-HIF-1α转染有效逆转。这些结果证明HIF-1α表达可以促使乏氧条件下鼻咽癌的恶性进展。
随着免疫治疗的发展,PD-L1的表达水平与鼻咽癌发展开始得到密切关注。PD-L1往往在肿瘤细胞表面高表达,通过与PD-1的结合抑制T细胞活化,促进肿瘤细胞免疫逃逸。研究表明乏氧条件下HIF-1α可能通过调节PD-L1,造成肿瘤细胞免疫耐受,促进癌症恶性发展[11-14]。最新研究发现鼻咽癌白人患者中肿瘤细胞上PD-L1表达与不良结果相关[15]。本研究发现,鼻咽癌细胞中HIF-1α的表达与PD-L1的表达呈显著正相关。除此之外,乏氧条件下,鼻咽癌细胞中STAT3 mRNA和蛋白水平显著高于常氧组,而转染siRNA-HIF-1α逆转了这一现象,同时降低了STAT3的磷酸化水平。已有研究报道STAT3是介导PD-L1表达的调控因子[16],而伊卡利汀可以通过抑制STAT3磷酸化抑制鼻咽癌细胞CNE2的增殖、迁移和侵袭[17]。因此,PD-L1可能是乏氧诱导鼻咽癌恶性进展的重要原因,并且涉及STAT3的活化,这与Xing等[18]研究结论一致。
PD-L1免疫治疗可能给鼻咽癌治疗带来新的治疗策略。PD-L1抗体阿特珠单抗,Durvalumab已可以用来治疗非小细胞肺癌和膀胱癌[19]。PD1免疫抑制剂联合化学疗法作为转移性鼻咽癌的一线治疗可以缓解91%患者的病情,34%复发鼻咽癌患者的病情[20],IFNβ和抗PD-1的组合可以增强NK细胞对鼻咽癌细胞的细胞毒性[21],但是尚未有临床报导PD-L1抑制剂对鼻咽癌的治疗作用。
PD-L1是鼻咽癌患者预后的独立影响因素[22],结合本研究发现,PD-L1在免疫耐受中的调控作用将会给鼻咽癌治疗带来新的方向,PD-L1有望为鼻咽癌免疫疗法提供新的分子靶标。另外,本研究在评估PD-L1的表达与临床鼻咽癌患者的相关性,验证PD-L1抑制剂对鼻咽癌的治疗作用等实验方面还待展开,如何使鼻咽癌免疫治疗更优化,需要我们结合更多的实验和大数据分析,进一步探索PD-L1影响鼻咽癌的相关机制,考察以PD-L1为靶点的治疗方案。
作者贡献:
蒋豆豆:实验操作及论文撰写
董佳文:实验操作
胡德胜、周亚娟:实验设计及指导
| [1] |
许珊, 姜学钧. Dicer1低表达与鼻咽癌患者预后的关联性研究[J]. 临床耳鼻咽喉头颈外科杂志, 2015, 29(2): 126-131. [Xu S, Jiang XY. Reduced expression of Diceri is associated with Poor Prognosis in Patients with nasopharyngeal carcinoma[J]. Lin Chuang Er Bi Yan Hou Tou Jing Wai Ke Za Zhi, 2015, 29(2): 126-131.] |
| [2] |
Lee C, Park SH, Yoon SY, et al. Gamma Knife Radiosurgery Using Co-Registration with PET-CT and MRI for Recurrent Nasopharyngeal Carcinoma with Previous Radiotherapy: A Single Center 14-Year Experience[J]. J Korean Neurosurg Soc, 2020, 63(3): 397-405. DOI:10.3340/jkns.2019.0011 |
| [3] |
Liang XX, Li Q, Su Z, et al. Significant Prognostic impact of chemoradiotherapy-induced hemoglobin decrease on treatment outcomes of nasopharyngeal carcinoma[J]. J Cancer, 2015, 6(6): 502-510. DOI:10.7150/jca.11403 |
| [4] |
Wong EHC, Liew YT, Loong SP, et al. Five-year Survival Data on the Role of Endoscopic Endonasal Nasopharyngectomy in Advanced Recurrent rT3 and rT4 Nasopharyngeal Carcinoma[J]. Ann Otol Rhinol Laryngol, 2020, 129(3): 287-293. DOI:10.1177/0003489419887410 |
| [5] |
Xu Q, Briggs J, Park S, et al. Targeting Stat3 blocks both HIF-1 and VEGF expression induced by multiple oncogenic growth signaling Pathways[J]. Oncogene, 2005, 24(36): 5552-5560. DOI:10.1038/sj.onc.1208719 |
| [6] |
乌日罕, 呼群, 马强, 等. PD-1和PD-L1在肿瘤免疫逃逸中的作用机制及临床意义[J]. 现代肿瘤医学, 2019, 27(9): 1635-1638. [Wu RH, Hu Q, Ma Q, et al. Clinical significance and mechanism of PD-1 and PD-L1 in cancer immune escape[J]. Xian Dai Zhong Liu Yi Xue, 2019, 27(9): 1635-1638. DOI:10.3969/j.issn.1672-4992.2019.09.040] |
| [7] |
Chen TC, Wu CT, Wang CP, et al. Associations among Pretreatment tumor necrosis and the expression of HIF-1alPha and PD-L1 in advanced oral squamous cell carcinoma and the Prognostic impact thereof[J]. Oral Oncol, 2015, 51(11): 1004-1010. DOI:10.1016/j.oraloncology.2015.08.011 |
| [8] |
Chang YL, Yang CY, Lin MW, et al. High co-expression of PD-L1 and HIF-1α correlates with tumour necrosis in Pulmonary Pleomorphic carcinoma[J]. Eur J Cancer, 2016, 60: 125-135. DOI:10.1016/j.ejca.2016.03.012 |
| [9] |
Han S, Yin X, Wang Y, et al. Co-expression of HIF-1 and TLR3 is associated with Poor Prognosis in oral squamous cell carcinoma[J]. Int J Clin Exp Pathol, 2020, 13(1): 65-72. |
| [10] |
Masoud GN, Li W. HIF-1alPha Pathway: role, regulation and intervention for cancer therapy[J]. Acta Pharm Sin B, 2015, 5(5): 378-389. DOI:10.1016/j.apsb.2015.05.007 |
| [11] |
Wong CA, McCarthy RJ, Fitzgerald PC, et al. Gastric emptying of water in obese Pregnant women at term[J]. Anesth Analg, 2007, 105(3): 751-755. DOI:10.1213/01.ane.0000278136.98611.d6 |
| [12] |
Noman MZ, Desantis G, Janji B, et al. PD-L1 is a novel direct target of HIF-1alPha, and its blockade under hypoxia enhanced MDSC-mediated T cell activation[J]. Exp Med, 2014, 211(5): 781-790. DOI:10.1084/jem.20131916 |
| [13] |
Daniel SK, Sullivan KM, Labadie KP, et al. Hypoxia as a barrier to immunotherapy in Pancreatic adenocarcinoma[J]. Clin Transl Med, 2019, 8(1): 10. DOI:10.1186/s40169-019-0226-9/fulltext.html |
| [14] |
Barsoum IB, Smallwood CA, Siemens DR, et al. A mechanism of hypoxia-mediated escaPe from adaptive immunity in cancer cells[J]. Cancer Res, 2014, 74(3): 665-674. DOI:10.1158/0008-5472.CAN-13-0992 |
| [15] |
Minichsdorfer C, Oberndorfer F, Krall C, et al. PD-L1 Expression on Tumor Cells Is Associated With a Poor Outcome in a Cohort of Caucasian Nasopharyngeal Carcinoma Patients[J]. Front Oncol, 2019, 9(6): 1334. |
| [16] |
Messai Y, Gad S, Noman MZ, et al. Renal Cell Carcinoma Programmed Death-ligand 1, a New Direct Target of Hypoxia-inducible Factor-2 Alha, is Regulated by von HiPPel-Lindau Gene Mutation Status[J]. Eur Urol, 2016, 70(4): 623-632. DOI:10.1016/j.eururo.2015.11.029 |
| [17] |
Li X, Li C, Zhou P, et al. Inhibitory effect of icaritin on Proliferation, migration, and invasion of human nasopharyngeal carcinoma cell CNE2 by regulating STAT3 activation[J]. Pharmazie, 2019, 74(11): 685-687. |
| [18] |
Xing Y, Mi C, Wang Z, et al. Fraxinellone has anticancer activity in vivo by inhibiting Programmed cell death-ligand 1 expression by reducing hypoxia-inducible factor-1α and STAT3[J]. Pharmacol Res, 2018, 135: 166-180. DOI:10.1016/j.phrs.2018.08.004 |
| [19] |
Frank A, Bonney M, Bonney S, et al. Myocardial ischemia reperfusion injury: from basic science to clinical bedside[J]. Semin Cardiothoracic Vasc Anesth, 2012, 16(3): 123-132. DOI:10.1177/1089253211436350 |
| [20] |
Zhou Y, Miao J, Wu H, et al. PD-1 and PD-L1 expression in 132 recurrent nasopharynx-geal carcinoma: the correlation with anemia and outcomes[J]. Oncotarget, 2017, 8(31): 51210-51223. DOI:10.18632/oncotarget.17214 |
| [21] |
Makowska A, Braunschweig T, Denecke B, et al. Interferon β and Anti-PD-1/PD-L1 Checkpoint Blockade Cooperate in NK Cell-Mediated Killing of Nasopharyngeal Carcinoma Cells[J]. Transl Oncol, 2019, 12(9): 1237-1256. DOI:10.1016/j.tranon.2019.04.017 |
| [22] |
Masterson L, Howard J, Gonzalez-Cruz J, et al. Immune checkpoint inhibitors in advanced nasopharyngeal carcinoma: Beyond an era of chemoradiation[J]. Int J Cancer, 2020, 146(8): 2305-2314. DOI:10.1002/ijc.32869 |
| [23] |
江蓉, 邱艳芳, 王晖, 等. PD-L1蛋白在鼻咽癌中的表达及其临床意义[J]. 中国耳鼻咽喉颅底外科杂志, 2018, 24(6): 561-564, 570. [Jiang R, Qiu YF, Wang H, et al. Expression and clinical significance of PD-L1 protein in nasopharyngeal carcinoma[J]. Zhongguo Er Bi Yan Hou Lu Di Wai Ke Za Zhi, 2018, 24(6): 561-564, 570.] |
 2021, Vol. 48
2021, Vol. 48