文章信息
- LncRNA SNHG5靶向miR-421调控胶质母细胞瘤细胞增殖、侵袭和凋亡的机制
- Mechanism of LncRNA SNHG5 on Proliferation, Invasion and Apoptosis of Glioblastoma Multiforme Cells by Targeting miR-421
- 肿瘤防治研究, 2021, 48(6): 586-593
- Cancer Research on Prevention and Treatment, 2021, 48(6): 586-593
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.20.1505
- 收稿日期: 2020-12-23
- 修回日期: 2021-01-24
2. 050000 石家庄,河北医科大学第二医院全科医学科;
3. 054300 邢台,临城县人民医院神经外科
2. Department of General Practice, The Second Hospital of Hebei Medical University, Shijiazhuang 050000, China;
3. Department of Neurosurgery, Lincheng County People's Hospital, Xingtai 054300, China
胶质母细胞瘤(glioblastoma multiforme, GBM)是人脑胶质瘤中恶性程度最高一个亚型(WHO Ⅳ级)。尽管近几年针对GBM的化疗与放疗已取得巨大进展,但GBM患者5年生存率仍不超过5%[1]。研究发现已有多种分子机制、信号通路与表观遗传学变化等共同参与了GBM的发生和发展,过程极其复杂。目前有关长链非编码RNA(long non-coding RNA, LncRNA)、小RNA(microRNA)在胶质母细胞瘤发生与发展中的作用已成为研究热点[2]。LncRNA SNHG5已被证实在GBM中呈高表达并促进GBM细胞增殖、侵袭与抗凋亡进程[3]。本课题组查询LncBase等生物信息网站发现,SNHG5与miR-421具有潜在的结合位点,故本研究将探讨SNHG5与miR-421在GBM中的相互作用关系,进一步研究SNHG5在GBM中的作用机制。
1 资料与方法 1.1 一般资料收集河北医科大学第二医院神经外科2018年1月—2020年5月住院的GBM患者标本31例,其中男性20例,女性11例,年龄42~71(53.43±4.42)岁。每例肿瘤标本均由该院两名经验丰富的病理医师核实并诊断为GBM(根据WHO 2007年标准),术中对上述患者分别留取少许肿瘤组织标本进行后续实验,取32例重型颅脑创伤的患者术中失活脑组织作为对照。本研究经该院伦理委员会审核后批准同意。
1.2 试剂与仪器国产Hyclone DMEM/High-Glucose培养基购自中国Gibco公司,10%特级胎牛血清及双抗购自美国Gibco公司,BAX、Bcl-2、CyclinD1、p21及GAPDH抗体购自英国Abcam公司,miR-421及U6引物由北京Invitrogen公司合成,干扰SNHG5表达的慢病毒购自上海吉凯基因医学科技股份有限公司,SNHG5野生型和突变型双荧光素酶报告载体、SNHG5干扰剂(si-SNHG5)与SNHG5过表达质粒(pcDNA-SNHG5)均购自上海吉玛制药技术有限公司,裸鼠购自南京君科生物工程有限责任公司,Dual-Luciferase® Reporter试剂盒购自北京普洛麦格生物技术有限公司,Applied Biosystems 9700实时荧光定量PCR仪购自美国Life Technologies公司,BioTek Synergy HT多功能酶标仪购自美国伯腾公司,SDS-聚丙烯酰胺凝胶电泳仪和转膜仪购自美国伯乐Bio-Rad公司,DYCZ-24DN型双垂直电泳仪购自北京六一仪器厂,Olympus光学显微镜和倒置相差显微镜购自日本Olympus公司,SW-CJ-IFD净化工作台购自苏州苏净集团安泰空气技术公司,Thermo Forma 3111二氧化碳培养箱购自美国Thermo Fisher Scientific公司,AP250D-0电子天平购自美国Ohaus公司,MLS-3020CH高压蒸汽灭菌器购自日本SANYO公司。
1.3 细胞培养取人胶质母细胞瘤细胞株U87(中国科学院),于10%的FBS、100 u/ml青霉素、100 pg/ml链霉素的DMEM高糖培养基中,置于37℃、5%CO2饱和湿度下孵育,倒置显微镜下观察U87细胞生长情况,每两日更换一次培养基,当细胞处于对数生长期时进行转染。
1.4 细胞转染构建并合成分别干扰SNHG5、miR-421表达的慢病毒及对照空载慢病毒,当U87细胞融合率至40%左右时计算病毒用量,MOI值取4,计算出所需慢病毒的体积并将其与溴化己二甲铵及转染增效试剂转染至U87细胞系中,转染后16 h更换完全培养基,72 h在荧光显微镜下观察绿色荧光并收集细胞进行PCR检测验证转染效果。建立SNHG5稳定低表达的U87细胞系sh-SNHG5及对照细胞系sh-control,用实时荧光定量PCR检测两组miR-421的表达,验证miR-421的表达变化。
用上述方法将干扰miR-421表达的慢病毒转染至SNHG5低表达的U87细胞系sh-SNHG5中,建立SHNG5与miR-421均低表达的细胞系sh-SNHG5+anti-miR-421与对照细胞系sh-SNHG5+anti-control进行动物实验,检测两组裸鼠成瘤体积与重量的差异。
收集对数生长期的U87细胞,以每孔2×105个细胞接种于6孔板中,待细胞长满瓶底时进行转染。用Lipofectamine 2000将pcDNA-SNHG5、pcDNA-control、si-SNHG5+miR-421-inhibitor与si-SNHG5+ control-inhibitor质粒转入U87细胞,建立pcDNA-SNHG5细胞系、pcDNA-control细胞系、si-SNHG5+miR-421-inhibitor细胞系与si-SNHG5+ control-inhibitor细胞系,48 h后收集各组细胞进行PCR验证效果。
1.5 实时荧光定量PCR实验收集GBM肿瘤组织与正常脑组织标本及各组转染后的U87细胞,根据试剂盒说明书提取组织与细胞总RNA,用紫外分光光度计测定其吸光度值,当OD260/OD280的值在1.6~2.0之间时,说明RNA质量最好,计算RNA浓度,将上述总RNA反转录成cDNA,根据试剂盒说明书进行PCR进行扩增,检测组织标本与各组U87细胞中的SNHG5与miR-421的相对表达水平。GAPDH与U6作为内参照。引物设计如下:SNHG5上游引物:5’-CGCTTGGTTAAAACCTGACACT-3’,下游引物:5’-CCAAGACAATCTGGCCTCTATC-3’;miR-421上游引物:5’-GCGCGGATCAACAGACATTAATT-3’,下游引物:5’-GTGCAGGGTCCGAGGT-3’;GAPDH上游引物:5’-GTCTCCTCTGACTTCAACAGCG-3’,下游引物:5’-ACCACCCTGTTGCTGTAGCCAA-3’;U6上游引物:5’-CTCGCTTCGGCAGCACA-3’,下游引物:5’-AACGCTTCACGAATTTGCGT-3’。每组实验重复3次。
1.6 双荧光素酶报告基因实验通过检索生物信息网站LncBase Predicted V2.0,本课题组预测SNHG5可能与miR-421靶向结合,构建插入荧光素酶的野生型与突变型SNHG5质粒,并将上述两种质粒分别与miR-421过表达的质粒及空载质粒共转染入U87细胞中,建立WT-SNHG5+miR-421、WT-SNHG5+miR-control、MUT-SNHG5+miR-421和MUT-SNHG5+miR-control四组细胞系,于转染后48 h收集各组细胞,根据双荧光素酶检测试剂盒说明书步骤先后测定出萤火虫荧光素酶活性与海肾荧光素酶活性,萤火虫荧光素酶/海肾荧光素酶活性即为报告基因活性。
1.7 CCK-8细胞增殖实验将转染后的实验组(si-SNHG5+miR-421-inhibitor)及对照组(si-SNHG5+control-inhibitor)细胞种植于96孔板上,每组分别取5个时间点(24、48、72、96和120 h)进行检测,每组各时间点分别取4个复孔,每孔的细胞密度为4×103个细胞/孔,培养基100 μl,置于培养箱孵育,分别于24、48、72、96和120 h,加入10 μl的CCK-8试剂,加试剂前更换培养基。空白孔内添加100 μl培养基与10 μl的CCK-8试剂,将上述细胞孵育4 h后用酶标仪测定560 nm的吸光度值。
1.8 Transwell实验将si-SNHG5+miR-421-inhibitor组与si-SNHG5+control-inhibitor组细胞种植于24孔板的小室上,细胞密度为1×105个细胞/孔,加入100 μl无血清的培养基孵育,小室底部铺纤维连接蛋白膜,小室外加600 μl含30%血清的培养基,孵育24 h后取出,轻轻擦去小室面膜上的细胞,在小室膜的外表面用甲醇固定30 min,结晶紫染色20 min后清水洗涤3遍,置于显微镜下放大100倍并随机选取6个视野,计数每个视野内的细胞数量,计算细胞数量的平均值并拍照。
1.9 流式细胞术检测细胞凋亡率按试剂盒说明书预先配置工作液,将sh-SNHG5组细胞与sh-control组细胞、si-SNHG5+miR-421-inhibitor组细胞与si-SNHG5+control-inhibitor组细胞经胰酶消化后取预冷过的PBS缓慢冲洗两遍,离心后弃上清液,取事先配置好的工作液缓慢冲悬细胞,再分别依次添加10 μl的7-AAD及5 μl的Annexin V试剂,于室温避光放置15 min后上流式细胞仪测细胞凋亡率。实验重复3次。
1.10 Western blot实验于冰浴中充分研磨细胞同时加入适量的RIPA蛋白裂解液,取蛋白浓度测定试剂盒(BCA, Pierce)测量样品蛋白浓度,根据样品体积与上样缓冲液体积的比值为4:1计算需要加入的5×上样缓冲液的体积,取封口膜封紧管口,煮沸5 min,分装放置于-20℃保存。在预先制好的12%的聚丙烯酰胺凝胶板的每孔内加入100 μg的蛋白进行电泳,转膜时按照海绵、滤纸、凝胶、PVDF膜、滤纸、海绵的顺序放好,约1.5 h后取5%脱脂奶粉的TBST缓冲液封闭1 h,分别加入兔抗人BAX、Bcl-2、CyclinD1与p21多克隆抗体(抗体稀释浓度分别是1:500、1:2000、1:5000与1:1000),密封后置于4℃冰箱过夜。次日添加二抗,避光,室温孵育2 h。用1×TBST清洗3次,每次15 min,于双色红外激光成像系统扫描使条带显影,最后用利Image-Pro Plus 6软件进行灰度定量分析。检测Anti-SNHG5+si-control与Anti-SNHG5+si-miR-421组间CyclinD1、p21、BAX与Bcl-2蛋白表达水平的差异。每组实验重复3次。取GAPDH作为内参照,计算目的蛋白条带与内参条带的灰度比值。
1.11 裸鼠成瘤实验选购20只4周龄雌性裸鼠,分为实验组与对照组(各10只),将sh-SNHG5+anti-miR-421细胞与对照细胞系sh-SNHG5+anti-control分别注射于两组裸鼠侧背部皮下,每只注射5×106个细胞,于无菌饲养室饲养,每周测量一次成瘤的长径及短径,饲养5周后宰杀裸鼠并取出瘤体,称重拍照。
1.12 统计学方法所有数据均采用SPSS17.0统计软件进行处理。计量资料以均数±标准差表示,两组比较采用t检验,多组间比较采用单因素方差分析,P < 0.05为差异有统计学意义。
2 结果 2.1 胶质母细胞瘤中SNHG5和miR-421的表达情况与正常脑组织标本相比,GBM组织中SNHG5的表达显著升高,而miR-421表达显著降低,差异均有统计学意义(均P < 0.05),见图 1。
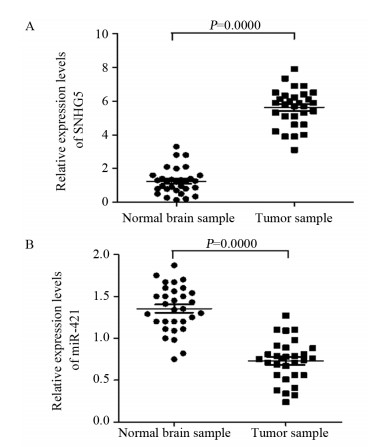
|
| 图 1 SNHG5(A)和miR-421(B)在正常脑组织标本与GBM组织中的表达 Figure 1 Expression of SNHG5(A) and miR-421(B) in normal brain sample and GBM sample |
CCK-8实验结果显示:sh-SNHG5组和sh-control组细胞450 nm吸光度值比较,差异均有统计学意义(均P < 0.05),见图 2。第5天sh-SNHG5组U87细胞增殖能力比sh-control组显著下降(t=3.444, P=0.0137)。Transwell实验结果表明:sh-SNHG5组细胞侵袭力(48.6±9.2个)明显低于sh-control组(142±8.7个)(t=7.361, P=0.0018),见图 3。流式细胞仪检测结果显示:sh-SNHG5组的细胞凋亡比例((16.21±0.86)%)显著高于sh-control组((7.32±0.72)%)(t=7.91, P=0.0014),见图 4。以上实验结果提示SNHG5低表达可有效抑制GBM细胞增殖、侵袭,促进细胞的凋亡。
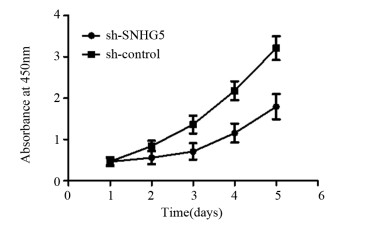
|
| 图 2 抑制SNHG5表达后sh-SNHG5组与sh-control组细胞增殖能力的比较 Figure 2 Comparison of cell proliferation abilities between sh-SNHG5 group and sh-control group after decreasing SNHG5 expression |
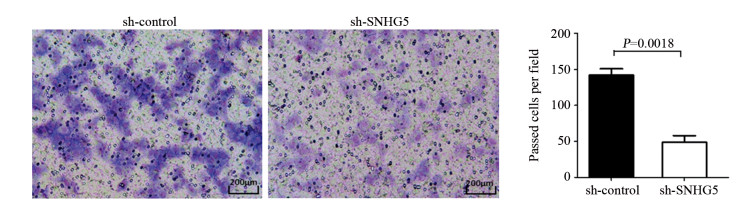
|
| 图 3 抑制SNHG5表达后sh-SNHG5组与sh-control组细胞侵袭力的比较 Figure 3 Comparison of cell invasive abilities between sh-SNHG5 group and sh-control group after decreasing SNHG5 expression |
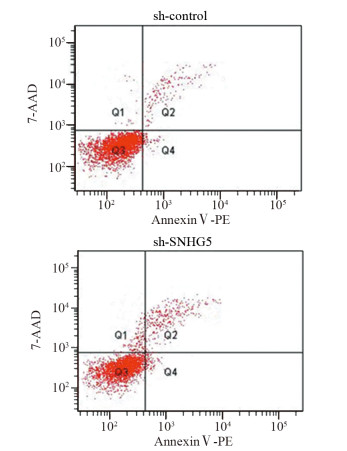
|
| 图 4 抑制SNHG5表达后sh-SNHG5组与sh-control组细胞凋亡的比较 Figure 4 Comparison of cell apoptosis between sh-SNHG5 group and sh-control group after decreasing SNHG5 expression |
实时荧光定量PCR结果发现,在GBM组织中SNHG5与miR-421表达呈负相关(r2=0.5274, P=0.0000),见图 5A。与pcDNA-control组(0.77±0.09)相比,pcDNA-SNHG5组细胞中miR-421表达(0.24±0.08)显著降低(t=5.196, P=0.0004),见图 5B,与sh-control组(0.77±0.10)相比,sh-SNHG5组细胞中miR-421表达(1.94±0.23)显著升高(t=4.470, P=0.0010),见图 5C。通过miRcode和LncBase数据库预测到SNHG5与miR-421存在潜在的结合位点,双荧光素酶活性检测结果显示,与MUT-SNHG5+miR-421组及WT-SNHG5+miR-control组相比,WT-SNHG5+miR-421组细胞相对荧光活性显著降低,差异均有统计学意义(P < 0.05),见图 6。
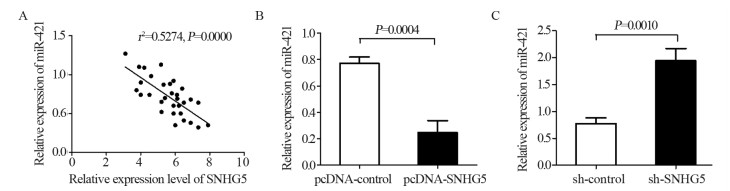
|
| A: the negative correlation of SNHG5 and miR-421 expression levels in GBM sample; B: the expression of miR-421 was decreased after SNHG5 upregulation; C: the expression of miR-421 was increased after SNHG5 downregulation. 图 5 在GBM细胞中lncRNA SNHG5负向调控miR-421的表达 Figure 5 LncRNA SNHG5 regulated negatively miR-421 expression in GBM cells |
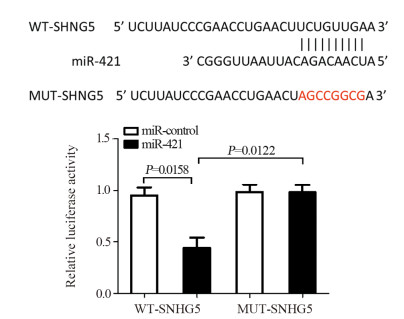
|
| 图 6 SNHG5可靶向结合miR-421 Figure 6 SNHG5 targetedly interacted with miR-421 |
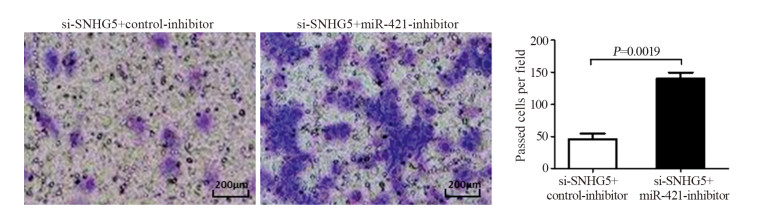
Western blot实验结果表明,si-SNHG5+ control-inhibitor组和si-SNHG5+miR-421-inhibitor组细胞450 nm吸光度值比较差异均有统计学意义(均P < 0.05),见图 7。第5天si-SNHG5+control-inhibitor组比si-SNHG5+miR-421-inhibitor组U87细胞增殖能力显著下降(t=4.137, P=0.0033)。si-SNHG5+control-inhibitor组U87细胞凋亡比例((17.21±2.09)%)显著高于si-SNHG5+miR-421-inhibitor组((7.1±1.21)%)(t=7.319, P=0.0019),见图 8A。与对照组si-SNHG5+control-inhibitor组相比,si-SNHG5+miR-421-inhibitor组中CyclinD1与Bcl-2表达水平升高(t=7.246, P=0.0019与t=6.888, P=0.0023),p21与BAX表达水平下降,差异均有统计学意义(t=4.392, P=0.0118与t=4.508, P=0.0108),见图 8B。si-SNHG5+control-inhibitor组U87细胞侵袭力(45.67±8.76个)明显低于si-SNHG5+miR-421-inhibitor组(140.3±9.50个)(t=7.297, P=0.0019),见图 9。上述结果表明SNHG5是通过靶向miR-421进而促进肿瘤细胞增殖、侵袭及抑制细胞凋亡。
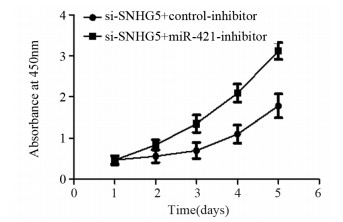
|
| 图 7 拯救实验中si-SNHG5+control-inhibitor组与si-SNHG5+miR-421-inhibitor组细胞增殖能力的比较 Figure 7 Comparison of cell proliferation abilities between si-SNHG5+control-inhibitor group and si-SNHG5+miR-421-inhibitor group in rescue experiments |
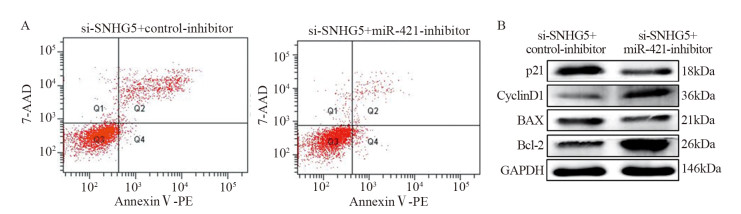
|
| 图 8 拯救实验中Anti-SNHG5+si-control组与si-SNHG5+miR-421-inhibitor组细胞凋亡(A)、BAX、Bcl-2、p21与CyclinD1表达水平(B)的比较 Figure 8 Comparison of cell apoptosis(A) and BAX, Bcl-2, p21 and CyclinD1 expression(B) between si-SNHG5+control-inhibitor group and si-SNHG5+miR-421-inhibitor group in rescue experiments |
|
| 图 9 拯救实验中si-SNHG5+control-inhibitor组与si-SNHG5+miR-421-inhibitor组细胞侵袭能力的比较 Figure 9 Comparison of cell invasion between si-SNHG5+control-inhibitor group and si-SNHG5+miR-421-inhibitor group in rescue experiments |
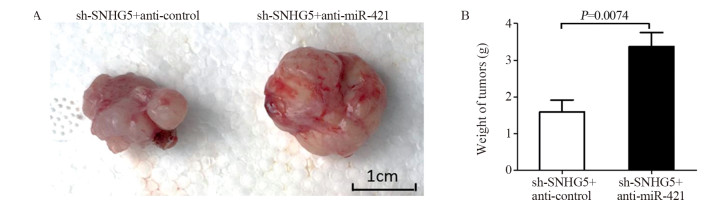
结果表明:sh-SNHG5+anti-control组裸鼠成瘤的体积与重量明显低于sh-SNHG5+anti-miR-421组(t=4.821, P=0.0013; t=3.560, P=0.0074),见图 10。
|
| 图 10 拯救实验中sh-SNHG5+anti-control组与sh-SNHG5+anti-miR-421组裸鼠成瘤体积(A)与重量(B)的比较 Figure 10 Comparison of xenograft tumor volume(A) and weight(B) in nude mice between sh-SNHG5+anti-control group and sh-SNHG5+anti-miR-421 group in rescue experiments |
长链非编码RNA(LncRNA)是长度超过200核苷酸(nt)的一类非编码RNA序列,人体约4%~9%的DNA序列产生的转录本是LncRNA,在表观遗传学、转录及转录后水平等各种生物学活动中均发挥重要的调节作用[4-5]。大量研究发现LncRNA参与人体多种恶性肿瘤的发生与进展[6-8]。SNHG5是LncRNA家族中的一员,它在食管癌、胃癌、乳腺癌等多种恶性肿瘤中呈异常表达,已被证实是一种重要的肿瘤相关因子[9-12]。Chen等[13]发现SNHG5在GBM细胞中显著高表达并通过激活p38/MAPK信号通路促进GBM细胞的增殖。Hu等[3]实验证实抑制SNHG5的表达可经Wnt/CTNNB1信号通路抑制胶质瘤的发展。Meng等[14]发现SNHG5可靶向miR-205-5p并调控ZEB2的表达来促进胶质瘤的增殖与侵袭。由于人体内LncRNA作用机制广泛,本课题组考虑SNHG5作为重要的肿瘤相关因子,是否还通过其他机制调控GBM的发生与发展?本研究经检索生物信息网站发现SNHG5与其他miRNA存在潜在的靶向结合位点,因此,本研究从microRNA角度入手进一步探索SNHG5的作用机制。
miR-421定位于Xq13.2,其异常表达可影响与非小细胞肺癌的发生并与结直肠癌和前列腺癌的发展有关[15-17]。Li等[15]研究发现miR-421过表达可显著促进非小细胞肺癌细胞的增殖。Xue等[16]实验证实miR-421可经靶向抑制MTA1的表达进而抑制结直肠癌的侵袭与转移。Meng等[17]发现miR-421的低表达促进前列腺癌的发生并可负向调控NRAS、PRAME等表达进而影响前列腺癌的增殖与侵袭。Liu等[18]研究发现miR-421在GBM中细胞呈显著低表达并可靶向抑制MEF2D的表达进而抑制GBM肿瘤血管的生成、细胞的糖代谢与细胞侵袭的能力。Meng等[19]研究发现miR-421可靶向抑制SP1的表达及其下游的血管内皮生长因子A(VEGFA)的表达进而抑制胶质瘤的侵袭与生长。本研究利用生物信息网站预测出SNHG5与miR-421具有潜在的结合位点,提出SNHG5也极有可能靶向miR-421并抑制其下游机制,进而促进GBM的发生与进展的假说。首先我们利用实时荧光定量PCR实验发现,GBM肿瘤标本中SNHG5与miR-421的表达呈显著负相关;通过质粒等转染上调与下调U87细胞中SNHG5的表达水平,再用实时荧光定量PCR检测发现miR-421与SNHG5的表达水平变化方向相反。为进一步探索SNHG5靶向mR-421的分子机制,本研究构建野生型与突变型SNHG5的质粒并利用荧光素酶报告基因实验证实SNHG5可直接靶向结合miR-421。上述实验说明在GBM中SNHG5可靶向miR-421并负向调控miR-421的表达。
为进一步明确GBM中SNHG5是否可通过靶向及抑制miR-421的表达而发挥其促肿瘤的作用,本研究进行拯救实验并发现抑制miR-421的表达可在体内外抵消SNHG5低表达对GBM肿瘤增殖、侵袭与抗凋亡的抑制作用。为进一步明确SNHG5靶向miR-421影响GBM细胞增殖与凋亡的机制,本实验发现相比si-SNHG5+miR-421-inhibitor组,si-SNHG5+control-inhibitor组U87细胞中p21与Bax的表达水平升高,而CyclinD1与Bcl-2的表达水平降低。以上结果提示SNHG5可通过靶向miR-421再经某种机制影响p21、Bax、CyclinD1与Bcl-2蛋白的表达,进而调控GBM细胞增殖与凋亡。SNHG5靶向miR-421影响p21、Bax等蛋白表达的机制是否与miR-421靶向抑制MEF2D的表达有关,今后将有待进一步研究[20]。
总结,LncRNA SNHG5可通过靶向miR-421促进GBM细胞增殖与侵袭并抑制其细胞凋亡,且SNHG5过表达是miR-421在GBM细胞中低表达的原因之一。本研究从microRNA的角度进一步探索了SNHG5在GBM中的作用机制,今后还将从可变剪接等其他作用机制进一步探索非编码RNA对GBM发生与进展的调控,为GBM的基因与靶向治疗提供新的思路与理论依据。
作者贡献:
杨吉鹏:实验设计及操作、文章撰写
邱翔、王同聚、李京臣:实验操作、标本收集
李琛、杨建凯:实验操作
焦保华:确定研究方向、实验设计及文章修改
| [1] |
Bryukhovetskiy I, Pak O, Khotimchenko Y, et al. Personalized therapy and stem cell transplantation for pro-inflammatory modulation of cancer stem cells microenvironment in glioblastoma: Review[J]. Int Rev Neurobiol, 2020, 151: 67-98. |
| [2] |
Volovat SR, Volovat C, Hordila I, et al. MiRNA and LncRNA as Potential Biomarkers in Triple-Negative Breast Cancer: A Review[J]. Front Oncol, 2020, 10: 526850. DOI:10.3389/fonc.2020.526850 |
| [3] |
Hu X, Hong Y, Shang C. Knockdown of long non-coding RNA SNHG5 inhibits malignant cellular phenotypes of glioma via Wnt/CTNNB1 signaling pathway[J]. J Cancer, 2019, 10(5): 1333-1340. DOI:10.7150/jca.29517 |
| [4] |
Luo J, Gao Y, Lin X, et al. Systematic analysis reveals a lncRNA-miRNA-mRNA network associated with dasatinib resistance in chronic myeloid leukemia[J]. Ann Palliat Med, 2021, 10(2): 1727-1738. DOI:10.21037/apm-20-343 |
| [5] |
Chen Q, Hu L, Huang D, et al. Six-lncRNA Immune Prognostic Signature for Cervical Cancer[J]. Front Genet, 2020, 11: 533628. DOI:10.3389/fgene.2020.533628 |
| [6] |
Wang D, Zhang S, Zhao M, et al. LncRNA MALAT1 accelerates non-small cell lung cancer progression via regulating miR-185-5p/MDM4 axis[J]. Cancer Med, 2020, 9(23): 9138-9149. DOI:10.1002/cam4.3570 |
| [7] |
Tang Q, Li Z, Han W, et al. High expression of lncRNA SNHG1 in prostate cancer patients and inhibition of SNHG1 suppresses cell proliferation and promotes apoptosis[J]. Indian J Pathol Microbiol, 2020, 63(4): 575-580. DOI:10.4103/IJPM.IJPM_612_19 |
| [8] |
Wang GF, Wen LN. LncRNA SNHG14 promotes proliferation of endometrial cancer through regulating microRNA-655-3p[J]. Eur Rev Med Pharmacol Sci, 2020, 24(20): 10410-10418. |
| [9] |
Wei S, Sun S, Zhou X, et al. SNHG5 inhibits the progression of EMT through the ubiquitin-degradation of MTA2 in oesophageal cancer[J]. Carcinogenesis, 2021, 42(2): 315-326. DOI:10.1093/carcin/bgaa110 |
| [10] |
Chi JR, Yu ZH, Liu BW, et al. SNHG5 Promotes Breast Cancer Proliferation by Sponging the miR-154-5p/PCNA Axis[J]. Mol Ther Nucleic Acids, 2019, 17: 138-149. DOI:10.1016/j.omtn.2019.05.013 |
| [11] |
Zhao L, Han T, Li Y, et al. The lncRNA SNHG5/miR-32 axis regulates gastric cancer cell proliferation and migration by targeting KLF4[J]. FASEB J, 2017, 31(3): 893-903. DOI:10.1096/fj.201600994R |
| [12] |
Zhao L, Guo H, Zhou B, et al. Long non-coding RNA SNHG5 suppresses gastric cancer progression by trapping MTA2 in the cytosol[J]. Oncogene, 2016, 35(44): 5770-5780. DOI:10.1038/onc.2016.110 |
| [13] |
Chen L, Gong X, Huang M. YY1-Activated Long Noncoding RNA SNHG5 Promotes Glioblastoma Cell Proliferation Through p38/MAPK Signaling Pathway[J]. Cancer Biother Radiopharm, 2019, 34(9): 589-596. DOI:10.1089/cbr.2019.2779 |
| [14] |
Meng X, Deng Y, Lv Z, et al. LncRNA SNHG5 Promotes Proliferation of Glioma by Regulating miR-205-5p/ZEB2 Axis[J]. Onco Targets Ther, 2019, 12: 11487-11496. DOI:10.2147/OTT.S228439 |
| [15] |
Li X, Chen SH, Zeng JW. MiR-421 Is Overexpressed and Promotes Cell Proliferation in Non-Small Cell Lung Cancer[J]. Med Princ Pract, 2020, 29(1): 80-89. DOI:10.1159/000503020 |
| [16] |
Xue L, Yang D. MiR-421 inhibited proliferation and metastasis of colorectal cancer by targeting MTA1[J]. J BUON, 2018, 23(6): 1633-1639. |
| [17] |
Meng D, Yang S, Wan X, et al. A transcriptional target of androgen receptor, miR-421 regulates proliferation and metabolism of prostate cancer cells[J]. Int J Biochem Cell Biol, 2016, 73: 30-40. DOI:10.1016/j.biocel.2016.01.018 |
| [18] |
Liu L, Cui S, Zhang R, et al. MiR-421 inhibits the malignant phenotype in glioma by directly targeting MEF2D[J]. Am J Cancer Res, 2017, 7(4): 857-868. |
| [19] |
Meng Q, Li S, Liu Y, et al. Circular RNA circSCAF11 Accelerates the Glioma Tumorigenesis through the miR-421/SP1/VEGFA Axis[J]. Mol Ther Nucleic Acids, 2019, 17: 669-677. DOI:10.1016/j.omtn.2019.06.022 |
| [20] |
Zhao Y, Li Y, Ma Y, et al. Myocyte enhancer factor 2D promotes tumorigenicity in malignant glioma cells[J]. Tumour Biol, 2016, 37(1): 601-610. DOI:10.1007/s13277-015-3791-6 |
 2021, Vol. 48
2021, Vol. 48


