文章信息
- 甲状腺乳头状癌组织中S100A14与LOXL2的表达及临床意义
- Expression and Clinical Significance of S100A14 and LOXL2 in Papillary Thyroid Carcinoma
- 肿瘤防治研究, 2021, 48(6): 594-599
- Cancer Research on Prevention and Treatment, 2021, 48(6): 594-599
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.20.1500
- 收稿日期: 2020-12-23
- 修回日期: 2021-03-22
甲状腺乳头状癌是内分泌系统最常见的恶性肿瘤,占所有甲状腺癌的85%~90%,大多数甲状腺乳头状癌(papillary thyroid carcinoma, PTC)进展缓慢,侵袭性较弱,10年生存率达95%以上[1],随着高分辨率彩超的普及应用及人们对甲状腺体检意识的提高,部分PTC患者早期就检测出淋巴结转移,甚至是远处转移,其中一些病例不乏是甲状腺微小乳头状癌。根据2017版WHO内分泌器官肿瘤分类的标准,将甲状腺乳头状癌分为15个病理亚型,其中部分甲状腺乳头状癌病理亚型具有高侵袭性。越来越多的研究表明,S100A14和LOXL2在消化道肿瘤和妇产科肿瘤转移中发挥一定的作用,而二者在甲状腺乳头状癌中的研究鲜有报道[2-3]。本试验运用免疫组织化学法对甲状腺乳头状癌组织中钙结合蛋白S100A14和赖氨酰氧化酶(LOXL)2的表达水平进行半定量检测,并结合临床病理资料分析,探讨二者之间的相关性及其与甲状腺乳头状癌发生发展、侵袭转移的关系。
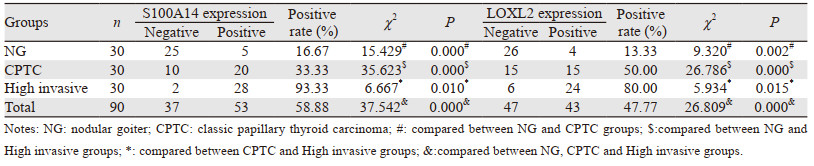
1 资料与方法 1.1 一般资料选取2014年1月至2019年12月空军特色医学中心甲状腺乳头状癌753例,通过对组织切片重新阅片、判读,从中随机筛选出30例经典型甲状腺乳头状癌(classic papillary thyroid carcinoma, CPTC)、30例高侵袭性甲状腺乳头状癌(包括6例鞋钉样亚型、7例实体/梁状亚型、8例柱状细胞亚型、9例高细胞亚型甲状腺乳头状癌病例)和30例结节性甲状腺肿病例(nodular goiter, NG),以上病例均经病理证实。30例结节性甲状腺肿患者年龄28~70岁,平均年龄(53.4±9.84)岁,男女比例为1:5;30例CPTC患者年龄18~57岁,平均年龄(37.8±10.49)岁,男女比例为1:2;30例高侵袭性PTC患者年龄26~65岁,平均年龄(40.57±11.52)岁,男女比例为1:5。在60例PTC中(包括CPTC组和高侵袭组),22例肿瘤直径≥2 cm,38例直径 < 2 cm;其中37例发生淋巴结转移,23例未转移。CPTC和高侵袭组纳入标准:(1)首次入住本院且经手术冰冻或术后病理确诊;(2)临床资料和病理资料齐全。排除标准:(1)病理诊断不明确或肿瘤细胞个数极少;(2)转移性甲状腺肿瘤或伴有其他转移恶性肿瘤病史。根据2018版AJCC甲状腺乳头状癌分期标准,30例CPTC中有2例Ⅱ期,28例Ⅰ期;30例高侵袭性PTC中,1例Ⅱ期,29例Ⅰ期;所有PTC患者均给予甲状腺癌根治术+区域淋巴结清扫术,术中神经检测(NIM3.0)、纳米碳淋巴结显影示踪。本研究经中国人民解放军空军特色医学中心伦理委员会批准。
1.2 组织芯片90例PTC组织和结节性甲状腺肿组织蜡块由北京龙迈达斯科技开发有限公司代加工为组织芯片,芯片直径为1.5 mm,切片厚度4 μm,主要分为以下几个步骤:(1)芯片微阵列设计;(2)评估蜡块、确定研究目标区域;(3) TMA受体蜡块制备;(4)点样、再包埋;(5)切片、捞片;(6) 质控。
1.3 主要试剂及方法S100A14抗体和LOXL2抗体均为兔多克隆抗体,购自英国Abcam公司;根据预实验的结果,所需配制的最佳滴度S100A14为1:2 000,LOXL2为1:200。免疫组织化学方法为SP法,试剂盒购自北京中杉金桥生物技术有限公司,所有操作步骤严格按照说明书进行,用PBS缓冲液代替一抗作阴性对照,分别用前期预试验证实阳性的食管上皮和胎盘组织作为阳性对照。
1.4 结果判定[4]S100A14和LOXL2分别以细胞膜和细胞质着色为主。阳性判断标准采用半定量计数法,即按着色强度和阳性细胞所占的百分比进行结果判定,按染色强度:阴性为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;按着色细胞百分比,无阳性细胞为0分,< 25%为1分,25%~50%为2分,> 50%~75%为3分,> 75%为4分。两者的乘积作为总积分,总分0分为-,1~5分为弱+,5~8分为+,8~12分为++。总分 < 5分为阴性表达,≥5分为阳性表达,5~8分为低表达,8~12分为高表达。所有结果均由两位病理科医师在双盲情况下进行计分。
1.5 统计学方法采用SPSS23.0软件进行统计学分析,计数资料比较应用卡方检验,当出现1 < T < 5时,改用卡方检验的校正公式或者用Fisher精确检验,S100A14和LOXL2表达的相关性分析采用Pearson相关性检验;P < 0.05为差异有统计学意义。
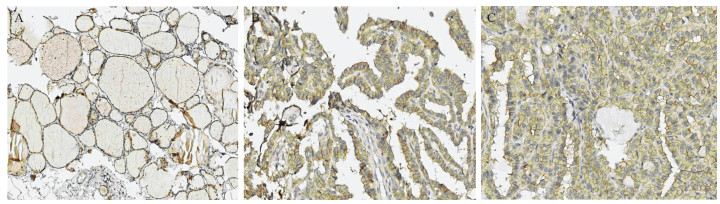
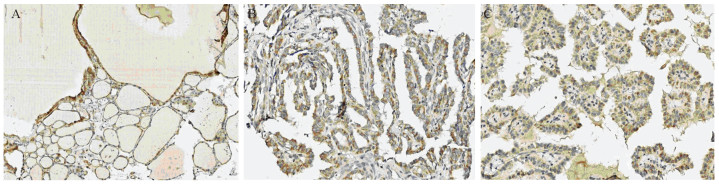
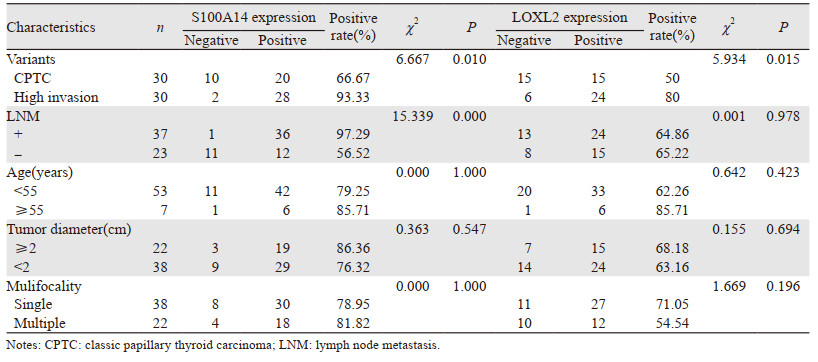
2 结果 2.1 S100A14和LOXL2在甲状腺乳头状癌组织中的表达S100A14的阳性表达主要位于细胞质和细胞膜,以细胞膜上分布更典型,表达强度在NG组、CPTC组、高侵袭组逐步呈上升趋势(χ2=37.542, P=0.000)。LOXL2阳性表达定位主要位于细胞质,个别病例出现细胞核着色,表达强度在NG组、CPTC组、高侵袭组逐步呈上升趋势(χ2=26.809, P=0.000)。S100A14和LOXL2在经典型甲状腺乳头状癌与高侵袭性甲状腺乳头状癌中的表达差异有统计学意义(χ2=6.667, P=0.01; χ2=5.934, P=0.015),见图 1~2、表 1。
|
| 图 1 S100A14在结节性甲状腺肿(A, SP×300)、经典型甲状腺乳头状癌(B, SP×500)和高侵袭性实体/梁状亚型甲状腺乳头状癌(C, SP×500)中的表达 Figure 1 Expression of S100A14 in nodular goiter(A, SP×300), classic papillary thyroid carcinoma (B, SP×500) and highly invasive solid/trabecular variant of papillary thyroid carcinoma (PTC) (C, SP×500) |
|
| 图 2 LOXL2在结节性甲状腺肿(A, SP×300)、经典型甲状腺乳头状癌(B, SP×500)和高侵袭性鞋钉样亚型甲状腺乳头状癌(C, SP ×500)中的表达 Figure 2 Expression of LOXL2 in nodular goiter (A, SP×300), classic papillary thyroid carcinoma (B, SP×500) and highly invasive hobnail variant of PTC (C, SP ×500) |
|
S100A14在甲状腺乳头状癌组织中的表达与淋巴结转移、病理亚型具有显著相关性,而与患者的年龄、肿瘤大小、多灶性无关。LOXL2在甲状腺乳头状癌中的表达与病理亚型具有显著相关性,而与患者的年龄、肿瘤大小、多灶性无关,见表 2。
|
Pearson相关性分析结果显示,在60例甲状腺乳头状癌组织中,S100A14与LOXL2的表达呈正相关(r=0.332, P=0.01),见表 3。
PTC是甲状腺组织滤泡上皮来源的恶性肿瘤,虽然是公认的分化良好的肿瘤,具有良好的预后和较高的生存率,但是依然存在远处转移的风险,给患者带来经济和精神上的压力。已经证实一些亚型具有高侵袭性,包括高细胞亚型、鞋钉样亚型、柱状细胞亚型、实体/梁状亚型[5],具有很高的侵袭性行为和淋巴结转移率。有关研究表明S100A14和LOXL2与很多肿瘤的侵袭、转移具有相关性[6],但目前有关二者在甲状腺病变组织中的研究,国内外文献尚无报道。本文利用免疫组织化学法探讨二者在甲状腺乳头状癌组织中的表达情况及相关性。
3.2 S100A14与甲状腺乳头状癌S100A14是S100家族的新成员,定位在1q21.3,该区段稳定性差,染色体移位、重组、缺失及扩增频繁,易致S100A14表达失控,影响S100A14蛋白正常表达,与肿瘤的发生、发展关系紧密[7]。S100A14蛋白功能主要包括细胞内功能和细胞外功能。细胞内功能主要与二价钙离子结合而发挥作用,调控细胞增殖、分化、凋亡、周期、侵袭、转移、基因转录等,参与肿瘤的发生与进展。细胞外功能主要与受体结合,通过分泌来发挥作用,主要的受体是RAGE[8],部分也与Toll样受体4相互作用[9]。S100A14在不同肿瘤中的表达有明显差异,具有明显的组织特异性,在正常结、直肠、子宫内膜、食管组织中呈高表达,在肺[10]、肝、肾组织中中度表达,在心脏组织中低表达,脑、脾、外周血白细胞不表达,肝癌、肺癌、胃癌、膀胱癌、卵巢癌、乳腺癌和子宫肿瘤中高表达[11-13], 在肾癌、食管癌、口腔鳞癌、结直肠癌中低表达[14-15]。有研究[12]表明细胞内S100A14蛋白通过p53依赖上调基质金属蛋白酶2(MMP-2)的表达进而促进细胞侵袭。有研究[5]表明,细胞外低浓度S100A14蛋白可以激活MAPK信号通路,其中钙离子发挥了重要作用。NFKB信号分子与细胞增殖、应激反应、炎性反应密切相关,S100A14蛋白对其也有显著的激活作用,目前没有统一的机制,各学者报道不一。S100A14是具有双重作用的蛋白,对肿瘤既有促进作用,也有抑制作用[6],目前研究主要集中于其对肿瘤增殖、侵袭、转移与凋亡的影响。有文献[16]报道,S100A14在具有高风险注射药物行为且在未被HIV感染的人群中高表达,NK细胞的数量和活性增加,提示了其在增强自然免疫方面的潜在功能。王岩等发现S100A14蛋白在子宫内膜异位症相关性卵巢癌中阳性率达87.8%[4],本研究显示,S100A14蛋白在结节性甲状腺肿、CPTC及高侵袭性PTC中的表达呈上升趋势,且任两组比较均有显著差异。Hu等[2]通过Meta分析发现S100A14的高表达与肿瘤的分化不良有关,而在年龄、性别、肿瘤分期、肿瘤大小、淋巴结转移等因素差异无统计学意义。本研究中S100A14蛋白的高表达与PTC的高侵袭亚型有关,并且S100A14表达与甲状腺乳头状癌淋巴结转移具有显著相关性,提示S100A14蛋白的阳性表达可能参与了甲状腺乳头状癌的发生发展、侵袭及转移,这与Zhao等[17]在非小细胞肺癌中的研究一致。本研究尚未证实与患者年龄、肿瘤大小及多灶性有关,与文献[18]报道基本相符。
3.3 LOXL2与甲状腺乳头状癌LOXL2是赖氨酰氧化酶家族之一,LOXL2基因定位在8p21.2~21.3,11个外显子,该区域染色体易丢失,是一种铜依赖性胺氧化酶,主要作用是催化胶原和弹性蛋白在细胞外基质中的共价交联,使其纤维化[19],保持细胞外基质结构的完整性,与多种肿瘤及纤维化疾病的发展密切相关。近年来越来越多的研究发现其在乳腺癌、结肠癌、食管癌、胰腺癌、胃癌、肺癌等细胞和组织中表达上调,并可通过促进肿瘤相关纤维化、肿瘤血管的生成在肿瘤微环境中起重要作用。研究发现,LOXL2的高表达与肿瘤的侵袭性有关。刘鹏等[20]研究发现,47例胆管癌组织中LOXL2蛋白阳性率达68.1%,LOXL2 mRNA的表达为154.63±128.96。田洁等[21]研究发现,71例卵巢癌病例中LOXL2阳性表达率为78.87%。研究发现[22],LOXL2参与了肿瘤微环境下血管的形成,与乳腺癌细胞的侵袭及转移有关。相反,也有少量研究表明LOXL2可能起抑癌作用,方堃[23]研究发现LOXL2在前列腺癌组织中的表达明显低于良性前列腺增生组织。Ye等[24]在研究GINS2与甲状腺癌增殖和凋亡关系时发现,GINS2的干扰导致了LOXL2的显著下调,其调节可能与FAK/Akt/mTOR信号通路有关,富含肉豆蔻酰化丙氨酸的c激酶底物样1(MARCKSL1)可导致该调节通路的磷酸化降低,调节细胞周期和凋亡蛋白,而LOXL2可直接与MARCKSL1结合,激活FAK/Akt/mTOR信号调节通路,抑制MARCKSL1诱导的细胞凋亡,从而促进肿瘤的发生发展与转移[25]。本研究显示,LOXL2蛋白在三组的表达呈递增趋势,且任意两组比较均有显著差异,由此推断LOXL2可能参与了甲状腺乳头状癌的发生发展、侵袭和转移;Lin等[26]在肾透明细胞癌的荟萃分析表明,LOXL2 mRNA的高表达与肿瘤的不良预后、分级、淋巴结转移显著相关,而本研究结果发现LOXL2的表达与肿瘤大小、多灶性无关,且尚未证实在三组中表达递增的趋势与淋巴结转移有关,可能与样本量不足、缺乏代表性有关,有待进一步分析和研究。
3.4 S100A14与LOXL2的关系Chen等[27]研究发现S100A14蛋白通过p53依赖性转录调控MMP-2的表达和功能,参与细胞的侵袭,而MMP-2是一类可降解细胞外基质成分的蛋白酶,在高转移性肿瘤中,MMP-2的高表达可降解Ⅳ型胶原蛋白,从而促进肿瘤的侵袭和转移。LOXL2蛋白的功能是催化细胞外基质(ECM)中胶原蛋白、弹性蛋白的共价交联,Peng等[28]的研究表明,LOXL2的高表达可以上调MMP-2、MMP-9的表达,从而促进胃癌细胞的迁移和侵袭。S100A14与LOXL2高表达都可以上调MMP-2的表达,从而促进肿瘤的侵袭和转移。二者的交汇点和共同点是都可以上调基质金属蛋白酶的表达。还有研究[28-29]表明二者都可以促进肿瘤微血管的形成,具体协同机制不详。本实验表明S100A14与LOXL2在甲状腺病变组织中的表达依次呈递增趋势,通过Pearson相关性分析,二者具有显著相关性。关于两者具体协同发生机制有待进一步研究。
3.5 S100A14、LOXL2与甲状腺乳头状癌的关系本课题前期研究发现甲状腺乳头状癌在男性中比例有升高和年轻化的趋势,而肿瘤的诊治关键在于早发现,迫切需要寻找新的蛋白分子或血清学指标,对肿瘤的早期发现或预后提示具有重要意义[30]。而S100A14与LOXL2主要集中在妇科肿瘤、消化道肿瘤方面的研究,尚无在甲状腺乳头状癌中的研究报道。本研究发现,S100A14与LOXL2在甲状腺乳头状癌不同病理亚型中的表达具有显著差异,提示对规范甲状腺乳头状癌的诊治工作具有重要意义,再次强调对PTC病理分型的重要性。本实验尚有不足之处,比如样本量少、组织芯片采样产生的误差、缺乏对高侵袭性具体亚型讨论及抗体表达情况与患者预后等,有待进一步提高改进。
作者贡献:
王冬海:论文撰写
任力:课题设计,修改论文
李腾:统计学分析,阅片判读
郑吉春:阅片判读,结果分析
朱建平:实验设计及操作
| [1] |
Chen Y, Chen S, Lin X, et al. Clinical Analysis of Cervical Lymph Node Metastasis Risk Factors and the Feasibility of Prophylactic Central Lymph Node Dissection in Papillary Thyroid Carcinoma[J]. Int J Endocrinol, 2021, 2021: 6635686. |
| [2] |
Hu L, Kong F, Pan Y. Prognostic and clinicopathological significance of S100A14 expression in cancer patients: A meta -analysis[J]. Medicine(Baltimore), 2019, 98(28): e16356. |
| [3] |
Zhang X, Huang J, You F, et al. Prognostic and clinicopathological significance of LOXL2 in cancers: A systematic review and meta-analysis[J]. J Cell Physiol, 2019, 234(11): 21369-21379. DOI:10.1002/jcp.28746 |
| [4] |
王岩, 马宁耶, 汤丽红, 等. KLF4与S100A14在子宫内膜异位症相关性卵巢癌中的表达及临床意义[J]. 现代肿瘤医学, 2019, 27(14): 2565-2570. [Wang Y, Ma NY, Tang LJ, et al. Expression and clinical significance of KLF4 and S100A14 in endometriosis associated ovarian carcinoma[J]. Xian Dai Zhong Liu, 2019, 27(14): 2565-2570. DOI:10.3969/j.issn.1672-4992.2019.14.033] |
| [5] |
Nath MC, Erickson LA. Aggressive variants of papillary thyroid carcinoma: hobnail, tall cell, colummar, and solid[J]. Adv Anat Pathol, 2018, 25(3): 172-179. DOI:10.1097/PAP.0000000000000184 |
| [6] |
姬峻芳. S100蛋白家族与肿瘤[J]. 国外医学(肿瘤学分册), 2002, 29(4): 261-263. [Ji JF. S100 protein family and tumor[J]. Guo Wai Yi Xue (Zhong Liu Xue Fen Ce), 2002, 29(4): 261-263. DOI:10.3760/cma.j.issn.1673-422X.2002.04.007] |
| [7] |
Xu C, Chen H, Liu Z, et al. S100A14, a member of the EF-hand Calcium-binding proteins, is overexpressed in breast cancer and acts as a modulator of HER2 signaling[J]. Biol Chen, 2014, 289(2): 827-837. DOI:10.1074/jbc.M113.469718 |
| [8] |
Jin Q, Chen H, Luo A, et al. S100A14 stimulates cell proliferation and induces cell apoptosis at different concentrations via receptor for advanced glycation end products(RAGE)[J]. PLoS One, 2011, 6(4): e19375. DOI:10.1371/journal.pone.0019375 |
| [9] |
Chen B, Miller AL, Rebelatto M, et al. S100A9 induced inflammatory responses are mediated by distinct damage associated molecular patterns(DAMP) receptors in vitro and in vivo[J]. PLoS One, 2015, 10(2): e0115828. DOI:10.1371/journal.pone.0115828 |
| [10] |
Wang T, Huo X, Chong Z, et al. A review of S100 protein family in lung cancer[J]. Clin Chim Acta, 2018, 476: 54-59. DOI:10.1016/j.cca.2017.11.010 |
| [11] |
Hu R, Huffman KE, Chu M, et al. Quantitative secretomic analysis identifies extracellular protein factors that modulate the metastatic phenotype of non-small cell lung cancer[J]. J Proteome Res, 2016, 15(2): 477-486. DOI:10.1021/acs.jproteome.5b00819 |
| [12] |
Wang X, Yang J, Qian J, et al. S100A14, a mediator of epithelialmesenchymal transition, regulates proliferation, migration and invasion of human cervical cancer cells[J]. Am J Cancer Res, 2015, 5(4): 1484-1495. |
| [13] |
Cho H, Shin HY, Kim S, et al. The role of S100A14 in epithelial ovarian tumors[J]. Oncotarget, 2014, 5(11): 3482-3496. DOI:10.18632/oncotarget.1947 |
| [14] |
Kim G, Chung JY, Jun SY, et al. Loss of S100A14 expression is associated with the progression of adenocarcinomas of the small intestine[J]. Pathobiology, 2013, 80(2): 95-101. DOI:10.1159/000342394 |
| [15] |
Diamantopoulou A, Mantas D, Kostakis ID, et al. A Clinicopathological Analysis of S100A14 Express in Colorectal Cancer[J]. In Vivo, 2020, 34(1): 321-330. DOI:10.21873/invivo.11777 |
| [16] |
Colón K, Speicher DW, Smith P, et al. S100A14 is increased in activated NK cells and plasma of HIV-exposed seronegative people who inject drugs and promotes monocyte-NK crosstalk[J]. J Acquir Immune Defic Syndr, 2019, 80(2): 234-241. DOI:10.1097/QAI.0000000000001911 |
| [17] |
Zhao W, Chen T, Zhao Y. Upregulated lncRNA CASC9 Contributes to Progression of Non-Small Cell Lung Cancer Through Inhibition of miR-335-3p and Activation S100A14 Expression[J]. Onco Targets Ther, 2020, 13: 6027-6036. DOI:10.2147/OTT.S249973 |
| [18] |
杨晶, 王翔宇, 王欣, 等. S100A14与RAGE在子宫鳞癌组织中的表达及临床意义[J]. 现代妇产科进展, 2015, 24(9): 660-664. [Yang J, Wang XY, Wang X, et al. The expression and significances of S100A14 and RAGE in cervical squamous cell carcinoma[J]. Xian Dai Fu Chan Ke Jin Zhan, 2015, 24(9): 660-664.] |
| [19] |
Matsuo A, Tanida R, Yanagi S, et al. Significance of nuclear LOXL2 inhibition in fibroblasts and myofibroblasts in the fibrotic process of acute respiratory distress syndrome[J]. Eur J Phamacol, 2021, 892: 173754. DOI:10.1016/j.ejphar.2020.173754 |
| [20] |
刘鹏, 王建华, 蒋海滨, 等. LOXL2和E-cadherin在胆管癌浸润转移中的表达及相关性[J]. 世界华人消化杂志, 2014, 22(35): 5542-5549. [Liu P, Wang JH, Jiang HB, et al. Expression of E-cadherin and lysyl oxidase-like 2 in cholangiocarcinoma[J]. Shi Jie Hua Ren Xiao Hua Za Zhi, 2014, 22(35): 5542-5549.] |
| [21] |
田洁, 丁丽君, 李晓兰. 赖氨酰氧化酶样蛋白2在卵巢上皮性癌组织中表达及意义[J]. 山西医科大学学报, 2018, 49(11): 1387-1390. [Tian J, Ding LJ, Li XL. Expression and significance of lysyl oxidase-like protein 2 in epithelial ovarian cancer[J]. Shanxi Yi Ke Da Xue Xue Bao, 2018, 49(11): 1387-1390.] |
| [22] |
Ahn SG, Dong SM, Oshima A, et al. LOXL2 expression is associated with invasiveness and negatively influences survival in breast cancer patients[J]. Breast Cancer Res Treat, 2013, 141(1): 89-99. DOI:10.1007/s10549-013-2662-3 |
| [23] |
方堃. 赖氨酰氧化酶家族蛋白在人前列腺癌组织中的表达及意义[D]. 辽宁: 大连医科大学, 2015. [Fang K. Expression and significance of lysyl oxidase family proteins in human prostate cancer[D]. Liaoning: Dalian Medical University, 2015.]
|
| [24] |
Ye Y, Song YN, He SF, et al. GINS2 promotes cell proliferation and inhibits cell apoptosis in thyroid cancer by regulating CITED2 and LOXL2[J]. Cancer Gene Ther, 2019, 26(3-4): 103-113. DOI:10.1038/s41417-018-0045-y |
| [25] |
Kim BR, Dong SM, Seo SH, et al. Lysloxidase-like2(LOXL2) controls tumor-associated cell proliferation through the interaction with MARCKSL1[J]. Cell Signal, 2014, 26(9): 1765-1773. DOI:10.1016/j.cellsig.2014.05.010 |
| [26] |
Lin S, Zheng L, Lu Y, et al. Comprehensive analysis on the expression levels and prognostic values of LOX family genes in kidney renal clear cell carcinoma[J]. Cancer Med, 2020, 9(22): 8624-8638. DOI:10.1002/cam4.3472 |
| [27] |
Chen H, Yuan Y, Zhang C, et al. Involvement of S100A14 protein in cell invasion by affecting expression and function of matrix metalloproteinase(MMP)-2 via p53-dependent transcriptional regulation[J]. J Biol Chem, 2012, 287(21): 17109-17119. DOI:10.1074/jbc.M111.326975 |
| [28] |
Peng T, Deng X, Tian F, et al. The interaction of LOXL2 with GATA6 induces VEGFA expression and angiogenesis in cholangiocarcinoma[J]. Int J Oncol, 2019, 55(3): 657-670. |
| [29] |
陈颖, 张三元. S100A14在妇科肿瘤发生发展中的研究进展[J]. 国际妇产科学杂志, 2019, 46(5): 552-555. [Chen Y, Zhang SY. Research Progress of S100A14 Protein in Gynecologic Oncology Development[J]. Guo Ji Fu Chan Ke Xue Za Zhi, 2019, 46(5): 552-555. DOI:10.3969/j.issn.1674-1870.2019.05.018] |
| [30] |
Al-Ashkar N, Zetoune AB. S100A14 serum level and its correlation with prognostic factors in breast cancer[J]. J Egypt Natl Canc Inst, 2020, 32(1): 37. DOI:10.1186/s43046-020-00048-y |
 2021, Vol. 48
2021, Vol. 48