文章信息
- 胃癌中MPZL1的表达及其对胃癌细胞增殖能力的影响
- Expression of MPZL1 in Gastric Cancer and Its Effect on Proliferation of Tumor Cells
- 肿瘤防治研究, 2021, 48(7): 679-685
- Cancer Research on Prevention and Treatment, 2021, 48(7): 679-685
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.20.1458
- 收稿日期: 2020-12-11
- 修回日期: 2021-05-06
2. 200127 上海,上海交通大学医学院附属仁济医院放疗科;
3. 200032 上海,复旦大学附属肿瘤医院肿瘤内科
2. Department of Radiotherapy Oncology, Renji Hospital, School of Medicine, Shanghai Jiaotong University, Shanghai 200127, China;
3. Department of Medical Oncology, Fudan University Shanghai Cancer Center, Shanghai 200032, China
我国胃癌的发病及死亡病例数超过世界胃癌总数的一半,是造成我国癌症死亡的第二大原因[1]。胃癌起病隐匿,早期诊断率低,约一半的患者就诊时已是晚期。药物治疗是晚期胃癌的主要治疗方式,但其疗效有限,多数患者生存期仅一年左右[2]。探索促进胃癌发展的分子机制可能为其临床治疗提供新的靶点。
MPZL1(myelin protein zero like 1),又称为PZR(protein zero-related),是属于Ig-Ⅴ型免疫受体家族的一种细胞膜糖蛋白,最早报道于1998年[3]。在小鼠体内的相关研究发现,MPZL1同源蛋白在胚胎成纤维细胞中持续表达,可在纤连蛋白的诱导下,增强细胞迁移能力[4-5];在牛体内,同源蛋白在髓鞘形成以及维持其形态中发挥作用,配体尚不清楚,可能与细胞黏附相关信号通路有关[6]。早期研究报道MPZL1在人体多个系统组织中有所分布,可能在细胞增殖、分化、运动等方面发挥重要作用。近年来,有学者发现,MPZL1在肝细胞肝癌中高表达[7],能够促进结直肠癌转移[8],但是在胃癌中的作用还未见报道。因此,本研究通过在线数据库分析MPZL1与胃癌患者预后的关系,观察MPZL1对胃癌细胞增殖、克隆形成的影响,并探讨其机制,从而为胃癌治疗新靶点的探索提供理论基础及实验依据。
1 材料与方法 1.1 实验材料DMEM培养基、RPMI 1640培养液和胎牛血清均购自美国Gibco公司;MPZL1抗体、Vinculin抗体和HRP-标记二抗等均购自美国Abcam公司,MPZL1过表达及敲减慢病毒购自汉尹生物科技(上海)有限公司。RIPA裂解液、蛋白提取试剂盒和BCA蛋白定量试剂盒均购自上海碧云天生物技术研究所;RNA反转录试剂盒和实时荧光定量PCR试剂盒购自日本TaKaRa公司;Lipofectamine 3000购自美国Invitrogen公司;CCK-8试剂盒购自日本同仁公司;荧光定量PCR仪和凝胶成像系统购自美国Bio-Rad公司;相机购自日本Canon公司;荧光倒置显微镜购自日本Olympus公司。
1.2 实验方法 1.2.1 利用GEPIA数据库挖掘MPZL1在多种肿瘤中的表达情况运用GEPIA数据库研究MPZL1在多种肿瘤中的表达趋势,以及在胃癌患者中的表达水平。GEPIA数据库是用于分析来自癌症基因组图谱(The Cancer Genome Atlas, TCGA)和基因型-组织表达(Genotype-Tissue Expression, GTEx)项目的9 736种肿瘤和8 587个正常样本的RNA测序表达数据[9]。
1.2.2 利用UALCAN数据库进行MPZL1的mRNA水平在胃癌与正常胃组织表达差异性的分析采用UALCAN数据库分析MPZL1的mRNA水平在胃癌与正常胃组织中表达的差异性。UALCAN数据库拥有多种癌症类型的TCGA RNA-seq和临床数据,可以在各亚组肿瘤和正常组织样本中,查询某个或某些基因的相对表达临床病理资料以及对肿瘤患者生存时间的影响[10]。
1.2.3 利用KM Plotter和UALCAN数据库进行MPZL1的表达与胃癌患者总生存时间关系的分析利用KM Plotter和UALCAN数据库[11]的GC数据集进行生存分析。KM Plotter数据库依据MPZL1的表达量中位值,将胃癌患者分为高表达组和低表达组,UALCAN数据库依据MPZL1的表达第三四分位数将胃癌患者分为高表达组和低表达组;通过计算Log rank P值和HR、95%区间来估算总体生存期,以P < 0.05为差异有统计学意义。
1.2.4 构建MPZL1过表达及敲减的稳转细胞株将慢病毒按比例加入待感染的胃癌细胞中,感染48 h后,加入最适浓度的嘌呤霉素(Puromycin)进行药物筛选,获得抗性克隆并扩大培养,Puromycin维持10~14天,构建稳定感染细胞株。
1.2.5 实时荧光定量PCR法检测25 μl反应体系中包括上下游引物各0.5 μl、2×Mix 12.5 μl(含反应缓冲液、dN TP、MgCl2、SYBRGreen、TaqDNA polymerase)、灭菌MQ水11 μl、cDNA 1 μl。PCR反应体系如下:10×缓冲液25 μl,25 mmol/L MgCl2 1.5 μl,dNTP(10 mmol/L)0.5 μl,基因上下游引物各0.5 μl,Taq DNA聚合酶25 u,RT反应产物1.5 μl,灭菌MQ水加至25 μl;PCR反应条件:95℃ 30 s,60℃ 30 s,72℃ 45 s,共30个循环,经预实验确认处于指数扩增期。GAPDH和MPZL1的读靶温度为82℃,将监测临界点设在PCR扩增过程中,荧光信号由本底进入指数扩增阶段的拐点所对应的循环数(Ct)作为模板初始浓度的间接指标。在扩增效率达95%~105%时,使用2-ΔΔCt法(Ct代表循环阈值)计算相对定量比值。GAPDH引物序列为:上游:5’-GCACCGTCAAGGCTGAGAAC-3’,下游:5’-TGGTGAAGACGCCAGTGGA -3’;MPZL1引物序列为:上游:5’-TGTTTCCAGTTTGGGTAG-3’,下游:5’-TGAGATCCAGAAGGCAGA-3’。
1.2.6 Western blot法检测蛋白表达细胞收集后加入RIPA裂解液常规方法提取细胞的总蛋白,BCA法测定蛋白浓度。取30~50 μg蛋白质,行10%~15%SDS-PAGE电泳。电泳完毕后,4℃、100 V电转移100 min至0.45 μm PVDF膜上。PVDF膜用含5%~10%脱脂奶粉的TBST室温封闭1 h后,加入一抗4℃孵育过夜,洗膜后,加入二抗室温孵育1.5 h,洗膜后,加入显色曝光液常规显像。
1.2.7 CCK-8法检测细胞增殖胃癌细胞株使用含10%FBS的培养基;取2 000个/孔(每孔100 μl)的浓度将处于对数期的细胞接种到96孔板,每孔设3个对照;待细胞贴壁后,加入10 μl CCK-8,温育2 h;用自动酶标仪在450 nm波长处,测定各孔的OD值。连测4 d,最后取各样本的平均值进行比较。
1.2.8 平板克隆形成实验将胃癌细胞株常规消化重悬为细胞悬液,密度调整至每毫升250个;在6孔板中,每孔加入2 ml上述密度的细胞,每种细胞设置3个平行孔;放入37℃培养箱中培养10~14天,3~5天更换一次新鲜培养基。每孔加入4%多聚甲醛30 min,然后用1.0%~1.5%结晶紫染色10~20 min,洗涤晾干后拍照并计数,独立实验重复3次。
1.2.9 流式细胞术检测细胞凋亡将胃癌细胞株常规消化重悬为细胞悬液,离心计数,将细胞调至2×106个/毫升,经Annexin-V-PE、7AAD标准染色后,利用流式细胞术检测细胞凋亡情况。
1.3 统计学方法采用SPSS22.0统计软件对数据进行统计学分析,所有实验数据均用(x±s)表示,多组均数的比较采用单因素方差分析,两组均数的比较采用t检验。P < 0.05为差异有统计学意义。
2 结果 2.1 MPZL1在多种恶性肿瘤中呈高表达趋势GEPIA数据库分析结果显示,MPZL1在弥漫性大B细胞淋巴瘤(DLBC)、食管癌(ESCA)、多形性胶质母细胞瘤(GBM)、脑低级别胶质瘤(LGG)、肝细胞肝癌(LIHC)、胰腺癌(PAAD)、直肠腺癌(READ)、胸腺癌(THYM)及胃癌(STAD)等多种肿瘤中呈高表达趋势,与正常组织比较,表达差异均有统计学意义(均P < 0.05),见图 1。
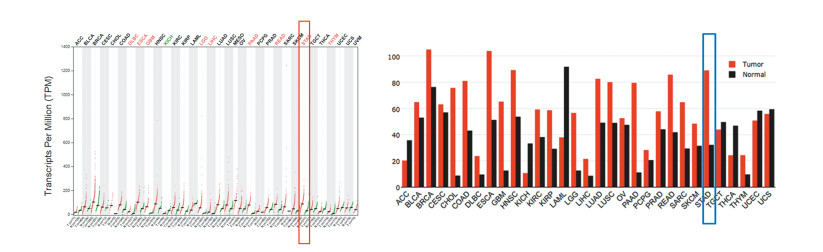
|
| 图 1 MPZL1在多种恶性肿瘤中呈高表达趋势 Figure 1 MPZL1 was highly expressed in many malignancies |
UALCAN数据库分析正常胃上皮组织(34例)和胃癌组织(415例)中MPZL1的表达,结果显示:胃癌组织中MPZL1的表达量明显高于正常胃组织,见图 2A,差异有统计学意义(P=1.624E-12)。与正常胃上皮组织相比,MPZL1在G1级(12例)、G2级(148例)和G3级(246例)(9例数据库未提供阳性数据)胃癌患者中的表达差异有统计学意义(P=3.44E-04,P < 1E-12,P < 1E-12)。在G1级和G3级、G2级和G3级的胃癌患者中的表达差异有统计学意义(P=0E+00,P=4.88E-03),而在G1级和G2级的胃癌患者中的表达无明显差异(G1 vs. G2 P=7.20E-01),见图 2B。与正常胃上皮组织相比,MPZL1在N1组(112例)、N2组(79例)、N3组(82例)(数据库未提供其他分级)的表达差异有统计学意义(P < 1E-12,P=1.624E-12,P=1.627E-12),见图 2C。以上结果表明,胃癌组织中MPZL1的高表达与胃癌组织学分级及淋巴结转移有关。
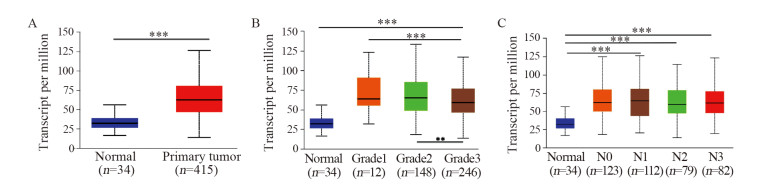
|
| A: Expression of MPZL1 in STAD based on sample types; B: Expression of MPZL1 in STAD based on tumor grade; C: Expression of MPZL1 in STAD based on node metastasis status. **: P < 0.01; ***: P < 0.001. 图 2 UALCAN数据库分析MPZL1在胃癌中的表达 Figure 2 MPZL1 expression in gastric cancer tissues analyzedby UALCAN database |
对KM Plotter数据库中631例(高表达患者402例,低表达患者229例)胃癌患者总生存时间进行统计分析结果显示,MPZL1高表达与胃癌患者的总生存时间负相关(P < 0.01),见图 3A。对UALCAN数据库中392例(高表达患者94例,低表达患者298例)胃癌患者总生存时间进行统计分析,结果显示MPZL1不同表达水平患者之间的总生存时间差异无统计学意义(P=0.51),见图 3B。

|
| 图 3 KM Plotter(A)和UALCAN(B)数据库分析MPZL1的表达对胃癌患者总生存时间的影响 Figure 3 Effect of MPZL1 expression on OS of gastric cancer patients analyzed by KM Plotter(A) and UALCAN databases(B) |
通过MPZL1过表达慢病毒感染MPZL1低表达的胃癌细胞株SGC-7901、SNU-216,利用MPZL1敲减慢病毒感染高表达的胃癌细胞株GTL-16,感染48 h后加入含嘌呤霉素的培养基进行筛选,收集筛选后的细胞进行检测。Western blot及荧光定量PCR检测结果均提示,感染MPZL1的SGC-7901/MPZL1和SNU-216/MPZL1细胞较转入空载体的SGC-7901/Con和SNU-216/Con细胞中MPZL1的表达水平明显提高,感染shMPZL1的GTL-16/shMPZL1细胞较感染对照空载体的GTL-16/NC细胞的MPZL1表达水平明显降低,见图 4。
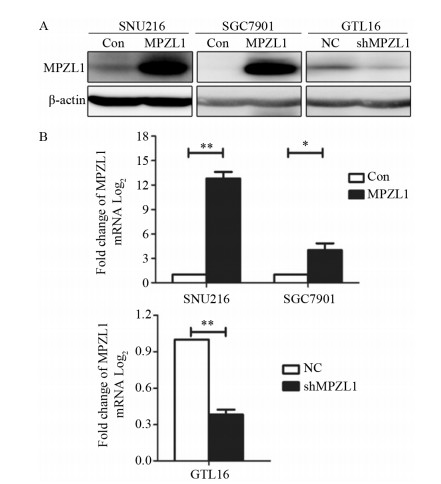
|
| *: P < 0.05, **: P < 0.01; NC: normal control. 图 4 Western blot(A)和实时荧光定量PCR(B)检测胃癌细胞中MPZL1的表达水平 Figure 4 MPZL1 expression in gastric cancer cells detected by Western blot(A) and real-time PCR(B) |
CCK-8实验结果显示,与SGC-7901/Con、SNU-216/Con组相比,SGC-7901/MPZL1、SNU-216/MPZL1组的细胞增殖能力明显增强(SGC-7901组:Pd2=0.0171, Pd3=0.0007, Pd4 < 0.0001;SNU-216组:Pd3=0.0033, Pd4=0.0024);GTL-16/shMPZL1增殖能力明显低于GTL-16/NC组(Pd2=0.0291, Pd3=0.0012, Pd4=0.0088),见图 5。
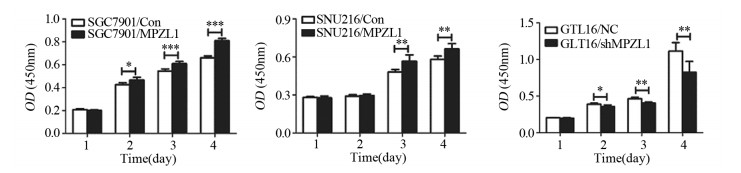
|
| *: P < 0.05, **: P < 0.01, ***: P < 0.001. 图 5 CCK-8法检测胃癌细胞的增殖能力 Figure 5 Proliferation ability of gastric cancer cells detected by CCK-8 assay |
SGC-7901/MPZL1组和SNU-216/MPZL1组形成的克隆数明显多于SGC-7901/Con组和SNU-216/Con组,差异有统计学意义(SGC-7901组P=0.0001,SNU-216组P=0.0040),见图 6。GTL-16/shMPZL1组的克隆形成数显著低于GTL-16/NC组(P=0.0411)。上述结果说明,MPZL1能促进胃癌细胞的克隆形成能力。

|
| *: P < 0.05, **: P < 0.01, ***: P < 0.001. 图 6 平板克隆实验检测胃癌细胞的克隆形成能力 Figure 6 Colony formation ability of gastric cancer cells detected by colony formation assay |
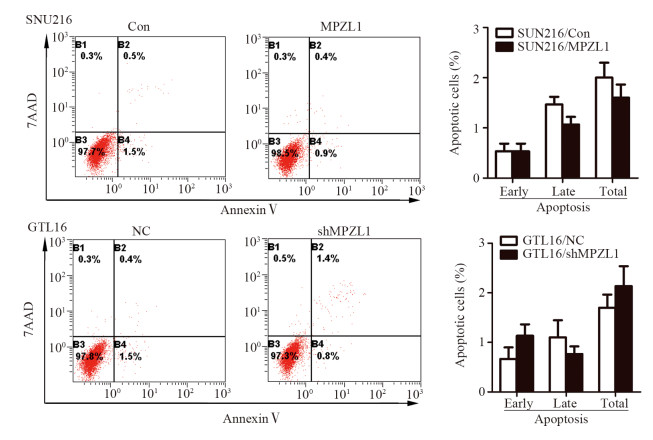
Western blot实验发现,促凋亡因子Bad、Caspase-7在SGC-7901/MPZL1、SNU-216/MPZL1组中的表达水平均较SGC-7901/Con和SNU-216/Con组明显降低,GTL-16/shMPZL1组中的表达水平高于GTL-16/NC组,而抗凋亡因子Bcl-2及促凋亡因子Caspase-9未见明显变化,见图 7。流式细胞术结果发现MPZL1过表达后凋亡细胞比例相对减少,敲减后凋亡细胞比例稍有增高,但差异均未达到统计学意义,见图 8。

|
| 图 7 Western blot实验检测凋亡相关蛋白表达变化 Figure 7 Apoptosis-related protein expression detected by Western blot |
|
| 图 8 流式细胞术检测细胞凋亡 Figure 8 Cell apoptosis detected by flow cytometry |
MPZL1最初是从293细胞中分离出来的SHP2连接蛋白,其Ig结构域同髓鞘蛋白P存在46%同源,胞内段含有ITIM(immunoreceptor tyrosine-based inhibitory motif)结构域,借此进行细胞信号转导,在细胞增殖、分化、运动等方面发挥重要作用[4, 6, 12]。在小鼠细胞中发现,MPZL1在纤连蛋白的诱导下可以增强细胞迁移能力[5]。但MPZL1在肿瘤中报道并不多。2014年何祥火团队发现,肝细胞肝癌(HCC)组织中MPZL1呈高表达,且其表达水平与HCC肝内转移正相关,MPZL1可能与MPZL1/Src/Cortactin通路相关[7]。2019年,有学者发现MPZL1可以通过Src和Fak促进结直肠癌的转移[8]。在胆囊癌和卵巢癌的研究中发现,MPZL1过表达不仅可以促进转移,也可以促进肿瘤细胞的增殖,Src激酶可能是其作用靶点[13-14]。2020年,在非小细胞肺癌的研究中发现,MPZL-1可能通过影响EMT通路参与调控顺铂的药物敏感度[15]。
目前,MPZL1在肿瘤中的相关报道均提示该基因可能发挥促进肿瘤发展的作用,但是在胃癌中的作用没有进行过探索。因此,为了探索MPZL1在胃癌中的作用,我们首先分析了MPZL1在全球胃癌患者样本中的表达情况。通过对在线数据库GEPIA进行数据挖掘,我们发现MPZL1在多种肿瘤中呈现高表达趋势,之后通过UALCAN数据库验证了MPZL1在胃癌组织中高表达,且与胃癌分期及淋巴结转移有关。进一步分析KM Plotter的数据提示,胃癌患者中MPZL1高表达与总生存时间缩短有关;分析UALCAN数据库的生存数据提示,MPZL1不同表达水平的患者之间总生存时间差异并没有统计学意义。在目前已发表的相关研究中,没有关于MPZL1表达与恶性肿瘤患者总生存时间之间关系的报道[7-8, 13-15]。不同在线数据库中,MPZL1表达与胃癌患者总生存时间关系结论不一致。本研究缺乏胃癌患者组织标本中MPZL1表达的数据结果及相应的病理特征分析,无法对MPZL1在我国胃癌患者中的表达进行深入分析,这是本文的不足之处,后续我们将进一步开展相关的研究工作。
我们采用CCK-8法检测细胞的增殖能力,MPZL1过表达的SGC-7901/MPZL1和SNU-216/MPZL1组细胞增殖能力较对照组明显增强,敲减组的GTL-16/shMPZL1增殖能力明显低于对照组(P < 0.05),提示MPZL1在胃癌细胞的生长中起促进作用。本研究发现MPZL1过表达后细胞的克隆形成能力显著提高(P < 0.05),敲减组的GTL-16/shMPZL1组中观察的克隆形成能力明显低于对照组(P < 0.05),提示MPZL1提高胃癌细胞株的体内成瘤能力。我们的体外实验结果基本与数据库中对MPZL1预测的结果相符。
细胞凋亡异常与肿瘤的发生发展及预后密切相关,凋亡抑制或减弱是多种癌症所共有的表现。Caspase家族是细胞凋亡的重要组成部分,通过级联反应诱导细胞凋亡。有研究证实,Caspase-7的表达与胃癌的进展呈负相关[16]。Bad蛋白属于Bcl-2家族,Bad活化后可加速细胞凋亡。Barrezueta等证实Bad与胃癌的增殖能力有关[17]。本研究发现,胃癌细胞过表达MPZL1后促凋亡蛋白Bad和Caspase表达减少,敲减MPZL1后其表达增加,提示MPZL1抑制了胃癌细胞的凋亡;流式细胞术检测发现MPZL1表达水平增加后细胞凋亡比例减少、表达敲减后细胞凋亡比例增高,但并没有达到统计学差异。这些提示抑制凋亡可能是MPZL1促进细胞增殖的重要机制之一,但是其具体机制有待进一步的研究。
综上所述,MPZL1能够增强胃癌细胞增殖和克隆形成能力,有可能与下调促凋亡蛋白Bad、Caspase-7的表达相关。虽然MPZL1的功能、分子机制和信号转导通路尚待深入研究,但体外促癌作用提示MPZL1有可能成为胃癌的潜在治疗靶点。
作者贡献:
林凤娟:数据库数据调研、凋亡实验及文稿撰写
葛潇潇:细胞功能和实时荧光定量实验实施
吴峥:统计分析
唐文博:Western blot实验实施
林莹:细胞构建
李进:课题设计及文稿审阅、修改
| [1] |
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2020[J]. CA Cancer J Clin, 2020, 70(1): 7-30. DOI:10.3322/caac.21590 |
| [2] |
Li J, Qin S, Xu J, et al. Randomized, Double-Blind, Placebo-Controlled Phase Ⅲ Trial of Apatinib in Patients With Chemotherapy-Refractory Advanced or Metastatic Adenocarcinoma of the Stomach or Gastroesophageal Junction[J]. J Clin Oncol, 2016, 34(13): 1448-1454. DOI:10.1200/JCO.2015.63.5995 |
| [3] |
Zhao ZJ, Zhao R. Purification and cloning of PZR, a binding protein and putative physiological substrate of tyrosine phosphatase SHP-2[J]. J Biol Chem, 1998, 273(45): 29367-29372. DOI:10.1074/jbc.273.45.29367 |
| [4] |
Zannettino AC, Roubelakis M, Welldon KJ, et al. Novel mesenchymal and haematopoietic cell isoforms of the SHP-2 docking receptor, PZR: identification, molecular cloning and effects on cell migration[J]. Biochem J, 2003, 370(Pt 2): 537-549. |
| [5] |
Roubelakis MG, Martin-Rendon E, Tsaknakis G, et al. The murine ortholog of the SHP-2 binding molecule, PZR accelerates cell migration on fibronectin and is expressed in early embryo formation[J]. J Cell Biochem, 2007, 102(4): 955-969. DOI:10.1002/jcb.21334 |
| [6] |
Kusano K, Thomas TN, Fujiwara K. Phosphorylation and localization of protein-zero related (PZR) in cultured endothelial cells[J]. Endothelium, 2008, 15(3): 127-136. DOI:10.1080/10623320802125250 |
| [7] |
Jia D, Jing Y, Zhang Z, et al. Amplification of MPZL1/PZR promotes tumor cell migration through Src-mediated phosphorylation of cortactin in hepatocellular carcinoma[J]. Cell Res, 2014, 24(2): 204-217. DOI:10.1038/cr.2013.158 |
| [8] |
Tan D, Zhang W, Tao Y, et al. PZR promotes metastasis of colorectal cancer through increasing FAK and Src phosphorylation[J]. Acta Biochim Biophys Sin(Shanghai), 2019, 51(4): 356-364. |
| [9] |
Tang Z, Li C, Kang B, et al. GEPIA: a web server for cancer and normal gene expression profiling and interactive analyses[J]. Nucleic Acids Res, 2017, 45(W1): W98-W102. DOI:10.1093/nar/gkx247 |
| [10] |
Chandrashekar DS, Bashel B, Balasubramanya SAH, et al. UALCAN: A Portal for Facilitating Tumor Subgroup Gene Expression and Survival Analyses[J]. Neoplasia, 2017, 19(8): 649-658. DOI:10.1016/j.neo.2017.05.002 |
| [11] |
Gyorffy B, Lánczky A, Szállási Z. Implementing an online tool for genome-wide validation of survival-associated biomarkers in ovarian-cancer using microarray data from 1287 patients[J]. Endocr Relat Cancer, 2012, 19(2): 197-208. DOI:10.1530/ERC-11-0329 |
| [12] |
Zhao R, Zhao ZJ. Dissecting the interaction of SHP-2 with PZR, an immunoglobulin family protein containing immunoreceptor tyrosine-based inhibitory motifs[J]. J Biol Chem, 2000, 275(8): 5453-5459. DOI:10.1074/jbc.275.8.5453 |
| [13] |
Liu X, Huang J, Liu L, et al. MPZL1 is highly expressed in advanced gallbladder carcinoma and promotes the aggressive behavior of human gallbladder carcinoma GBCSD cells[J]. Mol Med Rep, 2019, 20(3): 2725-2733. |
| [14] |
Chen D, Cao L, Wang X. MPZL1 promotes tumor cell proliferation and migration via activation of Src kinase in ovarian cancer[J]. Oncol Rep, 2019, 42(2): 679-687. |
| [15] |
Ye Y, Gu J, Liu P, et al. Long Non-Coding RNA SPRY4-IT1 Reverses Cisplatin Resistance by Downregulating MPZL-1 via Suppressing EMT in NSCLC[J]. Onco Targets Ther, 2020, 13: 2783-2793. DOI:10.2147/OTT.S232769 |
| [16] |
Du P, Zhao J, Wang J, et al. Sine Oculis Homeobox Homolog 1 Regulates Mitochondrial Apoptosis Pathway Via Caspase-7 In Gastric Cancer Cells[J]. J Cancer, 2017, 8(4): 636-645. DOI:10.7150/jca.16018 |
| [17] |
Barrezueta LF, Oshima CT, Lima FO, et al. The intrinsic apoptotic signaling pathway in gastric adenocarcinomas of brazilian patients: Immunoexpression of the Bcl-2 family (Bcl-2, Bcl-x, Bak, Bax, Bad) determined by tisssue microarray analysis[J]. Mol Med Rep, 2010, 3(2): 261-267. |
 2021, Vol. 48
2021, Vol. 48


