文章信息
- DNA修复基因及其TP53共突变在肺腺癌免疫治疗疗效预测中的价值
- Value of DNA Repair Gene and TP53 Co-mutation in Predicting Effect of Immunotherapy on Lung Adenocarcinoma
- 肿瘤防治研究, 2021, 48(7): 704-708
- Cancer Research on Prevention and Treatment, 2021, 48(7): 704-708
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.20.1438
- 收稿日期: 2020-12-09
- 修回日期: 2021-02-04
2. 100853 北京,解放军医学院;
3. 100071 北京,中国人民解放军总医院第五医学中心肿瘤内科
2. Medical School of Chinese PLA, Beijing 100853, China;
3. Department of Oncology, The Fifth Medical Center, Chinese PLA General Hospital, Beijing 100071, China
肺癌是世界上发病率和死亡率最高的恶性肿瘤之一,其中肺腺癌是主要的病理类型,因此对于肺腺癌的精准治疗一直是临床研究的热点,目前肺腺癌的治疗,已经从化疗、靶向治疗的模式,转向以PD-1单抗为代表的免疫治疗模式;然而,基于PD-L1表达水平、肿瘤突变负荷等疗效预测标志物指导下的肺腺癌的免疫治疗[1-3],并不能完全预测肺腺癌免疫治疗的疗效,所以探索肺腺癌新的免疫治疗疗效预测标志物值得深入研究。
前期研究显示,基于二代测序技术的发展,已经发现了一些与肺癌免疫治疗疗效预测的相关基因,Dong等研究发现肺腺癌中突变频率较高的KRAS联合TP53共突变可以预测肿瘤免疫治疗疗效[4];但是随着二代测序技术的发展,同样发现了一些在肺腺癌突变频率比较低的基因,而对于突变频率相对较低的DNA修复相关基因(DNA repair genes, DRGs)如果发生相应的突变,同样可能导致新生抗原及更高的肿瘤突变负荷(tumor mutational burden, TMB),或许也可以预测免疫治疗反应。如何分析这些少见基因的突变检测结果,从而更加精准指导肺腺癌的免疫治疗具有重要意义。本研究基于此出发点,进一步探索突变频率相对较低的DRGs基因突变及其共突变在肺腺癌免疫治疗疗效中的预测价值。
1 资料与方法 1.1 肺腺癌基因突变数据集筛选和获取基于cBioPortal数据库检索肺腺癌与免疫治疗相关数据集,按照纳入/排除标准进行筛选。其中纳入标准:(1)病理诊断为肺腺癌患者;(2)接受免疫单药治疗的患者;(3)临床资料和基因突变数据完整;(4)基于二代测序技术分析突变特征。排除标准:(1)病理类型为肺鳞癌或未分类非小细胞肺癌;(2)接受免疫联合化疗或者免疫联合抗血管生成治疗。
本研究从cBioPortal公共数据库中纳入两项肺腺癌免疫治疗研究:包括TMB and Immunotherapy(MSKCC, Nat Genet 2019)中271例肺腺癌患者和Non-Small Cell Lung Cancer(MSK, Cancer Cell 2018)中59例肺腺癌患者。这两项独立研究分别作为测试集和验证集。同时,分别下载基因突变数据集和临床特征数据集进行后续研究。
1.2 肺腺癌肿瘤突变负荷和总生存关系分析基于肿瘤突变负荷评分和肺腺癌的生存期关系,分析和比较不同肿瘤突变负荷与肺腺癌总生存的关系。
1.3 肺腺癌患者KRAS、TP53和DRGs突变特征分析本研究以KRAS/TP53共突变作为疗效预测阳性对照,选择DRGs中BRCA1、BRCA2、POLE、POLD1进行研究。基于测试集271例肺腺癌患者突变特征谱,对这些DRGs基因进行基因突变频率谱特征分析。
1.4 肺腺癌患者KRAS/TP53共突变、DRGs突变及其共突变与肿瘤突变负荷的关系分析基于测试集首先比较DRGs突变组与KRAS/TP53共突变组在肿瘤突变数量、肿瘤突变负荷等方面的差异。其次,为了探索DRGs联合KRAS或者TP53共突变,能否更好预测肿瘤突变负荷,本研究进一步分析并比较DRGs与KRAS或者TP53的共突变,对于预测肿瘤突变数量、肿瘤突变负荷的效能问题。最后,比较DRGs联合KRAS或者TP53共突变组与KRAS/TP53共突变组在肿瘤突变数量、肿瘤突变负荷等方面的差异。
1.5 验证集分析KRAS/TP53共突变、DRGs突变及其共突变与肺腺癌免疫治疗疗效的关系基于验证集59例肺腺癌患者,进一步验证DRGs突变及其联合KRAS或者TP53共突变在预测肿瘤突变负荷、肿瘤新生抗原及免疫治疗无进展生存期等方面的差异。
1.6 统计学方法应用SPSS21.0软件进行统计分析。计量资料以(x±s)表示,两组间比较采用t检验;计数资料以例数和百分比表示,两组间比较采用χ2检验。所有统计检验均为双侧,P < 0.05为差异有统计学意义。
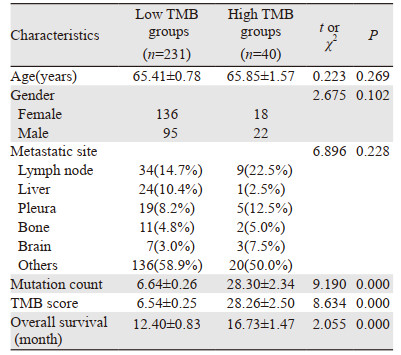
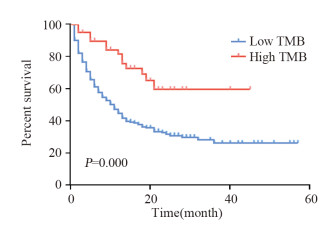
2 结果 2.1 不同突变负荷状态基线特征及其与总生存的关系以肿瘤突变负荷评分15为阈值,分成低突变负荷组和高突变负荷组,结果显示,两组患者在年龄、性别方面未见统计学差异(均P > 0.05),见表 1;但高突变负荷组具有更长的生存期,且差异有统计学意义(P=0.000),见图 1。
|
|
| 图 1 肿瘤突变负荷与肺腺癌患者总生存之间的关系 Figure 1 Relation between tumor mutation burden and overall survival of lung adenocarcinoma patients |
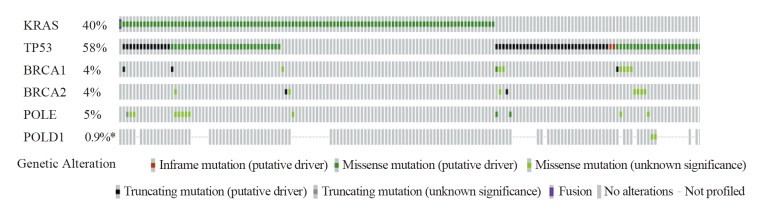
结果显示,相对于KRAS(40%)和TP53(58%)突变比例较高而言,DRGs的突变频率相对较低,分别为BRCA1(4%)、BRCA2(4%)、POLE(5%)和POLD1(0.9%),见图 2。
|
| 图 2 肺腺癌患者中KRAS、TP53和DNA修复相关基因突变特征谱 Figure 2 Characteristic spectrum of KRAS, TP53 and DNA repair related genes mutation in lung adenocarcinoma patients |
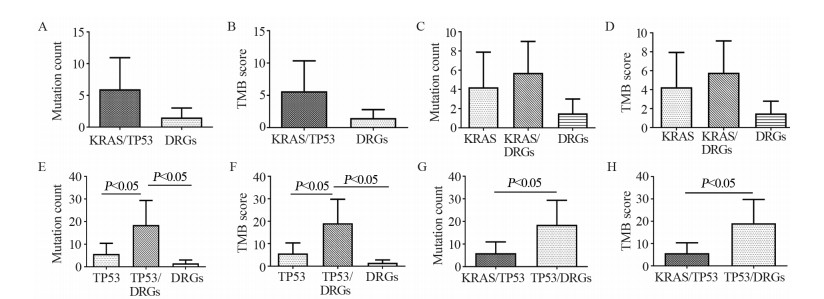
结果显示,以KRAS/TP53共突变为阳性对照,DRGs基因突变组显示出较低的基因突变数量(10.94±0.98 vs. 3.00±0.00)和肿瘤突变负荷(10.34±0.95 vs. 2.79±0.16),但两组间差异无统计学意义(P=0.069, P=0.072),见图 3A~B。
|
| A, B: Comparison of gene mutation count and tumor mutation burden between KRAS/TP53 co-mutation and DRGs mutation groups; C, D: Comparison of gene mutation count and tumor mutation burden between KRAS/DRGs co-mutation group and only KRAS or DRGs mutation groups; E, F: Comparison of gene mutation count and tumor mutation burden between TP53/DRGs co-mutation group and only TP53 or DRGs mutation groups; G, H: Comparison of gene mutation count and tumor mutation burden between KRAS/TP53 co-mutation and TP53/DRGs co-mutation groups; DRGs: DNA repair genes. 图 3 肺腺癌患者中KRAS、TP53、DRGs突变与KRA/TP53、TP53/DRGs共突变在基因突变数量和肿瘤突变负荷方面的比较 Figure 3 Comparison of gene mutation count and tumor mutation burden between only KRAS or TP53 or DRGs mutation groups and KRAS/TP53 or TP53/DRGs co-mutation groups of lung adenocarcinoma patients |
在进一步探索DRGs联合KRAS或TP53共突变,能否更好地预测肿瘤突变负荷方面,结果显示,KRAS/DRGs共突变组,相对于KRAS突变组和DRGs突变组,具有更高的肿瘤突变数量(9.00±2.45 vs. 7.90±0.54 vs. 3.00±0.00)和肿瘤突变负荷(9.15±2.43 vs. 7.94±0.58 vs. 2.79±0.16),但差异均无统计学意义(P=0.688, 0.178和P=0.633, 0.156),见图 3C~D;然而在TP53/DRGs共突变组,相对于TP53突变组和DRGs突变组来说,具有更高的肿瘤突变数量(29.36±7.63 vs. 10.37±0.96 vs. 3.00±0.00)和肿瘤突变负荷(29.78±8.44 vs. 10.36±0.96 vs. 2.79±0.16),且差异均有统计学意义(P=0.0033, 0.006和P=0.0045, 0.010),见图 3E~F;而且TP53/DRGs共突变组,相比阳性对照KRAS/TP53共突变组,具有更高的肿瘤突变数量(29.36±7.63 vs. 10.94±0.98)和肿瘤突变负荷(29.78±8.44 vs. 10.34±0.95),且两组之间差异亦有统计学意义(P=0.037, P=0.044),见图 3G~H。
2.4 验证集分析KRAS/TP53共突变、DRGs突变及其共突变与肺腺癌免疫治疗疗效的关系结果显示,在验证集中,相比于TP53突变组、DRGs突变组和Kras/TP53共突变组来说,TP53/DRGs共突变组不仅具有更高的非同源突变负荷(392.69±118.21、71.50±17.50、491.60±129.35、645.40±200.70),而且具有更高的肿瘤新生抗原(921.15±262.14、248.50±123.50、1264.80±338.77、1707.60±708.25),见图 4A~B。在无进展生存时间方面,相比KRAS/TP53共突变组(14.99±3.75)、DRGs突变组(18.64±5.31)和TP53突变组(7.36±1.99),TP53/DRGs共突变组(21.87±3.63)具有更长的无进展生存期,见图 4C。
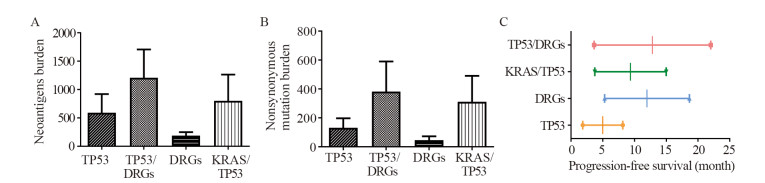
|
| 图 4 单纯TP53或DRGs突变与KRAS/TP53、TP53/DRGs共突变组在肺腺癌肿瘤新生抗原(A)、非同源肿瘤突变负荷(B)以及无进展生存期(C)的比较 Figure 4 Comparison of tumor neoantigens burden(A), tumor nonsynonymous mutation burden(B) and progression-free survival(C) between only TP53 or DRGs mutation groups and KRAS/TP53 or TP53/DRGs co-mutation groups of lung adenocarcinoma patients |
近年来,随着肺腺癌免疫治疗研究的深入,以PD-1为代表的的免疫治疗在肺腺癌中显示出卓越的疗效[5],但是免疫治疗并非对所有的肺腺癌患者都有效。目前NCCN指南和CSCO共识中,基于PD-L1表达水平来预测肺腺癌的免疫治疗疗效问题,但是限于PD-L1表达情况为免疫组织化学检测方法,受到检测抗体和平台等差异的影响,PD-L1表达结果往往具有不一致性,所以目前按照PD-L1表达来筛选免疫治疗获益人群存在一定的局限性[6-7]。如何更加精准地探索免疫治疗获益人群,对于肺腺癌的个体化免疫治疗来说显得尤为重要。本研究正是基于此,依靠二代测序技术的发展,探索DRGs及其基因共突变在肺腺癌免疫治疗中的价值及其预测作用。
本研究发现,更高的肿瘤突变负荷在肺腺癌中显示出更长的总生存期,提示肿瘤突变负荷对于总生存期具有重要影响,同时在患者基线特征方面,研究显示,对于伴有肝转移、脑转移等肺腺癌患者,可能具有较低的肿瘤突变负荷,与既往的研究结果一致;Shiroyama等[8]亦研究了三个日本中心接受Nivolumab治疗晚期非小细胞肺癌的201例患者,结果显示,肝转移肺癌患者与较短的无进展生存和较低的免疫治疗反应率密切相关,与我们的研究结果一致。另外,本研究还发现,在胸膜转移、骨转移的患者中,也往往具有较低的肿瘤突变负荷,提示在临床工作中,对于伴有肝脏、颅脑、骨等转移的肺腺癌患者,可能具有较低的肿瘤突变负荷,应用免疫治疗有效率偏低。综合分析这些研究结论,在临床诊疗中,基于患者临床特征的分析,或许有助于筛选免疫治疗可能有效的人群。
本研究的重要发现之一在于,相对于KRAS/TP53共突变组,虽然DRGs突变组具有相对较低肿瘤突变负荷,但是两组之间并没有显著性差异,提示DRGs突变可以在一定程度上预测肺腺癌患者的肿瘤突变负荷和免疫治疗的疗效。Yao等[9]研究发现,在中国人群中,基于POLE和POLD1基因突变检测,或许可以预测免疫治疗的疗效问题,与我们的研究结果一致;但Yao等的研究,仅仅选取了DRGs中POLE和POLD1基因,而其他的DRGs基因,如BRCA1、BRCA2等未纳入研究。本研究不仅纳入了BRCA1和BRCA2基因,弥补了前期研究的不足,还研究了DRGs与其他基因共突变问题,更能反应DRGs突变及其共突变在肺腺癌免疫治疗中的预测价值。DRGs基因突变可能影响免疫治疗疗效的可能机制在于,DRGs在DNA的损伤修复中扮演重要的角色,而DRGs基因发生突变后,可能产生新的抗原,从而导致更高的肿瘤突变负荷和更好的免疫治疗疗效。
为了进一步优化DRGs突变及其共突变在预测免疫治疗疗效的效能,本研究的另一个重要发现在于,在TP53/DRGs共突变中,显示出更高的肿瘤突变负荷和新生抗原形成,提示TP53/DRGs共突变肺腺癌患者具有更好的免疫治疗反应,但是,KRAS/DRGs共突变并不能预测肺腺癌免疫治疗的反应。更为重要的是,相对于目前已经证实的KRAS/TP53共突变肺腺癌患者,TP53/DRGs共突变肺腺癌患者具有更高的肿瘤突变负荷和更长的无进展生存期,提示TP53/DRGs共突变能更好地预测免疫治疗反应。
本研究也有一定的局限性,本研究是基于数据库研究而得出的结论,但是纳入国际数据库的研究,往往具有严格的试验筛选条件,排除了真实世界中免疫联合化疗或者免疫联合化疗等干扰问题;另外,为了避免单一数据集的结果偏倚,我们把纳入的数据集分为测试集和验证集,基于测试集得出的研究结论,经过另外一个独立的数据集进行验证,从而提高了研究结果的可信性和外推性。
综上所述,本研究结果初步表明,基因DRGs突变及其TP53共突变,可以在一定程度上预测肺腺癌的免疫治疗疗效,值得在后续临床工作中进一步研究证实。
作者贡献:
陈广英:文章设计,数据分析和撰写论文
马俊勋:协助数据分析
胡毅:文章整体设计、实施和校对
| [1] |
Takada K, Toyokawa G, Shoji F, et al. The Significance of the PD-L1 Expression in Non-Small-Cell Lung Cancer: Trenchant Double Swords as Predictive and Prognostic Markers[J]. Clin Lung Cancer, 2018, 19(2): 120-129. DOI:10.1016/j.cllc.2017.10.014 |
| [2] |
Chan TA, Yarchoan M, Jaffee E, et al. Development of tumor mutation burden as an immunotherapy biomarker: utility for the oncology clinic[J]. Ann Oncol, 2019, 30(1): 44-56. DOI:10.1093/annonc/mdy495 |
| [3] |
Goodman AM, Kato S, Bazhenova L, et al. Tumor Mutational Burden as an Independent Predictor of Response to Immunotherapy in Diverse Cancers[J]. Mol Cancer Ther, 2017, 16(11): 2598-2608. DOI:10.1158/1535-7163.MCT-17-0386 |
| [4] |
Dong ZY, Zhong WZ, Zhang XC, et al. Potential Predictive Value of TP53 and KRAS Mutation Status for Response to PD-1 Blockade Immunotherapy in Lung Adenocarcinoma[J]. Clin Cancer Res, 2017, 23(12): 3012-3024. DOI:10.1158/1078-0432.CCR-16-2554 |
| [5] |
Xia L, Liu Y, Wang Y. PD-1/PD-L1 Blockade Therapy in Advanced Non-Small-Cell Lung Cancer: Current Status and Future Directions[J]. Oncologist, 2019, 24(Suppl 1): S31-S41. |
| [6] |
Chae YK, Pan A, Davis AA, et al. Biomarkers for PD-1/PD-L1 Blockade Therapy in Non-Small-cell Lung Cancer: Is PD-L1 Expression a Good Marker for Patient Selection?[J]. Clin Lung Cancer, 2016, 17(5): 350-361. DOI:10.1016/j.cllc.2016.03.011 |
| [7] |
Tsoukalas N, Kiakou M, Tsapakidis K, et al. PD-1 and PD-L1 as immunotherapy targets and biomarkers in non-small cell lung cancer[J]. J BUON, 2019, 24(3): 883-888. |
| [8] |
Shiroyama T, Suzuki H, Tamiya M, et al. Clinical Characteristics of Liver Metastasis in Nivolumab-treated Patients with Non-small Cell Lung Cancer[J]. Anticancer Res, 2018, 38(8): 4723-4729. DOI:10.21873/anticanres.12779 |
| [9] |
Yao J, Gong Y, Zhao W, et al. Comprehensive analysis of POLE and POLD1 Gene Variations identifies cancer patients potentially benefit from immunotherapy in Chinese population[J]. Sci Rep, 2019, 9(1): 15767. DOI:10.1038/s41598-019-52414-z |
 2021, Vol. 48
2021, Vol. 48


