文章信息
- EIF5A2在人肝细胞癌中的表达及其与术后生存期的关系
- EIF5A2 Expression in Hepatocellular Carcinoma and Its Relation with Postoperative Survival
- 肿瘤防治研究, 2021, 48(6): 617-624
- Cancer Research on Prevention and Treatment, 2021, 48(6): 617-624
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.20.1437
- 收稿日期: 2020-12-09
- 修回日期: 2021-01-27
2. 266003 青岛,青岛大学附属医院病理科
2. Department of Pathology, The Affiliated Hospital of Qingdao University, Qingdao 266003, China
肝癌是全球范围内最常见的六大恶性肿瘤之一,严重威胁着人类的生命健康[1]。肝细胞癌(hepatocellular carcinoma, HCC)是肝癌最常见的组织学类型[2],目前占癌症相关死亡原因的第二位[3]。在我国,引起HCC高风险的关键因素是慢性HBV感染和黄曲霉毒素暴露。由于其高发病率以及缺乏针对性的药物[2, 4],患者预后不良,因此迫切需要进一步研究HCC的发病机制以及寻找有效的靶向标志物。
真核翻译起始因子5A2(eukaryotic translation initiation factor 5A2, EIF5A2)为EIF家族的重要一员,是一种相对分子质量较小(17 kDa)的保守酸性蛋白质[5]。有研究表明,EIF5A2在上尿路尿道上皮癌、鼻咽癌、乳腺癌等多种恶性肿瘤中表达上调,提示预后不良[6-9],但关于其影响HCC发生、发展的研究相对较少。本文旨在通过检测EIF5A2在人肝细胞癌组织中的表达,揭示其与临床病理参数及预后的关系,为寻找肿瘤治疗新靶点提供思路。
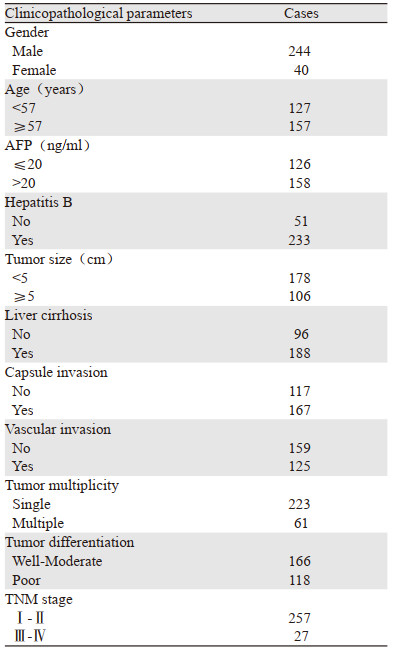
1 资料与方法 1.1 组织样本选取青岛大学附属医院2014年2月—2016年10月手术切除的284例肝细胞癌标本(由于所掌握的临床病理资料中仅有乙型肝炎的情况,因此我们仅进行了EIF5A2与乙肝的相关分析),包括患者的癌组织及相应癌旁非瘤组织(距肿瘤边缘 > 5 cm)进行此次研究,患者术前均未接受任何放化疗,入组病例情况见表 1。此外,收集2019年1月至3月经手术切除的12对新鲜HCC及相应癌旁非瘤组织,迅速置于-80℃冰箱中冻存。定期对患者进行电话随访,随访日期截至2020年4月29日,284例HCC患者中术后满三年且随访资料完整者有250例,其中63例死亡;术后满五年且随访资料完整者有83例,其中31例死亡。试验经青岛大学附属医院伦理委员会批准。
|
PV6000免疫组织化学检测试剂盒购于北京中杉金桥生物技术有限公司,EIF5A2兔单克隆抗体(EPR7412-50 cat.no.ab150439)购于英国Abcam公司,免疫组织化学工作浓度1:50,Western blot工作浓度1:500;RIPA裂解液购于北京索莱宝科技有限公司,BCA蛋白测定试剂盒购于美国Thermo Fisher Scientific公司,增强化学发光试剂盒(ECL)kit购于美国Millipore公司;PrimeScriptTM反转录试剂盒、SYBR Premix Ex TaqTMⅡ荧光定量试剂盒购于大连宝生物工程有限公司,EIF5A2引物和GAPDH引物均购于上海生工生物工程股份有限公司。
1.3 Western blot检测蛋白和mRNA的表达在新鲜切除的12对肿瘤组织和相应的毗邻非瘤组织中加入RIPA裂解液,均质化并在冰上裂解30 min,BCA蛋白测定试剂盒测定提取总蛋白浓度。配制12%SDS-PAGE胶,蛋白上样、电泳分离后,72 V恒压电转至PVDF膜上。5%脱脂奶粉封闭2 h后,加入目标一抗室温孵育2 h,4℃过夜。次日TBST洗膜3次,加入二抗室温孵育1 h,再次洗膜后于暗室中使用ECL试剂盒显影。β-actin作为标准化内参。
1.4 qRT-PCR检测EIF5A2的表达用TRIzol进行组织总RNA的提取,紫外分光光度计测定其纯度及浓度,按操作说明反转录为cDNA,随后进行实时荧光PCR测定。每个样本设置三个复孔,反应条件如下:95℃预变性,30 s;95℃变性5 s,60℃退火30 s,72℃延伸30 s;共40个循环。以GAPDH为标准化内参,2-△△Ct法计算EIF5A2在HCC及相应癌旁非瘤组织中的相对表达量。EIF5A2及GAPDH引物序列见表 2。
取样前由两位病理医师对蜡块的HE切片进行镜下形态学观察,圈出典型位置,并在蜡块确定取样部位,使用直径1.5 mm的取样针在每个蜡块穿取组织芯转移到受体蜡块,53℃阵列融合,4 μm连续切片。芯片经HE染色后进行复检。
1.5.2 免疫组织化学染色按照试剂盒说明书采用PV6000法进行免疫组织化学染色。白片经60℃恒温烘箱烤片30 min后,二甲苯脱蜡,梯度酒精水化;置于3%H2O2中浸泡20 min,充分水洗;微波修复(1 mmol/L EDTA,pH8.0),自然冷却,PBS洗3次;滴加目标一抗,4℃过夜,PBS洗3次;滴加二抗于37℃水浴锅中孵育30 min,PBS洗3次;DAB显色,光学显微镜下控制显色时间;苏木精对比染色,脱水,透明,中性树胶封片。用已知阳性表达EIF5A2的结肠癌组织作为阳性对照,PBS代替一抗作为阴性对照。
1.5.3 免疫组织化学结果判读以胞质或胞核中出现棕黄色或棕褐色计为EIF5A2阳性表达,评判标准参考文献[10-11]:阳性细胞染色强度计分标准:0分(阴性)、1分(弱染色)、2分(中等强度染色)、3分(强染色);阳性细胞所占百分比计分标准:1分(< 25%)、2分(25%~50%)、3分(≥50%~75%)、4分(≥75%)。EIF5A2免疫组织化学染色总得分=染色强度得分×阳性细胞百分比得分,≤4分为低表达,> 4分为高表达。
1.6 统计学方法采用SPSS23.0软件对实验数据进行统计学分析:EIF5A2在肝细胞癌及相应癌旁非瘤组织中的表达应用配对t检验、Wilcoxon秩和检验进行分析;EIF5A2在肝细胞癌中的表达与临床病理参数间的关系采用χ2检验进行分析;Kaplan-Meier生存曲线和Log rank检验对患者术后生存时间进行分析;Cox比例风险回归模型对影响患者术后生存时间的因素进行单因素和多因素分析。P < 0.05为差异有统计学意义。
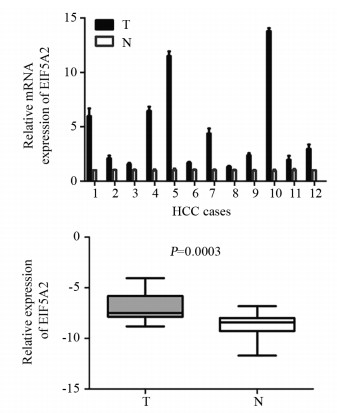
2 结果 2.1 EIF5A2在肝细胞癌及相应癌旁非瘤组织中mRNA水平的表达qRT-PCR法检测12对组织中EIF5A2 mRNA水平的表达情况。结果表明,肝细胞癌中EIF5A2的表达水平显著高于相应癌旁非瘤组织,差异具有统计学意义(t=5.305, p=0.0003),见图 1。
|
| T: HCC tissues; N: adjacent non-tumor tissues. 图 1 qRT-PCR法检测EIF5A2在肝细胞癌及相应癌旁非瘤组织中的表达 Figure 1 EIF5A2 expression in HCC and adjacent nontumor tissues detected by qRT-PCR |
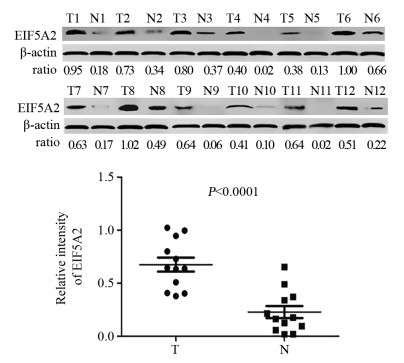
Western blot法检测12对组织中EIF5A2蛋白水平的表达情况,发现相比于癌旁非瘤组织,EIF5A2在肝细胞癌中表达均上调,且表达差异具有统计学意义(t=10.120, P < 0.001),见图 2。
|
| T: HCC tissues; N: adjacent non-tumor tissues. 图 2 Western blot法检测EIF5A2在肝细胞癌及相应癌旁非瘤组织中的表达 Figure 2 EIF5A2 expression in HCC and adjacent non-tumor tissues detected by Western blot |
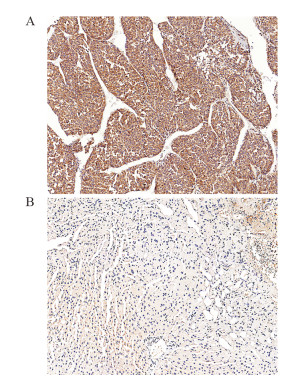
免疫组织化学技术检测结果显示EIF5A2在胞质和胞核中均有表达,见图 3。肝细胞癌中176例(61.97%)呈高表达,相应癌旁非瘤组织中11例(3.87%)呈高表达,差异有统计学意义(z=-12.186, P < 0.001)。
|
| A: HCC tissues; B: adjacent non-tumor tissues. 图 3 EIF5A2在肝细胞癌及癌旁非瘤组织中的表达(IHC ×200) Figure 3 Expression of EIF5A2 in HCC and adjacent non-tumor tissues (IHC ×200) |
EIF5A2的表达与肝细胞癌患者的肿瘤大小、肿瘤是否多发、分化程度有关(P < 0.05),而与患者的性别、年龄、AFP水平、是否有乙型肝炎、肝硬化、包膜侵犯、脉管侵犯、TNM分期无关(P > 0.05),见表 3。
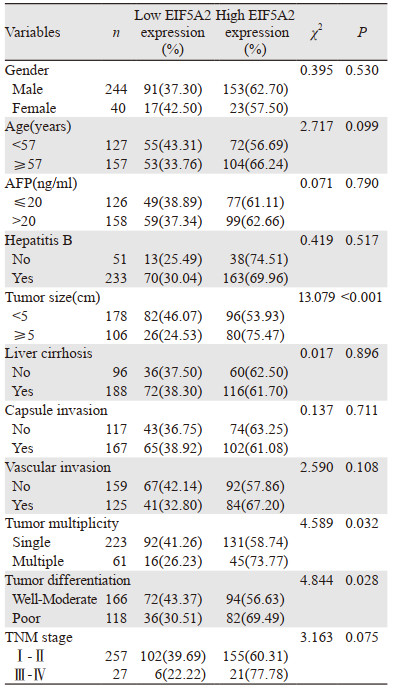
|
对250例术后满三年且有完整随访资料的患者进行生存预后分析,结果显示:EIF5A2低表达组和高表达组的生存率分别为88.8%、65.8%,低表达患者术后总体生存期及无病生存期较高表达患者更长(均P < 0.001),见图 4A、B。对83例术后满5年有完整随访资料的患者进行预后分析,结果显示:EIF5A2低表达组和高表达组的5年生存率分别为91.3%、27.0%,低表达患者术后总体生存期及无病生存期较高表达患者更长(均P < 0.001),见图 4C、D;在肿瘤≥5 cm分组中,低表达组和高表达组的五年生存率分别为100%、23.8%,低表达患者术后总体和无病生存期高于高表达患者(p=0.004、0.002),见图 4E、F。
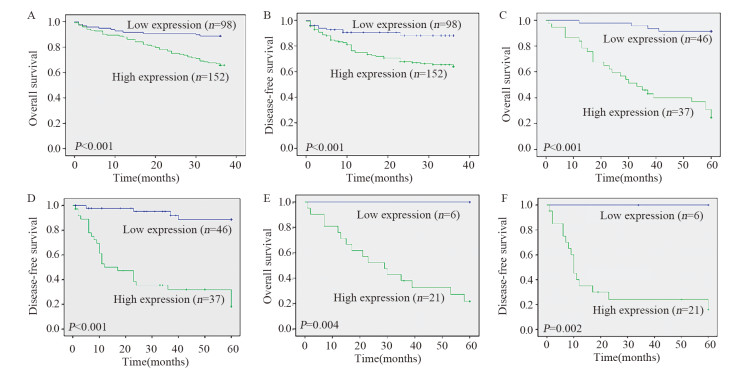
|
| A: the relation between the expression of EIF5A2 and the 3-year overall survival time of HCC patients; B: the relation between the expression of EIF5A2 and the 3-year disease-free survival time of HCC patients; C: the relation between the expression of EIF5A2 and the 5-year overall survival time of HCC patients; D: the relation between the expression of EIF5A2 and the 5-year disease-free survival time of HCC patients; E: the relation between the expression of EIF5A2 and the 5-year overall survival time of HCC patients with tumor size≥5cm; F: the relation between the expression of EIF5A2 and the 5-year disease-free survival time of HCC patients with tumor size ≥5cm. 图 4 EIF5A2的表达与肝细胞癌患者术后三年及五年生存时间的关系 Figure 4 Relation between EIF5A2 expression and 3- and 5-year survival time of HCC patients |
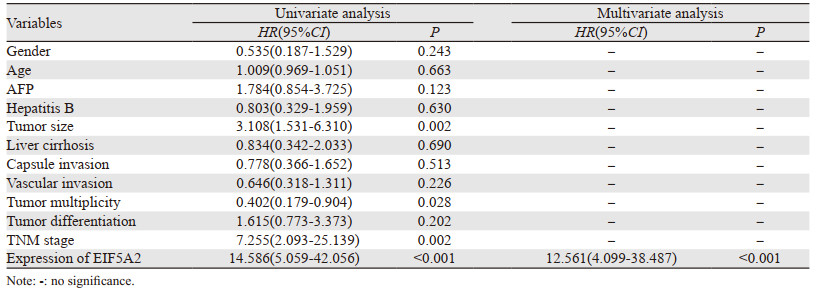
将EIF5A2的表达水平与可能影响HCC术后生存期的临床病理参数进行单因素分析,结果发现影响术后三年总体生存期的因素为:AFP(p=0.002)、肿瘤大小(P < 0.001)、包膜侵犯(p=0.019)、脉管侵犯(p=0.004)、肿瘤是否多发(P < 0.001)、分化程度(P < 0.001)、TNM分期(p=0.009)、EIF5A2的表达水平(P < 0.001);影响术后三年无病生存期的因素为:AFP(P < 0.001)、肿瘤大小(P < 0.001)、包膜侵犯(p=0.012)、脉管侵犯(p=0.003)、肿瘤是否多发(P < 0.001)、分化程度(P < 0.001)、TNM分期(p=0.010)、EIF5A2的表达水平(P < 0.001)。进一步行多因素分析发现影响术后三年总体生存期的独立预后因素有:肿瘤大小(p=0.021)、肿瘤是否多发(p=0.004)、EIF5A2的表达水平(p=0.005);影响术后三年无病生存期的独立预后因素有:肿瘤大小(p=0.035)、肿瘤是否多发(p=0.003)、EIF5A2的表达水平(p=0.007),见表 4~5。
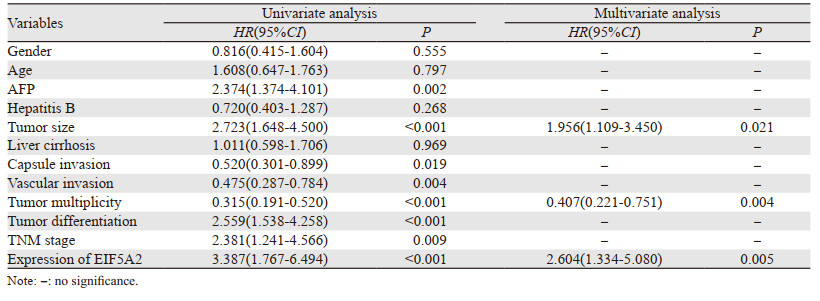
|
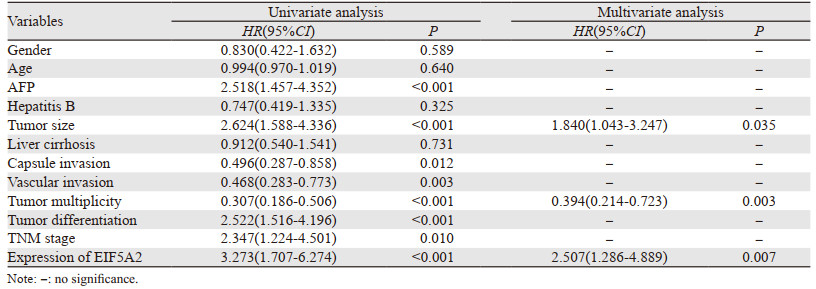
|
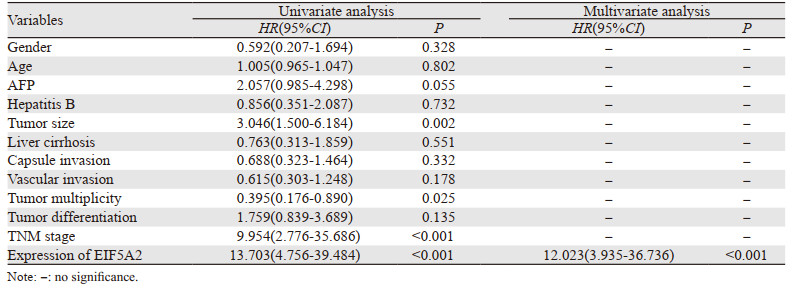
影响术后五年总体生存期的因素为:肿瘤大小(p=0.002)、肿瘤是否多发(p=0.028)、TNM分期(p=0.002)、EIF5A2的表达水平(P < 0.001);影响术后五年无病生存期的因素:肿瘤大小(p=0.002)、肿瘤是否多发(p=0.025)、TNM分期(P < 0.001)、EIF5A2的表达水平(P < 0.001)。进一步多因素分析发现影响术后五年总体和无病生存时间的独立预后因素为:EIF5A2的表达水平(P < 0.001),见表 6~7。
|
|
EIF5A2最初是从原发性卵巢癌细胞系UACC-1598中分离出的一种候选癌基因,位于染色体3q26.2位点上[12]。EIF5A是一种包含特殊氨基酸8-羟基2,7,10-三氨基癸酸(hypusine)的细胞蛋白,其家族中的各个成员通过核糖体亚基和mRNA相互作用组成复合体,在蛋白质的翻译起始阶段发挥作用[13]。EIF5A2作为EIF5A家族的重要一员,与另一成员EIF5A1的广泛表达不同,EIF5A2只存在于特定的组织(睾丸、脑或部分恶性肿瘤)或细胞中[14]。EIF5A2参与了mRNA相关的核质运输、转录和翻译等功能,尤其在翻译过程中起着核心作用[15]。研究发现EIF5A2在多种恶性肿瘤中过表达,促进肿瘤形成和癌细胞生长,增加癌细胞转移,并通过多种手段(诱导上皮间充质转换、细胞骨架重排和代谢重编程等)促进肿瘤耐药[16]。
Zheng等[17]研究发现,与非肿瘤组织相比,EIF5A2在胆囊癌组织中过表达。Lu等[18]通过免疫组织化学检测发现EIF5A2在72例前列腺癌组织中表达上调;实时荧光定量PCR以及Western blot检测发现EIF5A2在3例前列腺癌组织中的表达水平高于癌旁非瘤组织。本研究采用免疫组织化学检测284对HCC和相应癌旁非瘤组织标本,显示EIF5A2在HCC组织中的表达显著上调,与上述结果一致。此外,我们还通过qRT-PCR和Western blot检测了12对新鲜HCC及相应癌旁非瘤组织中EIF5A2的表达水平,发现EIF5A2在HCC中的mRNA和蛋白水平均上调。以上结果提示EIF5A2可能与肝细胞癌的发生过程有关。
进一步分析EIF5A2与肝细胞癌的临床病理参数的关系发现,EIF5A2的表达与肝细胞癌的肿瘤大小、肿瘤是否多发及分化程度有关。与高-中分化组相比,低分化肝细胞癌组中的EIF5A2表达水平明显上调;肿瘤直径≥5 cm组的EIF5A2表达水平高于肿瘤直径 < 5 cm组,这与Yang等[19]在胃癌中的研究结果一致,该研究发现EIF5A2的表达与胃癌的肿瘤大小相关;此外,肿瘤多发组中EIF5A2的表达水平高于肿瘤单发组,以上结果提示EIF5A2可能与肝细胞癌的发展过程有关。已有研究表明,EIF5A2在肿瘤增殖中发挥重要作用[20],提示在肝细胞癌中,EIF5A2可能通过影响其增殖过程进一步影响HCC的进展。然而目前关于EIF5A2影响肝细胞癌增殖的具体分子机制研究较少,值得我们在今后的研究中进一步深入探讨。
染色体3q26.2扩增是在实体瘤中发现的最常见的遗传改变之一,而位于染色体3q26的eIF5A2基因也经常在多种人类恶性肿瘤中扩增。Meng等[20]发现EIF5A2表达上调与胃癌患者预后差有关。在HGC27细胞中沉默EIF5A2可显著降低细胞的增殖能力,进一步研究显示EIF5A2可能通过上调细胞周期蛋白D1(cyclinD1)和细胞周期蛋白D3(cyclinD3)促进胃癌细胞增殖。Yang等[19]研究发现在胃癌组织中,EIF5A2表达上调患者的三年及五年术后总体生存时间较低表达者更短,并未对EIF5A2影响患者的术后无病生存时间进行评估。我们应用Kaplan-Meier生存曲线分析发现高表达EIF5A2的HCC患者术后三年及五年总体生存时间和无病生存时间均较低表达者短;此外,我们还发现在肿瘤直径≥5 cm的HCC患者中,EIF5A2高表达组的五年总体生存期和无病生存期较低表达组短。由于患者术后没有经过抗肿瘤治疗,只进行了营养支持治疗,因此无法分析抗肿瘤治疗是否对预后产生影响,有待在今后研究中加以探讨。随后进一步行Cox回归模型分析,发现EIF5A2的表达水平、肿瘤大小及肿瘤是否多发是影响HCC患者三年总体生存期和无病生存期的独立预后因素;EIF5A2的表达水平是影响HCC患者五年总体生存期和无病生存期的独立预后因素。以上Cox回归统计结果所显示的因素有所不同,推测可能与样本数量有关(284例HCC患者中术后满三年病例数为250例,满五年病例数仅83例),因此有待今后继续随访,增加五年病例数进一步统计证实。综合以上结果,提示EIF5A2高表达与HCC患者预后差关系密切,EIF5A2可能成为评估肝细胞癌患者术后生存期的潜在标志物。
综上所述,EIF5A2可能在肝细胞癌的发生及发展过程中扮演十分重要的角色,EIF5A2高表达的HCC患者术后预后不良,因此具有判断HCC患者的预后指标的潜在应用价值,但EIF5A2在HCC中发挥的具体生物学作用及分子机制还需要在以后的研究中继续探讨。
作者贡献:
杨茜:实验实施、采集及分析数据、撰写文章
叶冬雪、马晏然、胡小媛:采集数据
李宏:实验实施
周璇:设计指导实验
项锋钢:设计实验、指导及修改论文
| [1] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
Llovet JM, Zucman-Rossi J, Pikarsky E, et al. Hepatocellular carcinoma[J]. Nat Rev Dis Primers, 2016, 2: 16018. |
| [3] |
Ryerson AB, Eheman CR, Altekruse SF, et al. Annual Report to the Nation on the Status of Cancer, 1975-2012, featuring the increasing incidence of liver cancer[J]. Cancer, 2016, 122(9): 1312-1337. DOI:10.1002/cncr.29936 |
| [4] |
Zucman-Rossi J, Villanueva A, Nault JC, et al. Genetic Landscape and Biomarkers of Hepatocellular Carcinoma[J]. Gastroenterology, 2015, 149(5): 1226-1239. |
| [5] |
Wang FW, Guan XY, Xie D. Roles of eukaryotic initiation factor 5A2 in human cancer[J]. Int J Biol Sci, 2013, 9(10): 1013-1020. DOI:10.7150/ijbs.7191 |
| [6] |
Xu G, Yu H, Shi X, et al. Cisplatin sensitivity is enhanced in non-small cell lung cancer cells by regulating epithelial-mesenchymal transition through inhibition of eukaryotic translation initiation factor 5A2[J]. BMC Pulm Med, 2014, 14: 174. DOI:10.1186/1471-2466-14-174 |
| [7] |
Liu Y, Du F, Chen W, et al. EIF5A2 is a novel chemoresistance gene in breast cancer[J]. Breast Cancer, 2015, 22(6): 602-607. DOI:10.1007/s12282-014-0526-2 |
| [8] |
Huang PY, Zeng TT, Ban XJ, et al. Expression of EIF5A2 associates with poor survival of nasopharyngeal carcinoma patients treated with induction chemotherapy[J]. BMC Cancer, 2016, 16(1): 669. DOI:10.1186/s12885-016-2714-2 |
| [9] |
Fang Y, Cen JJ, Cao JZ, et al. Overexpression of EIF5A2 in upper urinary tract urothelial carcinoma is a new independent prognostic marker of survival[J]. Future Oncol, 2019, 15(17): 2009-2018. DOI:10.2217/fon-2018-0748 |
| [10] |
He LR, Zhao HY, Li BK, et al. Overexpression of eIF5A-2 is an adverse prognostic marker of survival in stage Ⅰ non-small cell lung cancer patients[J]. Int J Cancer, 2011, 129(1): 143-150. |
| [11] |
Yang GF, Xie D, Liu JH, et al. Expression and amplification of eIF-5A2 in human epithelial ovarian tumors and overexpression of EIF-5A2 is a new independent predictor of outcome in patients with ovarian carcinoma[J]. Gynecol Oncol, 2009, 112(2): 314-318. |
| [12] |
Guan XY, Sham JS, Tang TC, et al. Isolation of a novel candidate oncogene within a frequently amplified region at 3q26 in ovarian cancer[J]. Cancer Res, 2001, 61(9): 3806-3809. |
| [13] |
Jackson RJ, Hellen CU, Pestova TV. The mechanism of eukaryotic translation initiation and principles of its regulation[J]. Nat Rev Mol Cell Biol, 2010, 11(2): 113-127. |
| [14] |
Caraglia M, Park MH, Wolff EC, et al. eIF5A isoforms and cancer: two brothers for two functions?[J]. Amino Acids, 2013, 44(1): 103-109. |
| [15] |
Li Y, Fu L, Li JB, et al. Increased expression of EIF5A2, via hypoxia or gene amplification, contributes to metastasis and angiogenesis of esophageal squamous cell carcinoma[J]. Gastroenterology, 2014, 146(7): 1701-1713. |
| [16] |
Meng QB, Peng JJ, Qu ZW, et al. Eukaryotic initiation factor 5A2 and human digestive system neoplasms[J]. World J Gastrointest Oncol, 2019, 11(6): 449-458. |
| [17] |
Zheng X, Gao L, Wang BT, et al. Overexpression of EIF5A2 is associated with poor survival and aggressive tumor biology in gallbladder cancer[J]. Histol Histopathol, 2019, 35(6): 579-587. |
| [18] |
Lu J, Zhao HW, Chen Y, et al. Eukaryotic translation initiation factor 5A2 is highly expressed in prostate cancer and predicts poor prognosis[J]. Exp Ther Med, 2019, 17(5): 3741-3747. |
| [19] |
Yang Q, Ye Z, Zhang Q, et al. Expression of eukaryotic translation initiation factor 5A-2 (eIF5A-2) associated with poor survival in gastric cancer[J]. Tumour Biol, 2016, 37(1): 1189-1195. DOI:10.1007/s13277-015-3894-0 |
| [20] |
Meng QB, Kang WM, Yu JC, et al. Overexpression of eukaryotic translation initiation factor 5A2 (EIF5A2) correlates with cell aggressiveness and poor survival in gastric cancer[J]. PLoS One, 2015, 10(3): 0119229. |
 2021, Vol. 48
2021, Vol. 48



