文章信息
- 丹参水溶性组分SABP对小鼠肝癌免疫微环境的影响
- Effect of SABP, A Water-soluble Component of Salvia Miltiorrhiza, on Immune Microenvironment of Mice with Liver Cancer
- 肿瘤防治研究, 2021, 48(7): 694-698
- Cancer Research on Prevention and Treatment, 2021, 48(7): 694-698
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.20.1405
- 收稿日期: 2020-12-03
- 修回日期: 2021-03-16
2. 050200 石家庄,河北中医学院基础医学院
2. Basic Medical College, Hebei University of Chinese Medicine, Shijiazhuang 050200, China
原发性肝细胞癌(hepatocellular carcinoma, HCC)死亡率高居癌症第三位[1],是长期慢性炎性反应转化为肿瘤的典型案例。目前,除手术和肝移植外,放化疗是主要的治疗手段,但放化疗药物的不良反应及耐受性限制了其治疗效果,使患者五年生存率低于30%[1]。因此,制定新的治疗策略,对于肝癌治疗及降低死亡率具有重要意义。
中药有效组分配伍是中药配伍的新模式。课题组前期研究已确定了丹参素、丹酚酸A、丹酚酸B和原儿茶醛四种水溶性成分作用于动物的浓度和比例,并将此最佳组合命名为SABP[2]。另外也有研究表明,丹参多酚酸盐(depsides salts)可以降低Ki-67和VEGF的表达,抑制肝癌细胞SMMC-7721裸鼠皮下移植瘤的生长[3]。本研究利用H22细胞肝癌原位移植瘤小鼠模型探讨丹参水溶性组分SABP对H22细胞肝癌原位移植瘤的作用以及对肝癌免疫微环境的影响。
1 材料与方法 1.1 实验材料及试剂小鼠腹水型肝癌细胞株H22由河北医科大学免疫学教研室曾瑞红教授惠赠。接种于含10%胎牛血清的高糖DMEM完全培养基,于37℃、CO2培养箱中培养。35只雄性BALB/c小鼠,4~6周龄,18~20 g,SPF级购于北京维通利华实验动物技术有限公司。动物的饲养及操作通过河北中医学院伦理委员会批准(编号:YXLL2018002)。丹参素、丹参酚酸A、丹参酚酸B及原儿茶醛(纯度≥98%)均购自上海将来实业股份有限公司,批次分别为20180109、20180110、20180110及20170606;0.9%氯化钠溶液(批号:20160129)购自石家庄四药有限公司。
1.2 实验方法 1.2.1 H22细胞肝癌原位移植瘤小鼠模型将浓度为1×107个/毫升的H22肝癌细胞注射入5只BALB/c小鼠腹腔进行肿瘤细胞复壮,每只小鼠的注射剂量为0.2 ml。7天后,用异氟烷麻醉小鼠,抽取腹腔腹水,并用0.9%氯化钠溶液调整H22细胞浓度为2×106个/毫升。然后再取30只BALB/c小鼠进行肝脏H22肿瘤细胞移植手术,具体手术步骤参考文献[4]进行。每只小鼠肝脏注射H22肝癌细胞的剂量为0.05 ml。术后15天随机抽取10只,取肝脏进行HE染色,检测造模成功率。随后将剩余小鼠随机分为对照组(NC组)和SABP组,每组10只。SABP组:腹腔注射SABP的剂量为0.1 ml/d,SABP作用小鼠的浓度及比例按本课题组前期发表文献进行[2]。对照组:腹腔注射0.9%氯化钠溶液0.1 ml/d作为溶剂对照组。共注射15 d。
1.2.2 体重及肝、脾、肾系数的计算每5天称量体重一次。末次干预后,禁食不禁水6~12 h,异氟烷吸入麻醉后,摘除小鼠眼球取血,并处死动物。立即摘取肝、脾、肾,用滤纸吸干残血后分别称重,计算肝、脾和肾系数。脏器系数=脏器重量/体重×100%。
1.2.3 酶联免疫吸附试验肝脏组织匀浆后,收集上清液,标准品绘制标准曲线,然后按照试剂盒说明书步骤进行操作,用酶标仪测量OD450值,根据标准曲线求出相应的PD-L1、TGF-β、IL-1β、IL-10、IL-4、IFN-γ、IL-18、IL-7、IL-2、CCL-2和CCL-21的含量,试剂盒购自上海酶联生物科技有限公司。
1.3 统计学方法用SPSS16.0统计软件进行数据分析。符合正态分布的计量资料采用均数±标准差(x±s)的方式表示,组间两两比较用独立样本t检验。P < 0.05为差异有统计学意义。
2 结果 2.1 丹参水溶性组分SABP抑制H22细胞肝癌原位移植瘤的生长H22细胞进行复壮后的状态见图 1A。对照组小鼠的左肝叶可见两处突出肝脏表面的白色硬质瘤灶,正常肝组织颜色淡红。SABP组小鼠的左肝叶可见一处明显灰白色癌灶,而正常肝组织淡红,见图 1B。此结果说明SABP可以抑制肝原位移植瘤的生长。

|
| A: the picture on the left showed the pre-rehabilitation state of H22 cells and the picture on the right showed the post-rehabilitation state of H22 cells; B: the tumors were shown by white arrows. 图 1 SABP抑制H22细胞肝癌原位移植瘤的生长 Figure 1 SABP inhibited growth of orthotopic transplantation of H22 cell liver cancer |
药物处理第5、10和15天,SABP组与对照组体质量差异无统计学意义(P=0.8342、0.4937和0.0782),见图 2A。SABP组小鼠脾重量是对照组重量的1.29倍,差异有统计学意义(P=0.0156),见图 2B。SABP组小鼠肝、脾、肾系数分别是对照组1.19、1.34和1.23倍,差异有统计学意义(P=0.0327、0.0083和0.0381),见图 2C~E。
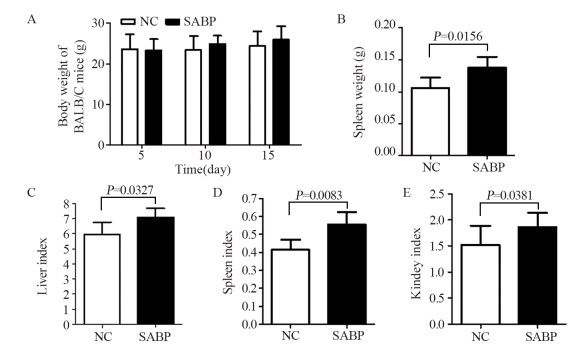
|
| 图 2 SABP对H22细胞肝癌原位移植瘤小鼠体重(A)、脾重(B)和肝、脾、肾系数(C~E)的影响 Figure 2 Effect of SABP on body weight(A), spleen weight(B) and coefficients of liver, spleen and renal(C-E) of orthotopic transplantation of H22 cell liver cancer in mice |
ELISA检测结果显示,SABP组PD-L1表达量是对照组的1.4倍(P=0.0433),见图 3A。SABP组TGF-β表达量是对照组的1.3倍(P=0.0228),见图 3B。SABP组小鼠的IL-1β表达量是对照组1.5倍(P=0.0153),见图 3C。SABP组小鼠的IL-10指数是对照组1.3倍(P=0.0156),见图 3D。ELISA检测发现SABP组IL-4表达量是对照组的1.19倍,差异无统计学意义(P=0.2131),见图 3E。上述结果表明SABP可以通过上调PD-L1、TGF-β、IL-1β和IL-10的表达促进免疫抑制微环境的形成。
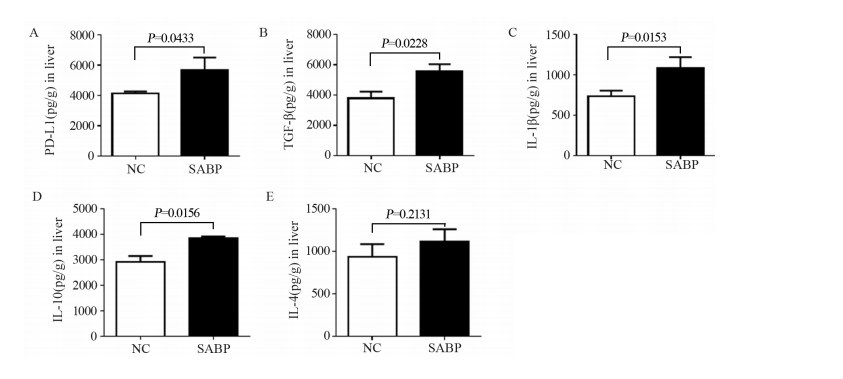
|
| 图 3 SABP对H22细胞肝癌原位移植瘤PD-L1、TGF-β、IL-1β、IL-10和IL-4表达的影响 Figure 3 Effect of SABP on PD-L1, TGF-β, IL-1β, IL-10 and IL-4 expression in orthotopic transplantation of H22 cell liver cancer in mice |
SABP组小鼠IFN-γ、IL-18、IL-7和IL-2的表达水平分别为(5703.33±471.70)pg/g、(892.45±62.39)pg/g、(1288.74±105.65)pg/g和(3379.23±374.67)pg/g。对照组的表达水平分别是(5923.99±362.61)pg/g、(927.10±91.26)pg/g、(1496.07±55.41)pg/g和(2736.23±111.94)pg/g。SABP组和对照组IFN-γ、IL-18、IL-7和IL-2的表达水平差异均无统计学意义(P=0.5556、0.6160、0.0901和0.1163)。结果表明SABP不改变抗肿瘤免疫因子的表达水平。
2.5 SABP不影响H22细胞肝癌原位移植瘤中CCL-2和CCL-21的表达水平SABP组的CCL-2和CCL-21表达水平分别是(386.72±23.21)ng/g和(419.34±71.1)ng/g。对照组的表达水平分别是(495.09±67.66)ng/g和(388.72±34.87)ng/g。SABP组和对照组CCL-2和CCL-21表达水平差异均无统计学意义(P=0.0707和0.5395)。结果表明SABP不影响细胞趋化因子的表达水平。
3 讨论肝癌的主要临床表现属于中医学“积聚”、“癥瘕”以及“肝积”等范畴。气滞血瘀湿热痰浊是肝癌发生的病理基础。丹参(Salvia miltiorrhiza)味苦微寒,归心肝经,是一味活血化淤药,同时还具有磨坚破滞、消瘿除瘤的作用,具有“一味丹参,功同四物”之说。丹参素(danshensu, DSS)、丹酚酸A(salvianolic acid A, Sal-A)、丹酚酸B(salvianolic acid B, Sal-B)以及原儿茶醛(protocatechuic aldehyde, PAL)是丹参主要的水溶性成分。丹参素能降低蛋白激酶B(protein kinase B, PKB)活性,从而抑制肝癌SMMC-7721细胞生长[5]。丹酚酸B通过激活线粒体途径,抑制AKT/mTOR通路使肝癌细胞降解,促进肝癌细胞的凋亡[6]。原儿茶醛靶向抑制肝癌细胞Wilms肿瘤蛋白1(Wilms tumor1, WT1)的表达,进而发挥抗肝癌作用[7]。上述研究均表明,丹参中主要水溶性成分均具有抑制肝癌细胞生长的作用。
SABP是丹参的四种水溶性成分的组合,本课题组前期研究也已证实SABP有一定的抗氧化作用。有研究发现,丹参注射液治疗能有效提高原发性肝癌患者免疫球蛋白水平,刺激CD3+T细胞和CD4+T细胞的增殖,改善肝癌患者的免疫功能[8]。本研究发现,SABP能抑制H22细胞肝癌原位移植瘤的生长。有研究报道,丹参能使小鼠脾脏树突状细胞增加[9]。本研究发现,SABP处理15天荷瘤小鼠的脾指数显著升高。有研究表明丹酚酸B通过抗氧化,发挥对肾缺血再灌注损伤的保护作用,恢复肾脏的功能[10]。本研究显示,SABP处理提高了H22细胞肝癌原位移植瘤模型的肾系数,说明SABP无肾毒性。SABP不改变荷瘤小鼠的体重,因此SABP可能是通过调节免疫发挥抗肿瘤的作用。
高表达程序性死亡配体1(programmed death ligand-1, PD-L1)的肿瘤细胞通过与T细胞表面的程序性死亡配体1(programmed death ligand-1, PD-1)相结合导致肿瘤浸润性淋巴细胞(tumor Infiltrating Lymphocytes, TILs)功能的耗竭,从而导致效应T细胞的功能被抑制。PD-L1基因的敲除有助于肝脏中小鼠CD8+T细胞的积累,表明PD-L1是调节肝脏CD8+T细胞聚集和清除的关键蛋白。因此SABP通过促进PD-L1的表达,促进免疫抑制微环境的形成。骨髓来源的抑制细胞产生的TGF-β促进CD8+T细胞上PD-1的表达,从而导致对肿瘤微环境(tumor microenvironment, TME)中PD-1/PD-L1阻断的抵抗[11]。另外升高的TGF-β还可以阻断未成熟的T细胞向Th1细胞分化,促进其向调节性T细胞(regulatory cell, Treg)亚群转化,并抑制树突细胞的抗原呈递功能,抑制CD8+T细胞产生IFN-γ的产生,从而造成肿瘤细胞的免疫逃逸[12]。IL-1β通过调节M2型巨噬细胞促进HCC细胞的迁移[13],M2型巨噬细胞到肿瘤组织的浸润与预后不良有关[14]。另外,由于巨噬细胞表达CCL-2受体,因此CCL-2对巨噬细胞具有趋化性,这种信号分子在巨噬细胞的募集过程中发挥作用[15]。但是在本研究中发现SABP可以促进IL-1β的表达,但并不改变CCL-2的表达量,所以我们推断SABP可能通过促进IL-1β表达,促进M2型巨噬细胞到肿瘤组织的浸润。
血清中高水平的IL-10与HCC患者的不良预后有关。IL-10可通过NF-κB和STAT3信号通路促进肿瘤细胞PD-L1的表达[16]。IL-10抑制T细胞产生IL-2和IFN-γ,并直接影响T细胞的分化和增殖。IL-10也可诱导肝癌中Treg的分化,Treg扩张与HCC的侵袭性和患者较差的生存期密切相关[17]。我们的研究发现SABP促进IL-10的表达,类似研究发现,应用丹酚酸B和原儿茶醛后IL-10的表达水平升高[18-19]。IL-10促进辅助性T细胞分化为Th2。这为癌细胞提供了逃避免疫系统的机会[20]。IL-7作为T细胞发育和成熟T细胞稳态的关键细胞因子,促进T细胞增殖[21]。IL-7刺激增加了外周和肝驻留CD8+T细胞的细胞毒性,这个过程伴随着CD8+T细胞上PD-1表达的下调[22]。前期的研究发现,SABP不改变IL-7、IL-2和IFN-γ的表达水平,所以SABP发挥抗肿瘤作用不是基于正向调控抗肿瘤免疫应答。
以上研究表明,SABP可以促进肿瘤免疫抑制微环境的形成,主要是通过提高免疫抑制因子PD-L1、TGF-β、IL-1β和IL-10的水平发挥作用,而没有通过改善抗肿瘤免疫的IFN-γ、IL-7、IL-18和IL-2来发挥抗肿瘤作用,也没有改变肿瘤相关的趋化因子CCL-2和CCL-21。丹参水溶性成分SABP可以发挥抗肿瘤的作用,但是并没有通过正向调节抗肿瘤免疫发挥抗肿瘤的效果,反而提高免疫抑制信号分子的表达水平促进免疫抑制微环境形成,影响SABP的抗肿瘤作用。后期本课题组将进一步探讨SABP发挥抗肿瘤作用机制,联合相关免疫治疗药物PD-1单抗或PD-L1单抗,观察SABP的抗肿瘤作用。
作者贡献:
李圣豪:实验实施,论文撰写
郝立园、国英琳:数据分析,论文修订
彭晴、丁静茹:数据收集、整理及分析
石新丽:实验设计,论文审核
| [1] |
Siegel RL, Miller KD, Fedewa SA, et al. Colorectal cancer statistics, 2017[J]. CA Cancer J Clin, 2017, 67(3): 177-193. DOI:10.3322/caac.21395 |
| [2] |
Zhang J, An SJ, Fu JQ, et al. Mixed Aqueous Extract of Salvia Miltiorrhiza Reduces Blood Pressure through Inhibition of Vascular Remodelling and Oxidative Stress in Spontaneously Hypertensive Rats[J]. Cell PhysiolBiochem, 2016, 40(1-2): 347-360. |
| [3] |
李湘平, 宋周烨, 钟海英, 等. 丹参多酚酸盐对裸鼠HCC系人肝癌细胞株SMMC-7721移植瘤的影响[J]. 中南大学学报(医学版), 2015, 40(2): 158-164. [Li XP, Song ZY, Zhong HY, et al. Effect of depsides salts from Salvia miltiorrhiza on human hepatoma cell line SMMC-7721 subcutaneous xenografts in nude mice[J]. Zhong Nan Da Xue Xue Bao(Yi Xue Ban), 2015, 40(2): 158-164.] |
| [4] |
侯杰罗, 焦成斌, 杨彦民, 等. H22昆明鼠肝癌原位模型的建立[J]. 黑龙江医药科学, 2015, 38(1): 78-79. [Hou JL, Jiao CB, Yang YM, et al. Establishment of H22 Kunming mouse liver cancer orthotopic model[J]. Heilongjiang Yi Yao Ke Xue, 2015, 38(1): 78-79. DOI:10.3969/j.issn.1008-0104.2015.01.033] |
| [5] |
刘珊琳, 刘冠中, 程建, 等. 蛋白激酶对活性氧调节7721人肝癌细胞生长的影响[J]. 生物化学与生物物理学报, 2002, 34(1): 67-72. [Liu SL, Liu GZ, Cheng J, et al. Influence of PKB on ROS regulation of proliferation in human 7721 hepatoma cells[J]. Sheng Wu Hua Xue Yu Sheng Wu Wu Li Xue Bao, 2002, 34(1): 67-72.] |
| [6] |
Gong L, Di C, Xia X, et al. AKT/mTOR signaling pathway is involved in salvianolic acid B-induced autophagy and apoptosis in hepatocellular carcinoma cells[J]. Int J Oncol, 2016, 49(6): 2538-2548. DOI:10.3892/ijo.2016.3748 |
| [7] |
Guo X, Zhao Y, Yan H, et al. Single tumor-initiating cells evade immune clearance by recruiting type Ⅱ macrophages[J]. Genes Dev, 2017, 31(3): 247-259. DOI:10.1101/gad.294348.116 |
| [8] |
朱亚玲, 易峰涛. 复方丹参注射液联合伽马刀治疗对原发性肝癌患者免疫功能的影响[J]. 中西医结合肝病杂志, 2020, 30(2): 111-113. [Zhu YL, Yi FT. The effect of γ knife the combined application of danshen injections on immune function in patients with primary liver cancer[J]. Zhong Xi Yi Jie He Gan Bing Za Zhi, 2020, 30(2): 111-113.] |
| [9] |
王斌, 胡岳山, 李杰芬. 丹参注射液对小鼠脾脏树突状细胞增殖的影响[J]. 河南中医学院学报, 2005, 20(6): 22-23. [Wang B, Hu YS, Li JF. Effect of Injection Salvia Miltiorrhiza Bunge on Proliferation of Dendritic cellsfrom mouse spleen[J]. Henan Zhong Yi Xue Yuan Xue Bao, 2005, 20(6): 22-23.] |
| [10] |
唐桂毅, 李靖菲, 李琳, 等. 丹酚酸B对大鼠肾缺血再灌注损伤的保护作用[J]. 中成药, 2012, 34(9): 1639-1643. [Tang GY, Li JF, Li L, et al. Protective effects of salvianolic acid B on renal ischemia reperfusion injury in rats[J]. Zhong Cheng Yao, 2012, 34(9): 1639-1643. DOI:10.3969/j.issn.1001-1528.2012.09.003] |
| [11] |
Chen X, Wang L, Li P, et al. Dual TGF-β and PD-1 blockade synergistically enhances MAGE-A3-specific CD8(+) T cell response in esophageal squamous cell carcinoma[J]. Int J Cancer, 2018, 143(10): 2561-2574. DOI:10.1002/ijc.31730 |
| [12] |
Batlle E, Massagué J. Transforming Growth Factor-β Signaling in Immunity and Cancer[J]. Immunity, 2019, 50(4): 924-940. DOI:10.1016/j.immuni.2019.03.024 |
| [13] |
Zhang Q, Wang H, Mao C, et al. Fatty acid oxidation contributes to IL-1β secretion in M2 macrophages and promotes macrophage-mediated tumor cell migration[J]. Mol Immunol, 2018, 94: 27-35. DOI:10.1016/j.molimm.2017.12.011 |
| [14] |
Lin EY, Pollard JW. Tumor-associated macrophages press the angiogenic switch in breast cancer[J]. Cancer Res, 2007, 67(11): 5064-5066. DOI:10.1158/0008-5472.CAN-07-0912 |
| [15] |
Qian B, Deng Y, Im JH, et al. A distinct macrophage population mediates metastatic breast cancer cell extravasation, establishment and growth[J]. PLoS One, 2009, 4(8): e6562. DOI:10.1371/journal.pone.0006562 |
| [16] |
Chen J, Li G, Meng H, et al. Upregulation of B7-H1 expression is associated with macrophage infiltration in hepatocellular carcinomas[J]. Cancer Immunol Immunother, 2012, 61(1): 101-108. DOI:10.1007/s00262-011-1094-3 |
| [17] |
Shen X, Li N, Li H, et al. Increased prevalence of regulatory T cells in the tumor microenvironment and its correlation with TNM stage of hepatocellular carcinoma[J]. J Cancer Res Clin Oncol, 2010, 136(11): 1745-1754. DOI:10.1007/s00432-010-0833-8 |
| [18] |
Chen T, Liu W, Chao X, et al. Salvianolic acid B attenuates brain damage and inflammation after traumatic brain injury in mice[J]. Brain Res Bull, 2011, 84(2): 163-168. DOI:10.1016/j.brainresbull.2010.11.015 |
| [19] |
Xu Y, Jiang WL, Zhang SP, et al. Protocatechuic aldehyde protects against experimental sepsis in vitro and in vivo[J]. Basic Clin Pharmacol Toxicol, 2012, 110(4): 384-389. DOI:10.1111/j.1742-7843.2011.00827.x |
| [20] |
Kim WS, Kim H, Kwon KW, et al. Cisplatin induces tolerogenic dendritic cells in response to TLR agonists via the abundant production of IL-10, thereby promoting Th2- and Tr1-biased T-cell immunity[J]. Oncotarget, 2016, 7(23): 33765-33782. DOI:10.18632/oncotarget.9260 |
| [21] |
Mackall CL, Fry TJ, Gress RE. Harnessing the biology of IL-7 for therapeutic application[J]. Nat Rev Immunol, 2011, 11(5): 330-342. DOI:10.1038/nri2970 |
| [22] |
Teng D, Ding L, Cai B, et al. Interleukin-7 enhances anti-tumor activity of CD8(+) T cells in patients with hepatocellular carcinoma[J]. Cytokine, 2019, 118: 115-123. DOI:10.1016/j.cyto.2018.04.003 |
 2021, Vol. 48
2021, Vol. 48


