文章信息
- 鼻咽癌患者免疫功能状态与EBV DNA的相关性及对预后的影响
- Correlation Between Immune Function Status and EBV DNA in Patients with Nasopharyngeal Carcinoma and Their Influence on Prognosis
- 肿瘤防治研究, 2021, 48(6): 600-606
- Cancer Research on Prevention and Treatment, 2021, 48(6): 600-606
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.20.1402
- 收稿日期: 2020-12-03
- 修回日期: 2021-01-22
2. 610041 成都,四川省肿瘤医院放疗科;
3. 610054 成都,电子科技大学临床医学院
2. Department of Radiotherapy, Sichuan Provincial Tumor Hospital, Chengdu 610041, China;
3. Department of Clinical Medicine, University of Electronic Science and Technology of China, Chengdu 610054, China
鼻咽癌(nasopharyngeal carcinoma, NPC)是华南地区最重要的头颈部恶性肿瘤,放射治疗为主要治疗方法。随着放疗技术的发展和化疗方案的不断完善,鼻咽癌生存率得到改善,目前5年OS高达80%[1]。尽管鼻咽癌对放化疗敏感,但仍有20%~30%患者发生局部复发或远处转移[2]。
NPC的发病机制与爱泼斯坦-巴尔病毒(Epstein-Barr virus, EBV)密切相关,其中EBV致癌作用的潜在机制涉及LMP1、LMP2、microRNA等物质[3]。目前血浆中循环EBV DNA载量已被确定为NPC的肿瘤标志物,也被广泛确立为筛查、监测和预测NPC疾病进展的重要标志[4]。病毒能够感染刺激机体产生免疫效应,除一些非特异的免疫外,也有特异性免疫的产生[5]。特异性免疫包括细胞免疫和体液免疫,在病毒感染的情况下,外周血免疫细胞的比例将发生明显改变,而大量研究显示免疫细胞的变化能够直接影响肿瘤患者的预后。早期研究中,主要影响鼻咽癌预后的外周血免疫细胞包括:CD8+T淋巴细胞比例、CD44+T淋巴细胞比例、CD4+/CD8+比值等[6-8]。
目前,免疫治疗在鼻咽癌治疗中越来越受重视,免疫疗法的提出为鼻咽癌的治疗提供了新的选择[9]。EBV作为导致鼻咽癌发病的重要病毒因素,其对患者免疫状况的影响已被证实[10]。但是在鼻咽癌患者中有关EBV与外周血免疫细胞亚群间的关系研究较少,这种改变对患者预后的影响也尚不清楚。因此,本研究对NPC患者外周血EBV DNA载量与循环免疫细胞亚群的关系及其对预后的影响进行探索。
1 资料与方法 1.1 一般资料纳入2016年1月—2019年10月四川省肿瘤医院收治的203例初治无远处转移的鼻咽非角化型癌患者,从病历中获取临床信息(包括性别、年龄、有无慢性病、有无吸烟饮酒史、诊断时间和治疗数据)。纳入及排除标准:(1)首次经病理明确诊断,并未行治疗的NPC;(2)未见其他肿瘤疾病;(3)无远处转移,即排除初治时则转移的NPC(n=11);(4)对常规放化疗治疗无禁忌;(5)未合并重症感染者、精神疾病者;(6)无免疫系统疾病及既往未行免疫治疗者。
1.2 治疗方法患者均接受了根治性放射治疗,在肿瘤靶区、亚临床靶区和淋巴引流区的中位总剂量分别为70~73 Gy、60~66 Gy和50~54 Gy。其中有111例患者接受了2~3周期诱导化疗,然后接受同步放化疗2~3周期。其余92例患者直接进行同步放化疗。诱导化疗为含铂两药方案或三药方案,顺铂+吉西他滨、顺铂+多西他赛或多西他赛+顺铂+氟尿嘧啶。其中多西他赛75 mg/m2,静脉输注d1;顺铂75 mg/m2,静脉输注d1~3;氟尿嘧啶500 mg/m2,静脉输注d1~5;每3周为1周期,诱导化疗2~3周期。同步化疗药物为多西他赛+顺铂或单药顺铂,其中顺铂75 mg/m2,静脉滴注d1~3,联合或不联合使用多西他赛75 mg/m2,静脉输注d1,每3周为1周期;或者单药顺铂30 mg/m2,静脉滴注,每周方案。
1.3 实验方法采集NPC患者治疗前的肘静脉血标本10 ml(EDTA抗凝)。通过实时荧光定量PCR法分析血浆EBV DNA。采用流式细胞仪分析治疗前外周血循环免疫细胞亚群,测定免疫细胞亚群类型包括:CD3+T淋巴细胞、CD3+CD4+T淋巴细胞、CD3+CD8+T淋巴细胞、CD19+B淋巴细胞、CD56+NK细胞的比例及CD4+/CD8+的比值。
1.4 随访末次随访时间为2020年10月,随访方式包括门诊复查、住院复查和电话随访等。随访后有11例患者失访;2例复发;10例发生转移(治疗后随访发生转移者);12例死亡,其中3例因其他疾病死亡。治疗结束后2年内每3月随访1次, 2~5年每6月复查1次, 5年以后每年复查1次。复查内容包括血常规及生化、EBV DNA、鼻咽镜及鼻咽MRI、胸片或低剂量胸部CT、腹部超声和骨扫描。
1.5 统计学方法采用SPSS 23.0统计软件对数据进行分析。计量资料以均数±标准差(x±s)进行描述,组间比较采用t检验。采用MedCalc进行ROC分析,选取曲线下最大面积所对应的数值作为界值进行外周血淋巴细胞分组。采用Kaplan-Meier法统计总生存率(overall survival, OS)、无进展生存率(progression-free survival, PFS)、无局部复发生存率(local recurrence-free survival, LRFS)、无远处转移生存率(distant metastasis-free survival, DMFS)。采用Cox回归模型进行多因素预后相关分析。采用Prism8.0软件绘制统计图。P < 0.05为差异有统计学意义。
2 结果 2.1 患者一般情况203例(不包括失访及因其他原因死亡的患者)初治非转移性鼻咽非角化性癌患者,随访截至2020年10月。纳入患者年龄18~79岁,中位年龄49岁。按照AJCC第8版鼻咽癌TNM分期进行分期。因非高发区可能会存在部分和EB病毒感染相关度不高的NPC患者,且不同实验所使用的定量阳性标准模板也不同。根据实时荧光定量PCR法检测结果,将患者分为两组:EBV DNA≥400 copies/ml组(81例)和EBV DNA < 400 copies/ml组(122例),见表 1。
分析结果表明,治疗前血浆EBV DNA水平与CD19+B细胞比例呈负相关(r=-0.138, P=0.040),而与其他循环免疫亚群,包括CD3+T淋巴细胞、CD3+CD4+T淋巴细胞、CD3+CD8+T淋巴细胞、CD56+NK细胞的比例及CD4+/CD8+的比值,无明显相关性(均P > 0.05)。NPC患者年龄与CD3+T细胞比例呈负相关(r=-0.177, P=0.012),与CD56+NK细胞比例呈正相关(r=0.216, P=0.002)。患者性别与CD4+/CD8+比值呈负相关(r=-0.139, P=0.049)。T分期与所有循环免疫亚群无明显相关性(P > 0.05),而N分期与CD3+T细胞比例(r=0.164, P=0.02)和CD4+T细胞比例(r=0.14, P=0.046)呈正相关。外周血CD8+T细胞比例在不同性别、年龄、吸烟史、饮酒史、慢性病史、T分期、N分期、TNM分期中比较,差异均无统计学意义(均P > 0.05),见表 2、图 1。
|

|
| 图 1 治疗前鼻咽癌患者EBV DNA与外周血中免疫亚群测量的特征 Figure 1 Characteristics of EBV DNA and immune subsets in peripheral blood of patients with nasopharyngeal carcinoma before treatment |
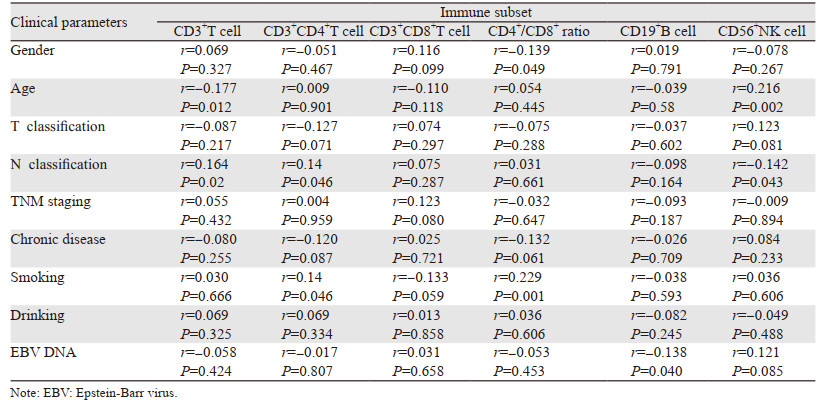
研究表明,EBV DNA < 400 copies/ml组和EBV DNA≥400 copies/ml组的3年OS、PFS、DMFS分别为99.2% vs. 90.1%(P=0.001),96.7% vs. 90.1%(P=0.028),98.4% vs. 90.1%(P=0.005),两组间差异均有统计学意义。EBV DNA < 400 copies/ml组和EBV DNA≥400 copies/ml组的3年LRFS分别为98.4%和100%,差异无统计学意义(P > 0.05),见图 2A~D。
|
| 图 2 Kaplan-Meier曲线显示鼻咽癌患者EBV DNA不同分组的总生存率(A)、无进展生存率(B)、无转移生存率(C)和无复发生存率(D) Figure 2 Kaplan-Meier curves of overall survival(A), progression-free survival(B), distant metastasis-free survival(C) and local recurrence-free survival(D) of NPC patients in different EBV DNA groups |
Cox比例风险模型进行多因素分析,其中引入以下参数来调整预后因素:性别(男性vs.女性),慢性病(有vs.无),吸烟史(有vs.无),饮酒史(有vs.无),年龄(≥50岁vs. < 50岁),T分期,N分期,治疗前EBV DNA(≥400 copies/ml vs. < 400 copies/ml)。研究表明,EBV DNA载量(P=0.024)是NPC患者3年PFS的独立预后影响因素,见表 3。

|
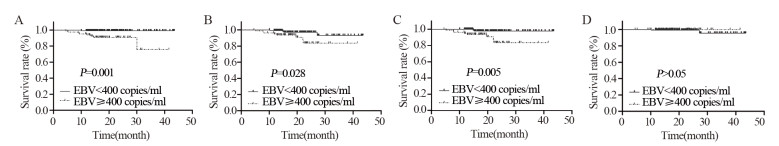
经ROC分析,选取曲线下最大面积所对应的数值,NPC患者治疗前CD3+T、CD3+CD4+T、CD3+CD8+T、CD56+NK细胞比例以及CD4+/CD8+比值未找到合适的Cut-off值。而CD19+B细胞比例以8.33%作为界值预测OS、PFS、LRFS、MDFS的准确度最高。故根据CD19+B细胞比例将NPC患者分为CD19+B细胞低比例组83例(≤8.33%)和CD19+B细胞高比例组120例(> 8.33%),见图 3。

|
| 图 3 鼻咽癌患者治疗前循环免疫细胞亚群的ROC曲线 Figure 3 ROC curves of circulating immune cell subsets in NPC patients before treatment |
采用Log rank法单因素分析NPC患者治疗前CD19+B细胞比例在预后中的价值。本研究表明,治疗前NPC患者CD19+B细胞高比例组(> 8.33%)的3年OS为99.2%,CD19+B细胞低比例组(≤8.33%)的3年OS为90.4%(P=0.003),差异有统计学意义。CD19+B细胞高比例组3年时的PFS为97.5%,而低比例组的3年PFS为89.2%,差异有统计学意义(P=0.008)。治疗前NPC患者CD19+B细胞低比例组与CD19+B细胞高比例组相比,3年DMFS(90.4% vs. 98.3%, P=0.008)较低,差异有统计学意义。CD19+B细胞低比例组与CD19+B细胞高比例组的无复发生存率分别为98.8%和99.2%,差异无统计学意义(P > 0.05),见图 4。
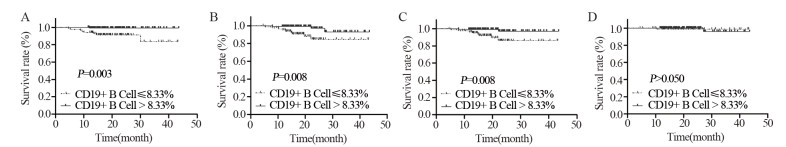
|
| 图 4 Kaplan–Meier曲线显示鼻咽癌患者CD19+B淋巴细胞不同分组的总生存(A)、无进展生存(B)、无转移生存(C)、无复发生存(D) Figure 4 Kaplan-Meier curves of overall survival(A), progression-free survival(B), distant metastasis-free survival(C) and local recurrence-free survival(D) of NPC patients in different CD19+B lymphocytes groups |
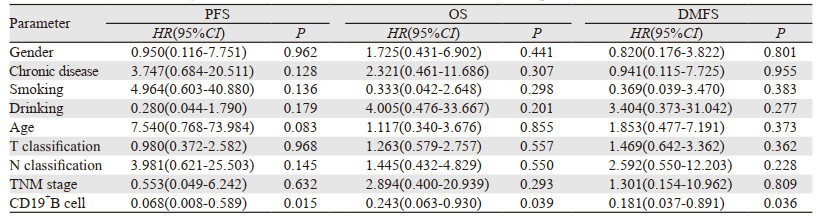
Cox比例风险模型进行多因素分析。因CD3+T、CD3+CD4+T、CD3+CD8+T、CD56+NK细胞比例以及CD4+/CD8+比值没有找到合适的Cut-off值,单因素分析对预后无明显意义,则未将这些免疫参数纳入多因素分析。研究表明,CD19+B细胞比例是鼻咽癌患者3年PFS(P=0.007)、DMFS(P=0.014)的独立预后影响因素,也是3年OS(P=0.008)的独立预后因素,见表 4。
|
目前鼻咽癌主要的治疗模式为同步放化疗为主的综合治疗,但仍有部分患者发生复发和转移。目前鼻咽癌预后的相关因素有:年龄,T、N、M分期和临床分期,EBV DNA等,但仍不完善。尤其是对DMFS的预后,尚未找到很好的预测因素。找到可筛选出容易发生远处转移的高危鼻咽癌患者的分子生物学指标,是目前急需解决的难题之一。
现有研究已经证明EBV和NPC之间有很强的病因学联系,循环血浆EBV DNA已被确定用于筛查、监测和预测NPC疾病进展的可靠肿瘤标志物[3, 11]。我们的研究结果表明,EBV DNA高的NPC患者PFS、OS以及DMFS均低于EBV DNA低的患者,而两组之间LRFS无明显差异。在多因素分析中,EBV DNA载量是NPC患者3年PFS的独立预后影响因素。在一项Meta分析中也得出相似的结论:治疗前EBV DNA水平可预测总体生存率、无进展生存率、无远处转移生存率和局部区域衰竭生存率[4]。王敏[12]研究发现EBV DNA水平能够辅助进行临床分型,并且能够指导临床进行预后的判断;同时研究表明治疗后出现远处转移者或复发者,EBV DNA水平较无远处转移、无复发者明显升高。黎晚霞等[13]研究也表示治疗前EBV DNA > 1500 copies/ml和≤1500 copies/ml两组患者的生存预后具有显著差异,治疗前EBV DNA > 1500 copies/ml是NPC疾病进展的独立危险因素。
从免疫的角度来看,部分鼻咽癌属于EBV感染的恶性疾病,鼻咽癌也是一种免疫相关疾病[14]。病毒能够感染刺激机体产生免疫效应,而肿瘤的发生、发展、复发、转移等生物学行为,均与免疫功能状态有关[15]。但有关鼻咽癌患者中血浆EBV DNA与循环免疫细胞亚群之间的相关性,以及其对预后研究较少。本研究结果显示,EBV DNA与CD19+B细胞比例呈负相关(r=-0.138, P=0.040),而与其他循环免疫细胞亚群,包括CD3+T淋巴细胞、CD3+CD4+T淋巴细胞、CD3+CD8+T淋巴细胞、CD56+NK细胞的比例及CD4+/CD8+的比值,无明显相关性(P > 0.05)。Xu等[16]研究结果也表示EB病毒载量与CD19+B细胞比例呈负相关,但其研究也表示EB病毒载量与CD4+/CD8+比值呈负相关,与其他循环细胞免疫亚群无明显相关性。B细胞是病毒感染的主要靶标,CD19是一种分子量为95000的糖蛋白,为最早发现的B淋巴细胞系表面标志[16-17]。EB病毒载量引起CD19+B细胞比例改变在其他疾病中也有相应的研究证据。Fedyanina等[18]研究表示与没有原发性EBV感染的传染性单核细胞增多症(IM)患者相比,由原发性EBV感染引起的经典IM儿童的CD19+细胞的比例较低。本研究同时表示NPC患者CD19+B细胞高比例组的OS、PFS以及DMFS均高于CD19+B细胞低比例组,两组之间LRFS也无明显差异。虽然其他循环免疫细胞亚群与EBV DNA无相关性,但是在本研究中发现某些循环免疫细胞亚群与其他临床参数有一定的相关性。NPC患者年龄与CD3+T细胞比例呈负相关,与CD56+NK细胞比例呈正相关。T分期与所有循环免疫亚群无明显相关性,而N分期与CD3+T细胞比例和CD4+T细胞比例呈正相关。正如努热古·阿热甫等[8]研究发现局部晚期NPC患者不同年龄阶段,CD3+T细胞比例和NK细胞比例存在差异, 而不同N分期之间CD3+T细胞比例也不同。
本研究仍具有局限性。首先,该研究所收集数据具有一定局限性,未能收集全所有患者治疗后EBV DNA数据,也未能收集全所有患者循环细胞免疫亚群的动态变化,所以未进行治疗后的分析。其次,本研究属于回顾性分析,样本量偏小,存在选择偏倚,可能对结果造成一定影响。未来需要大样本、多中心、前瞻性临床研究进行验证来支持目前的发现。
本研究发现,治疗前通过抽取NPC患者少量的外周血进行流式分析以及实时荧光定量PCR法,获取外周血淋巴细胞亚群的比例以及EBV DNA拷贝数,可以对NPC的预后有一定预测价值,尤其是对DMFS有一定的预测价值。治疗前血浆EBV DNA与外周血中CD19+B细胞比例存在负相关,两者可作为鼻咽癌患者的预后预测指标。我们或许能以此作为标准对高危远处转移患者进行初步筛选,并针对性地给予个体化的治疗,从而最大限度地消除肿瘤,并对这些高危患者进行更密切的随访观察。病毒感染影响免疫功能,而免疫功能不仅与肿瘤的发生发展密切相关,同时也与患者的预后显著相关[5, 19]。我们也可以进一步的对各种循环免疫亚群细胞表面的分子标记进行分析,从而进一步揭示免疫机制在NPC发生发展中的影响,为今后的免疫治疗在NPC的开展提供依据。
作者贡献:
魏雪玲:课题设计、数据收集及分析、撰写论文
兰美、彭新皓、张菡奕:课题设计、撰写及指导论文
龙恩、刘会:数据收集及分析
郎锦义:课题设计、指导及审阅论文
| [1] |
Chen YP, Chan ATC, Le QT, et al. Nasopharyngeal carcinoma[J]. Lancet, 2019, 394(10192): 64-80. DOI:10.1016/S0140-6736(19)30956-0 |
| [2] |
Ueda Y, Enokida T, Okano S, et al. Combination Treatment With Paclitaxel, Carboplatin, and Cetuximab (PCE) as First-Line Treatment in Patients With Recurrent and/or Metastatic Nasopharyngeal Carcinoma[J]. Front Oncol, 2020, 10: 571304. DOI:10.3389/fonc.2020.571304 |
| [3] |
Yoshizaki T, Kondo S, Endo K, et al. Modulation of the tumor microenvironment by Epstein-Barr virus latent membrane protein 1 in nasopharyngeal carcinoma[J]. Cancer Sci, 2018, 109(2): 272-278. DOI:10.1111/cas.13473 |
| [4] |
Qu H, Huang Y, Zhao S, et al. Prognostic value of Epstein-Barr virus DNA level for nasopharyngeal carcinoma: a meta-analysis of 8128 cases[J]. Eur Arch Otorhinolaryngol, 2020, 277(1): 9-18. DOI:10.1007/s00405-019-05699-9 |
| [5] |
秦铁军, 马文领. 全景呈现——免疫系统和病毒的星球大战[J]. 生命世界, 2020(5): 38-43. [Qin TJ, Ma WL. Panoramic presentation-Star Wars of the immune system and viruses[J]. Sheng Ming Shi Jie, 2020(5): 38-43.] |
| [6] |
白杨, 于利莉. 放化疗对鼻咽癌患者淋巴细胞亚群的影响研究进展[J]. 癌症进展, 2019, 17(17): 1997-1999, 2044. [Bai Y, Yu LL. Research progress on the effect of radiotherapy and chemotherapy on lymphocyte subsets in patients with nasopharyngeal carcinoma[J]. Ai Zheng Jin Zhan, 2019, 17(17): 1997-1999, 2044.] |
| [7] |
Ono T, Azuma K, Kawahara A, et al. Prognostic stratification of patients with nasopharyngeal carcinoma based on tumor immune microenvironment[J]. Head Neck, 2018, 40(9): 2007-2019. DOI:10.1002/hed.25189 |
| [8] |
努热古·阿热甫, 韩潇, 胡云辉. 局部晚期鼻咽癌患者外周血淋巴细胞亚群与预后的相关性[J]. 新疆医科大学学报, 2018, 41(12): 1518-1523. [Nuregu·Arefu, Han X, Hu YH. Distribution of lymphocyte in peripheral blood and the prognosis of patients with locally advanced nasopharyngeal carcinoma[J]. Xingjinag Yi Ke Da Xue Xue Bao, 2018, 41(12): 1518-1523. DOI:10.3969/j.issn.1009-5551.2018.12.016] |
| [9] |
Yeo ELL, Li YQ, Soo KC, et al. Combinatorial strategies of radiotherapy and immunotherapy in nasopharyngeal carcinoma[J]. Chin Clin Oncol, 2018, 7(2): 15. DOI:10.21037/cco.2018.04.05 |
| [10] |
Lee AZE, Tan LSY, Lim CM. Cellular-based immunotherapy in Epstein-Barr virus induced nasopharyngeal cancer[J]. Oral Oncol, 2018, 84: 61-70. DOI:10.1016/j.oraloncology.2018.07.011 |
| [11] |
Kimura H, Kwong YL. EBV Viral Loads in Diagnosis, Monitoring, and Response Assessment[J]. Front Oncol, 2019, 9: 62. DOI:10.3389/fonc.2019.00062 |
| [12] |
王敏. EB病毒DNA水平特征在鼻咽癌预后评估中的临床意义[J]. 中外医学研究, 2020, 18(31): 176-178. [Wang M. Clinical Significance of EBV DNA Level Characteristics in Prognosis Evaluation of Nasopharyngeal Carcinom[J]. Zhong Wai Yi Xue Yan Jiu, 2020, 18(31): 176-178.] |
| [13] |
黎晚霞, 刘伟, 袁晓飞, 等. 鼻咽癌患者血浆EBV-DNA大样本及长期随访分析[J]. 西南国防医药, 2020, 30(5): 410-413. [Li WX, Liu W, Yuan XF, et al. Analysis on plasma EBV-DNA with large sample size and long-tem follow-up data of NPC patients[J]. Xi Nan Guo Fang Yi Yao, 2020, 30(5): 410-413. DOI:10.3969/j.issn.1004-0188.2020.05.014] |
| [14] |
Tsao SW, Tsang CM, Lo KW. Epstein-Barr virus infection and nasopharyngeal carcinoma[J]. Philos Trans R Soc Lond B Biol Sci, 2017, 372(1732): 20160270. DOI:10.1098/rstb.2016.0270 |
| [15] |
赵美淇, 梁新强, 刘海洲, 等. 肿瘤患者外周血T淋巴细胞亚群及NK细胞比例检测的临床意义[J]. 中国实验诊断学, 2019, 23(3): 381-384. [Zhao MQ, Liang XQ, Liu HZ, et al. Clinical significance of peripheral blood T lymphocyte subsets and NK levels in tumor patients[J]. Zhongguo Shi Yan Zhen Duan Xue, 2019, 23(3): 381-384. DOI:10.3969/j.issn.1007-4287.2019.03.001] |
| [16] |
Xu T, Huang Z, Su B, et al. Prognostic significance of circulating CD19+ B lymphocytes in EBV-associated nasopharyngeal carcinoma[J]. Med Oncol, 2014, 31(10): 198. DOI:10.1007/s12032-014-0198-y |
| [17] |
阎红, 邓罗华. 外周血CD19+B淋巴细胞比例减少患儿病因分析[J]. 检验医学与临床, 2017, 14(Z1): 234-236. [Yan H, Deng LH. Analysis of the etiology of children with decreased ratio of CD19+B lymphocytes in peripheral blood[J]. Jian Yan Yi Xue Yu Lin Chuang, 2017, 14(Z1): 234-236.] |
| [18] |
Fedyanina OS, Filippova AE, Demina OI, et al. The nature and clinical significance of atypical mononuclear cells in infectious mononucleosis caused by the Epstein-Barr virus in children[J]. J Infect Dis, 2020, 22: jiaa601. |
| [19] |
郭亮, 吴炅. 肿瘤患者外周血免疫细胞在疗效预测及预后价值中的研究进展[J]. 中华乳腺病杂志(电子版), 2018, 12(5): 299-301. [Guo L, Wu J. Research Progress of Peripheral Blood Immune Cells in Tumor Patients in Predicting Efficacy and Prognostic Value[J]. Zhonghua Ru Xian Bing Za Zhi (Dian Zi Ban), 2018, 12(5): 299-301. DOI:10.3877/cma.j.issn.1674-0807.2018.05.008] |
 2021, Vol. 48
2021, Vol. 48



