文章信息
- 胃癌D2根治术后短期并发症对患者远期生存率的影响
- Effect of Short-term Complications After D2 Radical Gastrectomy on Long-term Survival Rate of Gastric Cancer Patients
- 肿瘤防治研究, 2021, 48(6): 625-630
- Cancer Research on Prevention and Treatment, 2021, 48(6): 625-630
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.20.1390
- 收稿日期: 2020-11-27
- 修回日期: 2021-02-08
2. 350005 福州,福建医科大学消化道恶性肿瘤教育部重点实验室
2. Key Laboratory of Ministry of Education for Gastrointestinal Cancer, Fujian Medical University, Fuzhou 350005, China
胃癌是常见的消化道恶性肿瘤,约占胃全部恶性肿瘤的95%,进展快,预后差,严重影响患者身心健康和生活质量,其发病率呈逐年上升趋势[1-2]。胃癌根治术联合D2淋巴结清扫术是当前外科治疗局部进展期胃癌的标准术式之一[3-5]。随着手术技术的日益完善,以及新型手术器械广泛应用,胃癌根治术后的并发症显著下降,但术后短期并发症严重影响患者住院时间、出血风险和生活质量,因此术后出现的短期并发症仍是备受关注的问题[6-8]。目前对于术后短期并发症影响患者远期生存率的分析报道较少。本研究旨在探讨胃癌D2根治术后短期并发症对患者远期生存率的影响,并分析相关影响因素。
1 资料与方法 1.1 临床资料收集2010年1月—2011年12月于福建医科大学附属第一医院接受胃癌D2根治手术治疗的421例胃癌患者。纳入标准:(1)所有患者经临床表现、影像学资料及病理首次确诊为胃癌(Ⅰa~Ⅲc期),未进行术前相关治疗;(3)临床资料和生存数据完整,Clavien-Dindo(CD)评分系统进行并发症分级评估(CD评分≥Ⅱ级);(3)所有患者均接受胃癌D2根治术。排除标准:(1)患者合并其他恶性肿瘤;(2)有精神障碍、意识障碍;(3)合并严重肝肾功能和心肺功能障碍; (4)肿瘤复发或者转移;(5)失访的患者及意外事件引起的死亡。按照术后短期有无并发症分为:实验组(并发症组)76例,其中男58例,女18例,年龄45~75岁;对照组(无并发症组)345例,其中男256例,女89例,年龄45~89岁。倾向性得分匹配法(propensity score matching, PSM)平衡各变量,剔除未匹配的患者后,144例胃癌术后患者纳入本研究,其中76例为实验组,68例为对照组。本研究符合医学伦理学要求,患者及家属对本次研究知情并签署知情同意书。
1.2 手术方法421例患者行根治性全胃切除或者根治性远端胃切除。根据第13版日本胃癌规约,所有患者按照标准的D2手术范围清除区域淋巴结。根治性远端胃切除患者清除淋巴结范围为第1、3、4、5、6、7、8、9、11、12a组淋巴结,根治性全胃清除的淋巴结范围为第1、2、3、4、5、6、7、8a、9、10、11、12a组淋巴结。根治性远端胃癌患者的消化道重建方式为布朗吻合;根治性全胃患者的消化道重建方式为Roux-en-Y吻合,所有吻合口均以丝线加固,残端包埋,术毕创面彻底止血,大量温热蒸馏水冲洗腹腔,放置引流管,逐层关腹。
1.3 观察指标(1) 纳入分析的因素有年龄、性别、肿瘤最大径、pTNM分期、淋巴结转移、组织分化、脉管癌栓、神经侵犯和淋巴管侵犯等;(2)采用CD评分系统进行并发症分级评估观察患者术后短期并发症情况,包括肺部感染、腹腔感染、切口感染、吻合口出血、吻合口瘘、吻合口狭窄、胃排空延迟、肠梗阻和多器官衰竭等;(3)两组患者随访5年的生存情况。
1.4 随访情况采用门诊随访、信件回访及电话问询等方式进行随访。随访截至2016年3月2日。患者的生存时间(月数)为自手术日期起至死亡日期或随访截止日期。对于失访和意外事故死亡的患者予以剔除。
1.5 统计学方法采用SPSS24.0版统计软件处理数据。PSM通过软件中PS最邻近匹配法获得,其中最近距离与倾向得分对数的标准偏差的卡尺距离为0.02。实验组和对照组的基线资料比较采用卡方检验,生存分析采用Kaplan-Meier法,协变量与预后之间的关联分析采用Log rank单因素分析和Cox多因素分析。P < 0.05为差异有统计学意义。
2 结果 2.1 临床基线参数PSM前共纳入的421例患者中术后短期并发症(76例)有肺部感染、腹腔感染、切口感染、吻合口出血、吻合口瘘、吻合口狭窄、胃排空延迟、肠梗阻和多器官衰竭等。76例(18.05%)术后出现短期并发症为实验组、345例(81.95%)未出现明显并发症为对照组。两组患者基线参数比较结果显示,仅术后住院时间差异有统计学意义(P < 0.001)。为进一步减小选择性偏倚,本研究对421例患者通过PSM按照1:1匹配,均衡所有基线特征,最终144例纳入本研究,其中实验组76例,对照组68例,见表 1。
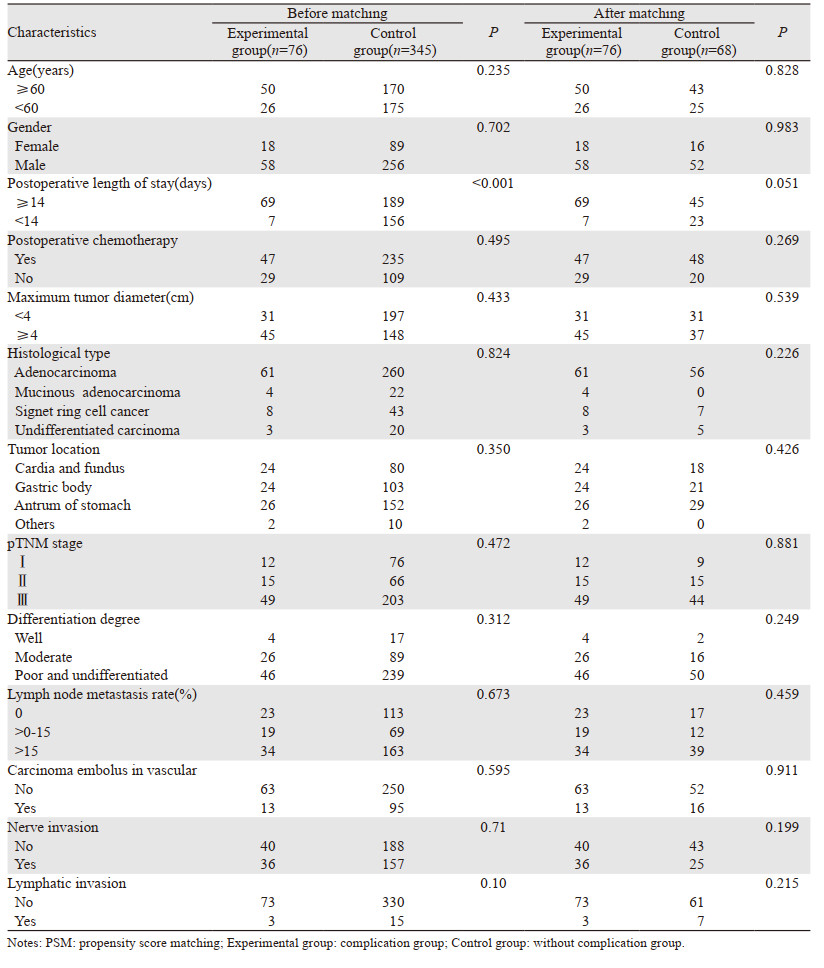
|
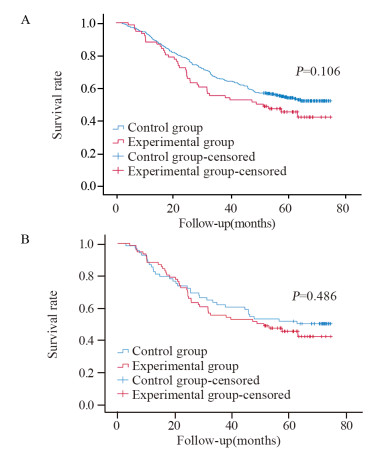
PSM前,实验组相对于对照组的远期生存率(HR=1.324, 95%CI: 0.942~1.860, p=0.106)差异无统计学意义。PSM后,与对照组比较,术后短期并发症患者的远期生存率(HR=1.175, 95%CI: 0.746~1.850, p=0.486)差异仍无统计学意义,结果进一步表明胃癌术后短期并发症对远期生存率影响结果无统计学意义,见图 1。
|
| 图 1 PSM前(A)后(B)患者术后短期并发症的生存曲线 Figure 1 Survival curves of gastric cancer patients with short-term postoperative complications before(A) and after (B) PSM |
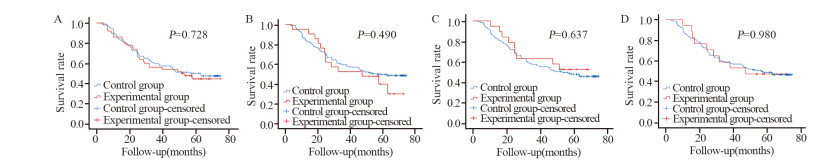
PSM后亚组分析结果显示,肺部感染(HR=1.087, 95%CI: 0.679~1.741, p=0.728)、切口感染(HR=1.234, 95%CI: 0.679~2.244, p=0.490)、腹腔感染(HR=0.846, 95%CI: 0.421~1.697, p=0.637)和其他并发症(吻合口出血、吻合口瘘、吻合口狭窄、胃排空延迟、肠梗阻和多器官衰竭等)(HR=1.009, 95%CI: 0.503~2.204, p=0.980)的胃癌患者的远期生存率均无统计学意义(均P > 0.05),见图 2。进一步表明胃癌D2根治术后短期并发症对患者远期生存时间无明显影响。
|
| A: pulmonary infection; B: incision infection; C: abdominal infection; D: other complications (anastomotic bleeding, anastomotic leakage, anastomotic stenosis, delayed gastric emptying, intestinal obstruction and multiple organ failure, etc.) 图 2 PSM后患者术后短期并发症亚组的生存曲线 Figure 2 Survival curves of gastric cancer patients in subgroups of short-term postoperative complications after PSM |
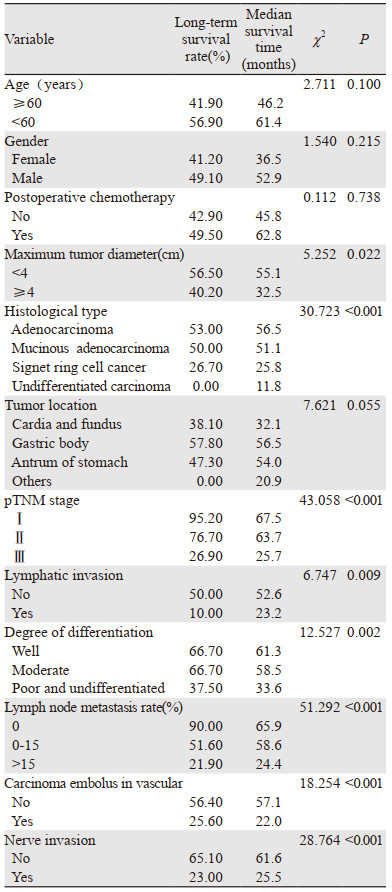
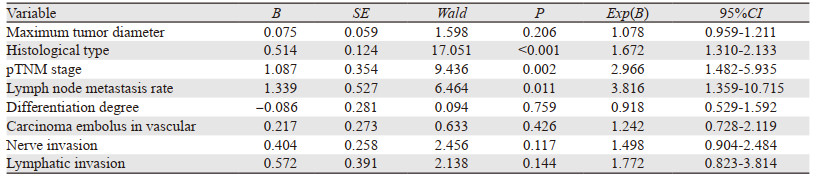
PSM后,采用Log rank单因素分析144例患者远期生存率的影响因素,其中肿瘤的最大径、组织学类型、pTNM分期、分化程度、淋巴结转移率、脉管内癌栓、神经侵犯和淋巴管侵犯与胃癌术后的远期生存率显著相关(均P < 0.05)。将上述有统计学意义的参数进行Cox多因素分析,结果表明,仅组织学类型、淋巴结转移率和pTNM分期是患者远期生存率的独立预后影响因素,见表 2~3。
|
|
在我国各种恶性肿瘤中发病率占第二位,死亡率居第三位[9]。目前,胃癌根治术联合D2淋巴结清扫术是当前外科治疗局部进展期胃癌的标准术式之一。在不影响胃癌根治疗效的前提下,减少术后短期并发症的发生,成为国内外胃恶性肿瘤治疗关注的热点问题[10],术后短期并发症加剧疾病痛苦,延缓患者术后恢复,延长住院天数,增加医疗资源负担及患者家庭的经济负担,因此控制和降低术后短期并发症的发生率具有重要临床意义。现对于术后短期并发症对于患者远期生存时间的影响研究尚有争议。
本研究中患者术后短期并发症主要以肺部感染为首,其发生率情况与既往研究胃癌术后远期生存率[11]的结果符合。
PSM前,对421例患者进行生存分析,结果显示胃癌D2根治术后的短期并发症未能对患者的远期生存率产生明显的影响。为减少选择偏倚,进行PSM平衡各变量。PSM后的结果表明,术后短期并发症仍未对患者的远期生存时间产生明显的影响,但根据Kaplan-Meier生存曲线描绘得到,无术后短期并发症的患者生存时间优于术后短期并发症患者[12],可能与术后短期并发症引起的炎性反应有关,并影响后续的首次化疗效果,表明控制和降低胃癌术后短期并发症仍具有一定的临床意义。我们分别对主要并发症包括肺部感染、切口感染、腹腔感染和其他症状(吻合口出血、吻合口瘘、吻合口狭窄、胃排空延迟、肠梗阻和多器官衰竭等)进行远期生存率分析,结果显示差异均无统计学意义(均P > 0.05),进一步表明术后短期并发症均对患者术后远期生存时间无显著影响。
探讨胃癌D2根治术后对患者远期生存时间的影响因素,对PSM后纳入的144例患者进行Log rank单因素分析患者远期生存率的影响因素,结果显示肿瘤的最大径、组织学类型、pTNM分期、分化程度、淋巴结转移率、脉管内癌栓、神经侵犯和淋巴管侵犯与胃癌术后的远期生存率显著相关[13]。Cox多因素分析结果表明,组织学类型、淋巴结转移率和pTNM分期是患者远期生存率的独立预后影响因素。有研究表明对于胃癌患者术后进行组织学类型、淋巴结转移率和pTNM分期的诊断具有良好指示预后的指标[14]。
胃癌患者临床症状较为隐匿,通常就诊时已属中晚期,失去了最佳治疗时机[15];早期胃癌的5年生存率可达95%,而进展期胃癌的生存率低于20%[16],因此提高胃癌的早期诊断率对胃癌的早期治疗至关重要。要根本上提高患者术后的远期生存率,通过早发现、早诊断和早治疗,将癌症尽量控制在早期,减低胃癌的晚期发生率。
本研究采用生存情况预测模型,结合有效检验,得到单个预测因子,并通过多因素校正等评价了该预测模型,有效地将临床各个病理特征及其所占的权重体现出来,具有较高、较强的预测水平,探讨对临床上行胃癌D2根治术后短期并发症对远期生存时间的影响,并提供精确的评估和预后判断的依据,为将来提高患者远期生存率提供新的改善方法与思路。
综上所述,胃癌D2根治术后的短期并发症对患者远期生存率没有显著性影响,但仍会降低患者术后的生活质量,加剧医疗资源压力,积极预防并控制并发症具有一定的临床意义。
作者贡献:
林鹏航、林春霖:收集数据、统计分析、论文撰写与修改
王琴、何若凡、陈辉:审核数据、统计分析结果、论文修改
黄永建、杨树钢、叶建新:回顾性临床研究设计、指导临床研究设计
朱广伟:文章审查与指导
| [1] |
Apicella M, Corso S, Giordano S. Targeted therapies for gastric cancer: failures and hopes from clinical trials[J]. Oncotarget, 2017, 8(34): 57654-57669. DOI:10.18632/oncotarget.14825 |
| [2] |
倪立新, 朱泓宇, 周健, 等. 完全腹腔镜与腹腔镜辅助远端胃癌根治术的近期临床疗效对比研究[J]. 腹腔镜外科杂志, 2019, 24(1): 25-29. [Ni LX, Zhu HY, Zhou J, et al. A comparative study of clinical short-term efficacy between total laparoscopic gastrectomy and laparoscopy-assisted gastrecto-my for distal gastric cancer[J]. Fu Qiang Jing Wai Ke Za Zhi, 2019, 24(1): 25-29.] |
| [3] |
Atsumi Y, Rino Y, Sato T, et al. Effectiveness of alendronate for bone disorder after gastrectomy for gastric cancer[J]. Asian J Surg, 2017, 40(6): 470-474. DOI:10.1016/j.asjsur.2016.07.003 |
| [4] |
Zhu L, Xu Y, Shan Y, et al. Intraperitoneal perfusion chemotherapy and whole abdominal hyperthermia using external radiofrequency following radical D2 resection for treatment of advanced gastric cancer[J]. Int J Hyperthermia, 2019, 36(1): 403-407. |
| [5] |
中国抗癌协会胃癌专业委员会青年委员会. 第5版日本《胃癌治疗指南》临床问题解读[J]. 中国实用外科杂志, 2019, 39(1): 53-69. [Youth Committee of Gastric Cancer Committee of China Anti-Cancer Association. Interpretation of clinical problems in the 5th edition of Japanese guidelines for the treatment of gastric cancer[J]. Zhongguo Shi Yong Wai Ke Za Zhi, 2019, 39(1): 53-69.] |
| [6] |
蒋玲, 施悦. 加速康复外科护理在腹腔镜胃癌根治术患者中的应用[J]. 齐鲁护理杂志, 2018, 24(20): 34-36. [Jiang L, Shi y. Application of accelerated rehabilitation surgical nursing in laparoscopic radical gastrectomy[J]. Qi Lu Hu Li Za Zhi, 2018, 24(20): 34-36. DOI:10.3969/j.issn.1006-7256.2018.20.012] |
| [7] |
胥丽, 陈丽娟, 颜哲, 等. 加速康复外科护理在腹腔镜胃癌根治术患者中的应用及对其并发症发生率的影响分析[J]. 当代医学, 2019, 25(31): 180-182. [Xu L, Chen LJ, Yan Z, et al. Application of accelerated rehabilitation surgical nursing in laparoscopic radical gastrectomy and analysis of its effect on the incidence of complications[J]. Dang Dai Yi Xue, 2019, 25(31): 180-182. DOI:10.3969/j.issn.1009-4393.2019.31.076] |
| [8] |
张林炜, 朱广伟, 叶建新, 等. 腹腔镜与开腹全胃切除术治疗Ⅰ期胃癌的近期疗效对比[J]. 肿瘤防治研究, 2020, 47(4): 294-297. [Zhang LW, Zhu GW, Ye JX, et al. A Comparative Study on Short-term Efficacy Between Laparoscopic and Open Total Gastrectomy on Stage Ⅰ Gastric Cancer[J]. Zhong Liu Fang Zhi Yan Jiu, 2020, 47(4): 294-297. DOI:10.3971/j.issn.1000-8578.2020.19.1036] |
| [9] |
胃癌诊疗规范(2018年版)[J]. 肿瘤综合治疗电子杂志, 2019, 5(1): 55-82. [Diagnosis and treatment of gastric cancer (2018 edition)[J]. Zhong Liu Zong He Zhi Liao Dian Zi Za Zhi, 2019, 5(1): 55-82.]
|
| [10] |
Scislo L, Pach R, Nowak A, et al. The Impact of Postoperative Enteral Immunonutrition on Postoperative Complications and Survival in Gastric Cancer Patients-Randomized Clinical Trial[J]. Nutr Cancer, 2018, 70(3): 453-459. DOI:10.1080/01635581.2018.1445770 |
| [11] |
Galata C, Blank S, Weiss C, et al. Role of Postoperative Complications in Overall Survival after Radical Resection for Gastric Cancer: A Retrospective Single-Center Analysis of 1107 Patients[J]. Cancers (Basel), 2019, 11(12): 1890. DOI:10.3390/cancers11121890 |
| [12] |
Li J, Zhang Y, Hu DM, et al. Impact of postoperative complications on long-term outcomes of patients following surgery for gastric cancer: A systematic review and meta-analysis of 64 follow-up studies[J]. Asian J Surg, 2020, 43(7): 719-729. |
| [13] |
Fuse N, Kuboki Y, Kuwata T, et al. Prognostic impact of HER2, EGFR, and c-MET status on overall survival of advanced gastric cancer patients[J]. Gastric Cancer, 2016, 19(1): 183-191. DOI:10.1007/s10120-015-0471-6 |
| [14] |
金俊蕊, 邓靖宇, 梁寒, 等. 胃癌根治术围手术期并发症危险因素分析及其对预后的影响[J]. 中华胃肠外科杂志, 2018, 21(1): 53-60. [Jin JR, Deng JY, Liang H, et al. Analysis of risk factor of perioperafive complications in pafients wim radical gastrectomy for gastric cancer and its influence on prognosis[J]. Zhonghua Wei Chang Wai Ke Za Zhi, 2018, 21(1): 53-60. DOI:10.3760/cma.j.issn.1671-0274.2018.01.010] |
| [15] |
Yang SY, Roh KH, Kim YN, et al. Surgical Outcomes After Open, Laparoscopic, and Robotic Gastrectomy for Gastric Cancer[J]. Ann Surg Oncol, 2017, 24(7): 1770-1777. |
| [16] |
Sumiyama K. Past and current trends in endoscopic diagnosis for early stage gastric cancer in Japan[J]. Gastric Cancer, 2017, 20(Suppl 1): 20-27. |
 2021, Vol. 48
2021, Vol. 48


