文章信息
- 消化系统肿瘤患者奥沙利铂相关血小板下降的临床分析
- Clinical Analysis of Oxaliplatin-related Thrombocytopenia in Patients with Digestive System Malignancy
- 肿瘤防治研究, 2021, 48(5): 497-502
- Cancer Research on Prevention and Treatment, 2021, 48(5): 497-502
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.20.1260
- 收稿日期: 2020-10-28
- 修回日期: 2021-01-21
2. 434020 荆州,荆州市中心医院肿瘤科
2. Department of Oncology, Jingzhou Central Hospital, Jingzhou 434020, China
奥沙利铂是第三代铂类药物,自2002年奥沙利铂被批准用于转移性结肠癌的治疗以来,该药已经广泛应用于胃癌、结直肠癌、胰腺癌等消化道肿瘤的治疗[1]。研究表明,奥沙利铂与5-氟尿嘧啶类药物联用方案(如FOLFOX、CAPOX、SOX等)治疗过程中,所有级别血小板减少的发生率均明显高于5-氟尿嘧啶类药物的单药治疗[2-3]。尽管3~4级血小板下降发生率较低,仍有部分患者因血小板下降而降低化疗剂量,从而影响疗效[4]。奥沙利铂也广泛应用于晚期肠癌肝转移患者的新辅助化疗或转化性化疗,在这部分患者中,化疗相关性血小板下降也增加了出血和围手术期并发症的发生,增加了输血率,并导致住院时间的延长。因此,在消化系统肿瘤患者中,奥沙利铂相关性血小板下降应引起临床医师的充分重视。
奥沙利铂相关性血小板下降多为1~2级,常合并脾脏肿大。停用奥沙利铂后,血小板计数大多能够随时间推移而逐渐改善,但伴有显著脾肿大患者血小板恢复缓慢[5]。既往研究认为,接受FOLFOX(奥沙利铂+亚叶酸钙+5-氟尿嘧啶)方案化疗的所有患者中,约有86%的患者在化疗过程中出现脾脏体积增大,且与血小板下降显著相关。脾脏体积增大被认为是奥沙利铂相关性肝损伤的阳性预测因子[6]。
本研究回顾性分析了72例消化系统肿瘤患者使用含奥沙利铂方案化疗后的血小板及脾脏直径变化情况,旨在了解奥沙利铂相关性血小板下降的发生率、严重程度,及奥沙利铂对于脾脏直径变化的影响。
1 资料与方法 1.1 临床资料回顾性收集2017年3月—2019年3月华中科技大学同济医学院附属同济医院肿瘤中心消化肿瘤科及荆州市中心医院肿瘤科收治的72例消化系统肿瘤患者临床资料,所有患者均获得病理诊断,均为接受辅助治疗(化疗方案包括奥沙利铂联合氟尿嘧啶及奥沙利铂联合卡培他滨)或一线治疗的患者,即既往未接受过化疗的患者,ECOG评分均为0~1,所有患者至少接受2周期以上含奥沙利铂方案化疗,72例患者的一般临床资料,见表 1。本研究经华中科技大学同济医院伦理委员会批准(TJ-IRB20201221)。

|
在43例一线治疗患者中,29例(67.4%)患者在完成含奥沙利铂方案化疗后进行了维持或二线治疗。其中6例患者采用单药氟尿嘧啶类药物维持治疗,12例患者采用含伊立替康方案化疗,5例患者更换为紫衫类药物治疗,3例患者采用了包括阿帕替尼、索拉非尼在内的小分子靶向药物治疗,3例患者在一线治疗结束后未再进行后续抗肿瘤治疗。
1.2 方法记录患者每周期治疗过程及随访过程中血小板变化情况。参照NCI-CTC 4.0(National Cancer Institute-Common Toxicity Criteria, NCI-CTC)毒性分级标准对患者血小板变化进行分级。二级及以上血小板下降的患者均采用包括IL-11、TPO以及艾曲波帕在内的升血小板制剂,血小板恢复至1级停止用药,并定义为血小板恢复。
全组患者在治疗及随访过程中每1.5~2月进行一次CT或MR检查,同一患者在治疗及随访过程中均采用同一种影像学评估方法。经过脾门测量垂直于脾脏最长径的径线长度作为脾脏直径,治疗前开始记录,治疗及随访过程中观察脾脏直径的变化。同一患者,由同一医生经同一径线测量脾脏直径并记录数值,并由另一名医生进行核对。脾脏直径较基线增加10%以上定义为脾脏体积增大,脾脏直径较最大值缩小10%以上定义为脾脏开始缩小,脾脏直径恢复至基线水平10%以内定义为脾脏直径恢复。脾脏增大比例=(脾脏最大直径-脾脏基线直径)/脾脏基线直径。
1.3 随访本研究随访时间从2017年3月开始截至2019年12月,中位随访时间为13.43±1.32月(3.2~33.9月)。随访方式包括住院及门诊预约随访,并对部分患者进行电话随访。随访期间患者定期进行血液学及影像学检查。
1.4 统计学方法采用SPSS23.0统计软件进行数据处理及统计分析,采用两样本t检验、卡方检验进行汇总统计比较;采用Spearman相关法分析血小板下降程度与脾脏增大比例的关系;血小板恢复时间采用Kaplan-Meier法进行分析,P < 0.05为差异有统计学意义。
2 结果 2.1 血小板变化全组72例患者中,共有47例(65.3%)患者在使用含奥沙利铂方案化疗后出现血小板下降,其中1级血小板下降26例(55.3%),2级12例(25.5%),3级7例(14.9%),4级2例(4.3%)。化疗开始后,出现血小板下降的中位周期数为4±0.31,中位时间为2.53±0.49月,中位奥沙利铂累积剂量为520±35.81 mg/m2;血小板出现最低值的中位周期数为6±10.73,中位时间为4.03±0.49月,中位奥沙利铂累积剂量为780±36.32 mg/m2。使用升血小板制剂的中位时间为4±0.57天。
在采用CAPOX方案化疗组的51例患者中,共35例(68.6%)出现血小板下降,其中1级18例,2级8例,3级7例,4级2例;而在使用FOLFOX方案化疗的18例患者中,共10例(55.6%)出现1~2级血小板下降,其中1级7例,2级3例,CAPOX和FOLFOX化疗组间血小板下降比例差异无统计学意义(χ2=1.002, P=0.317)。
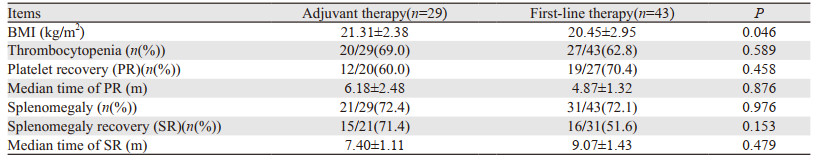
在含奥沙利铂化疗结束后的随访中,47例血小板下降患者中,31例(66.0%)患者血小板恢复,16例(34.0%)患者血小板尚未恢复,中位血小板恢复时间为5.80±1.22月。血小板恢复曲线见图 1。
|
| 图 1 72例患者含奥沙利铂方案化疗结束后血小板恢复时间曲线 Figure 1 Time curve of platelet count recovery in 72 patients after oxaliplatin-based chemotherapy |
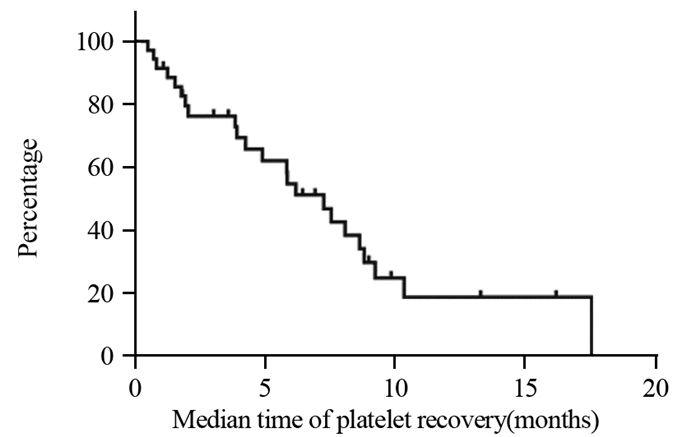
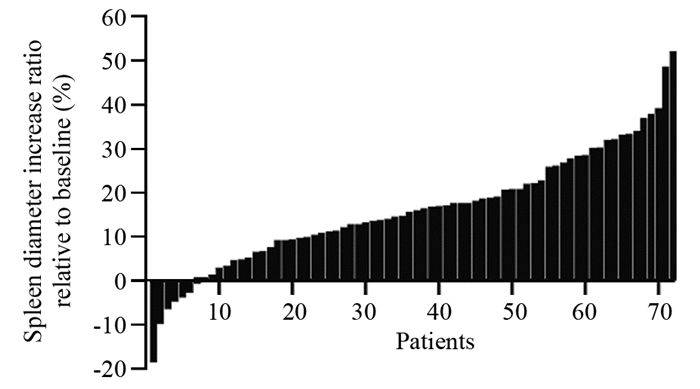
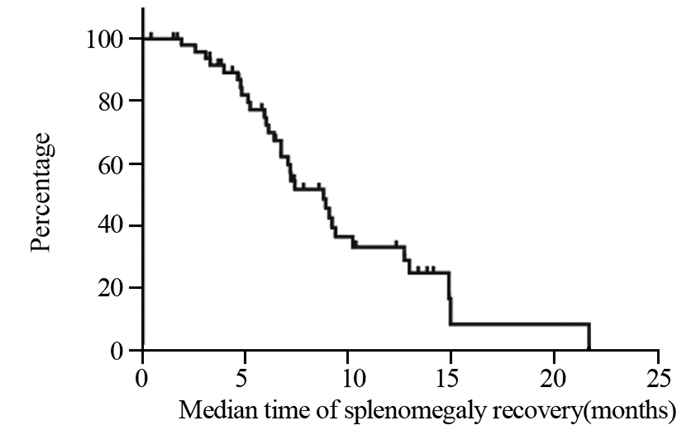
全组72例患者中,有52例(72.2%)出现不同程度的脾脏增大。患者脾脏直径增大趋势瀑布图见图 2。脾脏中位增大比例为(18.82±0.01)%。含奥沙利铂方案开始化疗后出现脾脏增大的中位时间为2.15±0.19月,脾脏直径最大的中位时间为开始化疗后4.68±2.89月。在含奥沙利铂化疗结束后,脾脏开始缩小的中位时间为3.28±0.44月。在随访过程中,共有31例患者脾脏直径恢复至基线±10%以内,21例患者未恢复,中位恢复时间为8.80±1.05月。脾脏直径变化趋势曲线见图 3,脾脏直径恢复曲线见图 4。
|
| 图 2 72例含奥沙利铂方案化疗患者脾脏直径增加趋势 Figure 2 Increase of spleen diameter in 72 patients received oxaliplatin-based chemotherapy |
|
| 图 3 72例含奥沙利铂方案化疗患者脾脏直径变化趋势 Figure 3 Change of spleen diameter in 72 patients received oxaliplatin-based chemotherapy |
|
| 图 4 72例患者含奥沙利铂方案化疗结束后脾脏直径中位恢复时间曲线 Figure 4 Time curve of spleen diameter recovery in 72 patients after oxaliplatin-based chemotherapy |
在52例发生脾脏增大的患者中,36例(69.2%)出现各级血小板下降,在20例无脾脏增大患者中,11例(55.0%)出现血小板下降,组间血小板下降比较差异无统计学意义(P=0.256)。经Spearman相关分析结果显示,血小板下降分级与脾脏增大比例之间显著相关(r=0.369, P=0.007)。发生脾脏增大的患者中位血小板恢复时间为7.23±1.03月,未发生脾脏增大的患者为3.9±2.02月,两者比较,差异有统计学意义(P=0.008),血小板恢复曲线见图 5。

|
| 图 5 有无脾脏增大患者血小板中位恢复时间 Figure 5 Time curve of platelet count recovery in patients with or without splenomegaly |
在全组72例患者中,共有29例患者接受辅助治疗,即含奥沙利铂方案化疗结束后即进入临床随访期,未继续接受其他抗肿瘤治疗;43例接受一线治疗的患者为晚期消化系统肿瘤患者,在结束含奥沙利铂方案化疗后,大部分患者接受包括氟尿嘧啶类药物单药维持、含伊立替康方案、含紫衫类药物方案化疗以及口服小分子靶向药物的后续治疗,仅3名患者在一线治疗结束后未再进行后续治疗。
辅助治疗组患者BMI指数较一线治疗组高,差异有统计学意义(P=0.046),提示辅助治疗患者可能具有更优的体能状况。尽管如此,两组间在血小板下降、脾脏增大的发生率、血小板恢复比例(随访中血小板恢复患者数/发生血小板下降的患者数)、脾脏恢复比例(随访中脾脏恢复患者数/发生脾脏增大患者数)以及血小板恢复时间、脾脏恢复时间方面差异均未见统计学意义,见表 2。
全组患者中位化疗周期数为6±0.27,中位化疗时长为4.53±0.22月,奥沙利铂累积量为780±22.96 mg/m2。奥沙利铂累积剂量与化疗后血小板恢复时间呈正相关(r2=0.420)。提示含奥沙利铂方案化疗时间越长,累积剂量越高,血小板恢复正常所需时间越长。而奥沙利铂累积剂量与脾脏增大比例及脾脏恢复时间之间均无显著相关性。
3 讨论奥沙利铂引起血小板下降的机制主要包括四个方面:(1)奥沙利铂化疗引起的肝窦损伤;(2)化疗引起的骨髓抑制;(3)奥沙利铂诱导的免疫性血小板减少;(4)其他特殊机制:包括溶血尿毒综合征等急性血小板减少症[7]。奥沙利铂通过增加肝窦血管内皮空隙,刺激自由基的释放,增加谷胱甘肽转移酶的消耗,增加金属蛋白酶(MMP2和MMP9)的表达,从而降解Disse空间的细胞基质,导致肝窦内皮的损伤及窦性屏障的破坏。红细胞通过损伤的肝窦血管内皮间隙进入Disse间隙,促进窦周间隙胶原沉积、窦周纤维化的发生。窦周纤维化的发生发展导致了肝小叶中心区的乏氧状态,随之而来的肝小静脉狭窄、闭塞,促进了肝脏结节性再生,从而导致肝内窦性门脉高压,即表现为肝窦阻塞综合征(sinusoidal obstruction syndrome, SOS)[5, 8-9]。调查显示,接受含有奥沙利铂药物化疗方案的患者中,约19%~79%合并肝窦阻塞综合征,从而引起窦性门脉高压、脾亢、肝功能损伤及血小板下降,应引起临床医生的充分重视[8, 10]。
目前,奥沙利铂相关性血小板下降尚无标准治疗方案,大多采用延迟化疗、给予IL-11升血小板治疗等方式处理,引发的临床后果常常是患者治疗强度的下降。而预防奥沙利铂相关性肝损伤的主要措施是缩短奥沙利铂使用时间及延长化疗与手术的时间间隔。在治疗方面,尚无明确治疗方案。有研究认为双环醇等降酶药物[11]、甘草酸铵等抗炎类药物以及多烯磷脂酰胆碱等肝细胞膜保护剂对奥沙利铂导致的肝损伤可能有一定的保护作用[12-13];Robinson等[14]在动物模型研究报道中指出,长期使用保护肝脏的抗氧化剂可能减少奥沙利铂相关肝窦阻塞综合征的发生。因此,预测及识别奥沙利铂诱导的肝损伤及血小板下降尤其重要。
本研究结果显示,奥沙利铂相关性血小板下降的发生率为65.3%,多为1~2级,3~4级血小板下降的发生率为12.5%。对于消化系统肿瘤患者来说,无论是采用CAPOX还是FOLFOX方案化疗,血小板下降的发生率差异无统计学意义,且化疗结束后血小板稳定恢复至正常水平时间差异也无统计学意义。
本研究发现,有72.2%(52/72)的患者在化疗过程中出现不同程度的脾脏增大,部分患者在含奥沙利铂方案化疗结束后的一段时间,脾脏仍在持续增大。半数患者在奥沙利铂停药2月后开始出现脾脏缩小,在出现脾脏增大的52例患者中,12例(23.1%)于半年内脾脏直径恢复至基线水平的±10%以内,而19例(36.5%)患者在奥沙利铂停药后1年内脾脏大小恢复至基线水平。接受辅助治疗和一线治疗的患者血小板恢复时间、脾脏体积恢复时间等指标组间差异均无统计学意义。分析原因,可能由于本研究一线治疗组的患者中,仅有67.4%的患者接受了后线治疗,其中15例患者为氟尿嘧啶或紫衫类药物单药治疗,总体化疗强度较低,骨髓毒性较小。是否提示在消化系统肿瘤后线治疗使用伊立替康、紫衫类药物、氟尿嘧啶类药物以及小分子口服靶向药物对于脾脏体积的影响较小,对肝窦的损伤较为轻微还需更深入的临床观察。
既往的研究显示,贝伐单抗能够减少奥沙利铂相关性的肝损伤的发生率,从而降低血小板下降的发生率[6, 15]。在一组由NO16966研究患者构成的队列中,加入贝伐单抗组6月血小板减少的累积发生率为19%,而单纯化疗组血小板减少的发生率为51%,差异具有统计学意义[16]。在接受结直肠癌肝转移切除的患者中,一些小样本的非随机报告也表明贝伐单抗降低了组织学确定的肝窦损伤的发生率[6, 17-18]。而在本研究中,有9例患者在化疗基础上联合贝伐单抗治疗。在是否联合贝伐单抗治疗的对比中,无论是血小板下降、脾脏增大的发生率,还是血小板恢复、脾脏直径恢复的时间,组间差异均无统计学意义。由于患者病例数较少,且部分患者并未在化疗开始时即同步联合贝伐单抗治疗,混杂因素较多,难以充分反映贝伐单抗对于奥沙利铂相关性血小板下降及脾肿大的真实影响。
在既往研究中,多采用测量脾脏体积的方法对脾脏的大小进行评估,提示奥沙利铂相关性脾脏肿大的发生率为44%~89%,脾脏增大的中位体积约为30%[16, 19-20]。但脾脏体积的测量方法较为复杂,并需要使用特殊的影像重建软件。国内外均有文献显示,脾脏的各个参数与脾体积具有一定的相关性,采用CT或B型超声测量包括脾脏厚度在内的脾脏径线能够在一定程度上反应脾脏体积的大小[21-24]。而本研究所采用的经脾门测量垂直于脾脏长轴径线的方法操作较为简便,胶片或简单的影像阅读软件即可进行评估,无需对脾脏进行重建及体积勾画,可较为便捷、迅速的帮助临床医师判断脾脏肿大情况,从而反映奥沙利铂相关性肝损伤及血小板下降。
综上所述,含奥沙利铂方案化疗在消化系统肿瘤患者中的使用可引起血小板下降、脾脏肿大,并且在化疗结束后较长时间内难以恢复基线水平。脾脏径线的测量可以很好的预估脾脏肿大和血小板下降的风险。但本研究样本量较小,为回顾性分析,并且混杂因素较多。因此,需要更大规模的研究、更长时间的随访以及更严谨的设计来评估奥沙利铂相关性SOS以及血小板下降。
作者贡献:
戴宇翃:研究实施、数据分析及论文写作
谭茜敏、李一鸣、黄婷婷:参与数据收集和结果分析
邱红:参与研究设计和构思
邱萍:研究构思及设计、论文写作和修改
| [1] |
程建平, 赵晓琳, 李珍, 等. mXELIRI和mFOLFIRI方案联合西妥昔单抗一线治疗转移性左半结肠癌的临床观察[J]. 肿瘤防治研究, 2020, 47(7): 542-546. [Cheng JP, Zhao XL, Li Z, et al. Clinical Observation of mXELIRI and mFOLFIRI Combined with Cetuximab in Firstline Treatment of Metastatic Left-side Colon Cancer[J]. Zhong Liu Fang Zhi Yan Jiu, 2020, 47(7): 542-546. DOI:10.3971/j.issn.1000-8578.2020.19.1475] |
| [2] |
André T, Boni C, Mounedji-Boudiaf L, et al. Oxaliplatin, fluorouracil, and leucovorin as adjuvant treatment for colon cancer[J]. N Engl J Med, 2004, 350(23): 2343-2351. DOI:10.1056/NEJMoa032709 |
| [3] |
de Gramont A, Figer A, Seymour M, et al. Leucovorin and fluorouracil with or without oxaliplatin as first-line treatment in advanced colorectal cancer[J]. J Clin Oncol, 2000, 18(16): 2938-2947. DOI:10.1200/JCO.2000.18.16.2938 |
| [4] |
Bautista MA, Stevens WT, Chen CS, et al. Hypersensitivity reaction and acute immune-mediated thrombocytopenia from oxaliplatin: two case reports and a review of the literature[J]. J Hematol Oncol, 2010, 3: 12. DOI:10.1186/1756-8722-3-12 |
| [5] |
Slade JH, Alattar ML, Fogelman DR, et al. Portal hypertension associated with oxaliplatin administration: clinical manifestations of hepatic sinusoidal injury[J]. Clin Colorectal Cancer, 2009, 8(4): 225-230. DOI:10.3816/CCC.2009.n.038 |
| [6] |
Overman MJ, Maru DM, Charnsangavej C, et al. Oxaliplatin-mediated increase in spleen size as a biomarker for the development of hepatic sinusoidal injury[J]. J Clin Oncol, 2010, 28(15): 2549-2555. DOI:10.1200/JCO.2009.27.5701 |
| [7] |
Jardim DL, Rodrigues CA, Novis YAS, et al. Oxaliplatin-related thrombocytopenia[J]. Ann Oncol, 2012, 23(8): 1937-1942. DOI:10.1093/annonc/mds074 |
| [8] |
Rubbia-Brandt L, Audard V, Sartoretti P, et al. Severe hepatic sinusoidal obstruction associated with oxaliplatin-based chemotherapy in patients with metastatic colorectal cancer[J]. Ann Oncol, 2004, 15(3): 460-466. DOI:10.1093/annonc/mdh095 |
| [9] |
Puente A, Fortea JI, Del Pozo C, et al. Porto-Sinusoidal Vascular Disease Associated to Oxaliplatin: An Entity to Think about It[J]. Cells, 2019, 8(12): 1506. DOI:10.3390/cells8121506 |
| [10] |
Aloia T, Sebagh M, Plasse M, et al. Liver histology and surgical outcomes after preoperative chemotherapy with fluorouracil plus oxaliplatin in colorectal cancer liver metastases[J]. J Clin Oncol, 2006, 24(31): 4983-4990. DOI:10.1200/JCO.2006.05.8156 |
| [11] |
杨锭洪, 孟凡军, 林长裕. 口服双环醇对奥沙利铂联合卡培他滨方案治疗胃癌患者引起肝损伤的防治研究[J]. 实用癌症杂志, 2014, 29(6): 660-662. [Yang DH, Meng FJ, Lin CY. Study of prevention of bicclol for hepatic damage caused by Oxaliplatin plus capecitabine for gastric cancer[J]. Shi Yong Ai Zheng Za Zhi, 2014, 29(6): 660-662. DOI:10.3969/j.issn.1001-5930.2014.06.016] |
| [12] |
徐盟, 费倩, 孟潇, 等. 多烯磷脂酰胆碱对奥沙利铂联合氟尿嘧啶所致荷瘤裸鼠肝损伤的保护作用[J]. 中国医科大学学报, 2017, 46(6): 544-547. [Xu M, Fei Q, Meng X, et al. Effects of Polyene Phosphatidylcholine on Hepatic Injury of Tumor?bearing Nude Mice Induced by Oxaliplatin and 5?fluorouracil Chemotherapy[J]. Zhongguo Yi Ke Da Xue Xue Bao, 2017, 46(6): 544-547.] |
| [13] |
Zou X, Wang Y, Peng C, et al. Magnesium isoglycyrrhizinate has hepatoprotective effects in an oxaliplatininduced model of liver injury[J]. Int J Mol Med, 2018, 42(4): 2020-2030. |
| [14] |
Robinson SM, Mann J, Vasilaki A, et al. Pathogenesis of FOLFOX induced sinusoidal obstruction syndrome in a murine chemotherapy model[J]. J Hepatol, 2013, 59(2): 318-326. DOI:10.1016/j.jhep.2013.04.014 |
| [15] |
Ribero D, Wang H, Donadon M, et al. Bevacizumab improves pathologic response and protects against hepatic injury in patients treated with oxaliplatin-based chemotherapy for colorectal liver metastases[J]. Cancer, 2007, 110(12): 2761-2767. DOI:10.1002/cncr.23099 |
| [16] |
Overman MJ, Ferrarotto R, Raghav K, et al. The Addition of Bevacizumab to Oxaliplatin-Based Chemotherapy: Impact Upon Hepatic Sinusoidal Injury and Thrombocytopenia[J]. J Natl Cancer Inst, 2018, 110(8): 888-894. DOI:10.1093/jnci/djx288 |
| [17] |
Klinger M, Eipeldauer S, Hacker S, et al. Bevacizumab protects against sinusoidal obstruction syndrome and does not increase response rate in neoadjuvant XELOX/FOLFOX therapy of colorectal cancer liver metastases[J]. Eur J Surg Oncol, 2009, 35(5): 515-520. DOI:10.1016/j.ejso.2008.12.013 |
| [18] |
Rubbia-Brandt L, Lauwers GY, Wang H, et al. Sinusoidal obstruction syndrome and nodular regenerative hyperplasia are frequent oxaliplatin-associated liver lesions and partially prevented by bevacizumab in patients with hepatic colorectal metastasis[J]. Histopathology, 2010, 56(4): 430-439. DOI:10.1111/j.1365-2559.2010.03511.x |
| [19] |
Iwai T, Yamada T, Koizumi M, et al. Oxaliplatin-induced increase in splenic volume; irreversible change after adjuvant FOLFOX[J]. J Surg Oncol, 2017, 116(7): 947-953. DOI:10.1002/jso.24756 |
| [20] |
Kim MJ, Han SW, Lee DW, et al. Splenomegaly and Its Associations with Genetic Polymorphisms and Treatment Outcome in Colorectal Cancer Patients Treated with Adjuvant FOLFOX[J]. Cancer Res Treat, 2016, 48(3): 990-997. DOI:10.4143/crt.2015.296 |
| [21] |
Bezerra AS, D'Ippolito G, Faintuch S, et al. Determination of splenomegaly by CT: is there a place for a single measurement?[J]. AJR Am J Roentgenol, 2005, 184(5): 1510-1513. DOI:10.2214/ajr.184.5.01841510 |
| [22] |
Rezai P, Tochetto SM, Galizia MS, et al. Splenic volume model constructed from standardized one-dimensional MDCT measurements[J]. AJR Am J Roentgenol, 2011, 196(2): 367-372. DOI:10.2214/AJR.10.4453 |
| [23] |
Yetter EM, Acosta KB, Olson MC, et al. Estimating splenic volume: sonographic measurements correlated with helical CT determination[J]. AJR Am J Roentgenol, 2003, 181(6): 1615-1620. DOI:10.2214/ajr.181.6.1811615 |
| [24] |
王萱, 薛华丹, 刘炜, 等. 应用64层螺旋CT探讨脾体积的简易估测方法[J]. 临床放射学杂志, 2009, 28(4): 560-563. [Wang X, Xue HD, Liu W, et al. A simple way to estimante splenic volume from CT images with 64-slice spiral CT[J]. Lin Chuang Fang She Xue Za Zhi, 2009, 28(4): 560-563.] |
 2021, Vol. 48
2021, Vol. 48