文章信息
- FBXW7α对结直肠癌细胞中热休克转录因子1表达和定位的影响
- Effects of FBXW7α on Expression and Localization of Heat Shock Transcription Factor 1 in Colorectal Cancer Cells
- 肿瘤防治研究, 2021, 48(5): 457-463
- Cancer Research on Prevention and Treatment, 2021, 48(5): 457-463
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.20.1216
- 收稿日期: 2020-10-21
- 修回日期: 2021-01-07
热休克转录因子1(heat shock transcription factor 1, HSF1)是调控热休克蛋白(heat-shock proteins, HSPs)表达的转录因子。细胞未受刺激时,HSF1以单体形式在细胞核和细胞质之间穿梭,当细胞受到刺激时,游离的HSF1以三聚体的形式磷酸化,并入核诱导靶基因的转录[1],在热激过程中Ser326位点的HSF1磷酸化可以正向调控转录。在此期间,HSF1与错误折叠的蛋白质被蛋白酶体降解,并延迟热休克反应的衰减直到清除受损的蛋白质为止[2]。
FBXW7(F-box and WD repeat domain containing 7)是F-box家族的重要成员之一,为SCF(SKP1-Cullin1-F-box)E3泛素连接酶复合物的靶蛋白识别组分[3]。FBXW7是继K-RAS和APC之后研究发现在结直肠癌中最常见的突变基因之一[4]。研究发现结直肠癌组织中FBXW7的表达水平低于正常组织,其失活会诱导癌症的发生[5]。约7.5%的转移性结直肠腺癌患者中发现FBXW7错义突变,与结直肠癌不良预后有关[6]。FBXW7介导多种癌蛋白的降解,如NF-κB、c-Myc、Cyclin E、Notch1、c-Jun和Brg1等[7]。FBXW7位于人4号染色体长臂(4q31.3)上,分为FBXW7α、FBXW7β和FBXW7γ三个亚型,其中FBXW7α位于细胞核中,FBXW7β位于细胞质中,而FBXW7γ位于核仁中[8]。FBXW7α通过与GSK3β激活的Ser303和Ser307位点磷酸化HSF1结合,介导HSF1泛素化降解。有研究发现缺失FBXW7α导致黑色素瘤细胞核HSF1蛋白表达水平明显升高,而对细胞质HSF1表达没有影响[9]。然而,FBXW7对结直肠癌细胞胞质和胞核内的HSF1在热刺激后及未刺激状态下的表达定位的调控尚不清楚。本研究利用细胞免疫荧光法观察敲除FBXW7对温热刺激及恢复期间HSF1在胞质和胞核中的定位的影响,明确FBXW7在HSF1及激活的HSF1在胞核中的表达定位的调控作用。
1 材料与方法 1.1 细胞株及试剂人结直肠癌细胞系HCT116、DLD1及HCT116 WT、HCT116 FBXW7 KO、DLD1 WT及DLD1 FBXW7 KO、真核表达质粒PcDNA3-HA-FBXW7α[10]均由美国哈佛医学院贝斯以色列女执事医疗中心病理系魏文毅教授馈赠。FBXW7基因敲除的HCT116和DLD1细胞由Bert Vogelstein和Christoph Lengauer构建,得到Bert Vogelstein的馈赠[11]。主要通过利用细菌人工染色体(BAC)系统进行基因克隆,并通过Cre/loxP敲除系统和单克隆细胞筛选获得FBXW7基因敲除的HCT116和DLD1细胞[12]。结直肠癌细胞均用含10%胎牛血清的DMEM培养液置于37℃、5%CO2的培养箱中培养。胎牛血清、DMEM高糖培养基、Opti-MEM减血清培养基购自美国Gibco公司,BCA试剂盒(货号P0011)及蛋白质提取相关试剂均购自上海碧云天公司,转染试剂Lipofectamine3000(货号L3000075)购自美国Invitrogen公司。
1.2 细胞转染取对数生长期的结直肠癌细胞株DLD1接种于6个60 mm的培养皿中,接种密度以过夜培养后细胞融合度为70%~90%为准。按照Lipofectamine3000说明书提供的操作流程,以Opti-MEM减血清培养基配制转染试剂及质粒工作液,将PcDNA3-HA-FBXW7α真核表达质粒转染入DLD1细胞中。转染6 h后更换含10%胎牛血清的完全培养基继续培养。
1.3 Western blot法检测过表达FBXW7α基因对HSF1蛋白表达水平的影响收集转染24 h后的DLD1细胞,加入细胞裂解液RIPA提取细胞总蛋白,用BCA法检测蛋白质浓度,通过10%SDS-PAGE分离蛋白,采用90V电压将分离蛋白条带转移到活化的PVDF膜。用含5%脱脂牛奶的TBST溶液封闭膜1.5 h,然后加入兔抗人HSF1(CST,货号4356,1:1000)、兔抗人pHSF1Ser326单克隆抗体(Invitrogen,货号MA5-32105,1:1000)及鼠抗人β-actin(CST,货号3700,1:1000)、HA(Sigma,货号H9658,1:1000)单克隆抗体4℃孵育过夜;加入HRP标记的羊抗鼠IgG(CST,货号7076,1:5000)及羊抗兔IgG(CST,货号7074,1:5000)。滴加化学发光HRP底物ECL发光液(Millipore,货号WBKLS0500),使用MiniChemi 610Plus型化学发光成像系统进行曝光显影。实验重复3次。
1.4 Western blot法检测FBXW7对结直肠癌细胞中HSF1蛋白表达的影响收集HCT116WT、HCT116 FBXW7 KO、DLD1 WT及DLD1 FBXW7 KO细胞, 加入细胞裂解液RIPA提取细胞总蛋白,取对数生长期细胞进行42℃水浴温热刺激1 h,并在37℃培养恢复30 min和60 min,用核蛋白提取试剂盒提取细胞核蛋白和胞质蛋白。用BCA法检测蛋白质浓度,通过10%SDS-PAGE分离蛋白,采用90V电压将分离蛋白条带转移到活化的PVDF膜。用含5%脱脂牛奶的TBST溶液封闭膜1.5 h,然后加入兔抗人HSF1(CST,货号4356,1:1000)、兔抗人pHSF1Ser326单克隆抗体(Invitrogen,货号MA5-32105,1:1000)及鼠抗人β-actin(CST,货号3700,1:1000)、Lamin A/C(CST,货号4777,1:1000)单克隆抗体4℃孵育过夜;加入HRP标记的羊抗鼠IgG(CST,货号7076,1:5000)及羊抗兔IgG(CST,货号7074,1:5000),滴加化学发光HRP底物ECL发光液(Millipore,货号WBKLS0500),使用MiniChemi 610Plus型化学发光成像系统进行曝光显影。实验重复3次。
1.5 细胞免疫荧光法检测FBXW7对激活的HSF1在结直肠癌细胞中表达定位的影响取对数生长期的HCT116 WT、HCT116 FBXW7 KO、DLD1 WT及DLD1 FBXW7 KO细胞,制备细胞爬片。待细胞融合度达90%时,进行42℃水浴温热刺激1 h,并在37℃培养恢复30 min和60 min,用4%多聚甲醛溶液室温固定20 min;用0.3%Triton X-100室温通透20 min;3%BSA室温封闭1 h;加入兔抗人HSF1(CST,货号4356,1:200)和pHSF1Ser326单克隆抗体(Invitrogen,货号MA5-32105,1:200)4℃过夜;加入Alexa Fluor 488标记(Invitrogen,货号A-11008,1:400)及Alexa Fluor 555标记(Invitrogen,货号A-21428,1:400)的羊抗兔IgG,避光反应2 h;加入DAPI荧光封片剂对细胞核进行染色及封片,荧光显微镜(日本奥林巴斯BX53)观察HSF1的表达位置变化。实验重复3次。
1.6 统计学方法应用SPSS23.0统计学软件对实验结果进行统计学分析。所有实验独立重复3次,结果数据以(x±s)表示。两组间比较采用独立样本t检验,以P < 0.05为差异有统计学意义。
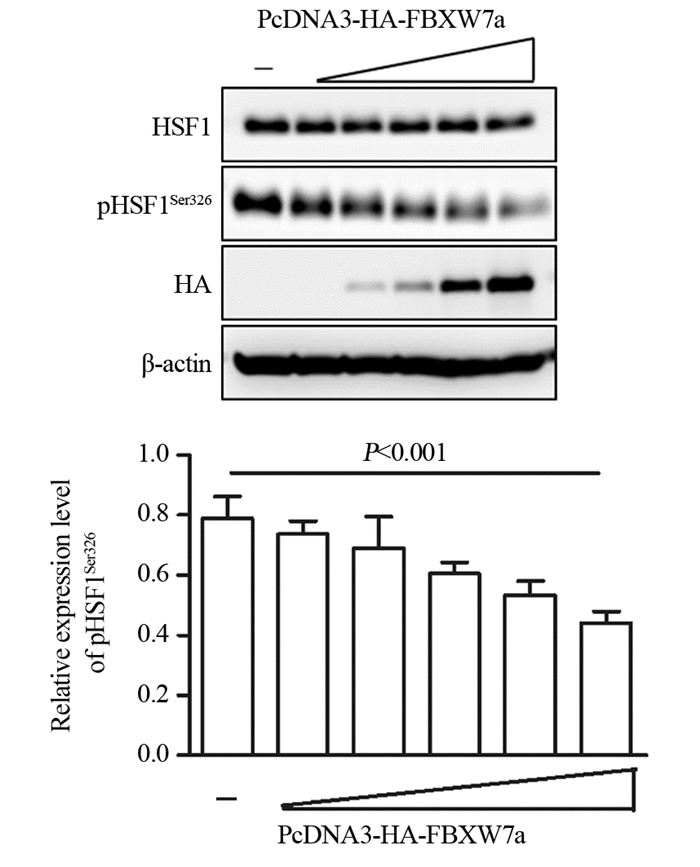
2 结果 2.1 FBXW7α基因过表达结直肠癌细胞中pHSF1Ser326蛋白的表达水平与对照组相比,DLD1细胞转染PcDNA3-HA-FBXW7α真核表达质粒后,pHSF1Ser326蛋白的表达水平显著降低(P=0.0003),见图 1。提示FBXW7α可以靶向下调HSF1的蛋白表达水平。
|
| 图 1 转染后DLD1细胞中pHSF1Ser326蛋白的表达(n=3) Figure 1 Expressions of pHSF1Ser326 protein decreased in DLD1 cells after transfection (n=3) |
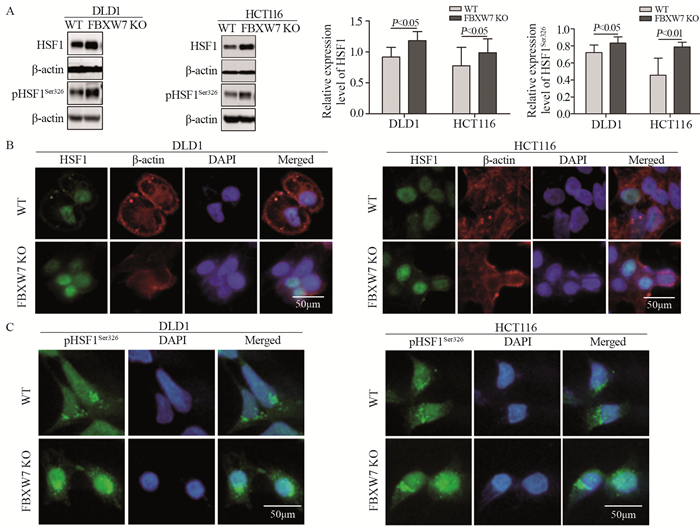
Western blot检测结果显示,DLD1 FBXW7 KO细胞的HSF1总蛋白的表达水平高于DLD1 WT细胞(P=0.029),HCT116 FBXW7 KO细胞的HSF1总蛋白的表达水平高于HCT116 WT细胞(P=0.039);HCT116 FBXW7 KO细胞中pHSF1Ser326总蛋白的表达水平显著高于HCT116 WT细胞(P=0.019),见图 2A。进一步采用细胞免疫荧光法观察到FBXW7 KO细胞中HSF1和pHSF1Ser326主要聚集在胞核,在胞质中仅有少量表达。结果表明,FBXW7的缺失导致HSF1和pHSF1Ser326总蛋白表达水平显著升高,并且主要在胞核中表达,见图 2B~C。
|
| A: the expression levels of HSF1 protein and pHSF1Ser326 protein in CRC cells were detected by Western blot; B: immunofluorescent staining of HSF1 protein and β-actin protein in CRC cells; C: immunofluorescent staining of pHSF1Ser326 protein in CRC cells (B, C×400, staining with 4, 6-diamidino-2-phenylindole (DAPI), Alexa Fluor 488 and Alexa Fluor 555, scale bar=50μm); n=3; WT: wild type. 图 2 FBXW7的缺失导致结直肠癌细胞中HSF1和pHSF1Ser326主要在胞核中累积 Figure 2 Loss of FBXW7 resulted in accumulation of HSF1 and pHSF1Ser326 mainly in nucleus of CRC cells |
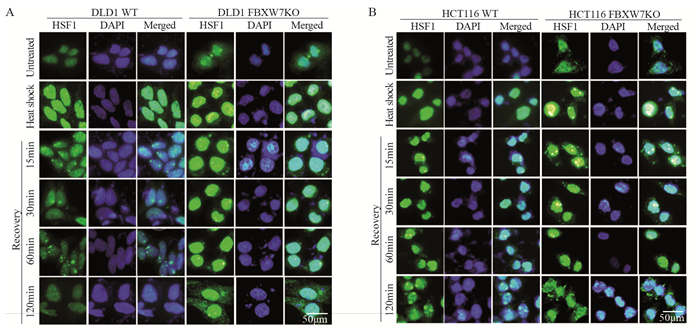
对结直肠癌细胞42℃温热刺激持续1 h,并在37℃培养指定时间。细胞免疫荧光法检测结果显示,温热刺激细胞后HSF1在细胞核中表达迅速增强,恢复30 min后,HCT116 WT和DLD1 WT细胞中的核HSF1表达逐渐恢复至未刺激水平,FBXW7 KO的两种细胞中HSF1在核中表达较强,恢复60 min后仍然可以看到在核中表达较强,见图 3。表明FBXW7的缺失导致温热刺激细胞后HSF1恢复至未刺激水平的时间延长。
|
| A, B: the expression of HSF1 in the nucleus and cytoplasm of CRC cells during recovery from heat shock were detected by immunofluorescence staining method (×400, staining with 4', 6-diamidino-2-phenylindole (DAPI) and Alexa Fluor 488, scale bar=50μm). 图 3 FBXW7的缺失使温热刺激细胞后HSF1在胞核中累积时间延长 Figure 3 Loss of FBXW7 prolonged accumulation of HSF1 in nucleus after warm stimulation |
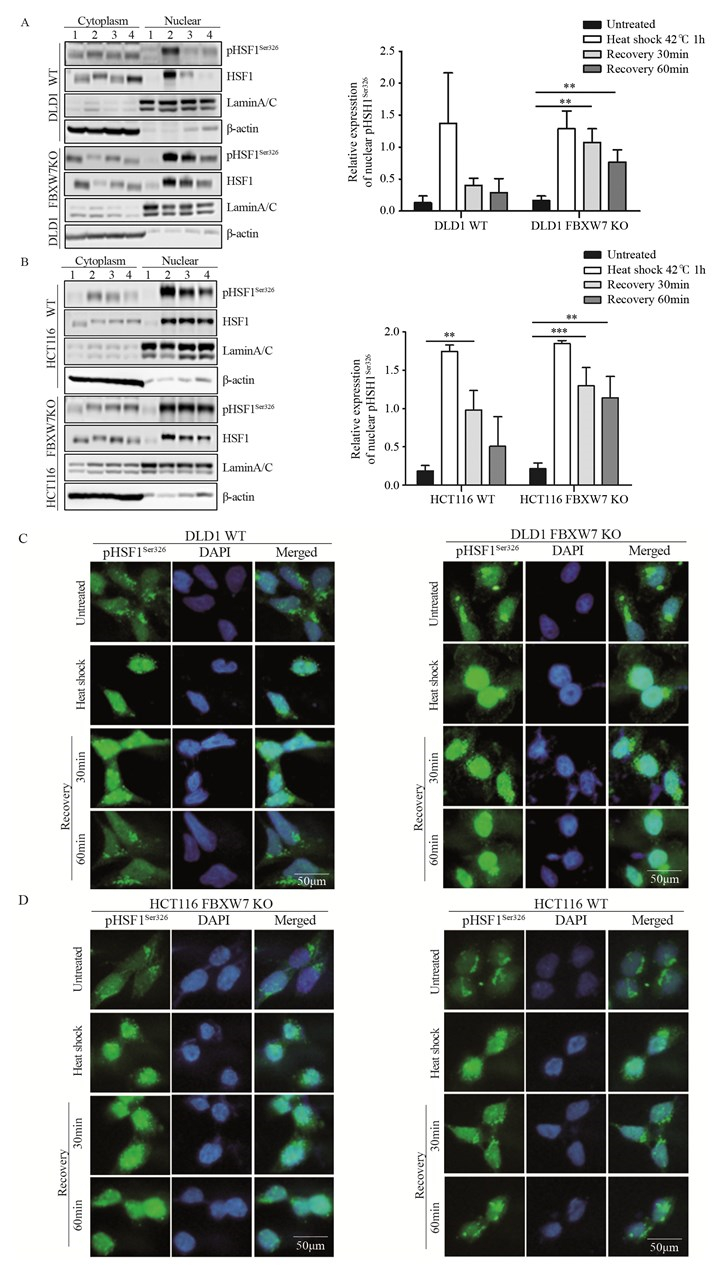
对结直肠癌细胞分别进行42℃温热刺激持续1 h,并在37℃恢复指定时间。Western blot结果显示,温热刺激后37℃恢复培养60 min组(Recovery 60 min组)和37℃培养对照组(Untreated组)的DLD1 WT细胞中的pHSF1Ser326蛋白表达水平差异无统计学意义(P=0.305),即恢复60 min后DLD1 WT细胞逐渐恢复至未刺激水平。与Untreated组相比,Recovery 60 min组的DLD1细胞的FBXW7 KO细胞核中pHSF1Ser326蛋白表达水平明显上调(P=0.007),HCT116细胞的FBXW7 KO细胞核中pHSF1Ser326蛋白表达水平也显著上调(P=0.002),见图 4A~B。细胞免疫荧光结果显示,温热刺激后FBXW7 KO细胞中的pHSF1Ser326在细胞核中表达均高于WT细胞,37℃培养60 min后,HCT116 WT和DLD1 WT细胞恢复至未刺激水平,FBXW7 KO细胞中的pHSF1Ser326在胞核中表达仍然很强,在胞质中表达较弱,见图 4C~D。以上结果表明,热激后HSF1表达水平恢复受阻可能与缺失FBXW7不能降解核HSF1有关,FBXW7可能调控激活及衰减期间的HSF1在胞质和胞核中的表达定位。
|
| A, B: the expression levels of pHSF1Ser326 protein in the nucleus were detected by Western blot; C, D: the expression of pHSF1Ser326 was detected using fluorescence microscopy(×400, staining with 4', 6-diamidino-2-phenylindole (DAPI) and Alexa Fluor 488, scale bar=50μm); **: P < 0.01, ***: P < 0.001, n=3; 1: Untreated; 2: Heat shock 42℃ 1h; 3: Recovery 30min; 4: Recovery 60min 图 4 FBXW7调控激活的HSF1在胞质和胞核中的表达定位 Figure 4 FBXW7 regulated the expression and the localization of activate HSF1 in cytoplasm and nucleus. |
热休克反应(heat shock response, HSR)是一种细胞保护机制,可防止由于温热刺激、缺氧、细胞内pH值波动或暴露于重金属等的刺激引起的蛋白质错误折叠。HSR由转录因子HSF1诱导热休克蛋白的动态转录过程。在未受刺激的细胞中,HSF1处于失活状态;当受到应激刺激时,HSF1在细胞核中被磷酸化,形成同源三聚体,结合DNA并激活热休克基因转录[1]。HSF1的激活和恢复期间受到多种翻译后修饰的调节,尤其是磷酸化对HSF1调控转录具有重要作用。Ser121、Ser303、Ser307以及Ser363磷酸化负调控HSF1的转录活性,而mTOR、MEK和P38 MAPK可以催化Ser326的磷酸化从而激活HSF1[13]。基质中磷酸化HSF1的激活与卵巢癌、慢性淋巴细胞性白血病和骨髓瘤患者的预后不良有关[14]。另有研究发现,细胞核中HSF1的表达水平增高与结直肠癌、乳腺癌、肾癌和口腔鳞状细胞癌的转移和不良的生存率有关[15]。因此,深入研究激活后的HSF1在细胞核中的表达水平及定位对肿瘤的治疗具有重要意义。
既往研究表明,FBXW7对HSF1的泛素化和降解与肿瘤细胞耐药有关[16]。在胃癌中,细胞核中的代谢酶PDK3以破坏HSF1磷酸化的方式阻止FBXW7介导的HSF1蛋白酶体降解,PDK3与HSF1相互作用形成正反馈回路以促进糖酵解[17]。近期有研究发现,ERK1/2在耐药细胞中可降低FBXW7的表达,并且通过抑制HSF1的泛素化降解导致MDR1的转录激活[18]。FBXW7参与HSF1靶向肠缺血再灌注期间的泛素化和降解,表明FBXW7可能是抑制肠缺血再灌注期间肠黏膜凋亡的潜在治疗靶标[19]。Nikos等[9]发现HSF1可以与FBXW7α结合,是FBXW7α的泛素化底物,通过Western blot实验发现缺失FBXW7的结直肠癌细胞HCT116在基础状态下,核HSF1蛋白的表达水平增高,胞质HSF1蛋白表达无变化;而温热刺激后的HSF1蛋白在核中表达水平显著增高,且热休克反应时间延长;他们还发现缺失FBXW7导致黑色素瘤细胞WM39的核HSF1表达水平明显升高,而对细胞质HSF1表达无影响,温热刺激后核HSF1蛋白表达水平增强,恢复期间缺失FBXW7的WM39细胞中的HSF1在核中累积[9]。HSF1在胞核中的累积是由于HSF1在胞质和胞核中的动态转移变化,还是温热刺激时FBXW7不调控HSF1的降解,导致HSF1在核中累积,还尚不清楚。
本研究采用细胞免疫荧光法对敲除FBXW7的结直肠癌细胞进行42℃温热刺激并观察HSF1的表达定位,此细胞免疫荧光HSF1的定位结果与文献[9]所报道的缺失FBXW7导致HSF1蛋白在核中累积的Western blot结果一致。为进一步探讨FBXW7是否调节激活的HSF1在胞核中的表达和定位,通过细胞免疫荧光实验发现,敲除FBXW7的细胞温热刺激并恢复37℃培养30 min后,pHSF1Ser326在胞核中的表达仍较强,表明缺失FBXW7导致细胞核中的HSF1降解受阻。有研究表明,HSF1基础表达主要在细胞核内[1]。研究发现,Western blot实验表明HSF1在胞质有较强的表达,而免疫荧光实验却显示HSF1主要定位在细胞核。这可能是由于分离细胞核和细胞质所用的裂解液造成的,大多数以单体形式存在的HSF1可能在裂解作用下从细胞核中提取出来,而三聚体的HSF1在提取过程中仍与细胞核DNA紧密结合[20]。
综上所述,本研究证实了FBXW7可调控HSF1及激活的磷酸化HSF1在胞质和胞核中的表达和定位。推测FBXW7可能成为结直肠癌治疗的潜在分子调控靶点。
作者贡献:
孙傲:实验设计与实施、文章撰写
焦寒:实验实施
付杰军:指导实验设计及实验评估、文章审校
| [1] |
Shen Y, Zou Y, Li J, et al. CDK5RAP3, a Novel Nucleoplasmic Shuttle, Deeply Regulates HSF1-Mediated Heat Stress Response and Protects Mammary Epithelial Cells from Heat Injury[J]. Int J Mol Sci, 2020, 21(21): E8400. DOI:10.3390/ijms21218400 |
| [2] |
Huang C, Wu J, Xu L, et al. Regulation of HSF1 protein stabilization: An updated review[J]. Eur J Pharmacol, 2018, 822: 69-77. DOI:10.1016/j.ejphar.2018.01.005 |
| [3] |
Chien-Hung Y, Marcia B, Christophe N. FBXW7: a critical tumor suppressor of human cancers[J]. Mol Cancer, 2018, 17(1): 115-134. DOI:10.1186/s12943-018-0857-2 |
| [4] |
Zhang Q, Mady ASA, Ma Y, et al. The WD40 domain of FBXW7 is a poly(ADP-ribose)-binding domain that mediates the early DNA damage response[J]. Nucleic Acids Res, 2019, 47(8): 4039-4053. DOI:10.1093/nar/gkz058 |
| [5] |
Li N, Babaei-jadidi R, Lorenzi F, et al. An FBXW7-ZEB2 axis links EMT and tumour microenvironment to promote colorectal cancer stem cells and chemoresistance[J]. Oncogenesis, 2019, 8(3): 13. DOI:10.1038/s41389-019-0125-3 |
| [6] |
Krittiya K, Van KM, Michael JO, et al. FBXW7 missense mutation: A novel negative prognostic factor in metastatic colorectal adenocarcinoma[J]. Oncotarget, 2017, 8(24): 39268-39279. DOI:10.18632/oncotarget.16848 |
| [7] |
Bethsebie LS, Kishore B, Sosmitha G, et al. FBXW7 in cancer: What has been unraveled thus far?[J]. Cancers, 2019, 11(2): 246. DOI:10.3390/cancers11020246 |
| [8] |
Kanae Y, Keiichi I N. Recent insight into the role of FBXW7 as a tumor suppressor[J]. Semin Cancer Biol, 2020, S1044-579X(20)30050-X.
|
| [9] |
Nikos K, Rana SM, Beatriz A, et al. FBXW7 modulates cellular stress response and metastatic potential through HSF1 post-translational modification[J]. Nat Cell Biol, 2015, 17(3): 322-332. DOI:10.1038/ncb3121 |
| [10] |
Wei W, Jin J, Schlisio S, et al. The v-Jun point mutation allows c-Jun to escape GSK3-dependent recognition and destruction by the Fbw7 ubiquitin ligase[J]. Cancer Cell, 2005, 8(1): 25-33. DOI:10.1016/j.ccr.2005.06.005 |
| [11] |
Inuzuka H, Shaik S, Onoyama I, et al. SCFFbw7 Regulates Cellular Apoptosis By Targeting Mcl-1 for Ubiquitination and Destruction[J]. Nature, 2011, 471(7336): 104-109. DOI:10.1038/nature09732 |
| [12] |
Rajagopalan H, Jallepalli PV, Rago C, et al. Inactivation of hCDC4 can cause chromosomal instability[J]. Nature, 2004, 428(6978): 77-81. DOI:10.1038/nature02313 |
| [13] |
Dai C. The heat-shock, or HSF1-mediated proteotoxic stress, response in cancer: from proteomic stability to oncogenesis[J]. Philos Trans R Soc Lond B Biol Sci, 2018, 373(1738): 20160525. DOI:10.1098/rstb.2016.0525 |
| [14] |
Dong B, Jaeger AM, Thiele DJ. Inhibiting Heat Shock Factor 1 in Cancer: A Unique Therapeutic Opportunity[J]. Trends Pharmacol Sci, 2019, 40(12): 986-1005. DOI:10.1016/j.tips.2019.10.008 |
| [15] |
Carpenter RL, Gökmen-Polar Y. HSF1 as a Cancer Biomarker and Therapeutic Target[J]. Curr Cancer Drug Targets, 2019, 19(7): 515-524. DOI:10.2174/1568009618666181018162117 |
| [16] |
Yun CW, Kim HJ, Lim JH, et al. Heat Shock Proteins: Agents of Cancer Development and Therapeutic T argets in Anti-Cancer Therapy[J]. Cells, 2019, 9(1): 60. DOI:10.3390/cells9010060 |
| [17] |
Xu J, Shi Q, Xu W, et al. Metabolic enzyme PDK3 forms a positive feedback loop with transcription factor HSF1 to drive chemoresistance[J]. Theranostics, 2019, 9(10): 2999-3013. DOI:10.7150/thno.31301 |
| [18] |
Gil-Im M, Eun C, Yeongmin L, et al. Decreased expression of FBXW7 by ERK1/2 activation in drug-resistant cancer cells confers transcriptional activation of MDR1 by suppression of ubiquitin degradation of HSF1[J]. Cell Death Dis, 2020, 11(5): 395. DOI:10.1038/s41419-020-2600-3 |
| [19] |
Tan W, Zhao H, Zhang F, et al. Inhibition of the ubiquitination of HSF1 by FBXW7 protects the intestine against ischemia-reperfusion injury[J]. Apoptosis, 2018, 23(11-12): 667-678. DOI:10.1007/s10495-018-1484-5 |
| [20] |
Agarwal S, Ganesh S. Perinuclear mitochondrial clustering, increased ROS levels, and HIF1 are required for the activation of HSF1 by heat stress[J]. J Cell Sci, 2020, 133(13): jcs245589. |
 2021, Vol. 48
2021, Vol. 48


