文章信息
- ALK融合基因阳性肺腺癌患者耐药核心基因鉴定及药物靶点分析
- Identification of Drug-resistance Core Genes and Drug Targets in Lung Adenocarcinoma Patients Harboring ALK Fusion Gene
- 肿瘤防治研究, 2021, 48(5): 451-456
- Cancer Research on Prevention and Treatment, 2021, 48(5): 451-456
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.20.1206
- 收稿日期: 2020-10-19
- 修回日期: 2021-02-09
2. 100853 北京,解放军总医院第一医学中心药剂科;
3. 100853 北京,解放军总医院第一医学中心肿瘤内科
2. Department of Pharmacy, The First Medical Center, Chinese PLA General Hospital, Beijing 100853, China;
3. Department of Oncology, The First Medical Center, Chinese PLA General Hospital, Beijing 100853, China
目前肺腺癌的治疗已经是基于基因分型的个体化治疗,间变性淋巴瘤激酶(anaplastic lymphoma kinase, ALK)融合基因阳性虽然比例低(1%~4%),但对于伴有ALK融合基因阳性肺腺癌患者,应用ALK抑制剂后生存期延长[1],所以ALK融合基因阳性被称为“钻石突变”,但转移灶进展或耐药问题是困扰ALK抑制剂应用的关键问题,相关探索及药物靶点的发现一直备受临床医师关注。
随着二代测序技术的发展,同一患者不同部位的基因表达谱的测序研究为进一步探索靶向药物的耐药提供了新的方法学支持,本研究利用GEO公共数据库二代测序的ALK阳性肺腺癌原始数据,分析并比较ALK阳性肺腺癌中原发灶和转移灶之间的基因表达谱及富集通路的差异,从而对理解肿瘤转移灶的异质性及其耐药机制具有重要意义,也将更好地回答转移灶靶向药物耐药问题。
1 材料与方法 1.1 肺腺癌基因表达谱数据集筛选在NCBI中检索ALK融合基因阳性的肺腺癌患者,选取GEO GSE125864进行研究,纳入ALK融合基因阳性的原发肿瘤及其转移病变为研究对象;同时下载该数据集的RNA表达谱矩阵进行后续研究,根据人类基因探针数据库,应用R语言进行基因探针与基因名称的转化,并对每个基因表达量进行标准对数化处理,以备后续研究;根据取材部位的不同,分为原发灶组和转移灶组。下载原始基因表达谱原始数据CSV文件进行后续研究。
1.2 差异基因分析应用R语言DEseq2软件包进行分析,参数设置log FoldChange=1, P < 0.05,筛选两组之间的差异表达基因,并利用R软件绘制热图及火山图。
1.3 GO功能注释及KEGG富集通路分析基于在线生物信息学在线数据库DAVID(https://david.ncifcrf.gov/),将两组之间显著差异表达基因纳入研究,进行基因本体论(Gene Ontology, GO)及京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes, KEGG)富集信号通路分析,观察两组在生物学行为及富集信号通路之间的差异。应用R软件Hmisc、ggplot2软件包绘制排名前10的GO及KEGG通路气泡图。
1.4 PPI网络及Cytoscape软件分析关键Hub基因对两组之间的差异表达基因进行蛋白-蛋白互作表达网络(PPI)研究,首先,采用String在线软件分析两组患者中差异基因的蛋白-蛋白互作网络;其次,将蛋白互作网络中的TSV文件在Cytoscape软件(3.7.1版本)中作进一步功能分析;剔除网络中的孤立节点,在原发灶中的差异基因表达显示为红色,而对转移灶中的差异基因显示为蓝色;最后,运用Cytoscape中的MCODE和Cytohubba软件,对这些蛋白-蛋白互作网络中进行重要模块及关键Hub基因分析。
1.5 关键核心基因与肺腺癌预后的关系通过GEPIA在线生存分析工具(广泛应用的肿瘤TCGA数据库的挖掘网站),对关键Hub基因进行预后研究分析并绘制生存曲线。P < 0.05为差异有统计学意义。
1.6 关键基因分子通路预测与药物靶点预测分析为进一步明确这些关键基因参与的分子通路及其与药物治疗靶点的关系,本研究应用GSCALite(http://bioinfo.life.hust.edu.cn/web/GSCALite/)及其癌症治疗反应门户(The Cancer Therapeutics Response Portal, CTRP)进行药物靶点预测分析,CTRP数据库是将癌症细胞系的遗传、细胞特征与小分子敏感度综合在一起进行分析,目的是发现与潜在靶点匹配药物的方法。
2 结果 2.1 两组患者差异基因表达谱分析结果显示,筛选出227个差异基因,以肺腺癌原发灶为对照组,转移灶中共发现134个上调基因,93个下调的差异基因,见图 1。
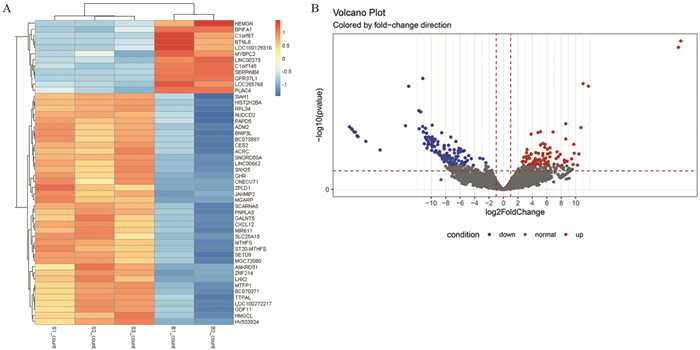
|
| A: heat map; B: volcanic plot. 图 1 原发灶和转移灶组患者显著差异基因表达谱比较 Figure 1 Comparison of differential genes expression profile between primary and metastatic sites |
GO功能注释结果显示,这些差异基因主要参与了异型生物质的代谢、类固醇代谢、细胞色素P450酶代谢等生物学过程,还参与了血液微粒、细胞外空间、外泌体等细胞组分以及氧气结合、铁离子结合、血红素结合等分子功能,见图 2A~C。
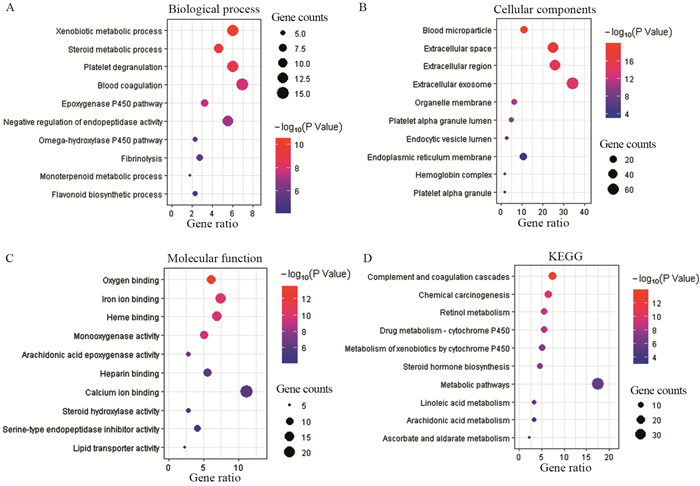
|
| A: GO analysis of DEGs in biological process; B: GO analysis of DEGs in cellular components; C: GO analysis of DEGs in terms of molecular function; D: KEGG enrichment analysis of DEGs. 图 2 气泡图展示差异表达基因排名前10的GO功能和KEGG通路分析 Figure 2 Bubble plots of top 10 GO terms and KEGG pathway enrichment of DEGs |
KEGG富集通路分析结果显示,这些差异表达基因主要参与了补体和凝血级联、化学致癌作用、视黄醇的新陈代谢等信号通路,见图 2D。
2.3 蛋白-蛋白互作网络及Hub基因分析通过对差异表达基因的蛋白-蛋白互作网络分析,构建的蛋白互作网络见图 3A,其中红色代表在原发灶中高表达,蓝色代表在转移灶组中高表达;为进一步分析蛋白互作网络中重要的功能区域,采用MCODE软件对蛋白-蛋白互作网络中的重要模型进行分析,选取最重要的两个模型进行展示,结果显示,这两个模块在蛋白-蛋白互作网络中具有重要的功能区域,见图 3B~C;为寻找蛋白-蛋白互作网络中关键的Hub基因,利用cytohubba软件,基于MNC算法,计算排名前10的重要的Hub基因:SERPINC1、TTR、NR1H4、FGA、FGG、APOB、HRG、APOA1、AHSG、FGB;对这些潜在重要的Hub基因进行后续研究,结果见图 3D。
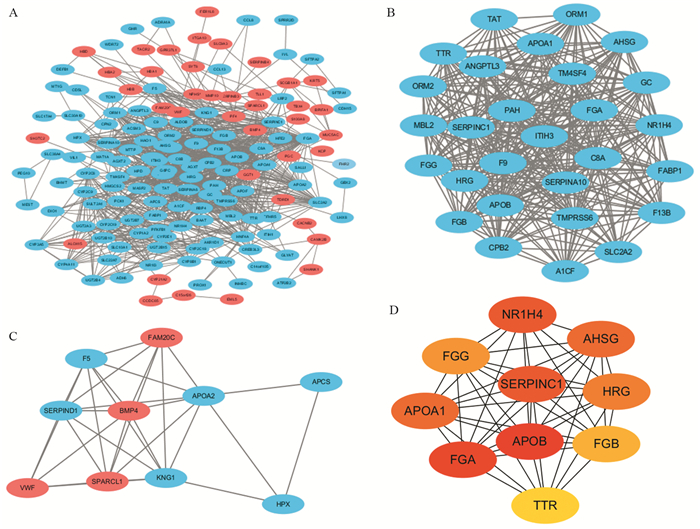
|
| A: the whole protein-protein interaction network of DEGs was constructed using Cytoscape; B, C: the protein-protein interaction network analysis of two core modules with important functions; D: top 10 hub genes were screened using the MNC algorithm. 图 3 构建蛋白-蛋白互作网络及Hub基因分析 Figure 3 Construction of protein-protein interaction networks and analysis of Hub genes |
结果显示,HRG、AHSG等高表达组的中位总生存时间明显短于低表达组,差异有统计学意义(P=0.018, P=0.015),而其他关键核心基因SERPINC1、TTR、NR1H4、FGA、FGG、APOB、APOA1、FGB与肺腺癌预后差异无统计学意义,见图 4。
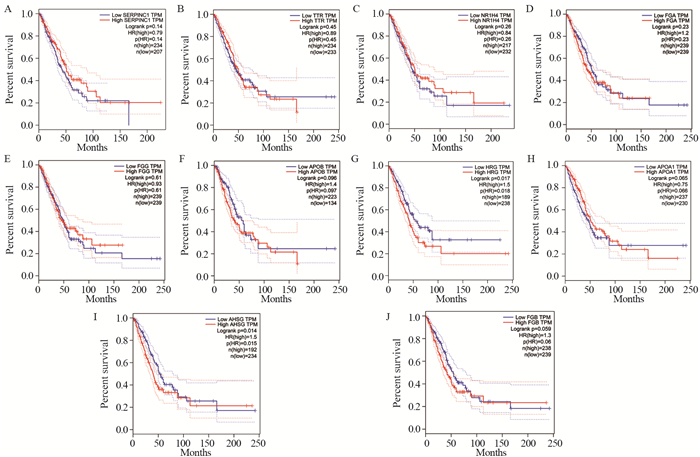
|
| A: SERPINC1; B: TTR; C: NR1H4; D: FGA; E: FGG; F: APOB; G: HRG; H: APOA1; I: AHSG; J: FGB. 图 4 Hub基因表达水平与肺腺癌的生存分析 Figure 4 Survival analysis of lung adenocarcinoma patients in relation to expression of hub genes |
结果显示,这些关键基因参与的信号通路有所不同,激活关键基因的通路,主要集中在DNA损伤修复反应、RAS/MAPK信号转导、RTK信号通路;而抑制这些关键基因后,主要是凋亡和细胞周期信号通路。在治疗药物靶点预测方面,SERPINC1、HRG、APOA1、FGA、FGG等与多种潜在小分子抑制剂具有一定相关性,见图 5。
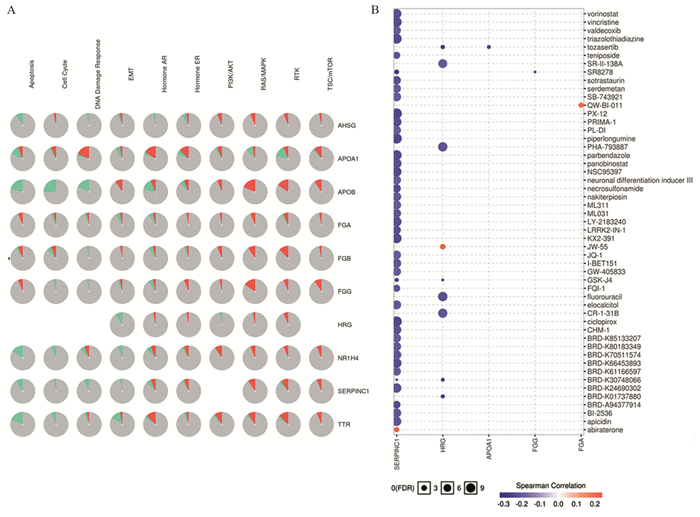
|
| 图 5 Hub基因参与通路富集(A)及潜在药物靶点(B)分析 Figure 5 Hub genes involved in pathways enrichment(A) and potential drug targets(B) |
目前肺腺癌的治疗是基于基因分析指导下个体化治疗时代,需要针对EGFR、ALK等不同的突变位点,针对性选择相应的靶向药物。然而靶向药物的耐药,尤其是转移灶出现进展或耐药问题仍是不可忽视的重要医学问题,一个很重要的原因在于肺腺癌是高度异质性的肿瘤[2-4],近年来研究发现,肿瘤的异质性中,时间-空间的异质性成为靶向耐药的新的重要机制。因此,针对肺腺癌患者进行时间-空间的异质性的研究具有重要意义,本课题正是基于此临床问题出发,探索ALK融合基因阳性的肺腺癌患者的空间异质性。这将有助于进一步明确应用ALK靶向药物后转移灶耐药的分子机制,从而可以更加精准化治疗肺腺癌患者。
本研究的重要结果之一在于,在肺腺癌ALK融合基因阳性这一亚型中,原发灶和转移灶组基因表达谱及富集通路之间存在差异,这些差异基因更多富集在代谢相关通路,而富集通路的差异或许可以解释临床中应用ALK融合抑制剂后出现原发灶和转移灶组反应不一致的情况。
本研究筛选了两个重要的模块区域和潜在的关键核心基因,提示这些功能模块和潜在的关键基因可能在ALK融合基因阳性的肺腺癌中具有重要的生物学意义,后续针对这些潜在关键基因进行深入研究,有望发现肺腺癌新的药物治疗靶点。
HRG(富含组氨酸糖蛋白)是一种蛋白编码基因。Chen等[5]分析在良性胰腺病变和恶性胰腺肿瘤中的差异表达,发现HRG参与了胰腺肿瘤的发生发展等恶性转换机制,Bogoevska等[6]在结肠癌研究中发现,HRG参与了Her2介导的肿瘤细胞迁移和侵袭等;其导致肿瘤恶性转移的可能机制在于,HRG-1在质膜上的表达增强了空泡-(H(+)) ATP酶的活性,参与了糖酵解通路,促进癌细胞的生长、迁移和侵袭[7]。而HRG与肺腺癌的研究未见报道,本研究结果显示,HRG不仅为肺腺癌预后不良的预测分子,而且也在一定程度上提示该基因可能在肺腺癌空间异质性恶性转化中扮演了重要的分子功能。
AHSG编码蛋白参与包括内吞作用、大脑发育和骨组织的形成,Niu等[8]研究发现,AHSG作为血清中肿瘤来源的外泌体生物标志物,检测血清外泌体中AHSG的表达水平,有助于早期筛查非小细胞肺癌患者。AHSG基因在肺癌恶性转化及耐药等机制方面亦未见报道,本研究提示其不仅参与了ALK融合基因阳性肺腺癌异质性等恶性转化过程,且该基因为肺腺癌预后不良的标志物之一,有待进一步对该基因进行功能研究,以揭示其参与肺腺癌时空异质性恶性转化的具体机制。
在关键基因靶点与其匹配的药物治疗分析方面,筛选出了5个潜在的药物治疗靶点,而且与目前已有的一些小分子药物具有一定的相关性,提示,针对这些潜在的药物治疗靶点深入研究,有望研发新的靶向药物,从而对更加精准化地治疗肺腺癌ALK阳性患者具有重要意义。
本研究在一定程度上揭示了ALK融合基因阳性肺腺癌患者在空间异质性的潜在机制,对探索ALK融合基因阳性肺腺癌患者靶向治疗的耐药新机制有重要意义。
作者贡献:
祁春艳:课题思路设计、数据分析及文章撰写
吴涛:数据筛选和分析
齐晓光:文章思路设计、审阅文章数据及校对工作
| [1] |
Woo CG, Seo S, Kim SW, et al. Differential protein stability and clinical responses of EML4-ALK fusion variants to various ALK inhibitors in advanced ALK-rearranged non-small cell lung cancer[J]. Ann Oncol, 2017, 28(4): 791-797. DOI:10.1093/annonc/mdw693 |
| [2] |
Cancer Genome Atlas Research Network. Comprehensive molecular profiling of lung adenocarcinoma[J]. Nature, 2014, 511(7511): 543-550. DOI:10.1038/nature13385 |
| [3] |
Neumann MP, González MV, Pitiot AS, et al. TP53 p.R72P genotype is a marker of poor prognosis in lung cancer[J]. Cancer Biomark, 2018, 21(4): 747-754. DOI:10.3233/CBM-170230 |
| [4] |
Kuroda H, Yoshida T, Arimura T, et al. Contribution of smoking habit to the prognosis of stage I KRAS-mutated non-small cell lung cancer[J]. Cancer Biomark, 2018, 23(3): 419-426. DOI:10.3233/CBM-181483 |
| [5] |
Chen XL, Xie KX, Yang ZL, et al. Expression of FXR and HRG and their clinicopathological significance in benign and malignant pancreatic lesions[J]. Int J Clin ExpPathol, 2019, 12(6): 2111-2120. |
| [6] |
Bogoevska V, Wolters-Eisfeld G, Hofmann BT, et al. HRG/HER2/HER3 signaling promotes AhR-mediated Memo-1 expression and migration in colorectal cancer[J]. Oncogene, 2017, 36(17): 2394-2404. DOI:10.1038/onc.2016.390 |
| [7] |
Fogarty FM, O'Keeffe J, Zhadanov A, et al. HRG-1 enhances cancer cell invasive potential and couples glucose metabolism to cytosolic/extracellular pH gradient regulation by the vacuolar-H+ ATPase[J]. Oncogene, 2014, 33(38): 4653-4663. DOI:10.1038/onc.2013.403 |
| [8] |
Niu L, Song X, Wang N, et al. Tumor-derived exosomal proteins as diagnostic biomarkers in non-small cell lung cancer[J]. Cancer Sci, 2019, 110(1): 433-442. DOI:10.1111/cas.13862 |
 2021, Vol. 48
2021, Vol. 48


