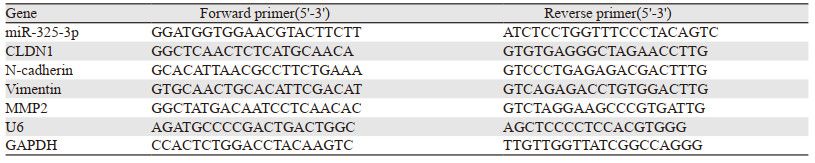
文章信息
- miR-325-3p靶向CLDN1基因调控胃癌上皮间质转化和侵袭转移
- miR-325-3p Regulates Epithelial-mesenchymal Transition, Invasion and Metastasis of Gastric Cancer via Targeting CLDN1 Gene
- 肿瘤防治研究, 2021, 48(7): 686-693
- Cancer Research on Prevention and Treatment, 2021, 48(7): 686-693
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.20.1200
- 收稿日期: 2020-10-15
- 修回日期: 2021-03-21
作为起源于胃黏膜上皮的恶性肿瘤,胃癌发病率在我国多种恶性肿瘤发病率中位居前三。受早期症状不明显的影响,多数患者在就诊时已处于晚期[1]。MicroRNA(miRNA)是一类长度约为20~25个核苷酸的内生的非编码RNA,被证实在人类多种癌症中表达失调并且发挥促进或抑制癌症进展的作用[2]。有研究表明miR-325-3p在非小细胞肺癌中发挥抑癌因子的作用,能够抑制非小细胞肺癌细胞的增殖和侵袭[3]。另外也有研究发现miR-325过表达能够改善膀胱癌的化疗耐药[4]。Sun等在关于miR-325-3p和胃癌的研究时发现miR-325-5p在胃癌中表达下调并且能够调节胃癌细胞的耐药[5]。紧密连接蛋白1(claudin 1, CLDN1)为紧密连接蛋白家族的一员,在结构上为跨细胞膜蛋白,在不同组织和细胞中存在差异性表达[6]。据国内外研究发现,CLDN1与肺癌、乳腺癌等多种肿瘤的发生存在关联[7-8]。Eftang等[9]发现CLDN1表达增高与胃癌患者生存率降低有关。此外,CLDN1被证实在胃癌组织肿瘤相关成纤维细胞中表达上调[10]。
本研究从影响胃癌进展的生物学网络角度出发,探究miR-325-3p/CLDN1在胃癌细胞增殖、凋亡和上皮间质转化(epithelial-mesenchymal transition, EMT)中的作用机制,以期为胃癌的诊断和治疗提供新的分子靶点。
1 材料与方法 1.1 材料与仪器人胃黏膜上皮细胞株GES-1以及人胃癌细胞株HGC27、SGC-7901、MKN-45和MGC-803购自中科院上海细胞库;TRIzol试剂盒购自美国Invitrogen公司;反转录试剂盒、SYBR®Premix Ex TaqTMⅡ试剂盒均购自日本TaKaRa公司,Western blot实验中抗体均购自英国ABCAM公司;pcDNA3.1(+)质粒购自美国Addgene公司;PGL3基本载体购自美国Promega公司;高糖DMEM培养基及RPMI1640培养基均购自北京索莱宝科技有限公司;Transwell试剂盒购自上海研卉生物科技有限公司;荧光素酶试剂盒购自美国BioVision公司;Lipofectamine2000试剂盒、CCK-8试剂盒、Annexin-V-FITC/PI细胞凋亡检测试剂盒及流式细胞仪均购自美国赛默飞世尔科技有限公司;细胞裂解液、BCA试剂盒购自北京奥维亚生物技术有限公司;HBS-1096A酶标仪购自南京德铁实验设备有限公司。
1.2 方法 1.2.1 细胞分组和转染将人胃黏膜细胞株GES-1以及人胃癌细胞株HGC27、SGC-7901、MKN-45和MGC-803培养于RPMI 1640培养基中。qRT-PCR检测miR-325-3p和CLDN1的表达,选取与miR-325-3p/CLDN1相关性最强的细胞株用于后续分组。取对数生长期的细胞以5×105个/毫升的浓度接种于6孔板中培养并分组:mimics NC组(转染miRNA mimic阴性对照)、mimics miR-325-3p组(转染miR-325-3p模拟物)、inhibitors NC组(转染miRNA inhibitor阴性对照)、inhibitors miR-325-3p组(转染miR-325-3p inhibitor)、pcDNA组(转染空载质粒)、pcDNA-CLDN1组(转染CLDN1过表达质粒)、miR-325-3p+pcDNA组(转染miR-325-3p mimic和空载质粒)和miR-325-3p+pcDNA-CLDN1组(转染miR-325-3p mimic和CLDN1过表达质粒)。转染步骤依据Lipofectamine 2000(Invitrogen)试剂盒说明书进行。
1.2.2 双荧光素酶验证miR-325-3p与CLDN1的靶向关系运用TargetScan靶向关系预测网站(http://www.targetscan.org/mamm_31/)预测miR-325-3p与CLDN1的结合位点。将含有miR-325-3p结合位点的CLDN1野生型(WT)序列或根据WT序列设计的突变体(MUT)序列扩增后导入PGL3基本载体,命名为CLDN1-3’UTR-WT或CLDN1-3’UTR-MUT。然后将正确测序的融合质粒与NC或miR-325-3p共转染到胃癌细胞。双荧光素酶报告实验验证miR-325-3p和CLDN1的靶向关系,实验步骤依据试剂盒说明书进行。借助化学发光检测仪检测细胞荧光素酶活性。
1.2.3 qRT-PCR检测mRNA表达按TRIzol试剂盒说明书提取胃癌细胞中总RNA。DEPC处理的超纯水溶解RNA,测定吸光度值鉴定RNA质量和浓度后使用反转录试剂盒完成反转录反应并合成cDNA,使用SYBR®Premix Ex TaqTM Ⅱ试剂盒进行荧光定量PCR,反应条件和体系均依据试剂盒说明书进行操作。所有序列由上海吉玛基因公司设计并合成,miR-325-3p以U6为内参,CLDN1以GAPDH为内参。2-ΔΔCt法测定目的因子mRNA的表达量。
各组细胞中加入1 ml细胞裂解液,冰上裂解10 min后提取总蛋白,12 000 r/min离心10 min,取上清液并借助BCA试剂盒对蛋白浓度进行测定。加入上样缓冲液100℃煮沸5 min变性,取30 μg蛋白样品上样, SDS-PAGE凝胶电泳后湿式转膜1 h。5%脱脂奶粉室温封闭1.5 h,加入一抗CLDN1、N-cadherin、Vimentin和MMP-2,4℃摇床孵育过夜,二抗采用山羊抗兔IgG,室温孵育2 h。用ECL显色液曝光,ImageJ软件对电泳条带进行灰度分析。
1.2.5 CCK-8测定细胞增殖活力细胞以3×105个每孔铺于96孔板。分别在24、48和72 h时加入10 μl CCK-8试剂,37℃继续孵育2 h,于450 nm处测量吸光度。
1.2.6 Transwell实验检测细胞侵袭借助预冷的无血清DMEM培养基以1:10稀释Matrigel胶,吸取100 μl充分混匀的Matrigel胶加入上室,37℃孵育Transwell小室4 h。将各组转染后的细胞消化后使用无血清培养基重悬,计数并稀释至5×105个/毫升后将200 μl细胞加入Transwell上室,下室加入600 μl含10%血清的DMEM培养基。依据Transwell小室说明书行结晶紫染色,光镜下随机选取三个视野并计数跨膜的细胞数。
1.2.7 Annexin V-FITC/PI双染法检测细胞凋亡PBS洗涤细胞,以2 000 r/min离心5 min,加入500 µl结合缓冲液,调整细胞密度为3×105个/毫升,加入5 µl Annexin V-FITC并混匀,避光室温温育10 min。加入5 µl PI并混匀,于5 min内上流式细胞仪进行检测。激发波长为480和530 nm检测FITC,大于575 nm检测PI。流式细胞仪显示右上象限代表晚期凋亡细胞,右下象限为早期凋亡细胞,细胞凋亡率=早期凋亡率+晚期凋亡率。
1.3 统计学方法采用SPSS21.0统计软件分析数据。计量资料以平均值±标准差表示,符合正态分布和方差齐性的组内比较采用配对t检验,组间采用非配对t检验,多组间比较采用单因素方差分析,组内两两比较使用post-hoc检验,不符合正态分布和方差齐性的数据采用秩和检验。P < 0.05为差异有统计学意义。
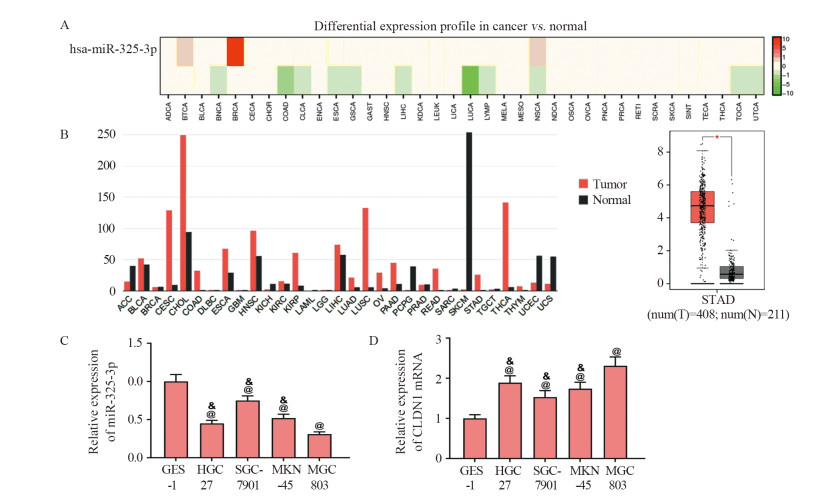
2 结果 2.1 MGC-803细胞中miR-325-3p表达下降而CLDN1表达增强使用dbDEMC2.0(https://www.picb.ac.cn/dbDEMC/index.html)和GEPIA(http://gepia.cancer-pku.cn/detail.php)生物信息学预测网站查找miR-325-3p和CLDN1,结果发现miR-325-3p在胃癌组织中的表达较正常组织降低,CLDN1在胃癌组织中的表达是正常组织的50倍。qRT-PCR检测结果发现,相较于GES-1细胞,HGC27、SGC-7901、MKN-45和MGC803细胞中miR-325-3p表达被抑制而CLDN1表达增高(均P < 0.05),且MGC-803细胞的miR-325-3p表达最低,CLDN1表达最高,因此选择MGC-803细胞用于后续实验,见图 1。
|
| A: miR-325-3p expression in gastric cancer tissues was predicted by dbDEMC2.0 website; B: CLDN1 expression in gastric cancer was predicted by GEPIA website (left: CLDN1 expression in different cancer types; right: CLDN1 expression in GC tissue and normal tissue); C: miR-325-3p expression in different cell lines was detected by qRT-PCR; D: mRNA expression of CLDN1 in different cell lines was detected by qRT-PCR. @: P < 0.05, compared with GES-1 cells; & : P < 0.05, compared with MGC-803 cells. 图 1 不同癌组织和细胞中miR-325-3p和CLDN1的表达 Figure 1 Expression of miR-325-3p and CLDN1 in different cancer tissues and cell lines |
TargetScan靶向关系预测网站表明miR-325-3p与CLDN1存在特异结合位点,见图 2A,推断CLDN1可能是miR-325-3p的靶基因。双荧光素酶报告实验进一步证实,与NC组相比,miR-325-3p显著抑制CLDN1-3’UTR-WT的荧光素酶活性(1±0.12 vs. 0.41±0.05, P=0.0014),而CLDN1-3’UTR-MUT荧光素酶活性变化则不明显(P > 0.05),见图 2B。qRT-PCR检测结果显示,相对于mimics NC组,过表达miR-325-3p能够显著抑制CLDN1的mRNA表达(P < 0.05),见图 2C,而inhibitors miR-325-3p组CLDN1的mRNA表达显著增强(P < 0.05),见图 2D。

|
| A: There were binding sites between miR-325-3p and CLDN1 predicted by TargetScan website; B: Results of dual luciferase reporter assay; C: CLDN1 mRNA expression in the cells transfected with mimics NC and mimics miR-325-3p; D: CLDN1 mRNA expression in the cells transfected with inhibitors NC and inhibitors miR-325-3p. 图 2 miR-325-3p与CLDN1的靶向关系验证 Figure 2 Validation of targeting relation between miR-325-3p and CLDN1 |
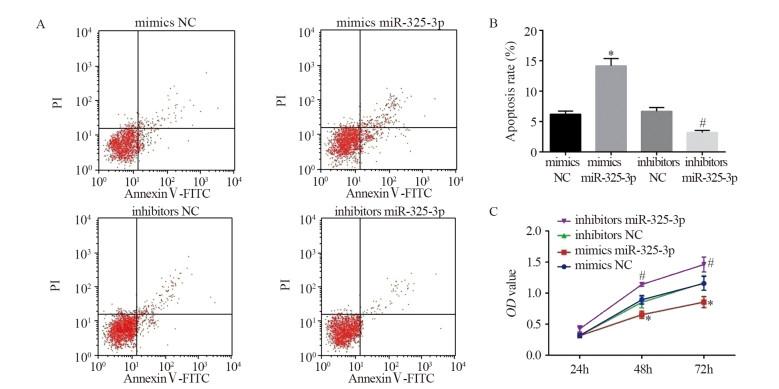
结果显示,相较于mimics NC组,mimics miR-325-3p组细胞凋亡率显著上升(6.21±0.51 vs. 14.17±1.21, P=0.0005)。而相较于inhibitors NC组,inhibitors miR-325-3p组细胞凋亡率显著降低(6.69±0.62 vs. 3.21±0.33, P=0.0010),见图 3A~B。与mimics NC组在48和72 h时的细胞活力相比,mimics miR-325-3p组细胞增殖活力显著降低(48 h: 0.89±0.07 vs. 0.65±0.06, P=0.0107; 72 h: 1.13±0.11 vs. 0.86±0.09, P=0.0302)。而相较于inhibitors NC组,inhibitors miR-325-3p组细胞增殖活力显著增强(0.85±0.09 vs. 1.14±0.13, P=0.0336; 72 h: 1.12±0.11 vs. 1.48±0.13, P=0.0216),见图 3C。
|
| *: P < 0.05, compared with mimics NC group; #: P < 0.05, compared with inhibitors NC group. 图 3 过表达miR-325-3p后各组细胞凋亡(A, B)和增殖(C)能力检测结果 Figure 3 Cell apoptosis(A, B) and proliferation(C) of each group after miR-325-3p was overexpressed |
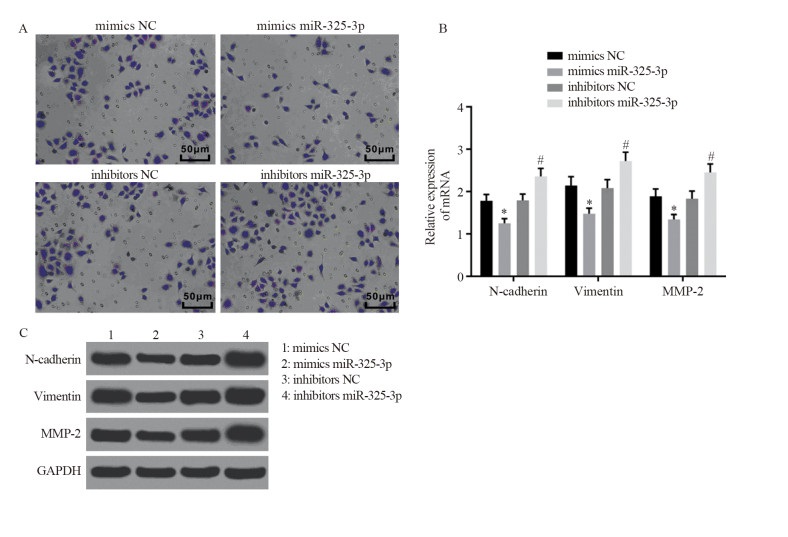
结果显示,与mimics NC组比较,mimics miR-325-3p组细胞侵袭数目显著减少(112±8 vs. 67±6, P=0.0015),EMT相关因子的mRNA(N-cadherin: 1.78±0.15 vs. 1.25±0.11, P=0.0078; Vimentin: 2.14±0.21 vs. 1.48±0.13, P=0.0098; MMP-2: 1.89±0.17 vs. 1.34±0.12, P=0.0102)和蛋白表达(N-cadherin: 1.25±0.10 vs. 0.83±0.07, P=0.0040; Vimentin: 1.51±0.12 vs. 1.03±0.10, P=0.0060; MMP-2: 1.37±0.11 vs. 0.94±0.08, P=0.0054)被抑制。相对于inhibitors NC组,inhibitors miR-325-3p组细胞侵袭数目增多(106±7 vs. 182±13, P=0.0009),EMT相关因子的mRNA(N-cadherin: 1.79±0.15 vs. 2.36±0.19, P=0.0151; Vimentin: 2.08±0.20 vs. 2.72±0.21, P=0.0187; MMP-2: 1.83±0.18 vs. 2.45±0.20, P=0.0163)和蛋白表达(N-cadherin: 1.28±0.12 vs. 1.64±0.13, P=0.0244; Vimentin: 1.56±0.11 vs. 1.88±0.14, P=0.0358; MMP-2: 1.35±0.14 vs. 1.72±0.13, P=0.0285)增强,见图 4。
|
| *: P < 0.05, compared with mimics NC group; #: P < 0.05, compared with inhibitors NC group. 图 4 过表达miR-325-3p后各组细胞侵袭能力(A)和EMT相关因子mRNA(B)及蛋白(C)的表达 Figure 4 Cell invasion(A) and EMT-related factors mRNA(B) and protein(C) expression in each group after miR-325-3p was overexpressed |
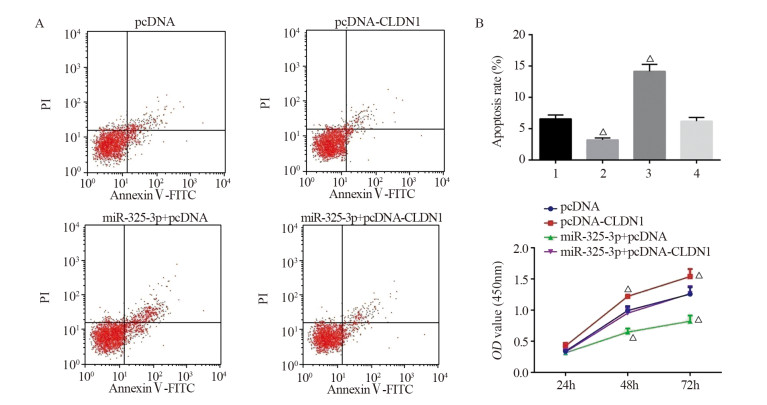
结果显示,相较于pcDNA组,pcDNA-CLDN1组细胞凋亡被抑制(6.58±0.62 vs. 3.22±0.31, P=0.0011),48和72 h细胞增殖活力(48 h: 0.99±0.07 vs. 1.22±0.061, P=0.0124; 72 h: 1.26±0.11 vs. 1.54±0.12, P=0.0408)增强;而miR-325-3p+pcDNA组细胞凋亡增多(6.58±0.62 vs. 14.26±1.12, P=0.0005),48和72 h细胞增殖活力(48 h: 0.64±0.05 vs. 0.95±0.09, P=0.0064; 72 h: 0.82±0.09 vs. 1.26±0.12, P=0.0071)被抑制。此外,miR-325-3p+pcDNA-CLDN1组与pcDNA组各指标差异不显著(P > 0.05),表明CLDN1过表达能够逆转miR-325-3p对胃癌细胞增殖和凋亡的影响,见图 5。
|
| △: P < 0.05, compared with pcDNA group; 1: pcDNA; 2: pcDNA-CLDN1; 3: miR-325-3p+pcDNA; 4: miR-325-3p+pcDNA-CLDN1. 图 5 过表达CLDN1后各组细胞增殖(A, B)和凋亡(C)能力检测结果 Figure 5 Cell proliferation(A, B) and apoptosis(C) of each group after CLDN1 was overexpressed |
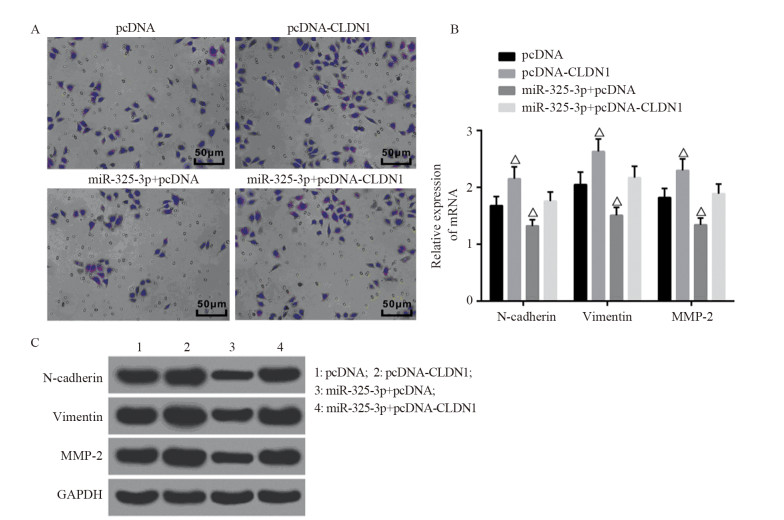
结果显示,与pcDNA组比较,pcDNA-CLDN1组细胞侵袭数目增多(114±10 vs. 174±15, P=0.0045),上皮间质转化相关因子的mRNA(N-cadherin: 1.68±0.16 vs. 2.15±0.21, P=0.0368; Vimentin: 2.05±0.21 vs. 2.63±0.24, P=0.0345; MMP-2: 1.81±0.16 vs. 2.30±0.21, P=0.0324)和蛋白表达(N-cadherin: 1.19±0.10 vs. 1.60±0.14, P=0.0145; Vimentin: 1.47±0.13 vs. 1.89±0.16, P=0.0243; MMP-2: 1.30±0.11 vs. 1.71±0.15, P=0.0188)增强;而miR-325-3p+pcDNA组细胞侵袭数目减少(114±10 vs. 59±5, P=0.0010)且上皮间质转化相关因子的mRNA(N-cadherin: 1.68±0.16 vs. 1.32±0.11, P=0.0325; Vimentin: 2.05±0.21 vs. 1.51±0.14, P=0.0207; MMP-2: 1.81±0.16 vs. 1.34±0.12, P=0.0152)和蛋白表达(N-cadherin: 1.19±0.10 vs. 0.80±0.07, P=0.0052; Vimentin: 1.47±0.13 vs. 1.03±0.09, P=0.0085; MMP-2: 1.30±0.11 vs. 0.92±0.08, P=0.0084)被抑制。miR-325-3p+pcDNA-CLDN1组(123±12)与pcDNA组差异无统计学意义(P > 0.05),提示CLDN1能够逆转miR-325-3p对胃癌细胞侵袭和上皮间质转化的影响,见图 6。
|
| △: P < 0.05, compared with pcDNA group. 图 6 过表达CLDN1后各组细胞侵袭能力(A)和EMT相关因子mRNA(B)及蛋白(C)的表达 Figure 6 Cell invasion(A) and EMT-related factors mRNA(B) and protein(C) expression in each group after CLDN1 was overexpressed |
本研究通过探讨miR-325-3p在胃癌中的作用机制发现,miR-325-3p在胃癌组织中表达被抑制,同时能够靶向CLDN1影响胃癌细胞的增长、凋亡和上皮间质转化。
CLDN1被认为是维持细胞间紧密连接结构的重要因子,有研究证实其与食管鳞癌、乳腺癌的侵袭转移有关[11-12]。目前有研究认为CLDN1的异常表达影响恶性肿瘤的侵袭性行为的具体机制在于其表达失调会破坏细胞的紧密连接结构,加速细胞间松散程度,促进了癌细胞的侵袭[13]。miRNA是自身并不编码蛋白质的非编码RNA分子,主要通过结合转录后mRNA,抑制其翻译或降解RNA进而对基因的表达进行调控[14]。在关于CLDN1与胃癌的研究中发现,CLDN1高表达预示患者较短的生存期[9]。表明CLDN1的表达与胃癌的恶性程度成正相关,因此我们选择CLDN1表达最高的细胞系MGC-803用于后续实验,而MGC803细胞中miR-325-3p在几株胃癌细胞中表达被抑制最明显,miR-325-3p与CLDN1的靶向关系也被验证。
在检测miR-325-3p/CLDN1调控胃癌细胞生物学行为时,我们首先对胃癌细胞中miR-325-3p的表达进行了干预,结果显示,与mimics NC组相比,过表达miR-325-3p能够诱导胃癌细胞凋亡并且抑制其增殖和侵袭,抑制miR-325-3p表达效果则相反。上皮间质转化是细胞失去细胞间黏附以及极性等上皮表型特征并且转化为高侵袭性、高迁移性的间质细胞的过程[15]。有研究证实上皮间质转化在多种癌症的侵袭转移中扮演重要角色[16-17]。此外,细胞外基质的降解是引起肿瘤浸润转移的重要原因,而MMP家族被认为是促进细胞外基质降解的重要因子[18]。在关于胰腺癌、乳腺癌、胃癌等的研究中发现,MMP-2在癌组织中的表达显著增强,且其高表达与肿瘤的恶性程度相关,能够加速癌细胞的侵袭和转移[19-21]。本研究在探究miR-325-3p的作用时发现,过表达miR-325-3p能够抑制N-cadherin、Vimentin和MMP-2的表达,即miR-325-3p对胃癌细胞恶性生物学行为的影响可能是通过调节上皮间质转化相关因子和侵袭转移相关因子实现的。为进一步研究miR-325-3p和CLDN1在胃癌调控中的关联,我们将miR-325-3p和CLDN1共转染胃癌细胞,结果发现,miR-325-3p对胃癌细胞增殖、凋亡以及侵袭的调控作用被CLDN1逆转,即miR-325-3p对胃癌细胞生物学特性的影响是通过靶向CLDN1实现的。
综上所述,miR-325-3p能够靶向抑制CLDN1基因进而调控胃癌细胞的生物学行为,过表达miR-325-3p能够诱导胃癌细胞凋亡,抑制细胞增殖、侵袭和上皮间质转化,有望成为胃癌治疗的潜在靶点。但是对于miR-325-3p调节胃癌上皮间质转化是否通过特定信号通路或转录因子实现,本研究未做过多探讨,这也是今后研究需关注的重点。
作者贡献:
杜记涛:实验方案设计、文章撰写和修改
曹建、赵稳:实验实施、数据统计
万相斌:文章撰写、数据核查
李智:实验方案设计、文章审核和修改
| [1] |
Zou J, Qin W, Yang L, et al. Genetic alterations and expression characteristics of ARID1A impact tumor immune contexture and survival in early-onset gastric cancer[J]. Am J Cancer Res, 2020, 10(11): 3947-3972. |
| [2] |
Zhang TQ, Zhang KP, Ji KY, et al. microRNA-365 inhibits YAP through TLR4-mediated IRF3 phosphorylation and thereby alleviates gastric precancerous lesions[J]. Cancer Cell Int, 2020, 20(1): 549. DOI:10.1186/s12935-020-01578-0 |
| [3] |
Yao SH, Zhao TJ, Jin H. Expression of MicroRNA-325-3p and its potential functions by targeting HMGB1 in non-small cell lung cancer[J]. Biomed Pharmacother, 2015, 70: 72-79. DOI:10.1016/j.biopha.2015.01.013 |
| [4] |
Li R, Zheng JZ, Huang X. Suppression of HAX-1 induced by miR-325 resensitizes bladder cancer cells to cisplatin-induced apoptosis[J]. Eur Rev Med Pharmacol Sci, 2020, 24(18): 9303-9314. |
| [5] |
Sun TH, Li K, Zhu K, et al. SNHG6 Interacted with miR-325-3p to Regulate Cisplatin Resistance of Gastric Cancer by Targeting GITR[J]. Onco Targets Ther, 2020, 13: 12181-12193. DOI:10.2147/OTT.S262896 |
| [6] |
Akizuki R, Maruhashi R, Eguchi H, et al. Decrease in paracellular permeability and chemosensitivity to doxorubicin by claudin-1 in spheroid culture models of human lung adenocarcinoma A549 cells[J]. Biochim Biophys Acta Mol Cell Res, 2018, 1865(5): 769-780. DOI:10.1016/j.bbamcr.2018.03.001 |
| [7] |
Wu JE, Wu YY, Tung CH, et al. DNA methylation maintains the CLDN1-EPHB6-SLUG axis to enhance chemotherapeutic efficacy and inhibit lung cancer progression[J]. Theranostics, 2020, 10(19): 8903-8923. DOI:10.7150/thno.45785 |
| [8] |
Ríos-Romero M, Cedro-Tanda A, Peña-Luna M, et al. FAM83H-AS1 is a potential modulator of cancer driver genes across different tumors and a prognostic marker for ER/PR + BRCA patients[J]. Sci Rep, 2020, 10(1): 14145. DOI:10.1038/s41598-020-71062-2 |
| [9] |
Eftang LL, Esbensen Y, Tannæs TM, et al. Up-regulation of CLDN1 in gastric cancer is correlated with reduced survival[J]. BMC Cancer, 2013, 13: 586. DOI:10.1186/1471-2407-13-586 |
| [10] |
陈学书, 袁航, 龙妮娅, 等. 胃癌组织中肿瘤相关成纤维细胞与正常成纤维细胞之间转录组学研究及验证[J]. 中国生物化学与分子生物学报, 2018, 34(4): 427-433. [Chen XS, Yuan H, Long NY, et al. Transcriptomics study for differentially expressed genes between CAFs and NFs in gastric cancer[J]. Zhongguo Sheng Wu Hua Xue Yu Fen Zi Sheng Wu Xue Bao, 2018, 34(4): 427-433.] |
| [11] |
张大伟, 吴剑, 任德莲, 等. CLDN1在食管鳞癌中的表达及其分布异常在食管癌发生中的作用[J]. 四川大学学报(医学版), 2017, 48(6): 850-856. [Zhang DW, Wu J, Ren DL, et al. Expression of CLDN1 and Its Nuclear Distribution in Esophageal Squamous Carcinoma[J]. Sichuan Da Xue Xue Bao(Yi Xue Ban), 2017, 48(6): 850-856.] |
| [12] |
Blanchard AA, Zelinski T, Xie J, et al. Identification of Claudin 1 Transcript Variants in Human Invasive Breast Cancer[J]. PLoS One, 2016, 11(9): e0163387. DOI:10.1371/journal.pone.0163387 |
| [13] |
Dey S, Liu S, Factora TD, et al. Global targetome analysis reveals critical role of miR-29a in pancreatic stellate cell mediated regulation of PDAC tumor microenvironment[J]. BMC Cancer, 2020, 20(1): 651. DOI:10.1186/s12885-020-07135-2 |
| [14] |
高红艳, 郭洁, 吴方雄, 等. miRNA-451通过MRP靶向调控胃癌细胞对5-Fu耐药性的机制研究[J]. 肿瘤防治研究, 2019, 46(12): 1073-1077. [Gao HY, Guo J, Wu FX, et al. Mechanism of miRNA-451 Regulating Resistance of Gastric Cancer Cells to 5-Fu Through MRP[J]. Zhong Liu Fang Zhi Yan Jiu, 2019, 46(12): 1073-1077. DOI:10.3971/j.issn.1000-8578.2019.19.0618] |
| [15] |
骆晓琴, 何娴, 刘星. 长链非编码RNA MALAT1对鼻咽癌转移和上皮间质转化的影响[J]. 中国临床药理学杂志, 2020, 36(11): 1524-1527. [Luo XQ, He X, Liu X. Effects of long non-coding RNA MALAT1 on metastasis and epithelial mesenchymal transformation of nasopharyngeal carcinoma[J]. Zhongguo Lin Chuang Yao Li Xue Za Zhi, 2020, 36(11): 1524-1527.] |
| [16] |
歧红阳, 王云溪, 肖占宇, 等. hsa-miR-448过表达下调HIF-1α对结肠癌细胞SW480作用及机制研究[J]. 中国免疫学杂志, 2019, 35(19): 2350-2356. [Qi HY, Wang YX, Xiao ZY, et al. Effect and mechanism of overexpression of hsa-miR-448 by down-regulating HIF-1α on colon cancer cell line SW480[J]. Zhongguo Mian Yi Xue Za Zhi, 2019, 35(19): 2350-2356. DOI:10.3969/j.issn.1000-484X.2019.19.009] |
| [17] |
Yi Y, Zeng S, Wang Z, et al. Cancer-associated fibroblasts promote epithelial-mesenchymal transition and EGFR-TKI resistance of non-small cell lung cancers via HGF/IGF-1/ANXA2 signaling[J]. Biochim Biophys Acta Mol Basis Dis, 2018, 1864(3): 793-803. DOI:10.1016/j.bbadis.2017.12.021 |
| [18] |
王丹凤, 郭晓娜, 张亚林, 等. 西达苯胺抑制人胃癌SGC-7901细胞侵袭机制探讨[J]. 中华肿瘤防治杂志, 2019, 26(15): 1072-1078. [Wang DF, Guo XN, Zhang YL, et al. Chidamide inhibits invasion of human gastric carcinoma SGC-7901 cells via up-regulating SFRP2[J]. Zhonghua Zhong Liu Fang Zhi Za Zhi, 2019, 26(15): 1072-1078.] |
| [19] |
Jin H, ZhaoY, Zhang S, et al. Hyperthermia inhibits the motility of gemcitabine-resistant pancreatic cancer PANC-1 cells through the inhibition of epithelial-mesenchymal transition[J]. Mol Med Rep, 2018, 17(5): 7274-7280. |
| [20] |
Wu H, Li S. Long non-coding RNA MT1JP exerts anti-cancer effects in breast cancer cells by regulating miR-92-3p[J]. Gen Physiol Biophys, 2020, 39(1): 59-67. DOI:10.4149/gpb_2019039 |
| [21] |
Chen L, Lu Z, Yang Y, et al. Effects of purified Omphalia lapidescens protein on metastasis, cell cycle, apoptosis and the JAK-STAT signaling pathway in SGC-7901 human gastric cells[J]. Oncol Lett, 2018, 15(4): 4161-4170. |
 2021, Vol. 48
2021, Vol. 48