文章信息
- CD8+T淋巴细胞浸润与三阴性乳腺癌新辅助化疗疗效的关系
- Relation Between CD8+T Lymphocyte Infiltration and Efficacy of Neoadjuvant Chemotherapy for Triple-negative Breast Cancer
- 肿瘤防治研究, 2021, 48(5): 484-488
- Cancer Research on Prevention and Treatment, 2021, 48(5): 484-488
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.20.1191
- 收稿日期: 2020-10-14
- 修回日期: 2021-02-17
2. 450000 郑州,河南大学肿瘤医院(郑州市第三人民医院)病理科;
3. 450000 郑州,河南大学肿瘤医院(郑州市第三人民医院)GCP中心
2. Pathology Department, Cancer Hospital of Henan University (The Third People's Hospital of Zhengzhou), Zhengzhou 450000, China;
3. GCP Center, Cancer Hospital of Henan University (The Third People's Hospital of Zhengzhou), Zhengzhou 450000, China
乳腺癌是一种严重威胁妇女健康的世界性疾病,死亡率仅次于肺癌,位居恶性肿瘤第二位[1]。2020年,美国新确诊乳腺癌约27万例,4.2万例乳腺癌患者死亡[2]。在所有乳腺癌中,三阴性乳腺癌(triple-negative breast cancer, TNBC)是一种特殊类型,TNBC约占所有乳腺癌的16%,确诊后5年生存率明显低于其他类型乳腺癌患者[3]。TNBC一旦发生转移,对化疗的敏感度显著降低,中位生存时间缩短至6月以下[4]。TNBC较其他乳腺癌具有更强的侵袭性和转移性,术后3年复发率和5年死亡率均较高[5-6]。由于缺乏ER、PR和HER-2表达,对其他类型乳腺癌治疗有效的药物通常对TNBC无效[7]。肿瘤浸润淋巴细胞(tumor infiltrating lymphocytes, Tils)主要存在于肿瘤微环境,主要由异质性淋巴细胞构成,在多种实体瘤的发生发展过程中发挥着重要的作用,尤其是CD8+Tils细胞数量减少和免疫失活关系密切[8]。近年来,CD8+Tils与免疫治疗的疗效关系研究成为热点,但结论尚不明确。在TNBC中,CD8+Tils相关研究较少,也无针对性的表达情况及疗效预后分析,本研究拟探讨CD8+Tils在TNBC患者中的表达情况及其与新辅助化疗疗效的关系。
1 资料与方法 1.1 病例资料本研究回顾性分析2013年6月—2019年6月在河南大学肿瘤医院接受手术治疗的126例三阴性乳腺癌患者临床病理资料,术前均行新辅助化疗。本研究经我院医学伦理委员会批准(批号:2019-12-017-K06)。因本研究为回顾性分析,仅采集患者临床病理资料,不涉及干预患者治疗方案,不会对患者生理带来任何风险,且最终数据不会泄露任何个人隐私,已申请免除知情同意。
纳入标准:(1)病理明确诊断为乳腺癌且免疫组织化学ER(-)、PR(-)、HER2(-),若免疫组织化学HER2为(+)或(++),须经FISH检测为未扩增;(2)临床分期为Ⅱ~Ⅲ期;(3)均为女性患者;(4)年龄18~75岁;(5)PS评分0~2分;(6)术前完成4~6周期新辅助化疗后,再行手术治疗;(7)术后标本或组织保存完整。排除标准:(1)病例资料不完整,缺乏必要的检查化验结果,例如心、肝、肾检查化验指标,术前肿瘤影像学评估不完善者;(2)术前穿刺组织或术后标本肿瘤组织过少,无法再行相关免疫组织化学检测;(3)研究者认为应该排除的患者,主要包括病史资料记录不完整、术后随访记录不完全或缺失、术前临床分期有误、无法判断是否真绝经等。
1.2 试剂与检测即用型CD8兔抗人单克隆抗体购自福州迈新公司。所有标本均经福尔马林固定,常规石蜡包埋,2 μm连续切片,烘干机烘烤,并经二甲苯、梯度酒精、蒸馏水脱蜡,使用3%H2O2封闭内源性过氧化酶,后加入兔抗人CD8单克隆抗体,置于37℃培养箱内1 h;PBS冲洗后滴加二抗,室温孵育20 min;DAB显色,苏木精对比染色,盐酸酒精分化、脱水、透明、封片、显微镜下观察。操作步骤严格按产品说明书(MaxVision试剂盒KIT-5030)进行,以PBS代替一抗作为阴性对照,以慢性扁桃腺炎组织作CD8的阳性对照。
1.3 结果判定CD8+Tils密度计算:CD8+Tils阳性着色均定位于细胞膜,呈淡黄色至棕褐色粗颗粒。于低倍镜下观察整张切片,选取CD8+Tils细胞丰富的5个高倍视野(×400)计算其阳性细胞比例,取平均值。阳性细胞比例 < 10%为低表达、10%~40%为中表达、≥40%~90%为高表达。根据CD8+Tils表达中位值将患者分为低密度组和高密度组[9],本研究Cut-off值为10%,即CD8+Tils表达比例 < 10%为低密度,记为(-);≥10%为高密度,记为(+)。
1.4 随访通过病历或电话随访获得患者术后病理情况、生存状况、无病生存时间(disease-free survival, DFS)。随访日期截至2020年6月30日。DFS定义为自术后第1天至肿瘤复发或任何原因死亡或至随访截止日期的生存时间。
1.5 统计学方法采用SPSS26和R软件进行数据分析。计数资料采用χ2检验,Kaplan-Meier法进行生存分析,并行Log rank检验。将DFS作为因变量,年龄、分级、月经状况、病理分期、淋巴结转移、Ki-67指数、PS评分、肿瘤大小、脉管受侵、手术方式、新辅助化疗方案等作为自变量进行Cox单因素、多因素分析。P < 0.05为差异有统计学意义。
2 结果 2.1 CD8+Tils的表达情况与入组患者临床资料特征的关系CD8+Tils表达高密度有45例(35.7%),具体情况见表 1。

|
46例患者术后病理完全缓解(pathological complete remission, pCR)。将126例患者根据CD8+Tils表达情况分为高密度组(n=45)和低密度组(n=81),高密度组有30例(66.7%)达pCR,低密度组有16例(19.8%)达pCR,两组pCR率差异有统计学意义(χ2=27.467, P=0.000),见图 1~2。

|
| LDG: Low-density group; HDG: high-density group. 图 1 高低密度CD8+Tils组pCR率对比 Figure 1 Comparison of pCR rates between high- and low- density CD8+Tils groups |

|
| A: high-density infiltration of CD8+Tils, and pale yellow or tan coarse particles showed positive staining of CD8+TiLs; B: low-density infiltration of CD8+Tils, and pale yellow or tan coarse particles with positive staining of CD8+Tils were rarely seen. 图 2 三阴性乳腺癌组织高低密度组CD8+Tils的表达 Figure 2 Expression of CD8+Tils in high- and low- density groups of triple negative breast cancer tissue |
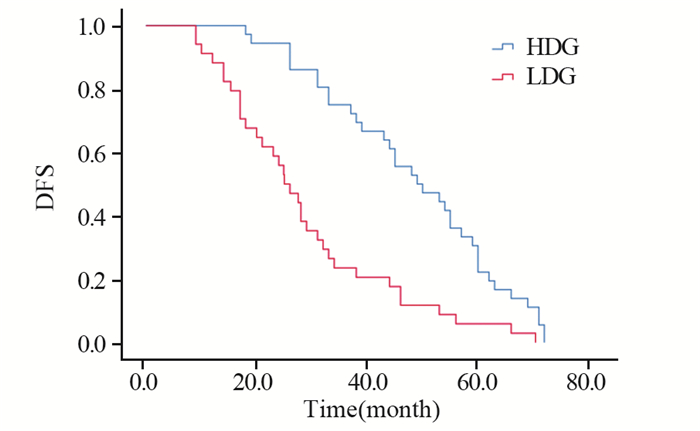
截至随访日期,79例因复发或转移达到DFS事件终点(其中35例生存),14例因非本病原因死亡,33例处于无复发生存状态。CD8+Tils高密度浸润患者中位DFS为49.0月(95%CI: 37.2~60.8),与CD8+Tils低密度浸润患者DFS 25.0月(95%CI: 20.0~30.0)比较,差异有统计学意义(χ2=18.480, P=0.000),见图 3。
|
| 图 3 CD8+Tils浸润密度对三阴性乳腺癌患者DFS的影响 Figure 3 Effects of CD8+TiLs infiltration densities on DFS of TNBC patients |
单因素分析结果显示:年龄、病理分级、肿瘤大小、淋巴结转移、脉管侵犯与预后密切相关(P < 0.05)。将上述单因素分析有意义的变量纳入多因素分析,另外结合临床实际情况,将单因素分析无意义的CD8+Tils强制纳入多因素分析,结果显示病理高分级、肿瘤 > 2 cm、淋巴结转移(+)、脉管侵犯(+)、CD8+Tils低密度表达均为长期生存的不良影响因素(P < 0.05)。另外CD8+Tils为独立预后因素,肿瘤组织高密度表达者,预后良好,HR为0.52,降低进展风险48%,见表 2。

|
目前虽然乳腺癌整体治疗效果及生存预后较之前有很大提高,但TNBC改善并不明显,治疗手段也较为有限[10]。对于局部晚期乳腺癌患者,尤其是TNBC患者,新辅助化疗是一种重要治疗手段,新辅助治疗的主要目的是提高治愈率[11],降低术后复发。研究表明,对TNBC患者,新辅助治疗后病理完全缓解的患者生存率明显提高[12]。但新辅助化疗达到pCR的患者比例较低(20%~40%),因此,迫切需要探索TNBC患者新辅助化疗疗效有意义的生物标志物。
近年来,随着免疫治疗的兴起,对免疫标志物的探索也成为热点,Tils曾被认为是免疫治疗有效的生物标志物,还有多项研究[13-15]表明,Tils尤其是CD8+高度浸润与多种上皮肿瘤患者的长期预后相关,但尚缺乏在TNBC中的研究。Liu等[16]研究表明CD8+淋巴细胞浸润可能与基底细胞乳腺癌预后相关。但基底细胞乳腺癌并不等同于TNBC,目前如何分型基底细胞乳腺癌尚存困难,难以在临床推广。本研究入组126例TNBC患者,检测患者肿瘤组织的CD8+Tils浸润程度,根据平均阳性细胞表达程度,以10%为界,分为低密度组和高密度组。结果显示,CD8+Tils高密度浸润与年龄 < 60岁、病理高分级、临床高分期有关,具有统计学差异(P < 0.05)。
在CD8+Tils浸润与疗效预后方面,国内外在其他实体瘤方面进行了一些研究。林晶等[17]研究显示CD8+T细胞浸润程度越高,胃癌患者预后越好。卢慧敏等[18]研究显示CD8+T细胞高浸润是结直肠癌的独立预后因素,浸润程度越高,预后越好。本研究观察了不同浸润密度与TNBC患者术后pCR的关系,结果显示高密度CD8+Tils浸润者术后pCR率明显高于低密度组(66.7% vs. 19.8%, P=0.000),这与de Groot等[19]研究结果一致。另外,本研究还观察了不同CD8+浸润密度导致的术后DFS差异,CD8+Tils高密度浸润患者中位DFS为49.0月(95%CI: 37.2~60.8),较CD8+Tils低密度浸润患者(DFS: 25.0月,95%CI: 20.0~30.0)有明显统计学差异(P < 0.05)。初步证实CD8+Tils可能是TNBC患者疗效及预后的有效指标。
本研究采用Cox分析对临床各项指标以及CD8+Tils浸润与预后关系进行研究,多因素分析结果表明病理高分级、肿瘤 > 2 cm、淋巴结转移(+)、脉管侵犯(+)、CD8+TiLs低密度浸润均为长期生存的不良影响因素,且差异有统计学意义。另外CD8+Tils为TNBC独立预后因素,这与Liu等[16]研究结果一致,肿瘤组织高密度表达者,预后良好,HR为0.52,降低DFS进展风险48%。
本研究具有潜在局限性:针对CD8+TiLs浸润密度评估并没有一个客观标准,不同的病理中心可能有较大差异。另外由于三阴性乳腺癌发病率较低,能够行术前新辅助化疗的患者较少,而符合本研究入组条件的合格病例更少,因此入组患者跨度较长,有可能对最终研究结果造成偏倚。而且因为组织样本的局限性,本研究无法观察化疗前后CD8+Tils浸润情况的变化,尚需要进一步开展前瞻性随机试验评估化疗对肿瘤组织Tils浸润变化情况的影响。
作者贡献:
孔天东:论文撰写
陈露:文献搜集及试验数据整理统计
段方方、王留晏、周寒丽:病例资料筛选及随访登记
赵晓丽:部分随访登记
刘萌萌:实验实施
刘丹娜:数据统计分析及论文审校
| [1] |
Thorat MA, Balasubramanian R. Breast cancer prevention in high-risk women[J]. Best Pract Res Clin Obstet Gynaecol, 2020, 65: 18-31. DOI:10.1016/j.bpobgyn.2019.11.006 |
| [2] |
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2020[J]. CA Cancer J Clin, 2020, 70(1): 7-30. DOI:10.3322/caac.21590 |
| [3] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [4] |
Blows FM, Driver KE, Schmidt MK, et al. Subtyping of Breast Cancer by Immunohistochemistry to Investigate a Relationship between Subtype and Short and Long Term Survival: A Collaborative Analysis of Data for 10, 159 Cases from 12 Studies[J]. PLoS Med, 2010, 7(5): e1000279. DOI:10.1371/journal.pmed.1000279 |
| [5] |
Jitariu AA, Cîmpean AM, Ribatti D, et al. Triple negative breast cancer: the kiss of death[J]. Oncotarget, 2017, 8(28): 46652-46662. DOI:10.18632/oncotarget.16938 |
| [6] |
Camorani S, Fedele M, Zannetti A, et al. TNBC Challenge: Oligonucleotide Aptamers for New Imaging and Therapy Modalities[J]. Pharmaceuticals (Basel), 2018, 11(4): 123. DOI:10.3390/ph11040123 |
| [7] |
Park JH, Ahn JH, Kim SB. How shall we treat early triple-negative breast cancer (TNBC): from the current standard to upcoming immuno-molecular strategies[J]. ESMO Open, 2018, 3(Suppl 1): e000357. |
| [8] |
Ikeda Y, Kiyotani K, Yew PY, et al. Clinical significance of T cell clonality and expression levels of immune-related genes in endometrial cancer[J]. Oncol Rep, 2017, 37(5): 2603-2610. DOI:10.3892/or.2017.5536 |
| [9] |
Al-Saleh K, Abd El-Aziz N, Ali A, et al. Predictive and prognostic significance of CD8(+) tumor-infiltrating lymphocytes in patients with luminal B/HER 2 negative breast cancer treated with neoadjuvant chemotherapy[J]. Oncol Lett, 2017, 14(1): 337-344. DOI:10.3892/ol.2017.6144 |
| [10] |
Ahn SG, Kim SJ, Kim C, et al. Molecular Classification of Triple-Negative Breast Cancer[J]. J Breast Cancer, 2016, 19(3): 223-230. DOI:10.4048/jbc.2016.19.3.223 |
| [11] |
Le Du F, Eckhardt BL, Lim B, et al. Is the future of personalized therapy in triple-negative breast cancer based on molecular subtype?[J]. Oncotarget, 2015, 6(15): 12890-12908. DOI:10.18632/oncotarget.3849 |
| [12] |
Liu YR, Jiang YZ, Xu XE, et al. Comprehensive transcriptome analysis identifies novel molecular subtypes and subtype-specific RNAs of triple-negative breast cancer[J]. Breast Cancer Res, 2016, 18(1): 33. DOI:10.1186/s13058-016-0690-8 |
| [13] |
Gooden MJM, de Bock GH, Leffers N, et al. The prognostic influence of tumour-infiltrating lymphocytes in cancer: a systematic review with meta-analysis[J]. Br J Cancer, 2011, 105(1): 93-103. DOI:10.1038/bjc.2011.189 |
| [14] |
Webb JR, Milne K, Nelson BH. Location, location, location: CD103 demarcates intraepithelial, prognostically favorable CD8+ tumor-infiltrating lymphocytes in ovarian cancer[J]. Oncoimmunology, 2014, 3: e27668. DOI:10.4161/onci.27668 |
| [15] |
Sarrabayrouse G, Corvaisier M, Ouisse LH, et al. Tumor-reactive CD4+ CD8αβ+ CD103+ αβT cells: a prevalent tumor-reactive T-cell subset in metastatic colorectal cancers[J]. Int J Cancer, 2011, 128(12): 2923-2932. DOI:10.1002/ijc.25640 |
| [16] |
Liu S, Lachapelle J, Leung S, et al. CD8+ lymphocyte infiltration is an independent favorable prognostic indicator in basal-like breast cancer[J]. Breast Cancer Res, 2012, 14(2): R48. DOI:10.1186/bcr3148 |
| [17] |
林晶, 陈誉, 陈刚, 等. CD8+T细胞浸润与STATs家族活化在胃癌组织中表达及临床意义[J]. 临床肿瘤学杂志, 2019, 24(6): 548-553. [Lin J, Chen Y, Chen G, et al. Expression and clinical significance of CD8+T cell infiltration and STATs family activation in gastric cancer[J]. Lin Chuang Zhong Liu Xue Za Zhi, 2019, 24(6): 548-553. DOI:10.3969/j.issn.1009-0460.2019.06.013] |
| [18] |
卢慧敏, 王琰, 陈陆俊, 等. CD103+CD8+T细胞在结直肠癌组织中的浸润分布及其临床意义[J]. 中国肿瘤生物治疗杂志, 2019, 26(1): 50-57. [Lu HM, Wang Y, Chen LJ, et al. Distribution of CD103+ CD8+T cell infiltration in colorectal cancer tissues and its clinical significance[J]. Zhongguo Zhong Liu Sheng Wu Zhi Liao Za Zhi, 2019, 26(1): 50-57.] |
| [19] |
de Groot AF, Blok EJ, Charehbili A, et al. Strong CD8+ lymphocyte infiltration in combination with expression of HLA class I is associated with better tumor control in breast cancer patients treated with neoadjuvant chemotherapy[J]. Breast Cancer Res Treat, 2019, 175(3): 605-615. DOI:10.1007/s10549-019-05195-y |
 2021, Vol. 48
2021, Vol. 48


