文章信息
- 阿帕替尼一线治疗晚期肝癌疗效观察
- Therapeutic Effect of Apatinib in First-line Treatment of Advanced Liver Cancer
- 肿瘤防治研究, 2021, 48(7): 723-726
- Cancer Research on Prevention and Treatment, 2021, 48(7): 723-726
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.20.1161
- 收稿日期: 2020-10-09
- 修回日期: 2021-03-17
根据2014年中国恶性肿瘤发病和死亡分析[1]:肝癌居全国恶性肿瘤发病例数第4位,死亡例数居第2位。大多数患者发现时已处于晚期,不到20%的肝癌患者有手术机会,且术后复发转移率较高。对于广泛性门脉癌栓、初始不可切或不能行肝动脉化疗栓塞(transarterial chemoembolization, TACE)的肝细胞癌(hepatocellular carcinoma, HCC)患者,立体定向体部放疗(stereotactic body radiation therapy, SBRT)作为初始治疗能在多数患者中达到癌栓的充分消退以及门静脉血流的恢复,能提供进一步的治疗机会包括手术或TACE等,SBRT联合TACE组对比单独SBRT组的OS分别为12和3月[2],多种方法的综合运用体现出了生存优势。随着肝癌靶向治疗以及放化疗的综合运用,晚期肝癌的疾病控制与生存都得到明显的改善。
目前被批准用于肝癌治疗的大多数为抗血管生成类分子靶向药物,2019年NCCN指南推荐肝癌一线药物为索拉非尼和乐伐替尼;二线治疗药物为瑞戈非尼等。目前免疫检查点抑制剂在肝癌治疗中兴起,但免疫检查点抑制剂与抗VEGF药物作用于晚期肝细胞癌二线治疗的一项对比研究显示两组的PFS和OS无明显差异[3],显示目前抗血管生成靶向药物仍为晚期肝癌治疗的基石。本研究探索单靶点抗血管生成药物阿帕替尼在晚期肝癌中的疗效。
1 资料与方法 1.1 一般资料回顾性分析2017年7月—2020年1月在武汉大学人民医院肿瘤中心口服阿帕替尼的晚期肝癌患者临床资料,见表 1。患者纳入标准为:(1)无法手术的局部晚期或者转移性肝癌;(2)尚未进行肝癌的靶向治疗;(3)巴塞罗那分期(Barcelona Clinic Liver Cancer, BCLC)A、B、C分期均可;(4)可伴有腹水;(5)患者年龄22~75岁,美国东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)PS评分0~3分;(6)根据RECIST 1.1版本有可检测的病灶;(7)对于不适合手术的晚期肝癌患者,可联合其他治疗,如肝癌放疗及肝动脉化疗栓塞。排除标准:(1)可手术患者;(2)既往接受过其他抗血管靶向治疗患者;(3)严重高血压难以控制患者;(4)胃底静脉等门静脉血管严重扩张,出血风险较大者。
患者初始均采用甲磺酸阿帕替尼片250~500 mg口服,每天1次,耐受不佳者减量至平均每天125 mg。对于疾病控制有效的患者,包括完全缓解(complete remission, CR)、部分缓解(partial remission, PR)和疾病稳定(stable disease, SD),继续给药直至疾病进展(progressive disease, PD)或者无法耐受或死亡。
1.3 观察指标主要研究终点为无进展生存期(progression-free survival, PFS)和总体生存期(overall survival, OS),次要终点为疾病控制率(disease control rate, DCR)、客观缓解率(objective remission rate, ORR)。从初始口服阿帕替尼治疗之后,每6周记录患者的影像学及血检、尿检指标,包括胸腹部CT、肝脏MRI及肝肾功能、肿瘤标志物及尿常规等,每日监测血压1次,综合判断疾病状况的变化。观察患者的不良反应,如手足综合征、高血压、蛋白尿等。随访截止时间为2020年7月。本回顾性研究符合赫尔辛基宣言的伦理精神。
1.4 统计学方法统计分析均使用SPSS16.0.1进行。采用Kaplan Meier法评估PFS和OS。
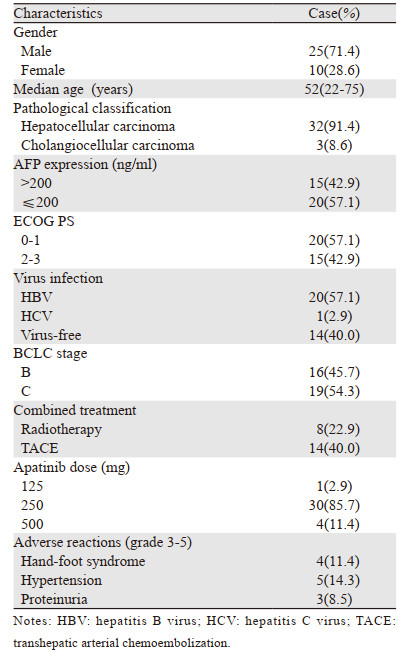
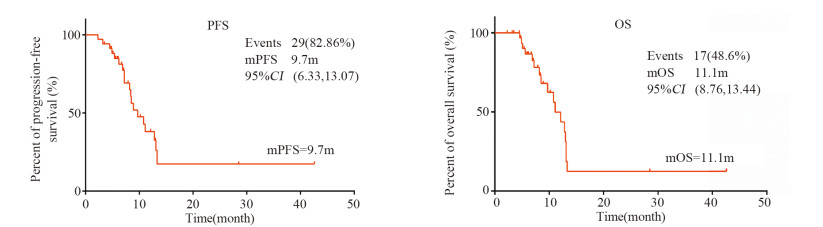
2 结果纳入35例肝癌患者,男性25例(71.4%),女性10例(28.6%);年龄22~75岁,中位年龄52岁;肝细胞癌32例,肝内胆管细胞癌3例。基线甲胎蛋白>200 ng/ml为15例(42.9%);3例肝内胆管癌的AFP均≤200 ng/ml;ECOG评分0~1分20例(57.1%),2~3分15例(42.9%);BCLC分期B期16例(45.7%),C期19例(54.3%)。依据RECIST1.1标准:CR 1例,PR 17例,SD 11例,ORR 51.43%,DCR 82.86%,中位PFS 9.7月,95%CI(6.33, 13.07)。中位OS 11.1月,95%CI(8.76, 13.44),其中3例胆管细胞癌患者的OS为6.1~9.7月,见图 1、2。不良反应(3~5级)主要有手足综合征(11.4%)、高血压(14.3%)、蛋白尿(8.5%)等。发生手足综合征先暂停阿帕替尼的使用,并对症处理,如镇痛、改善末梢循环、中药外涂等;3~5级高血压可采用盐酸贝那普利片及硝苯地平缓释片等;3~5级蛋白尿采用暂停或减量服用阿帕替尼、止血及改善肾功能等处理。大多3~5级不良反应均可逆转,安全性好。
|
| 图 1 阿帕替尼作用于晚期肝癌的无进展生存期和总生存期 Figure 1 Effects of apatinib on progression-free survival and overall survival of advanced hepatocellular carcinoma patients |
|
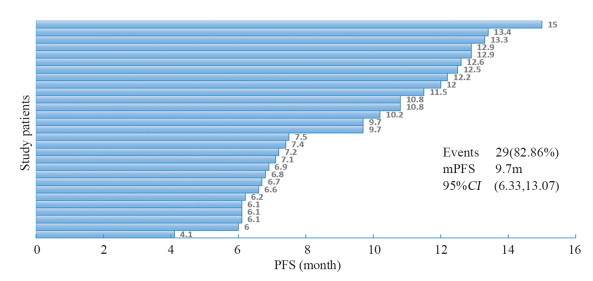
| 图 2 阿帕替尼作用于晚期肝癌的无进展生存泳动图 Figure 2 Swimming diagram of apatinib for progression-free survival of advanced liver cancer patients |
肝细胞癌对大多数化疗药物耐药,使得肝细胞癌的系统治疗一直停滞不前,出现突破性进展是在索拉非尼出现以后。索拉非尼是一种多靶点抑制剂,主要作用于血管内皮生长因子受体(VEGFRs 1、2和3)和血小板衍生生长因子受体(PDGFR)的激酶活性[4-5]。临床试验SHARP将未系统治疗的晚期肝癌患者随机分为索拉非尼组或安慰剂组,中位OS分别为10.7月和7.9月[6]。索拉非尼序贯瑞戈非尼治疗依然获益[7]。
抗血管生成药物阿帕替尼是一种小分子4-苯胺基喹唑啉类受体酪氨酸激酶抑制剂,通过作用于VEGFR-2而发挥作用,可用于晚期胃癌、小细胞肺癌及乳腺癌的治疗[8-9]。在HCC中,阿帕替尼具有与索拉非尼相似的抗肿瘤和抗血管生成作用,但毒性较小[10]。阿帕替尼可抑制人HepG2肝癌细胞的生长和迁移,其机制可能是上调了P53、Caspase-3和Caspase-8的表达[11];也可能通过抑制NF-κB信号通路,下调MMP相关基因的表达[12]。
阿帕替尼被认为在中晚期肝癌治疗中安全有效。一组疗效评价显示:阿帕替尼在晚期肝细胞癌中的疾病控制率(DCR)为56.6%,中位无进展生存时间(mPFS)为3.65月,不良反应主要为高血压、手足综合征、蛋白尿、疲乏等,但均可耐受[13]。另一项仅纳入20例患者的小样本肝癌研究显示:阿帕替尼用于晚期肝癌,一线治疗14例,二线治疗6例,整体的中位PFS为4.6月,中位OS为11.1月[14]。
本研究显示:阿帕替尼用于晚期肝癌的一线治疗,可以明显改善晚期肝细胞癌的PFS和OS,中位时间分别为9.7月和11.1月,疗效并不逊于索拉非尼肝癌一线治疗疗效。本研究中阿帕替尼联合姑息放疗8例,联合肝动脉化疗栓塞(TACE)有14例。研究显示:阿帕替尼联合TACE的疗效优于单独TACE,能显著延长肝癌患者的PFS[15]。
从本研究中的肝癌生存曲线可以看到阿帕替尼治疗的PFS最高为15月,该患者因高血压及蛋白尿难以通过药物缓解,阿帕替尼减量至隔天250 mg后仍难以耐受,总共使用15月后改用瑞戈非尼继续治疗,且随访42.6月后该患者仍能长期生存,原因可能是该患者接受了阿帕替尼同步联合肝癌局部放疗。肿瘤侵犯了该患者门静脉主干并伴有癌栓,在随访中肿瘤持续退缩,直至出现肿瘤的完全缓解,且无远处转移,随访至今仍为无瘤状态。本研究中阿帕替尼与放疗联用起到抗肿瘤的协同效应,这种协同增敏效应在多种肿瘤中已经得到验证,可能与阿帕替尼的抗血管生成机制有关[16]。
有研究显示阿帕替尼在肝细胞癌的PFS和OS分别5月和13月,在胆管细胞癌的PFS和OS分别为3.0和5.0月[17],这和本研究数据的差异可能源于患者纳入标准的差异性、纳入病例的不平衡性以及联合治疗方案的差异性。本研究纳入患者中PS 0~3分,BCLC分期均为B期和C期,对无法行手术治疗的中晚期肝癌患者依然体现了阿帕替尼的有效性,ORR 51.43%,DCR 82.86%;而且用药持续时间长,不良反应主要是高血压、蛋白尿和手足综合征,但3~4级不良反应低,耐受性好。在一项关于老年晚期肝癌的研究中,阿帕替尼的不良反应发生率为100%,以1~2级为主,耐受性尚可[18],与本研究数据类似。目前肝癌单一治疗方法已经遇到瓶颈,而抗血管生成治疗可将冷肿瘤转化为热肿瘤,从而促进抗PD-1/PD-L1单抗的效应,形成高效的协同作用。在IMbrave150研究中,免疫治疗联合抗血管生成治疗在对比索拉非尼在晚期肝癌的一线治疗中获得成功[19]。未来以阿帕替尼为基础的联合治疗有望获得高效的协同抗肿瘤效应。
本研究不足在于:病例数不够多,分层分析不够精细化,导致不良反应发生的比例和中位生存时间存在偏倚的可能。我们未来需要进一步增加研究的病例数,并探索哪些因素决定了阿帕替尼在晚期肝癌患者治疗中的获益差别,从而精确选择获益人群并进一步探索抗血管生成治疗与放疗及免疫治疗的协同效应。
作者贡献:
柯少波:思路设计,数据整理,论文撰写
汪晶、邱虎、蔡高科、龚毅:病例搜集,数据整理
陈永顺:参与选题及设计,提出建议、指导论文
| [1] |
陈万青, 李贺, 孙可欣, 等. 2014年中国恶性肿瘤发病和死亡分析[J]. 中华肿瘤杂志, 2018, 40(1): 5-13. [Chen WQ, Li H, Sun KX, et al. Report of Cancer Incidence and Mortality in China, 2014[J]. Zhonghua Zhong Liu Za Zhi, 2018, 40(1): 5-13.] |
| [2] |
Shui Y, Yu W, Ren X, et al. Stereotactic body radiotherapy based treatment for hepatocellular carcinoma with extensive portal vein tumor thrombosis[J]. Radiat Oncol, 2018, 13(1): 188. DOI:10.1186/s13014-018-1136-5 |
| [3] |
Saeed A, Hildebrand H, Park R, et al. Immune Checkpoint Inhibitors versus VEGF Targeted Therapy as Second Line Regimen in Advanced Hepatocellular Carcinoma (HCC): A Retrospective Study[J]. J Clin Med, 2020, 9(9): 2682-2691. DOI:10.3390/jcm9092682 |
| [4] |
Wilhelm S, Chien DS. BAY 43-9006: preclinical data[J]. Curr Pharm Des, 2002, 8(25): 2255-2257. DOI:10.2174/1381612023393026 |
| [5] |
Wilhelm SM, Carter C, Tang L, et al. BAY 43-9006 exhibits broad spectrum oral antitumor activity and targets the RAF/MEK/ERK pathway and receptor tyrosine kinases involved in tumor progression and angiogenesis[J]. Cancer Res, 2004, 64(19): 7099-7109. DOI:10.1158/0008-5472.CAN-04-1443 |
| [6] |
Kane RC, Farrell AT, Madabushi R, et al. Sorafenib for the treatment of unresectable hepatocellular carcinoma[J]. Oncologist, 2009, 14(1): 95-100. DOI:10.1634/theoncologist.2008-0185 |
| [7] |
Ogasawara S, Ooka Y, Itokawa N, et al. Sequential therapy with sorafenib and regorafenib for advanced hepatocellular carcinoma: a multicenter retrospective study in Japan[J]. Invest New Drugs, 2020, 38(1): 172-180. DOI:10.1007/s10637-019-00801-8 |
| [8] |
Ruan H, Dong J, Zhou X, et al. Multicenter phase Ⅱ study of apatinib treatment for metastatic gastric cancer after failure of second-line chemotherapy[J]. Oncotarget, 2017, 8(61): 104552-104559. DOI:10.18632/oncotarget.21053 |
| [9] |
王静, 贾敬好, 刘晶晶, 等. 阿帕替尼治疗晚期难治性乳腺癌的临床疗效观察[J]. 肿瘤防治研究, 2020, 47(11): 861-865. [Wang J, Jia JH, Liu JJ, et al. Clinical Observation of Apatinib in Treatment of Refractory Advanced Breast Cancer[J]. Zhong Liu Fang Zhi Yan Jiu, 2020, 47(11): 861-865. DOI:10.3971/j.issn.1000-8578.2020.19.1305] |
| [10] |
Liang Q, Kong L, Du Y, et al. Antitumorigenic and antiangiogenic efficacy of apatinib in liver cancer evaluated by multimodality molecular imaging[J]. Exp Mol Med, 2019, 51(7): 1-11. |
| [11] |
姜增凯, 叶晓歌, 陈琴华. 阿帕替尼对肝癌细胞增殖和迁移能力的影响研究[J]. 中国临床药理学杂志, 2016, 32(15): 1422-1424. [Jiang ZK, Ye XG, Chen QH. Effect of apatinib on the proliferation and migration of liver cancer cells[J]. Zhongguo Lin Chuang Yao Li Xue Za Zhi, 2016, 32(15): 1422-1424.] |
| [12] |
Qiu J, Zhou Q, Zhang Y, et al. Discovery of novel quinazolinone derivatives as potential anti-HBV and anti-HCC agents[J]. Eur J Med Chem, 2020, 205: 112581. DOI:10.1016/j.ejmech.2020.112581 |
| [13] |
宋锦添, 陈奕贵, 许春伟, 等. 阿帕替尼治疗53例晚期原发性肝癌的疗效[J]. 临床与病理杂志, 2017, 37(3): 557-563. [Song JT, Chen YG, Xu CW, et al. Effect of apatinib on treatment of 53 cases of advanced primary liver cancer[J]. Lin Chuang Yu Bing Li Za Zhi, 2017, 37(3): 557-563.] |
| [14] |
陶云霞, 李泳澄, 王翔, 等. 低剂量甲磺酸阿帕替尼治疗晚期原发性肝癌疗效与安全性[J]. 中华肿瘤防治杂志, 2020, 27(2): 141-145. [Tao YX, Li YC, Wang X, et al. Efficacy and safety of low-dose apatinib treatment for advanced primary liver cancer[J]. Zhonghua Zhong Liu Fang Zhi Za Zhi, 2020, 27(2): 141-145.] |
| [15] |
Lu W, Jin XL, Yang C, et al. Comparison of efficacy between TACE combined with apatinib and TACE alone in the treatment of intermediate and advanced hepatocellular carcinoma: A single-center randomized controlled trial[J]. Cancer Biol Ther, 2017, 18(6): 433-438. DOI:10.1080/15384047.2017.1323589 |
| [16] |
Liu S, Wu F, Zhang Y, et al. Apatinib Combined With Radiotherapy Enhances Antitumor Effects in an In Vivo Nasopharyngeal Carcinoma Model[J]. Cancer Control, 2020, 27(1): 1073274820922553. |
| [17] |
Zhen L, Jiali C, Yong F, et al. The Efficacy and Safety of Apatinib Treatment for Patients with Unresectable or Relapsed Liver Cancer: a retrospective study[J]. J Cancer, 2018, 9(16): 2773-2777. DOI:10.7150/jca.26376 |
| [18] |
朱振华, 褚行琦. 阿帕替尼治疗老年晚期肝癌的临床效果及安全性[J]. 中华老年多器官疾病杂志, 2020, 19(5): 360-363. [Zhu ZH, Zhu XQ. Efficacy and safety of apatinib in treatment of elderly patients with advanced hepatocellular cancer[J]. Zhonghua Lao Nian Duo Qi Guan Ji Bing Za Zhi, 2020, 19(5): 360-363.] |
| [19] |
Eugen K. Current treatment options for hepatocellular carcinoma[J]. Klin Onkol, 2020, 33(Supplementum 3): 20-25. |
 2021, Vol. 48
2021, Vol. 48