文章信息
- 白藜芦醇通过下调POLD1抑制乳腺癌MDA-MB-231细胞上皮间质转化
- RSV Inhibits Epithelial-mesenchymal Transition of MDA-MB-231 Cells by Down-regulating POLD1 Expression
- 肿瘤防治研究, 2021, 48(5): 445-450
- Cancer Research on Prevention and Treatment, 2021, 48(5): 445-450
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.20.1156
- 收稿日期: 2020-09-29
- 修回日期: 2020-12-18
2. 530021 南宁,广西医科大学第五附属医院创面修复科;
3. 530021 南宁,广西医科大学第五附属医院医学实验室;
4. 530021 南宁,广西医科大学第五附属医院病理科
2. Department of Wound Repair, The Fifth Affiliated Hospital of Guangxi Medical University, Nanning 530021, China;
3. Medical Laboratory, The Fifth Affiliated Hospital of Guangxi Medical University, Nanning 530021, China;
4. Department of Pathology, The Fifth Affiliated Hospital of Guangxi Medical University, Nanning 530021, China
上皮间质转化(epithelial-mesenchymal transition, EMT)被认为是癌细胞获得转移侵袭能力的生物学行为基础[1],众多细胞因子及转录因子参与了癌细胞EMT的调控[2]。近年来也有学者逐渐发现一些药物或者治疗手段可以通过逆转细胞的EMT状态从而达到降低细胞耐药性和杀伤细胞的目的[3]。
乳腺癌细胞中异常的DNA复制与侵袭能力密切相关。DNA聚合酶-δ(polymerase delta, Pol-δ)是DNA复制的关键酶,而DNA聚合酶的催化亚基基因POLD1编码的蛋白P125是Pol-δ的活性亚基之一。我们的前期研究发现POLD1在乳腺癌组织中高表达,与患者的临床分期[4]及细胞的侵袭能力[5]关系密切,可能是调控乳腺癌细胞EMT的重要靶点之一。
白藜芦醇(resveratrol, RSV)已被证实能对乳腺癌细胞的侵袭[6]、EMT[7]及衰老[8]等多种生物学行为进行调控,其对乳腺癌的疗效是肯定的,进一步探索其中的调控机制有利于寻找更多的作用靶点和调控涉及的通路。POLD1是乳腺癌细胞维持肿瘤相关行为的重要基因,但目前尚无研究指出RSV对POLD1的调控机制。本研究拟探索RSV对POLD1的调控作用,并探究POLD1在RSV抑制MDA-MB-231细胞侵袭过程中发挥的作用及机制。
1 材料与方法 1.1 主要试剂与设备MDA-MB-231细胞购自中国科学院上海生命科学研究院细胞资源中心。POLD1过表达重组慢病毒颗粒购自上海复百澳生物科技有限公司。胎牛血清(FBS)、胰酶、DMEM培养基和青、链霉素溶液均购自美国Gibco公司。细胞培养瓶、Transwell小室、6孔板、24孔板均购自美国Corning公司。基质胶购自美国BD公司。磷酸盐缓冲液(phosphate buffered saline, PBS)购自索莱宝生物试剂有限公司。实验所用一抗(GAPDH、POLD1、Vimentin)均购自美国Cell Signaling Technology公司;E-cadherin和N-cadherin均购自美国Abcam公司。辣根过氧化物酶标记山羊抗兔IgG(H+L)、抗鼠IgG(H+L)抗体、BCA蛋白浓度检测试剂盒、RIPA细胞裂解液、ECL化学发光显影液均购自碧云天公司。凝胶图像分析系统购自美国Bio-Rad公司。
1.2 方法 1.2.1 细胞培养MDA-MB-231细胞培养于含10%胎牛血清、青霉素100 u/ml+链霉素0.1 mg/ml的DMEM培养基中,置于37℃、5%CO2的培养箱中维持生长,2~3天传代一次,取对数生长期的细胞进行实验。本实验所用细胞均处于对数生长期。
1.2.2 CCK-8法检测细胞存活能力取对数生长期MDA-MB-231细胞,调整细胞浓度为5×104个/毫升,接种于96孔板中,每孔100 µl(共分为7组,每组设置5个复孔),置于37℃、5%CO2培养箱中孵育过夜。细胞贴壁后去培养基,按分组分别加入含终浓度为0、1、2.5、5、10、25、50 µmol/L RSV的DMEM 100 µl,另设空白对照组加入DMEM 100 µl,继续以同样条件孵育48 h。每孔加入CCK-8溶液10 µl,继续孵育4 h。使用酶标仪检测450 nm处的吸光度(A)值。比较7组细胞的存活率。实验重复3次。
1.2.3 细胞转染取对数生长期的MDA-MB-231细胞以5×104个/孔接种于6孔板内。培养12 h后,加入POLD1过表达重组慢病毒(带绿色荧光蛋白(green fluorescence protein, GFP)标签),另设不加病毒的空白对照组和空载阴性对照组,同时加入2 µg/L病毒增强液,12 h后换新鲜完全培养基。72 h后加入嘌呤霉素(2 mg/L)筛选。1周后嘌呤霉素浓度减半继续筛选1周。获得POLD1-OE和POLD1-NC稳定细胞株进行后续实验。
1.2.4 转染验证GFP荧光法测定转染效率:慢病毒转染后72 h,使用倒置荧光显微镜观察荧光细胞占总细胞数量比例(即暗场细胞数与明场细胞数的比),一般要求荧光细胞比例高于80%。
qRT-PCR实验法测定转染效率:分别用TRIzol法提取未处理的MDA-MB-231细胞(Ctrl组),POLD1-NC细胞(POLD1-NC组),POLD1-OE细胞(POLD1-OE组)的总RNA进行反转录(按PrimeScriptTM RT reagent Kit with gDNA Eraser(Perfect Real Time)试剂盒说明书操作)后,行qRT-PCR实验(按TB GreenTM Premix Ex TaqTM Ⅱ(Tli RNaseH Plus)试剂盒说明书操作)。
POLD1引物、GAPDH引物均由上海生工生物工程有限公司合成。POLD1上游引物:5′-GCTCCGCTCCTACACGCTCAA-3′;下游引物:5′-GGTCTGGTCGTTCCCATTCTGC-3′。GAPDH上游引物:5’-AGAAGGCTGGGGCTCATTTG-3’;下游引物:5’-AGGGGCCATCCACAGTCTTC-3’。
1.2.5 Western blot实验检测POLD1、N-cadherin、E-cadherin和Vimentin蛋白在各组细胞中的表达水平(POLD1-NC组、RSV+POLD1-NC组和RSV+POLD1-OE组)。将各实验组细胞收集于1.5 ml EP管中,RIPA细胞裂解液裂解,BCA方法测量蛋白浓度,与蛋白上样缓冲液充分混合后煮沸5 min使蛋白变性。根据蛋白浓度调整上样量,利用10%聚丙烯酰胺凝胶电泳分离蛋白,将凝胶上的蛋白转移至PVDF膜上,用含5%脱脂奶粉封闭液封闭1.5 h,一抗孵育过夜(4℃):POLD1、Vimentin、N-cadherin、E-cadherin、GAPDH(体积稀释比均为1:1 000),次日用TBST浸洗30 min,分别与辣根过氧化物酶标记二抗(1:1 000稀释)室温下孵育1 h,TBST浸洗30 min。ECL化学发光显影液显影,并在凝胶成像系统中扫描拍照。利用Image lab软件对Western blot检测的条带灰度值进行图像分析,用GAPDH蛋白表达量进行组间矫正,得到蛋白表达半定量分析柱状图。
1.2.6 Transwell侵袭实验将Transwell小室置于24孔板中,100 μl基质胶与DMEM培养基按照1:7比例稀释,取70 μl稀释胶均匀铺到Transwell小室上室。各组细胞用胰酶消化并用无血清的DMEM培养基重悬,分别取1×105个/毫升、100 μl细胞悬液接种于Transwell小室上室,下室加入含20%FBS的DMEM培养液600 μl刺激迁移。于5%CO2培养箱37℃培养48 h后,移除上室细胞。用棉签擦拭清除上室中未穿膜的细胞后用4%多聚甲醛固定40 min,下室用结晶紫染色,于显微镜下随机选取5个视野观察并计数穿膜的相对细胞数量。
1.2.7 划痕实验将各组细胞在6孔板中铺板,培养至100%融合。融合的单层细胞以100 μl吸头垂直划线,再用PBS将划掉的细胞洗净,以相应的培养条件培养于37℃、5%CO2培养箱中。在0和24 h对划痕进行拍照,用Image J软件处理图像,通过对初始划线(0 h)和后期观察点(24 h)划痕的面积对比来计算划痕愈合率。
1.3 统计学方法应用SPSS17.0统计软件进行数据的统计学分析。计量数据统计采取均数±标准差(x±s)表示,组间比较采用单因素方差分析(One-Way ANOVA),两两比较采用LSD检验,以P < 0.05为差异有统计学意义。
2 结果 2.1 RSV浓度依赖性杀伤MDA-MB-231细胞活性CCK-8法结果显示,RSV对MDA-MB-231细胞具有显著的杀伤能力,所有RSV刺激组的MDA-MB-231细胞存活率较0 µmol/L组下降,同时细胞的存活率随着RSV刺激浓度增加而降低,浓度上升至5 µmol/L时开始出现统计学差异(均P < 0.05),说明RSV的肿瘤杀伤力呈现浓度依赖性,见图 1。我们将25 µmol/L作为后续实验浓度。
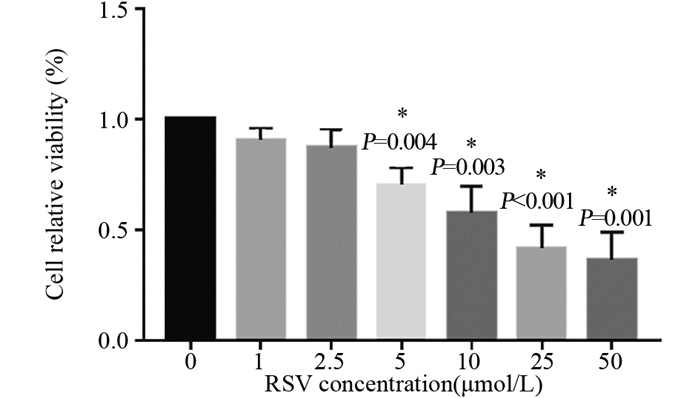
|
| *: compared with 0 μmol/L RSV group. 图 1 不同浓度RSV作用下MDA-MB-231细胞存活率 Figure 1 Viability of MDA-MB-231 cells after different concentration of RSV treatment |
POLD1-NC及POLD1-OE细胞株在普通显微镜下可见细胞轮廓突起于表面,荧光显微镜下显示绿色荧光,带绿色荧光的细胞比例超过90%,证实90%以上的MDA-MB-231细胞株皆稳定转染POLD1-NC或POLD1-OE,见图 2。
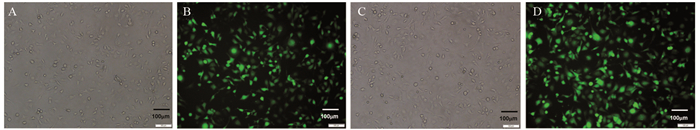
|
| A: POLD1-NC cells under the condition of bright field; B: the expression of GFP in POLD1-NC cells; C: POLD1-OE cells under the condition of bright field; D: the expression of GFP in POLD1-OE cells. 图 2 荧光显微镜下观察慢病毒转染MDA-MB-231细胞后GFP表达量(×100) Figure 2 GFP expression in MDA-MB-231 cells after lentiviral transfection observed under fluorescence microscope (×100) |
qRT-PCR实验结果显示:Ctrl组与POLD1-NC组细胞中POLD1 mRNA表达水平差异无统计学意义(P=0.954);而POLD1-OE组细胞中的POLD1 mRNA表达水平显著高于Ctrl组和POLD1-NC组(均P < 0.001),见图 3。
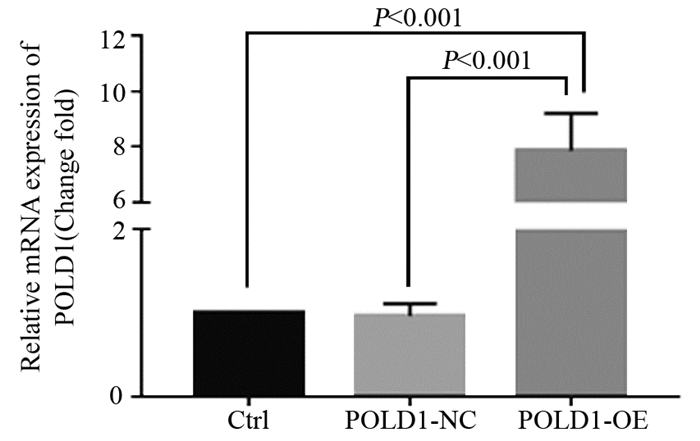
|
| 图 3 qRT-PCR实验检测各组细胞的POLD1 mRNA含量 Figure 3 mRNA expression level of POLD1 tested by qRT-PCR after transfection |
相对于POLD1-NC组,RSV+POLD1-NC组及RSV+POLD1-OE组的POLD1蛋白表达水平显著降低(P=0.003; P=0.013);相对于RSV+POLD1-NC组,RSV+POLD1-OE组中的POLD1表达水平更高(P=0.007),见图 4。
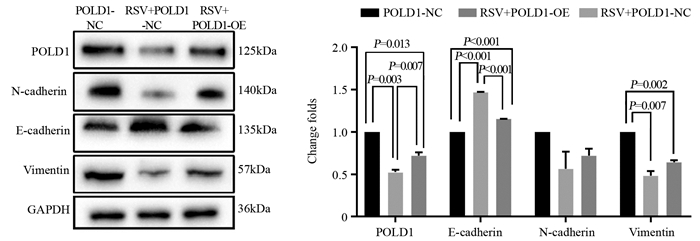
|
| 图 4 Western blot实验检测各组细胞中POLD1、E-Cadherin、N-Cadherin和Vimentin蛋白的表达水平 Figure 4 Protein expression levels of POLD1, E-Cadherin, N-Cadherin and Vimentin in each group detected by Western blot |
RSV刺激后,各组E-Cadherin的蛋白表达显著升高(均P < 0.001),N-Cadherin及Vimentin可观察到降低,但差异无统计学意义(P=0.136; P=0.060)。相对于RSV+POLD1-NC组,RSV+POLD1-OE组中E-Cadherin表达则显著降低(P < 0.001),N-Cadherin及Vimentin可观察到升高,但差异无统计学意义(P=0.879; P=0.054)。相对于POLD1-NC组,RSV+POLD1-OE组中N-Cadherin及Vimentin的表达低于POLD1-NC组(P=0.002; P=0.007),下降幅度小于RSV+POLD1-NC组;E-Cadherin的蛋白表达量可观察到升高(P > 0.001),见图 4。
2.5 Transwell实验结果结果表明,POLD1-NC组穿膜细胞为34.5±2.08个,RSV+POLD1-NC组穿膜细胞为21.75±4.99个,RSV+POLD1-OE组穿膜细胞为34.75±3.30个。RSV+POLD1-NC组与其他两组相比穿膜细胞数明显较少(均P=0.001),见图 5。
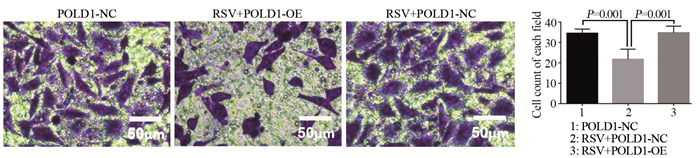
|
| 图 5 Transwell实验测定各组细胞侵袭能力(×200) Figure 5 Invasion ability of MDA-MB-231 cells in each group detected by Transwell assay (×200) |
结果表明,经过24 h愈合时间后POLD1-NC组愈合率为(32.03±2.02)%,RSV+POLD1-NC组愈合率为(13.43±1.53)%,RSV+POLD1-OE组愈合率为(28.35%±0.89)%,RSV+POLD1-NC组与其他两组相比,愈合率减少(均P < 0.001),见图 6。
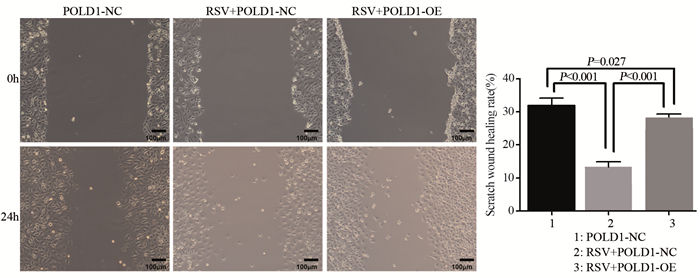
|
| 图 6 细胞划痕实验测各组细胞划痕愈合率(×100) Figure 6 Healing rate of MDA-MB-231 cells in each group detected by cell wound scratch assay (×100) |
POLD1表达水平或活性的升高会引起肿瘤细胞大量增殖,促进肿瘤的发生发展[9],此外其还与癌细胞的侵袭能力密切相关。Sanefuji等[10]报道,POLD1是评估肝癌细胞活性及侵袭能力的重要指标之一,其表达水平与癌细胞血管侵犯的程度相关。Sigurdson等[11]的研究发现,过度的POLD1表达会增加患乳腺癌的风险。我们的前期研究也发现POLD1不仅在乳腺癌组织中高表达[4],且高表达的POLD1还常与更多的淋巴结转移、更差的预后关系密切(P < 0.05)[12]。同时POLD1还参与了乳腺癌EMT的调节过程,沉默乳腺癌细胞中POLD1的表达能够显著抑制细胞的迁移侵袭能力[13]。此外POLD1还被发现与癌细胞的耐药性相关,POLD1表达的异常可引起细胞耐药性增强,敲除POLD1表达后细胞的药敏性可恢复至正常水平[14]。
EMT被认为是评价耐药性的指标之一,其机制与EMT癌细胞具有部分肿瘤干细胞(cancer stem cells, CSCs)的特性、耐药通路激活[15]、高表达AT P结合盒转运子(ATP-binding cassette, ABC)蛋白加速了药物的外流[16]有关。故而,如何靶向抑制细胞的EMT状态从而逆转细胞的耐药性成为了一些学者的关注重点。RSV对癌细胞EMT的抑制或逆转已被广泛证实[17],此外还被证实可以通过抑制EMT从而逆转癌细胞对化疗药物的耐药性[18-19],因此也被当做是一种抑癌治疗的增敏剂。
本研究也发现RSV能够显著抑制MDA-MB-231细胞的侵袭迁移能力,同时下调N-Cadherin及Vimentin的表达,上调E-Cadherin的表达,再次验证了RSV对MDA-MB-231细胞EMT的抑制作用。同时我们还首次发现了RSV对POLD1蛋白表达水平的下调作用。如前所述,POLD1与乳腺癌EMT关系密切,然而POLD1在RSV抑制EMT过程中的作用尚不明确。既往文献提示RSV的重要靶点P53是调控POLD1表达的上游因子,而P53是调控POLD1启动子活性的关键上游,据此我们可以推测RSV可能主要在转录水平调控POLD1表达。本研究使用慢病毒构建异位表达POLD1的MDA-MB-231细胞株,使细胞在RSV刺激下依然能保持POLD1的表达水平,模拟POLD1上游因子调控失常的效果。随后发现,RSV对POLD1-OE细胞的侵袭迁移能力及EMT水平的抑制作用显著弱于对正常的MDA-MB-231细胞,说明下调POLD1可能是RSV抑制MDA-MB-231细胞EMT的关键机制之一。
综上所述,RSV对乳腺癌MDA-MB-231细胞具有杀伤作用,并可能通过下调POLD1的表达进而抑制MDA-MB-231细胞的EMT过程。此外我们还发现过表达的POLD1可以在一定程度上拮抗RSV对MDA-MB-231细胞EMT的抑制作用,因此我们推断POLD1可能是调控MDA-MB-231细胞EMT过程的关键通路之一。由于EMT调控网络的错综复杂,故本研究还存在一定的局限性,因此,本课题组将进一步探索RSV对乳腺癌MDA-MB-231细胞EMT过程的作用机制,为临床研发抗癌新药和治疗靶点提供新的思路。
作者贡献:
王梦欣、梁至洁:细胞实验、数据分析及文章撰写
黄东琳:数据收集整理
万言、蒋洪棉:细胞实验、数据收集整理
黎洪棉:细胞实验、数据复核及文稿校正
陈茂剑:数据复核及文稿校正
韦长元:实验设计
| [1] |
Lambert AW, Pattabiraman DR, Weinberg RA. Emerging biological principles of metastasis[J]. Cell, 2017, 168(4): 670-691. DOI:10.1016/j.cell.2016.11.037 |
| [2] |
Guen VJ, Chavarria TE, Kröger C, et al. EMT programs promote basal mammary stem cell and tumor-initiating cell stemness by inducing primary ciliogenesis and Hedgehog signaling[J]. Proc Natl Acad Sci U S A, 2017, 114(49): E10532-E10539. DOI:10.1073/pnas.1711534114 |
| [3] |
Zhou Y, Liang C, Xue F, et al. Salinomycin decreases doxorubicin resistance in hepatocellular carcinoma cells by inhibiting the β-catenin/TCF complex association via FOXO3a activation[J]. Oncotarget, 2015, 6(12): 10350-10365. DOI:10.18632/oncotarget.3585 |
| [4] |
Zhang L, Yang W, Zhu X, et al. p53 inhibits the expression of p125 and the methylation of POLD1 gene promoter by downregulating the Sp1-induced DNMT1 activities in breast cancer[J]. Onco Targets Ther, 2016, 9: 1351-1360. |
| [5] |
Xu Y, Qin Q, Chen R, et al. SIRT1 promotes proliferation, migration, and invasion of breast cancer cell line MCF-7 by upregulating DNA polymerase delta1 (POLD1)[J]. Biochem Biophys Res Commun, 2018, 502(3): 351-357. DOI:10.1016/j.bbrc.2018.05.164 |
| [6] |
Kim YN, Choe SR, Cho KH, et al. Resveratrol suppresses breast cancer cell invasion by inactivating a RhoA/YAP signaling axis[J]. Exp Mol Med, 2017, 49(2): e296. DOI:10.1038/emm.2016.151 |
| [7] |
Xu J, Liu D, Niu H, et al. Resveratrol reverses Doxorubicin resistance by inhibiting epithelial-mesenchymal transition (EMT) through modulating PTEN/Akt signaling pathway in gastric cancer[J]. J Exp Clin Cancer Res, 2017, 36(1): 19. DOI:10.1186/s13046-016-0487-8 |
| [8] |
Giménez-Bastida JA, Ávila-Gálvez MÁ, Espín JC, et al. Conjugated Physiological Resveratrol Metabolites Induce Senescence in Breast Cancer Cells: Role of p53/p21 and p16/Rb Pathways, and ABC Transporters[J]. Mol Nutr Food Res, 2019, 63(22): e1900629. DOI:10.1002/mnfr.201900629 |
| [9] |
Nicolas E, Golemis EA, Arora S. POLD1: Central mediator of DNA replication and repair, and implication in cancer and other pathologies[J]. Gene, 2016, 590(1): 128-141. DOI:10.1016/j.gene.2016.06.031 |
| [10] |
Sanefuji K, Taketomi A, Iguchi T, et al. Significance of DNA polymerase delta catalytic subunit p125 induced by mutant p53 in the invasive potential of human hepatocellular carcinoma[J]. Oncology, 2010, 79(3-4): 229-237. DOI:10.1159/000322374 |
| [11] |
Sigurdson AJ, Hauptmann M, Chatterjee N, et al. Kin-cohort estimates for familial breast cancer risk in relation to variants in DNA base excision repair, BRCA1 interacting and growth factor genes[J]. BMC Cancer, 2004, 4: 9. DOI:10.1186/1471-2407-4-9 |
| [12] |
Qin Q, Tan Q, Li J, et al. Elevated expression of POLD1 is associated with poor prognosis in breast cancer[J]. Oncol Lett, 2018, 16(5): 5591-5598. |
| [13] |
Xu Y, Qin Q, Chen R, et al. SIRT1 promotes proliferation, migration, and invasion of breast cancer cell line MCF-7 by upregulating DNA polymerase delta1 (POLD1)[J]. Biochem Biophys Res Commun, 2018, 502(3): 351-357. DOI:10.1016/j.bbrc.2018.05.164 |
| [14] |
Karkhanis V, Wang L, Tae S, et al. Protein arginine methyltransferase 7 regulates cellular response to DNA damage by methylating promoter histones H2A and H4 of the polymerase δ catalytic subunit gene, POLD1[J]. J Biol Chem, 2012, 287(35): 29801-29814. DOI:10.1074/jbc.M112.378281 |
| [15] |
Mani SA, Guo W, Liao MJ, et al. The epithelial-mesenchymal transition generates cells with properties of stem cells[J]. Cell, 2008, 133(4): 704-715. DOI:10.1016/j.cell.2008.03.027 |
| [16] |
Saxena M, Stephens MA, Pathak H, et al. Transcription factors that mediate epithelial-mesenchymal transition lead to multidrug resistance by upregulating ABC transporters[J]. Cell Death Dis, 2011, 2(7): e179. DOI:10.1038/cddis.2011.61 |
| [17] |
Sun Y, Zhou QM, Lu YY, et al. Resveratrol Inhibits the Migration and Metastasis of MDA-MB-231 Human Breast Cancer by Reversing TGF-β1-Induced Epithelial-Mesenchymal Transition[J]. Molecules, 2019, 24(6): 1311. |
| [18] |
Alayev A, Berger SM, Holz MK. Resveratrol as a novel treatment for diseases with mTOR pathway hyperactivation[J]. Ann N Y Acad Sci, 2015, 1348(1): 116-123. DOI:10.1111/nyas.12829 |
| [19] |
Chatterjee B, Ghosh K, Kanade SR. Resveratrol modulates epigenetic regulators of promoter histone methylation and acetylation that restores BRCA1, p53, p21(CIP1) in human breast cancer cell lines[J]. Biofactors, 2019, 45(5): 818-829. DOI:10.1002/biof.1544 |
 2021, Vol. 48
2021, Vol. 48


