文章信息
- 人类肿瘤中Tie2阳性单核巨噬细胞研究进展
- Tie2 Expressing Monocytes/Macrophages in Human Tumors
- 肿瘤防治研究, 2021, 48(3): 314-318
- Cancer Research on Prevention and Treatment, 2021, 48(3): 314-318
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.20.1145
- 收稿日期: 2020-09-27
- 修回日期: 2020-12-02
肿瘤相关巨噬细胞(tumor associated macrophages, TAMs)是一类具有高度异质性和可塑性的细胞,有M1(抗瘤)和M2(促瘤)两种表型。在微环境的介导下,肿瘤浸润的巨噬细胞发生M2型极化,通过钝化抗肿瘤免疫、刺激血管淋巴管生成、促进细胞侵袭和转移,参与肿瘤进展,且与患者的不良预后相关[1]。Tie2阳性单核巨噬细胞(Tie2 expressing monocytes/macrophages, TEMs)是表达酪氨酸激酶受体Tie2(tyrosine kinase receptors with immunoglobulin and EGF homology domains receptors-2)的单核巨噬细胞,是促血管生成和组织重塑功能极强的TAMs亚群[2]。
Tie2是人血管生成素(angiopoietin, Ang)1、2、4的受体,主要表达于内皮细胞,参与调控胚胎血管发育、伤口愈合和肿瘤血管新生等生理和病理性血管生成过程。2003年De Palma等首次发现表达Tie2的CD11b+骨髓来源细胞,并命名为TEMs[3],后续研究发现肿瘤浸润TEMs承担大部分骨髓来源细胞的血管生成活性[2],同时参与肿瘤淋巴管生成[4]和抑制肿瘤特异性免疫反应[5],是TAMs中发挥促瘤作用的重要细胞亚群。
本文就TEMs在肿瘤中的浸润、功能及其机制进行综述,并总结其作为肿瘤标志物的临床价值和可能的靶向治疗策略,为肿瘤的精准治疗提供新的思路。
1 TEMs在肿瘤患者外周血和癌组织中比例增高健康人的外周血中TEMs约占总外周血单个核细胞(PBMC)的1.6%~7.4%,而肿瘤患者外周血中TEMs含量显著增高[6]。Wang等分析发现卵巢癌患者外周血中TEMs(CD14+Tie2+)占单核细胞(CD14+)的比例(n=30, 5.77%±4.86%)显著高于健康志愿者(n=25, 2.25%±2.89%, P=0.0024)和良性囊肿患者(n=52, 2.96%±4.85%, P=0.0124)[7];另有研究发现肝癌患者外周血中TEMs(CD14+CD16+Tie2+)占单核细胞(CD14+CD16+)的比例(n=82, 3.77%~13.45%)高于肝硬化患者(n=29, 2.36%~9.43%, P<0.05)[8]。
肿瘤细胞和肿瘤相关内皮细胞均可表达Ang2,使局部Ang2水平升高,从而趋化外周血TEMs向肿瘤部位迁移[6];且TEMs表达趋化因子受体CXCR4,肿瘤部位的趋化因子CXCL12亦可介导TEMs的招募[9],使肿瘤组织中浸润的TEMs增加。乳腺癌患者肿瘤组织中约有95%的CD14+细胞表达高水平Tie2[4];肾癌患者肿瘤组织中TEMs(CD14+Tie2+)占单核细胞(CD14+)的比例约23.15%~84.32%(中位数62.12%),而配对的远处正常组织中TEMs仅占1.51%~12.33%(中位数4.88%)[10]。
2 癌相关TEMs来源肿瘤组织TAMs可来源于骨髓细胞和组织滞留巨噬细胞[11],为了明确TEMs的来源,De Palma等用绿色荧光蛋白GFP特异性标记小鼠骨髓祖细胞的Tie2,发现肿瘤部位有一群表达GFP的CD45+Gr1-CD11b+CD31-单核细胞,且与内皮细胞(GFP-CD11b-CD31+)混杂在一起,表明肿瘤浸润TEMs可来源于骨髓,且与血管生成有关[3]。而外周血中的单核细胞根据细胞表面Gr1、Ccr2(单核细胞趋化因子CCL2的受体)、CD621(Sell,L-选择素)、CX3CL1(趋化因子fractalkine的受体)和CD43(唾液蛋白)表达的不同可分为Gr1+Ccr2+CD621+CX3CL1lowCD43-炎性单核细胞(来源于骨髓)和Gr1-Ccr2-CD621-CX3CL1highCD43+滞留单核细胞两种[12]。Pucci等发现荷瘤小鼠肿瘤浸润TEMs与正常小鼠外周血Gr1-滞留单核细胞有相似的基因表型,如Arg1、Igf1、Cxcl12、Lyve1、Stab 1、Cd163、Edg1、Mrc1表达上调,而Sell、Ccr2、Ptgs2/Cox2表达下调,提示来源于滞留单核细胞的循环TEMs可迁移至肿瘤组织[2]。
肿瘤TEMs通过以下方式实现Tie2表达上调。研究发现肿瘤缺氧可显著上调单核细胞或单核细胞来源巨噬细胞表面Tie2的表达,使肿瘤TEMs增加[13]。此外,胶原三股螺旋重复蛋白1(CTHRC1)在多种实体瘤中表达升高,可通过ERK-AP-1途径上调肿瘤内皮细胞Ang2表达进而介导肿瘤TEMs的增加[14]。
3 TEMs促进肿瘤生长转移的作用和机制 3.1 TEMs促进肿瘤血管生成血管生成是肿瘤进展的主要限速步骤之一[15],因血管内皮细胞中Ang-Tie2轴调控血管生成的作用在多种模型中得到验证[16],所以TEMs对肿瘤血管生成的作用受到广泛关注。
Coffelt等通过体外内皮细胞发芽和成管实验发现健康人外周血中的TEMs(CD14+Tie2+)已经具有促血管生成活性,与这些TEMs与Tie2-单核细胞(TNMs)相比,MMP9、VEGFA、COX-2、WNT5A及MRC1的mRNA水平更高,且分泌更高水平的促血管生成因子MMP9和VEGFA[17]。Venneri等在体内动物试验中得到相同的结果,将健康人外周血中的TEMs(CD14+Tie2+)和TNMs(CD14+Tie2-)分别与人恶性胶质瘤细胞系U87按一定比例混合注射,使裸鼠形成皮下瘤,发现TEMs组从肿瘤周围向中心延伸出丰富的血管网络,而TNMs组仅在肿瘤外周排列有小的内生血管边缘、中心区只有少量的新生血管,说明TEMs与TNMs相比更能促进肿瘤血管生成,而且TEMs组的瘤体积比TNMs组更大,提示TEMs对肿瘤生长具有促进作用[6]。
研究发现肾细胞癌患者肿瘤组织微血管密度(MVD)与肿瘤浸润TEMs(CD14+Tie2+)有关,TEMs占单核细胞(CD14+)比例越高,MVD越高(P<0.0001)[10];卵巢癌患者肿瘤组织MVD同样与肿瘤浸润TEMs(CD68+Tie2+)占巨噬细胞(CD68+)的比例呈正相关[7],从临床病理组织层面说明肿瘤浸润TEMs可以促进肿瘤血管生成。
3.2 TEMs促进肿瘤淋巴管生成淋巴结转移是肿瘤转移的主要方式之一,淋巴管生成则是发生淋巴结转移的重要机制[18],且越来越多的证据表明TAMs可参与肿瘤淋巴管生成[19],TEMs亦如此。
Bron等分析乳腺癌患者的组织切片,发现TEMs可表达经典的淋巴管标志物血管内皮生长因子受体(VEGFR-2、VEGFR-3)、淋巴管内皮透明质酸受体、平足蛋白以及VEGFR共受体神经纤毛蛋白2,且有部分TEMs嵌入到淋巴管结构中,提示TEMs很可能参与肿瘤淋巴管生成;角膜淋巴管生成和3D纤维蛋白凝胶淋巴管生成试验则分别在体内和体外证明TEMs可促进淋巴管生成;而且同时抑制Tie2和VEGFR激酶活性时TEMs的促淋巴管生成功能被明显抑制,提示Tie2和VEGFR协同控制肿瘤TEMs的促淋巴生成活性[4]。在宫颈癌中,循环TEMs比例与淋巴结转移有关[20],提示肿瘤组织TEMs很可能通过促进淋巴管生成进而促进肿瘤发生淋巴结转移。
3.3 TEMs参与免疫抑制微环境的形成TEMs在肿瘤免疫方面的功能也受到研究者们的关注。Coffelt等将健康志愿者外周血中分离得到的TEMs和自体CD3+T细胞按1:1的比例在体外共培养,发现经Ang2预处理的TEMs(Ang2-TEMs)可抑制T细胞增殖,加入IL-10抗体则可逆转Ang2-TEMs的抑制作用,提示Ang2-TEMs通过IL-10发挥抑制作用;分析共培养后CD3+T细胞的亚群情况,发现Ang2-TEMs组CD8+细胞毒性T细胞的比例下降、CD4+调节性T细胞比例显著上升,且CD4+T细胞中CD4+CD25+FOXP3+Treg细胞(CD4+T细胞的活化状态)比例升高,IL-10抗体同样可以逆转这种现象;分选出Ang2-TEMs与CD3+T细胞共培养后的CD4+CD25+FOXP3+Treg细胞再次与自体CD3+T细胞共培养,这些Treg细胞也能抑制T细胞增殖;这一结果在MMTV-PyMT小鼠自发乳腺癌和4T1乳腺癌皮下瘤模型中得到验证,但肿瘤组织中Ang2水平和TEMs(F4/80+Tie2+)表达的IL-10水平升高仅在肿瘤生长早期出现,提示在肿瘤环境中升高的Ang2诱导TEMs高表达IL-10,使CD4+CD25+FOXP3+Treg细胞池扩张、抑制T细胞增殖,促进肿瘤早期进展[21]。
此外,Ibberson等将从侵袭性乳腺癌患者新鲜肿瘤组织中分选出的TEMs和CD11c+树突状细胞(DCs)分别或同时与自体外周血T细胞在体外共培养,DCs可提呈肿瘤抗原、刺激T细胞发生肿瘤特异性反应导致T细胞增殖,虽然TEMs与T细胞单独共培养可刺激T细胞发生轻微增殖,但当TEMs和DCs同时与T细胞共培养时TEMs反而抑制DCs刺激T细胞增殖的作用[5];后续研究发现乳腺癌患者肿瘤组织中的TEMs和DCs均表达抗原提呈细胞的标记如HLA-DR、CD80、CD86及CD1a,且TEMs表面CD86水平(93.3±3.7)显著高于DCs(28.4±8.5, P<0.01),加入CD86抗体可逆转肿瘤TEMs对DCs功能的抑制作用,说明肿瘤TEMs通过高表达CD86抑制DCs功能进而阻碍T细胞发生肿瘤特异性反应[5]。由此可见,肿瘤TEMs不仅可以抑制T细胞增殖,还能抑制T细胞发生肿瘤特异性反应,从而发挥免疫抑制的作用,促进肿瘤进展。
综上所述,TEMs主要依靠其促血管生成、淋巴管生成和免疫抑制等功能来发挥促进肿瘤生长和转移的作用。
4 TEMs作为肿瘤生物标志物的临床意义 4.1 循环TEMs的临床诊断价值循环TEMs在肿瘤患者中显著增高,提示其作为临床诊断指标的可能性。研究报道发现AFP阴性的肝细胞癌患者外周血单核细胞中TEMs的比例明显高于乙肝肝硬化、慢性乙肝感染者和健康人,且循环TEMs区分AFP阴性肝细胞癌和乙肝肝硬化的敏感度和特异性可达到80.0%和65.52%[8],提示TEMs可作为AFP阴性肝细胞癌的补充标志物用于鉴别诊断。最新研究发现外周血中TEMs比例在非小细胞肺癌[22]和宫颈癌[20]中亦可作为潜在的诊断标志物。
4.2 肿瘤组织中TEMs可作为肿瘤患者的预后标志物回顾性研究发现肝细胞癌患者随肿瘤组织TEMs浸润增多,其肝脏部分切除术后的生存率相应下降,肿瘤TEMs浸润丰富的患者1、3、5年生存率分别为63.3%、42.8%、42.8%,均低于TEMs浸润缺乏的患者(79.6%、77.1%、75.0%)[23]。在肾细胞癌[10]中发现相似的结果,但在肝门胆管癌的回顾性研究中出现了不同的结果,肿瘤组织TEMs浸润丰富的肝门胆管癌患者术后1、3、5年生存率分别为83.2%、62.2%、56.6%,均高于TEMs浸润缺乏的患者(71.3%、36.3%、14.9%)[24]。所以肿瘤浸润TEMs在不同肿瘤中所代表的预后和生存情况可能是不一样的,还需具体情况具体分析。
4.3 肿瘤组织中TEMs可作为治疗反应的标志物在小鼠乳腺癌模型中,抗血管药物CA4P治疗后会引起肿瘤浸润TEMs(CD31-F4/80+Tie2+)增加,启动血管修复进而限制CA4P的疗效[9];而且TEMs浸润增加与小鼠恶性胶质瘤抗VEGF药物贝伐单抗治疗后的耐药、复发及侵袭表型有关[25]。肿瘤组织TEMs浸润增加还与肝细胞癌[23]、肾细胞癌[10]和非小细胞肺癌[22]等多种肿瘤的术后复发率呈正相关,与肝门胆管癌[24]术后复发率呈负相关,提示组织TEMs可评估多种肿瘤治疗方式的治疗反应。
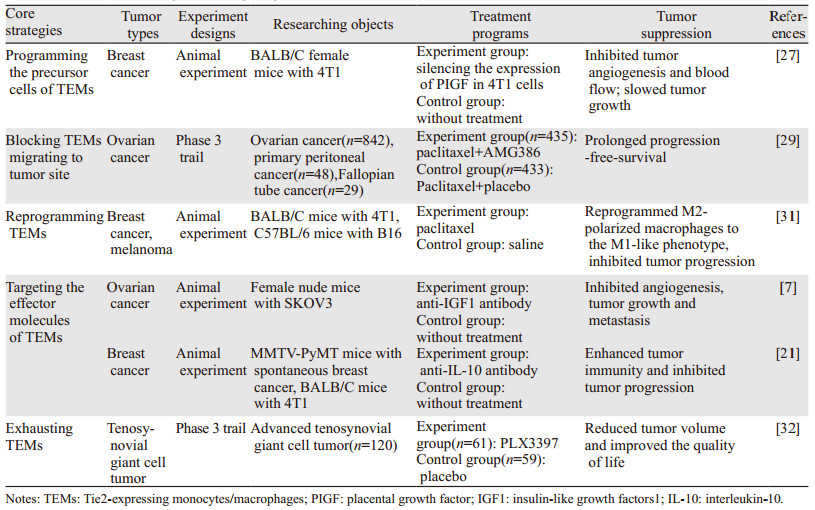
5 靶向TEMs的治疗策略TEMs作为TAMs的亚群,参考TAMs的治疗策略[26],目前针对TEMs预计的可行治疗方向主要有以下几点:(1)改造TEMs的前体细胞。改造前体细胞使其不能分化成TEMs,从源头减少TEMs的形成。乳腺癌患者的血浆通过胎盘生长因子(PIGF)诱导CD34+造血祖细胞分化成具有促血管和淋巴管生成活性的Tie2+CD11b+骨髓细胞,沉默鼠源乳腺癌细胞系4T1中PIGF的表达,可使CD34+造血祖细胞向TEMs分化减少,阻碍肿瘤血管生成和血流灌注,进而抑制肿瘤生长[27];(2)阻断趋化因子,防止TEMs向肿瘤部位聚集。TEMs的促血管生成活性和肿瘤招募TEMs受Ang-Tie2轴的严格调控[17],故成为临床试验治疗的目标。AMG386可抑制Ang1/2-Tie2相互作用,其单独或联合化疗应用在多种实体瘤中均有效果[28],尤其是卵巢癌[29];(3)重塑TEMs。肿瘤浸润TEMs表现为M2型[2],重塑TEMs使其变成M1型巨噬细胞,可抑制肿瘤血管生成、改变肿瘤免疫微环境从而推迟肿瘤生长,延长生存期[30]。负荷乳腺癌4T1或黑色素瘤B16的C57BL/6小鼠经紫杉醇处理后M1型巨噬细胞比例显著上升,且有抑制肿瘤进展的作用[31];(4)靶向TEMs的效应分子。TEMs发挥不同功能所依赖的效应因子是不同的,所以可靶向的目标是多样的。卵巢癌TEMs经Ang2趋化诱导后可旁分泌IGF1,使肿瘤血管内皮细胞IGF1R磷酸化增加以促进血管生成,动物试验证明应用IGF1抗体可以逆转这种促进肿瘤血管生成的作用,进而抑制肿瘤生长和转移,所以Ang2-TEMs-IGF1很可能成为潜在的治疗靶点[7];(5)耗竭TEMs。通过药物、免疫毒素偶联抗体靶向TEMs,进而导致TEMs的耗竭也是不错的思路。临床Ⅲ期试验表明CSF-1R抑制剂PLX3397的使用可使巨噬细胞耗竭,从而抑制腱鞘巨细胞瘤的进展,并显著改善患者生活质量[32];但这种治疗方式的靶向毒性即肿瘤外巨噬细胞的清除以及长期使用后的耐药性是仍需面对的挑战,见表 1。
TEMs在肿瘤患者外周血和癌组织中占单核巨噬细胞的比例显著增加,通过促进血管和淋巴管生长、抑制肿瘤免疫从而驱动肿瘤转移和进展。初步证据显示,循环TEMs可作为新型标志物用于肿瘤早期诊断和预后预测,一些靶向TEMs的治疗方案正在临床前和临床研究阶段。循环和组织浸润TEMs作为肿瘤标志物和治疗靶点的临床价值还有待进一步研究。
作者贡献
江楚怡:构思、设计并撰写文章
蔡晶、王泽华:修改文章
陈媛媛:协助获取及分析数据
| [1] |
Turrini R, Pabois A, Xenarios I, et al. TIE-2 expressing monocytes in human cancers[J]. Oncoimmunology, 2017, 6(4): e1303585. DOI:10.1080/2162402X.2017.1303585 |
| [2] |
Pucci F, Venneri MA, Biziato D, et al. A distinguishing gene signature shared by tumor-infiltrating Tie2-expressing monocytes, blood "resident" monocytes, and embryonic macrophages suggests common functions and developmental relationships[J]. Blood, 2009, 114(4): 901-914. DOI:10.1182/blood-2009-01-200931 |
| [3] |
De Palma M, Venneri MA, Roca C, et al. Targeting exogenous genes to tumor angiogenesis by transplantation of genetically modified hematopoietic stem cells[J]. Nat Med, 2003, 9(6): 789-795. DOI:10.1038/nm871 |
| [4] |
Bron S, Henry L, Faes-Van't Hull E, et al. TIE-2-expressing monocytes are lymphangiogenic and associate specifically with lymphatics of human breast cancer[J]. Oncoimmunology, 2016, 5(2): e1073882. DOI:10.1080/2162402X.2015.1073882 |
| [5] |
Ibberson M, Bron S, Guex N, et al. TIE-2 and VEGFR kinase activities drive immunosuppressive function of TIE-2-expressing monocytes in human breast tumors[J]. Clin Cancer Res, 2013, 19(13): 3439-3449. DOI:10.1158/1078-0432.CCR-12-3181 |
| [6] |
Venneri MA, De Palma M, Ponzoni M, et al. Identification of proangiogenic TIE2-expressing monocytes (TEMs) in human peripheral blood and cancer[J]. Blood, 2007, 109(12): 5276-5285. DOI:10.1182/blood-2006-10-053504 |
| [7] |
Wang X, Zhu Q, Lin Y, et al. Crosstalk between TEMs and endothelial cells modulates angiogenesis and metastasis via IGF1-IGF1R signalling in epithelial ovarian cancer[J]. Br J Cancer, 2017, 117(9): 1371-1382. DOI:10.1038/bjc.2017.297 |
| [8] |
Mao L, Wang Y, Wang D, et al. TEMs but not DKK1 could serve as complementary biomarkers for AFP in diagnosing AFP-negative hepatocellular carcinoma[J]. PLoS One, 2017, 12(9): e0183880. DOI:10.1371/journal.pone.0183880 |
| [9] |
Welford AF, Biziato D, Coffelt SB, et al. TIE2-expressing macrophages limit the therapeutic efficacy of the vascular-disrupting agent combretastatin A4 phosphate in mice[J]. J Clin Invest, 2011, 121(5): 1969-1973. DOI:10.1172/JCI44562 |
| [10] |
Ji J, Zhang G, Sun B, et al. The frequency of tumor-infiltrating Tie-2-expressing monocytes in renal cell carcinoma: its relationship to angiogenesis and progression[J]. Urology, 2013, 82(4): 974.e9-974.e13. |
| [11] |
Franklin RA, Liao W, Sarkar A, et al. The cellular and molecular origin of tumor-associated macrophages[J]. Science, 2014, 344(6186): 921-925. DOI:10.1126/science.1252510 |
| [12] |
Geissmann F, Auffray C, Palframan R, et al. Blood monocytes: distinct subsets, how they relate to dendritic cells, and their possible roles in the regulation of T-cell responses[J]. Immunol Cell Biol, 2008, 86(5): 398-408. DOI:10.1038/icb.2008.19 |
| [13] |
Steinberger K J, Forget M A, Bobko A A, et al. Hypoxia-Inducible Factor α Subunits Regulate Tie2-Expressing Macrophages That Influence Tumor Oxygen and Perfusion in Murine Breast Cancer[J]. J Immunol, 2020, 205(8): 2301-2311. DOI:10.4049/jimmunol.2000185 |
| [14] |
Lee J, Song J, Kwon ES, et al. CTHRC1 promotes angiogenesis by recruiting Tie2-expressing monocytes to pancreatic tumors[J]. Exp Mol Med, 2016, 48(9): e261. DOI:10.1038/emm.2016.87 |
| [15] |
Carmeliet P, Jain RK. Angiogenesis in cancer and other diseases[J]. Nature, 2000, 407(6801): 249-257. DOI:10.1038/35025220 |
| [16] |
Felcht M, Luck R, Schering A, et al. Angiopoietin-2 differentially regulates angiogenesis through TIE2 and integrin signaling[J]. J Clin Invest, 2012, 122(6): 1991-2005. DOI:10.1172/JCI58832 |
| [17] |
Coffelt SB, Tal AO, Scholz A, et al. Angiopoietin-2 regulates gene expression in TIE2-expressing monocytes and augments their inherent proangiogenic functions[J]. Cancer Res, 2010, 70(13): 5270-5280. DOI:10.1158/0008-5472.CAN-10-0012 |
| [18] |
Karaman S, Detmar M. Mechanisms of lymphatic metastasis[J]. J Clin Invest, 2014, 124(3): 922-928. DOI:10.1172/JCI71606 |
| [19] |
Weichand B, Popp R, Dziumbla S, et al. S1PR1 on tumor-associated macrophages promotes lymphangiogenesis and metastasis via NLRP3/IL-1β[J]. J Exp Med, 2017, 214(9): 2695-2713. DOI:10.1084/jem.20160392 |
| [20] |
Han Q, Zhang Q, Y F, et al. Circulating Tie2-Expressing Monocytes: A Potential Biomarker for Cervical Cancer[J]. Onco Targets Ther, 2020, 13: 8877-8885. DOI:10.2147/OTT.S262110 |
| [21] |
Coffelt SB, Chen YY, Muthana M, et al. Angiopoietin 2 stimulates TIE2-expressing monocytes to suppress T cell activation and to promote regulatory T cell expansion[J]. J Immunol, 2011, 186(7): 4183-4190. DOI:10.4049/jimmunol.1002802 |
| [22] |
Xue R, Sheng Y, Duan X, et al. Tie2-expressing monocytes as a novel angiogenesis-related cellular biomarker for non-small cell lung cancer[J]. Int J Cancer, 2021, 48(6): 1519-1528. |
| [23] |
Atanasov G, Dino K, Schierle K, et al. Angiogenic inflammation and formation of necrosis in the tumor microenvironment influence patient survival after radical surgery for de novo hepatocellular carcinoma in non-cirrhosis[J]. World J Surg Oncol, 2019, 17(1): 217. DOI:10.1186/s12957-019-1756-8 |
| [24] |
Atanasov G, Hau HM, Dietel C, et al. Prognostic significance of TIE2-expressing monocytes in hilar cholangiocarcinoma[J]. J Surg Oncol, 2016, 114(1): 91-98. DOI:10.1002/jso.24249 |
| [25] |
Gabrusiewicz K, Liu D, Cortes-santiago N, et al. Anti-vascular endothelial growth factor therapy-induced glioma invasion is associated with accumulation of Tie2-expressing monocytes[J]. Oncotarget, 2014, 5(8): 2208-2220. DOI:10.18632/oncotarget.1893 |
| [26] |
Mantovani A, Marchesi F, Malesci A, et al. Tumour-associated macrophages as treatment targets in oncology[J]. Nat Rev Clin Oncol, 2017, 14(7): 399-416. DOI:10.1038/nrclinonc.2016.217 |
| [27] |
Laurent J, Hull EF, Touvrey C, et al. Proangiogenic factor PlGF programs CD11b(+) myelomonocytes in breast cancer during differentiation of their hematopoietic progenitors[J]. Cancer Res, 2011, 71(11): 3781-3791. DOI:10.1158/0008-5472.CAN-10-3684 |
| [28] |
Chiu JW, Hotte SJ, Kollmannsberger CK, et al. A phase Ⅰ trial of ANG1/2-Tie2 inhibitor trebaninib (AMG386) and temsirolimus in advanced solid tumors (PJC008/NCI#9041)[J]. Invest New Drugs, 2016, 34(1): 104-111. DOI:10.1007/s10637-015-0313-8 |
| [29] |
Monk B J, Poveda A, Vergote I, et al. Final results of a phase 3 study of trebananib plus weekly paclitaxel in recurrent ovarian cancer (TRINOVA-1): Long-term survival, impact of ascites, and progression-free survival-2[J]. Gynecol Oncol, 2016, 143(1): 27-34. DOI:10.1016/j.ygyno.2016.07.112 |
| [30] |
Mahlbacher G, Curtis LT, Lowengrub J, et al. Mathematical modeling of tumor-associated macrophage interactions with the cancer microenvironment[J]. J Immunother Cancer, 2018, 6(1): 10. DOI:10.1186/s40425-017-0313-7 |
| [31] |
Wanderley CW, Colón DF, Luiz JPM, et al. Paclitaxel Reduces Tumor Growth by Reprogramming Tumor-Associated Macrophages to an M1 Profile in a TLR4-Dependent Manner[J]. Cancer Res, 2018, 78(20): 5891-5900. |
| [32] |
Tap WD, Gelderblom H, Palme rini E, et al. Pexidartinib versus placebo for advanced tenosynovial giant cell tumour (ENLIVEN): a randomised phase 3 trial[J]. Lancet, 2019, 394(10197): 478-487. DOI:10.1016/S0140-6736(19)30764-0 |
 2021, Vol. 48
2021, Vol. 48