文章信息
- 高危型绒癌3例和侵蚀性葡萄胎1例报道
- Report of Three Cases of High Risk Choriocarcinoma and One Case of Invasive Hydatidiform Mole
- 肿瘤防治研究, 2021, 48(4): 433-435
- Cancer Research on Prevention and Treatment, 2021, 48(4): 433-435
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.20.1141
- 收稿日期: 2020-09-27
- 修回日期: 2020-12-26
妊娠滋养细胞肿瘤(gestational trophoblastic neoplasia, GTN)是来源于胎盘滋养细胞的一组少见的恶性疾病。根据国际妇产科联盟(International Federation of Gynecology and Obstetrics, FIGO)2018最新分类,GTN在组织学上包括侵蚀性葡萄胎、绒毛膜癌(绒癌)、胎盘部位滋养细胞肿瘤、上皮样滋养细胞肿瘤和非典型胎盘部位结节[1]。GTN好发于年轻妇女,临床相对少见,对化疗高度敏感,治愈率高,其中高危型患者治愈率达80%~90%,但也有部分患者因耐药或复发或发生转移而治疗无效。现将武汉大学中南医院妇产科2007年1月—2019年10月得到有效治疗的3例绒癌和1例侵蚀性葡萄胎患者的诊治过程进行回顾,为高危型绒癌和侵蚀性葡萄胎的诊治提供参考。
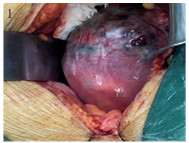
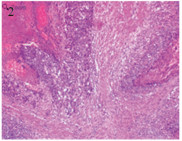
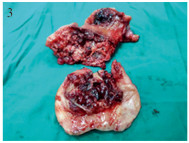
1 临床资料 1.1 一般资料例2术中见子宫体积明显增大,子宫肌层多个散在的紫兰色病灶,见图 1; 术后病理报告为绒癌,见图 2。例4子宫切除后剖视标本:宫腔及肌层见较多的水泡及凝血块,见图 3; 例4子宫切除后病理报告为侵蚀性葡萄胎,见图 4。4例患者的一般资料见表 1。
|
| 图 1 子宫绒癌 Figure 1 Choriocarcinoma of uterus |
|
| 图 2 子宫绒癌病理结果(HE ×100) Figure 2 Pathological examination of choriocarcinoma of uterus (HE ×100) |
|
| 图 3 侵蚀性葡萄胎 Figure 3 The invasive mole |

|
| 图 4 侵蚀性葡萄胎病理结果(HE ×100) Figure 4 Pathological examination of invasive mole (HE ×100) |
3例绒癌中1例为宫颈绒癌、1例为阴道转移绒癌、1例为宫体绒癌,其中阴道转移绒癌继发于流产,另2例继发于足月妊娠; 1例侵蚀性葡萄胎继发于葡萄胎妊娠。4例均有阴道不规则流血,流血时间最短1周,最长2月,其中2例发生阴道多量出血,有轻度到中度的贫血,1例需输血。4例均有轻微的腹痛、腹胀。均无咳嗽、咯血、胸痛、头痛等症状。1例宫体绒癌和1例侵蚀性葡萄胎发生肺部广泛转移; 1例绒癌仅有阴道转移而子宫未见原发灶; 1例宫颈绒癌未发生其他部位的转移。妇科检查:阴道、宫颈呈紫蓝色,宫颈软; 除外1例阴道转移者子宫不增大,其余3例子宫如孕3~4月大小,阴道转移者可见阴道前壁中段约一核桃大的紫蓝色包块,表面血管丰富,肿块表面破溃,有活动性出血,用纱布压迫不易止血。
1.3 辅助检查4例患者血液β-hCG均异常升高,治疗前β-hCG水平分别为阴道转移绒癌(15 133 mIU/ml)、宫颈绒癌(381 074 mIU/ml)、侵蚀性葡萄胎(678 081 mIU/ml)、宫体绒癌(700 000 mIU/ml)。盆腔彩色超声显示子宫明显增大,例2宫体实性肿块8.0 cm×9.0 cm×8.5 cm、例4子宫大小为14.0 cm×11.0 cm×10.0 cm,例3宫颈后方8.3 cm×7.6 cm×8.0 cm的肿块。阴道转移绒癌肿块大小为5.0 cm×5.0 cm×4.0 cm。2例患者肺部CT提示多发结节。
1.4 治疗对4例患者采取化疗加手术的综合治疗。按临床分期和预后评分结果,4例均采用甲氨蝶呤(MTX)+放线菌素D(ACT-D)的化疗方案。手术治疗的时机则因病情而定。例3宫颈绒癌化疗2个疗程后血β-hCG从381 074 mIU/ml下降到367 mIU/ml,因无生育要求行子宫切除术,术后行第3疗程化疗时β-hCG降至正常,再巩固治疗2疗程。1例年轻绒癌患者(例1)发生阴道转移,入院时血流不止,妇检发现阴道转移瘤破溃,有活动性出血,盆腔彩色超声未见子宫及附件有病灶,肺部CT未见转移。先行髂内血管分支栓塞止血,化疗2疗程后β-hCG由15 133 mIU/ml降至正常,再行瘤体切除,术后继续巩固化疗2疗程。1例宫体绒癌伴肺转移患者(例2)化疗3疗程后β-hCG从1 700 000 mIUml降至130 000 mIU/ml,考虑下降幅度缓慢、瘤体体积大,加上肺部转移,患者无生育要求,遂行子宫切除减少了瘤负荷,术后再化疗一疗程后β-hCG迅速下降至2 000 mIU/ml,6疗程化疗后β-hCG降至正常。该患者化疗疗程长,除与瘤负荷大有关,还与病理类型为绒癌、恶性程度高有关。例4(侵蚀性葡萄胎伴肺转移患者)在第一疗程化疗的第3天发生大出血,血红蛋白降至60 g/L,此前在外院也发生过大出血并给予输血治疗,考虑患者年龄为52岁,无生育要求,为防止继续出血急行全宫及双附件切除术,术后第6天β-hCG由678 081 mIU/ml降至17 700 mIU/ml,化疗2疗程后降至正常,后续给予2疗程的维持治疗。
1.5 随访治疗结束后,对4例患者均进行了电话随访。首次随访时间为出院后3月,然后每6月1次。2007年收治的2例患者进行了2年的随访。随访内容包括月经状况、有无阴道出血、咳嗽、咯血等症状、β-hCG、盆腹腔彩超和胸部X线或CT检查,未见复发。对于2019年收治的2例患者进行随访,例2随访时间满1年,例4随访时间满半年。患者目前身体状况良好,未出现复发征象。
2 讨论 2.1 关于诊断GTN60%继发于葡萄胎,30%继发于流产,10%继发于足月妊娠或异位妊娠[3]。本文4例患者2例继发于足月妊娠,1例继发于流产,1例继发于葡萄胎。GTN的症状主要为不规则阴道出血,甚至以大出血为首发症状。有的患者出血时间长达1~2月,就诊时病情往往已很严重,与该病起病隐匿,重视不够有关。该病同时伴随β-hCG异常升高,高达数十万甚至上百万。盆腔彩超显示子宫不同程度增大,肌层内有回声不均匀区域或团块及丰富的血流信号。X线胸片或CT检查发现肺部病灶对GTN的诊断也有帮助。组织学证据对于妊娠滋养细胞肿瘤的诊断不是必需的,但若有组织学证据时应以组织学诊断为主[3]。
目前,我国及国际上应用的是FIGO于2000年公布的解剖学分期标准以及改良FIGO预后评分系统[2]。该评分系统更加客观地反映了GTN患者的实际情况,在疾病诊断的同时更加简明地指出了患者除分期之外的病情轻重及预后危险因素。高危GTN指预后评分≥7分的FIGOⅡ~Ⅲ期患者和任何评分的Ⅳ期患者。高危GTN常继发于非葡萄胎妊娠,因此对于非葡萄胎妊娠后的GTN,诊断相对困难。2015年FIGO首次提出了非葡萄胎妊娠后GTN的诊断标准:当流产、足月产、异位妊娠后出现阴道流血或腹腔、肺、脑等脏器出血,或肺部症状、神经系统症状时,应考虑GTN可能,及时行血液β-hCG检测。极高危组的概念是在2015年FIGO妇癌报告中提出的,指FIGO评分≥13或伴有肝脑转移[4]。本文4例患者中有3例为非葡萄胎后绒癌,1例来源于葡萄胎后的侵蚀性葡萄胎,除了临床表现以及血液β-hCG升高外,均有组织病理学结果。
2.2 关于治疗滋养细胞肿瘤采用化疗为主,手术和放疗为辅的综合治疗方案。FIGO在2018年的指南更新提出[1]:对于FIGO评分5~6分或病理诊断为绒癌的患者,可以直接考虑按照高危患者的治疗方案选择联合化疗。甲氨蝶呤为抗叶酸类抗肿瘤药物,对滋养细胞肿瘤疗效突出。放线菌素-D对滋养细胞肿瘤敏感,疗效好,尤其对肺部转移灶患者。根据NCCN指南推荐及以往国内、国外文献报道,对这4例患者,我们采用了MTX+ACT-D的化疗方案,观察到联合化疗1~2个疗程后,期别低、肿瘤局限在生殖系统的绒癌以及期别高的侵蚀性葡萄胎,该方案显示了良好的疗效,总疗程数为4~6个。但对于临床分期高的绒癌(肿瘤体积大且伴有广泛的肺转移者)化疗的疗效降低,化疗的总疗程数增加,达10个,这也提醒我们以后碰到类似的情况是否考虑及时更换更强的化疗方案。由于对MTX有很好的解毒药物,因此相较于其他化疗方案,该方案对骨髓抑制作用较轻,整个疗程很少或不用升白细胞药物; 肝功能损伤轻,患者依从性好。由于病例数少,对该方案的临床适用情况和疗效评价还需积累更多的临床资料。
GTN的手术方案与时机应根据患者病情、手术指征及年龄、有无生育要求等情况决定。手术治疗的目的是:(1)去除子宫或转移部位中耐药或持续存在的病灶; (2)减少肿瘤负荷,缩短化疗时间; (3)控制肿瘤的出血; (4)解除由大块肿瘤引起的梗阻或压迫症状[5-6]。但因瘤体大,子宫充血,术中极易大出血,手术需作好准备。1例侵蚀性葡萄胎患者(例4)在手术中出血多不易止血,情急之下,先切下宫体止血,再切宫颈,有效地控制了出血。1例宫颈绒癌患者(例3)因瘤体直径约8~9 cm,为避免出血和损伤宫旁输尿管,先结扎双侧髂内动脉,游离双侧输尿管,切开阴道前穹窿后向上逆行性切除子宫。因此,对于体积大的子宫绒癌,在术前给予1~2个疗程的化疗使得hCG降至较低水平,有利于减少术中出血,在做好备血及充足的术前准备基础上,手术者娴熟的技巧也是保证手术成功的重要因素。
作者贡献:
卢静: 临床资料及文献收集,文章撰写
江敬红: 文章修订及审校
邬东平: 临床资料分析、指导试验方案制定及实施、论文修改
| [1] |
Ngan HYS, Seckl MJ, Berkowitz RS, et al. Update on the diagnosis and management of gestational trophoblastic disease[J]. Int J Gynaecol Obstet, 2018, 143(Suppl2): 79-85. |
| [2] |
Kohorn EI, Goldstein DP, Hancock BW, et al. Workshop Report: combining the staging system of the International Federation of Gynecology and Obstetrics with scoring system of the World Health Organization for Torphoblastic Neoplasia. Report of the Working Committee of the International Society for the Study of Trophoblastic Disease and the International Gynecologic Cancer Society[J]. Int J Gynecol Cancer, 2000, 10(1): 84-88. DOI:10.1046/j.1525-1438.2000.00002.x |
| [3] |
谢幸, 孔北华, 段涛. 妇产科学[M]. 第9版. 北京: 人民卫生出版社, 2018: 329-330. [Xie X, Kong BH, Duan T. Obstetrics and Gynecology[M]. 9th ed. Beijing: People Health Publishing House, 2018: 329-330.]
|
| [4] |
Ngan HY, Seckl MJ, Berkowitz RS, et al. Update on the diagnosis and management of gestational trophoblastic disease[J]. Int J Gynaecol Obstet, 2015, 131(Suppl 2): S123-126. |
| [5] |
Eysbouts YK, Massuger LFAG, IntHout J, et al. The added value of hysterectomy in the management of gestational trophoblastic neoplasia[J]. Gynecol Oncol, 2017, 145(3): 536-542. DOI:10.1016/j.ygyno.2017.03.018 |
| [6] |
Fülöp V, Szigetvári I, Szepesi J, et al. The Role of Surgery in the Management of Gestational Trophoblastic Neoplasia The Hungarian Experience[J]. J Reprod Med, 2016, 61(5-6): 197-204. |
 2021, Vol. 48
2021, Vol. 48



