文章信息
- 血小板/淋巴细胞比值与PD-1/PD-L1抑制剂治疗非小细胞肺癌患者预后关系的Meta分析
- Association Between Platelet Lymphocyte Ratio and Prognosis of Non-small Cell Lung Cancer Patients Treated with PD-1/PD-L1 Inhibitor: A Meta-analysis
- 肿瘤防治研究, 2021, 48(6): 611-616
- Cancer Research on Prevention and Treatment, 2021, 48(6): 611-616
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.20.1052
- 收稿日期: 2020-09-09
- 修回日期: 2020-11-17
2. 402160 重庆,重庆医科大学附属永川医院放射科
2. Department of Radiology, Yongchuan Hospital of Chongqing Medical University, Chongqing 402160, China
目前,肺癌仍然是癌症相关死亡的主要原因,最常见的病理类型为非小细胞肺癌(non-small cell lung cancer, NSCLC),约占肺癌的85%,绝大多数患者初诊时已属晚期,而晚期肺癌患者5年生存率不足5%[1]。近年来以程序性细胞死亡受体1(PD-1)及其配体(PD-L1)为靶点的免疫治疗极大地提高了晚期非小细胞肺癌的5年生存率[2]。为了更好地评估预后,大量研究集中在探寻PD-L1表达、肿瘤突变负荷(tumor mutation burden, TMB)、基因表达特征、肿瘤浸润性淋巴细胞(umor infiltrating lymphocyte, TIL)等一系列指标能否作为免疫治疗有效性的预测因子[3]。虽然Checkmate026、Keynote-010以及OAK研究均表明NSCLC患者接受PD-1/PD-L1抑制剂的治疗疗效与肿瘤细胞PD-L1的表达水平相关[4-5],但该指标受到随时间动态变化、肿瘤内异质性和阈值不同及检测方法不同等方面的限制[6]。此外,与免疫治疗疗效相关的TILs、TMB及基因状态的检测在价格及便捷性上存在一定的局限性[7]。因此,寻找可行、方便、经济的抗PD-1/PD-L1治疗的预测性生物标志物仍在探索中。
全身炎性反应在肿瘤发生、发展中起重要作用,影响着宿主对恶性肿瘤的免疫应答,血小板是其中重要的参与细胞。血小板和肿瘤细胞粘连成团保护肿瘤细胞免受血液循环中的高剪切力和免疫细胞的攻击,除此之外还可释放血管内皮生长因子及多种细胞因子,促进肿瘤的进展、转移并协助肿瘤细胞免疫逃逸[8]。淋巴细胞在诱导细胞毒性死亡、抑制肿瘤细胞增殖和迁移、建立宿主的抗肿瘤免疫反应等方面发挥关键作用,淋巴细胞数量降低则会导致淋巴细胞介导的抗肿瘤免疫反应功能下降[9]。PLR(platelet-lymphocyte ratio)定义为血小板计数与淋巴细胞计数的比值,已有研究显示PLR升高与晚期癌症患者接受包括PD-1/PD-L1抑制剂在内的免疫治疗反应不佳相关[10]。目前,关于血液PLR在接受PD-1/PD-L1抑制剂治疗的NSCLC患者预测价值的相关研究结果不一致且样本量较小[11-17]。考虑到PLR检测的异质性结果和潜在价值,本研究通过Meta分析,探索血液PLR对接受PD-1/PD-L1抑制剂的NSCLC患者的预后价值。
1 资料与方法 1.1 检索策略对PubMed、EMBASE、Web of Science、Medline、Cochrane Library、中国知网、中国生物医学文献数据库、维普、万方等数据库进行在线文献检索,查阅从建库至2020年4月公开发表的有关PLR与接受PD-1/PD-L1抑制剂治疗的非小细胞肺癌患者预后关系的文献。采用主题词和自由词结合的检索方法,英文检索词为“platelet lymphocyte ratio”“platelet to lymphocyte ratio”“PLR”“lung neoplasm”“lung cancer”“lung tumor”“non-small cell lung cancer”“immunotherapy” “anti PD-1”“anti PD-L1”;中文检索词为“血小板淋巴细胞比值”“血小板淋巴细胞比率”“肺癌”“肺肿瘤”“非小细胞肺癌”“免疫治疗”,并对纳入文献的参考文献进行补充检索。
1.2 文献纳入与排除标准纳入标准:(1)经病理学确诊为非小细胞肺癌患者并接受PD-1/PD-L1抑制剂治疗;(2)治疗前或治疗期间测定PLR;(3)研究目的为PLR与总生存期(overall survival, OS)和无进展生存期(progression-free survival, PFS)之间的关系;(4)文章提供了足够的信息计算风险比(hazard ratio, HR)值及其95%置信区间(confidence interval, CI)。
排除标准:(1)研究对象为非原发性肺癌如转移性癌或复发肿瘤;(2)文章类型为摘要、评论、个案、综述、系统评价等;(3)文章缺少合格的研究数据;(4)无法获得全文或不能进行质量评估的文献。对于重复发表或数据有重合的研究仅保留方法学质量较高的研究。
1.3 文献筛选、数据提取与质量评估由两名研究者根据纳入和排除标准独立进行文献筛选、数据提取及文献质量评价,出现任何分歧通过讨论解决。提取的数据信息包括:第一作者姓名、发表年份、国家、样本量、病理类型、肿瘤分期、治疗方案、随访时间、PLR临界值、结局指标及相应HR值和95%CI等。对于既有单因素分析和多因素分析的文献,提取多因素分析结果。OS定义为从PD-1/PD-L1抑制剂治疗开始至(因任何原因)死亡的时间。PFS定义为从PD-1/PD-L1抑制剂治疗开始到肿瘤发生进展或(因任何原因)死亡之间的时间。通过纽卡斯尔-渥太华量表[18]对纳入文献进行质量评价,该量表涉及队列选择、队列可比性及结局事件评估三个方面,得分≥6的研究被视为高质量研究。
1.4 统计学方法所有统计分析均采用Stata15.0软件完成。上述结局指标的合并效应量为HR值;用Cochran的Q检验和Higgins的I2来评估纳入研究中的异质性,若P < 0.10和(或)I2 > 50%则说明纳入文献异质性水平高,采用随机效应模型进行合并,反之则采用固定效应模型[18]。通过亚组分析探索异质性来源或进一步论证Meta分析结果。利用漏斗图分析发表偏倚。进行敏感度分析评估排除每项研究后结果的稳定性。所有统计学检验均为双侧,P < 0.05为差异有统计学意义。
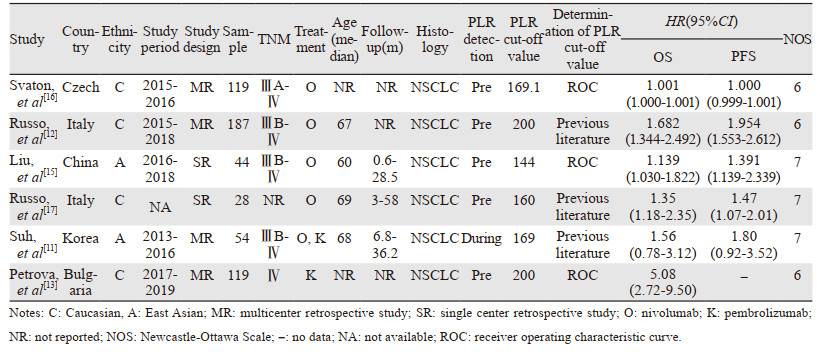
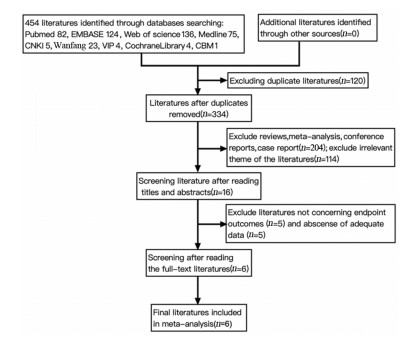
2 结果 2.1 文献检索结果根据制定的检索策略共检索到454篇文献,剔除120篇重复文献后,经阅读标题和摘要排除318篇文献,最后阅读全文按照纳入、排除标准进一步评估,最终纳入6篇文献[11-13, 15-17],总计551例非小细胞肺癌患者。筛选流程见图 1。
|
| 图 1 Meta分析研究纳入的流程图 Figure 1 Flow diagram of study selection for meta-analysis |
纳入研究均为回顾性研究,且NOS评分均≥6;其中4篇来自东亚人群,2篇来自高加索人群;PLR临界值的范围为144~200,其中位数为169.05;其余基本特征见表 1。
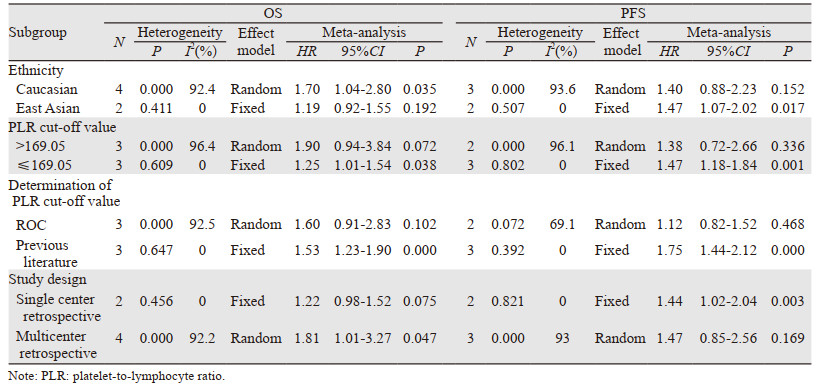
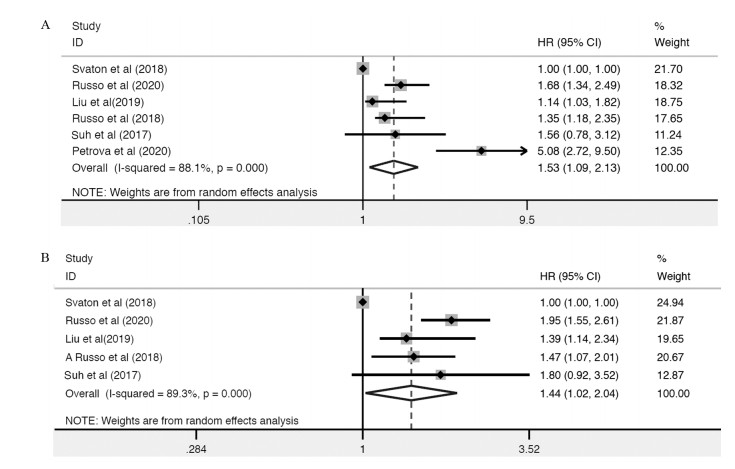
6项研究均报道了PLR与接受PD-1/PD-L1抑制剂治疗的NSCLC患者OS的关系。异质性检验结果显示文献间存在较高异质性,故采用随机效应模型。Meta分析结果显示,血液PLR较高与患者OS缩短存在明显关系(HR=1.53, 95%CI: 1.09~2.13, P=0.013, I2=88.1%, P异质性=0.000),见图 2。为探究异质性来源及进一步论证上述结果,我们进行了基于不同种族人群、PLR临界值、PLR临界值测定方式以及研究设计的亚组分析,结果显示高PLR在高加索人群、临界值≤169.05、依据以往文献制定PLR临界值以及多中心回顾性研究的患者中有预后价值(P < 0.05)。
|
| 图 2 PLR对于OS(A)和PFS(B)汇总HR的森林图 Figure 2 Forest plot of pooled HR of PLR for OS(A) and PFS(B) |
5项研究报道了PLR与PFS的关系,其结果显示血液PLR较高与接受PD-1/PD-L1抑制剂治疗的NSCLC患者PFS缩短存在明显关系(HR=1.44, 95%CI: 1.02~2.04, P=0.038, I2=89.3%, P异质性=0.000),见图 2,同时也进行了基于不同种族人群、PLR临界值、PLR临界值测定方式以及研究设计的亚组分析,结果显示高PLR在东亚人群、临界值≤169.05、依据以往文献制定PLR临界值以及单中心回顾性研究的患者中有预后价值(P < 0.05),见表 2。
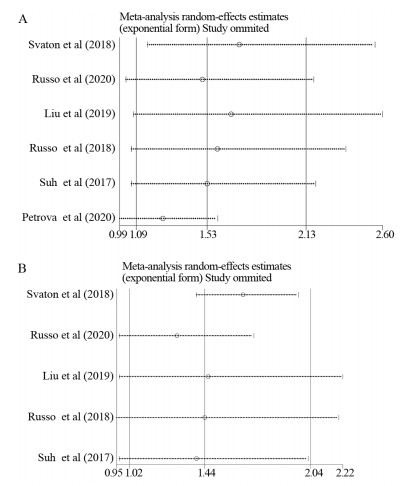
敏感度分析结果发现,依次去除任何一项研究,剩下研究所合并的HR均在Meta分析中合并的HR的95%CI之内,见图 3。以上结果表明本Meta分析合并的HR具有良好的稳定性。
|
| 图 3 OS(A)和PFS(B)的敏感度分析 Figure 3 Sensitivity analysis of OS(A) and PFS(B) |
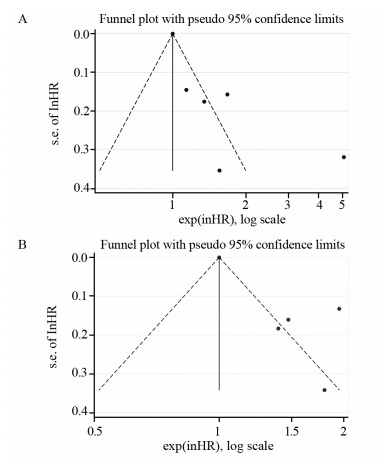
各研究的漏斗图不对称,表明纳入研究存在发表偏倚,见图 4。
|
| 图 4 OS(A)和PFS(B)的HR合并后的漏斗图 Figure 4 Funnel plot of merged HR of OS(A) and PFS(B) |
炎性反应已被证实在肿瘤发生、浸润、转移等多个方面起到重要作用,淋巴细胞和血小板是全身炎性反应的一部分[19]。聚集的血小板包裹循环肿瘤细胞,增强其逃避宿主免疫攻击的能力[20]。同时循环肿瘤细胞可释放组织因子(tissue factor, TF)、基质金属蛋白酶(matrix metalloproteinase, MMPs)、凝血酶等多种生物活性物质激活血小板。活化的血小板分泌TGF-β、CXC型趋化因子配体5、VEGF、PDGF等生物活性因子促进肿瘤血管生成,加快肿瘤细胞生长及转移。另一方面,淋巴细胞在抗肿瘤免疫中发挥关键作用,可通过再循环作用增加免疫细胞与抗原以及抗原提呈细胞接触,且肿瘤浸润性CD8+和CD4+T淋巴细胞可诱导细胞毒性死亡。相反,淋巴细胞数量的减少可影响抗肿瘤免疫应答[21]。PLR作为循环血液中血小板计数和淋巴细胞计数的比值,其升高代表了循环血液中血小板增多和(或)淋巴细胞减少,从而可能预测接受免疫治疗患者的预后[22]。
本研究结果显示血液PLR较高与接受PD-1/PD-L1抑制剂治疗NSCLC患者OS和PFS的缩短相关。OS的亚组分析显示,高PLR在高加索人群、临界值≤169.05、依据以往文献制定PLR临界值以及多中心回顾性研究的患者中有预后价值(P < 0.05);PFS的亚组分析显示,高PLR在东亚人群、临界值≤169.05、依据以往文献制定PLR临界值以及单中心回顾性研究的患者中有预后价值(P < 0.05)。
本研究的局限性:(1)仅纳入了6项研究,且均为回顾性研究,故可能存在较大偏倚;(2)由于无法获得纳入研究的原始数据,也无法以PD-L1表达状态、基因表达特征、TNM分期、性别、年龄等预后相关因素进行分层分析;(3)目前,关于PLR的临界值尚没有统一标准,这也可能是造成异质性的原因;(4)纳入研究确有发表偏倚存在,可能的原因有:相较于阴性结果的研究,阳性结果的研究更易发表。我们仅纳入了英文文献,其他语言的研究未纳入其中,这也会导致一定程度的偏倚。
综上,本研究结果显示血液PLR较高可能是接受PD-1/PD-L1抑制剂治疗的NSCLC患者预后不良的危险因素,从而在制定治疗策略方面提供一定的参考价值,可根据血液PLR的高低初步判断非小细胞肺癌患者接受PD-1/PD-L1抑制剂治疗的预后情况,帮助筛选免疫治疗临床获益人群。PLR可在常规血液检测中获得,经济、适用性强。然而由于上述局限性的存在,本研究结果需谨慎解释,还需要大样本、前瞻性的临床研究进一步验证。
作者贡献:
田甜:查阅文献、提取数据、统计分析、论文撰写
唐苏丹:整理数据、论文修改
| [1] |
Arbour KC, Riely GJ. Systemic therapy for locally advanced and metastatic non-small cell lung cancer: A review[J]. JAMA, 2019, 322(8): 764-774. DOI:10.1001/jama.2019.11058 |
| [2] |
Garon EB, Hellmann MD, Rizvi NA, et al. Five-year overall survival for patients with advanced non-small-cell lung cancer treated with pembrolizumab: Results from the phase Ⅰ KEYNOTE-001 study[J]. J Clin Oncol, 2019, 37(28): 2518-2527. DOI:10.1200/JCO.19.00934 |
| [3] |
Soyano AE, Dholaria B, Marin-Acevedo JA, et al. Peripheral blood biomarkers correlate with outcomes in. advanced non-small cell lung Cancer patients treated with anti-PD-1 antibodies[J]. J Immunother Cancer, 2018, 6(1): 129. DOI:10.1186/s40425-018-0447-2 |
| [4] |
Herbst RS, Baas P, Kim DW, et al. Pembrolizumab versus docetaxel for previously treated, PD-L1-positive, advanced non-small-cell lung cancer (KEYNOTE-010): a randomised controlled trial[J]. Lancet, 2016, 387(10027): 1540-1550. DOI:10.1016/S0140-6736(15)01281-7 |
| [5] |
Bylicki O, Barazzutti H, Paleiron N, et al. First-Line Treatment of Non-Small-Cell Lung Cancer (NSCLC) with Immune Checkpoint Inhibitors[J]. BioDrugs, 2019, 33(2): 159-171. DOI:10.1007/s40259-019-00339-4 |
| [6] |
Chae YK, Arya A, Iams W, et al. Current landscape and future of dual anti-CTLA4 and PD-1/PD-L1 blockade immunotherapy in cancer; lessons learned from clinical trials with melanoma and non-small cell lung cancer (NSCLC)[J]. J Immunother Cancer, 2018, 6(1): 39. DOI:10.1186/s40425-018-0349-3 |
| [7] |
Tray N, Weber JS, Adams S. Predictive biomarkers for checkpoint immunotherapy: Current status and challenges for clinical application[J]. Cancer Immunol Res, 2018, 6(10): 1122-1128. DOI:10.1158/2326-6066.CIR-18-0214 |
| [8] |
Menter DG, Tucker SC, Kopetz S, et al. Platelets and cancer: A casual or causal relationship: Revisited[J]. Cancer Metastasis Rev, 2014, 33(1): 231-269. |
| [9] |
Kobayashi N, Usui S, Kikuchi S, et al. Preoperative lymphocyte count is an independent prognostic factor in node-negative non-small cell lung cancer[J]. Lung Cancer, 2012, 75(2): 223-227. DOI:10.1016/j.lungcan.2011.06.009 |
| [10] |
Bilen MA, Martini DJ, Liu Y, et al. The prognostic and predictive impact of inflammatory biomarkers in patients who have advanced-stage cancer treated with immunotherapy[J]. Cancer, 2019, 125(1): 127-134. DOI:10.1002/cncr.31778 |
| [11] |
Suh KJ, Kim SH, Kim YJ, et al. Post-treatment neutrophil-to-lymphocyte ratio at week 6 is prognostic in patients with advanced non-small cell lung cancers treated with anti-PD-1 antibody[J]. Cancer Immunol Immunother, 2018, 67(3): 459-470. DOI:10.1007/s00262-017-2092-x |
| [12] |
Russo A, Russano M, Franchina T, et al. Neutrophil-to-Lymphocyte Ratio (NLR), Platelet-to-Lymphocyte Ratio (PLR), and Outcomes with Nivolumab in Pretreated Non-Small Cell Lung Cancer (NSCLC): A Large Retrospective Multicenter Study[J]. Adv Ther, 2020, 37(3): 1145-1155. DOI:10.1007/s12325-020-01229-w |
| [13] |
Petrova MP, Eneva MI, Arabadjiev JI, et al. Neutrophil to lymphocyte ratio as a potential predictive marker for treatment with pembrolizumab as a second line treatment in patients with non-small cell lung cancer[J]. Biosci Trends, 2020, 14(1): 48-55. |
| [14] |
Zer A, Sung MR, Walia P, et al. Correlation of neutrophil to lymphocyte ratio and absolute neutrophil count with outcomes with PD-1 axis inhibitors in patients with advanced non–small-cell lung cancer[J]. Clin Lung Cancer, 2018, 19(5): 426-434. |
| [15] |
Liu J, Li S, Zhang S, et al. Systemic immune-inflammation index, neutrophil-to- lymphocyte ratio, platelet-to-lymphocyte ratio can predict clinical outcomes in patients with metastatic non-small-cell lung cancer treated with nivolumab[J]. J Clin Lab Anal, 2019, 33(8): e22964. |
| [16] |
Svaton M, Zemanova M, Skrickova J, et al. Chronic inflammation as a potential predictive factor of nivolumab therapy in non-small cell lung cancer[J]. Anticancer Res, 2018, 38(12): 6771-6782. |
| [17] |
Russo A, Franchina T, Ricciardi GRR, et al. Baseline neutrophilia, derived neutrophil-to-lymphocyte ratio (dNLR), platelet-to-lymphocyte ratio (PLR), and outcome in non small cell lung cancer (NSCLC) treated with Nivolumab or Docetaxel[J]. J Cell Physiol, 2018, 233(10): 6337-6343. |
| [18] |
曾宪涛, 刘慧, 陈曦, 等. Meta分析系列之四: 观察性研究的质量评价工具[J]. 中国循证心血管医学杂志, 2012, 8(4): 297-299. [Zeng XT, Liu H, Chen X, et al. Meta Analysis Series Ⅳ: Quality Evaluation Tool for Observational Research[J]. Zhong Guo Xun Zheng Xin Xue Guan Yi Xue Za Zhi, 2012, 8(4): 297-299.] |
| [19] |
Balkwill F, Mantovani A. Inflammation and cancer: Back to Virchow?[J]. Lancet, 2001, 357(9255): 539-545. |
| [20] |
Schlesinger M. Role of platelets and platelet receptors in cancer metastasis[J]. J Hematol Oncol, 2018, 11(1): 125. DOI:10.1186/s13045-018-0669-2 |
| [21] |
Pinto MP, Balmaceda C, Bravo ML, et al. Patient inflammatory status and CD4+/CD8+ intraepithelial tumor lymphocyte infiltration are predictors of outcomes in high-grade serous ovarian cancer[J]. Gynecol Oncol, 2018, 151(1): 10-17. |
| [22] |
Xu F, Xu P, Cui W, et al. Neutrophil-to-lymphocyte and platelet-to-lymphocyte ratios may aid in identifying patients with non-small cell lung cancer and predicting tumor-node-metastasis stages[J]. Oncol Lett, 2018, 16(1): 483-490. |
 2021, Vol. 48
2021, Vol. 48