文章信息
- 诱导细胞焦亡抑制恶性肿瘤的新策略研究进展
- New Strategies of Inhibiting Malignant Tumor Based on Inducing Pyroptosis
- 肿瘤防治研究, 2021, 48(4): 393-399
- Cancer Research on Prevention and Treatment, 2021, 48(4): 393-399
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.20.0983
- 收稿日期: 2020-08-21
- 修回日期: 2020-12-01
细胞焦亡在过去常与细胞凋亡混淆,其最早命名为“pyroptosis”,是2001年Cookson等[1]形容半胱氨酸的天冬氨酸蛋白水解酶1(Caspase-1)介导的细胞程序性死亡。与细胞凋亡不同的是,细胞焦亡时伴随着质膜破裂、水内流、细胞肿胀、渗透溶解和促炎性细胞内容物的释放[2]。随着研究的逐渐深入,细胞焦亡的机制已有大量论述,而其作用正在不断被发掘。
1 细胞焦亡机制细胞焦亡目前较为确定的有两条途径,即经典细胞焦亡途径和非经典焦亡途径。经典细胞焦亡途径主要为:炎性小体→(激活)Caspase-1→(切断)Gasdermin D蛋白(GSDMD)→(N端诱导)细胞焦亡。其中炎性小体包含有Caspase-1前体(Pro-Caspase-1)、模式识别受体(NLR家族(NOD-like receptors, NLRs)、黑色素瘤缺乏因子2(absent in melanoma 2, AIM2)与Pyrin等及凋亡相关斑点样蛋白(ASC)。Caspase-1是经典细胞焦亡中最具特点的部分,在非经典途径探索出来之前一直被认为是细胞焦亡所必需的。Caspase家族成员较多,熟知的Caspase-3可以诱导细胞凋亡,Caspase-1可以参与炎性反应诱导细胞焦亡[2]。GSDMD是2015年发现的与炎性Caspase相关的底物蛋白[3],其被Caspase-1切断后形成N端和C端,N端可以引起细胞焦亡,C端可以与N端结合抑制焦亡。非经典细胞焦亡途径主要为:细菌脂多糖(Lipopolysaccharide, LPS)→(结合)Cspase-4、Caspase-5和Caspase-11→(切断)GSDMD→(N端诱导)细胞焦亡。2014年研究人员确认LPS可以直接通过结合Caspase-4、Caspase-5和Caspase-11来诱导细胞焦亡,无需Caspase-1,因而被称为非经典细胞焦亡途径[4],见图 1。目前有研究也探索出细胞膜半通道蛋白Pannexin-1可开放自身通道参与到非经典途径中[5]。
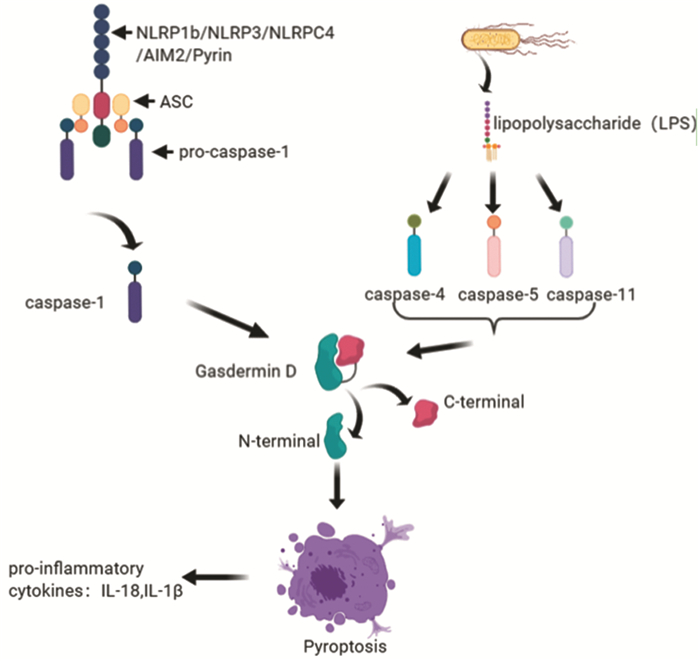
|
| 图 1 细胞焦亡通路 Figure 1 Pyroptosis pathway |
肿瘤发病原因较为复杂,但炎性反应可能是其相关因素,如长期慢性炎性反应可以导致局部组织异型增生从而发生癌变。目前研究发现肿瘤细胞中也可以存在炎性小体,并且这些小体有促进和抑制肿瘤生长的双重作用[6-7]。由于炎性小体是引导Caspase-1进行细胞焦亡的关键分子,这可能是肿瘤细胞与焦亡关联的重要节点。不同的肿瘤涉及的炎性小体不尽相同,如NLRP3在肿瘤细胞中广泛存在[8],与之相关的肿瘤有鼻咽癌[6]、结直肠癌[9]、肺腺癌[10]等。此外肝癌也与AIM2炎性小体相关[11]。虽然可以推定细胞焦亡与肿瘤相关,但其之间的关系却比较复杂,研究显示焦亡可以抑制肿瘤的发生和发展,但另一方面焦亡是促炎性死亡,也可以形成适合肿瘤细胞生长的微环境,从而促进肿瘤的生长。目前认为诱导肿瘤焦亡可以是一种潜在的癌症治疗新策略[12]。
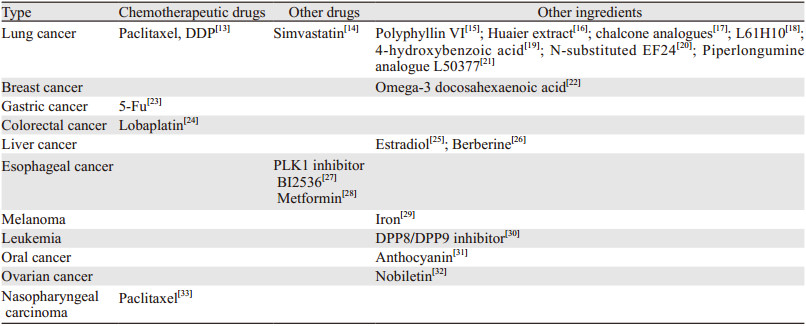
3 肿瘤细胞焦亡相关诱发分子可以诱导肿瘤细胞焦亡的分子较多,且在不同的肿瘤中作用并不一致。根据其临床应用可大致分为化疗药物、其他药物以及其他分子,见表 1。
化疗药物对肿瘤尤其是广泛期恶性肿瘤的治疗一直占有重要地位,不同类型化疗药物发挥的作用靶点不同,随着对细胞焦亡认识的深入,部分化疗药物可以诱导细胞焦亡得以证明。2017年发表于Nature上的一项研究证明,拓扑替康、伊立替康、依托泊苷、顺铂均可以引起Jurkat细胞、MeWo细胞的焦亡,而阿霉素及氟尿嘧啶可以引起HeLa细胞的焦亡,阿霉素、放线菌素d或拓扑替康可诱导NCI-H522细胞的焦亡,并指出这些途径均通过Caspase-3、GSDMD诱发,且GSDMD的广泛存在可导致化疗时正常细胞的焦亡[34]。另有研究称紫杉醇和顺铂可以引起肺癌A549细胞的焦亡,且顺铂引起肺癌细胞焦亡的能力比紫杉醇更强[13]。此外紫杉醇也可以诱导鼻咽癌细胞焦亡[33]。在结肠癌的治疗上,洛铂也被证实可以诱导HT-29和HCT116细胞的焦亡[24]。
既往认为化疗药物诱导肿瘤细胞凋亡较多,但随着对细胞焦亡认识的深入,部分原来被认为是凋亡的过程证实为焦亡。如有研究使用5-Fu处理胃癌细胞后,其细胞膜表现为肿胀破裂的焦亡特征,并揭示了GSDME将化疗药物诱导的Caspase-3依赖性细胞凋亡转换为胃癌细胞的焦亡[23],这对化疗药物作用的重新认识有提示作用。但组合治疗诱导焦亡是否有利于改善患者的预后情况尚有争议[35]。
细胞焦亡在一些认为可以给化疗药物增效的分子研究中也有所进展。如Polo样激酶1(Polo-like kinase 1, PLK1)抑制剂BI2536通过在食管鳞状细胞癌中诱导细胞焦亡而增强顺铂的化学敏感度,顺铂配合BI2536在低剂量时即可诱导食管鳞状细胞癌细胞发生焦亡[27]。真核生物延伸因子2激酶(eukaryotic elongation factor 2 kinase, eEF-2K)在阿霉素治疗黑色素瘤细胞时也发挥了协同作用,并且观察到抑制eEF-2K会抑制肿瘤细胞焦亡,eEF-2K间接增强阿霉素的抗肿瘤功效[36]。
另外关于化疗药物对正常机体损伤的研究也有一定进展。以往研究显示阿霉素在临床使用中受到心脏毒性的限制,而最新研究指出其诱导了心肌细胞焦亡,幸运的是该研究也指出了终末分化诱导非蛋白编码RNA(terminal differentiation inducing non-protein coding RNA, TINCR)可以作为有希望的治疗靶点,以克服化学疗法对癌症治疗的心脏毒性[37]。
3.2 性质较确定的诱导物质随着细胞焦亡研究的深入,部分临床与生活中的常见物质也被确定了具有诱导细胞焦亡尤其是肿瘤细胞焦亡的作用。
细胞焦亡的发生与炎性小体关系密切,而炎性小体最早发现于感染性疾病中,较常见的为细菌感染。如食管细菌诱导产生NLRP3,从而导致Barrett食管上皮细胞焦亡,其中包括早期癌变的细胞[38]。有研究深入探究了细菌发挥促细胞焦亡作用的靶点,并提出鞭毛蛋白AN/C(FlaAN/C)抑制了活性氧的产生,降低了NLRP3的活性,并减少了Caspase-1依赖性细胞焦亡的发生[39]。一些细菌的内容物同样可以引起肿瘤细胞的焦亡,如嗜盐假单胞菌TAC125的粗提物在抑制细胞增殖中最活跃,其主要成分为4-羟基苯甲酸(4-HBA),已被证实可以抑制A549肺癌细胞的增殖,而正常的肺上皮细胞(WI-38)不会影响细胞活力[19]。
病毒感染同样可以诱导部分肿瘤细胞焦亡,但目前研究尚不深入,多处于探索状态。如流感病毒感染可诱导正常或癌前人支气管上皮细胞凋亡和焦亡,也可诱导感染流感病毒的恶性肿瘤细胞凋亡,而且Lee等[40]发现Ⅰ型干扰素(IFN)介导的Janus激酶/信号转导与转录激活子(Janus kinase/signal transducer and activator of transcription, JAK/STAT)信号通路可能通过诱导Bcl-xL抗凋亡基因的表达来抑制凋亡,从而促进了从凋亡向焦亡的转换。但是否可以通过让肿瘤细胞感染病毒来治疗恶性肿瘤有待于进一步研究。
二甲双胍的作用已经不仅仅局限于调节血糖。近期研究证实了其可以诱导人食管癌细胞焦亡。Wang等[28]体内和体外实验均证实二甲双胍通过靶向miR-497/脯氨酸-谷氨酸-亮氨酸富集蛋白1(PELP1)轴诱导人食管癌细胞焦亡。在食管鳞状细胞癌(ESCC)晚期阶段PELP1表达上调,这与癌症进展和患者预后高度相关,而二甲双胍治疗可导致Gasdermin D介导的细胞焦亡。类似的研究还包括抗高血脂药物辛伐他汀,其可在非小细胞肺癌(NSCLC)细胞系和异种移植小鼠模型中诱导细胞焦亡,辛伐他汀有可能作为NSCLC的新型治疗剂[14]。
另有研究报道,人体所含的部分调节因子可能参与细胞的焦亡。如17β-雌二醇(E2)和雌激素受体(ER)信号转导可预防肝细胞癌(HCC),E2诱导的NLRP3炎性小体的激活可以作为HCC进程的抑制剂,诱导肝癌细胞的焦亡[25]。肝X受体β(LXRβ)是核受体超家族基因的一名成员,与体内胆固醇代谢密切相关,其与Pannexin1(新型缝隙连接蛋白Pannexin家族中的成员之一,它能够在神经、心血管等系统中广泛表达并形成非选择性的、大电导的半通道)结合导致NLRP3炎性小体的组装以及ASC和Caspase-1的激活[41],而这种激活可以特异性地诱导结肠癌细胞通过焦亡而死亡[42]。人脐带间充质干细胞(HUCMSCs)疗法是一种使用干细胞群诱导肿瘤细胞凋亡的新方法,而目前的研究证实了HUCMSCs的分泌因子可通过诱导细胞焦亡而导致乳腺癌细胞MCF7的死亡[43]。
中医药抗肿瘤的作用也逐步得到证实,尤其是单体分子的机制越来越清晰,通过某些中药的抗肿瘤作用去反向推导相关抗肿瘤分子是较便捷的研究方法。花朵类的中药普遍含有花青素,而一项研究也指出花青素降低了口腔鳞状细胞癌细胞的活力并抑制了迁移和侵袭能力,在施用Caspase-1抑制剂后,花青素的作用大大减弱,而Caspase-1是细胞焦亡的关键分子,可以推测花青素可能通过Caspase-1诱导肿瘤细胞的焦亡而发挥抗肿瘤作用[31]。红花等中药含有查耳酮,Zhu等[17]实验证实查耳酮通过调节ROS诱导肿瘤细胞焦亡,并在体内实验中表现出较好的安全性。地黄酮是从远志(Polygala caudata)中提取的一种黄酮化合物,具有多种药理活性,Chen等[44]研究小组探究了其与肝细胞癌的关系,并发现地黄酮显著抑制肝癌细胞的增殖并诱导细胞死亡,还抑制了肿瘤细胞的迁移和侵袭,他们将其归因于Caspase-2依赖性方式导致细胞焦亡。同样能引起肝癌细胞焦亡的还有小檗碱[26]。陈皮中的川陈皮素可以降低线粒体膜电位,诱导活性氧生成来引起卵巢癌细胞的焦亡[33]。肺癌细胞焦亡研究也较多,现已证实的有中药重楼中的成分重楼皂苷Ⅵ[15],以及槐耳提取物[16]。中药抗肿瘤作用已经被广泛证明,但其成分复杂,值得进一步挖掘。
此外,在ω-3脂肪酸可以调节炎性反应并发挥抗癌作用的基础上,Pizato等[22]发现二十二碳六烯酸(DHA)处理的乳腺癌细胞触发了Caspase-1和Gasdermin D激活的增加,并证实其诱导了乳腺癌细胞的焦亡。类似的营养物质还有铁,一项关于黑色素瘤细胞焦亡的研究指出了铁发挥了重要作用[29]。Li等[45]研究酒精性胃炎时发现,乙醇可能会引起细胞DNA损伤,激活Caspase-1,并促进IL-1β和IL-18的产生和释放,可能会引起细胞焦亡。至于乙醇是否可以用来诱导肿瘤细胞焦亡也成为进一步探究的方向,如肝细胞癌使用无水乙醇介入治疗后作用的发挥是否与乙醇诱导细胞焦亡相关。
3.3 新型诱导焦亡分子新型药物的研发常常需要探索功能未明的新型分子,而这些分子有部分也被证明了可以诱导肿瘤细胞焦亡的作用,但尚无商业化应用及确定的名称。丝氨酸肽酶DPP8和DPP9(DPP8/9)的小分子抑制剂可以在单核细胞和巨噬细胞中诱导Caspase-1依赖性的焦亡[46],而最新研究指出,DPP8/9抑制剂在大多数人类急性髓样白血病(AML)细胞系和原发性AML样品中诱导了肿瘤细胞的焦亡[30]。其有可能成为AML治疗新型分子,并且可以尝试在其他血液系统、淋巴系统肿瘤中应用。
有机单体成分较多也较混杂,目前可以诱导肿瘤细胞焦亡的有机单体有荜茇酰胺类似物L50377、硫代吡喃衍生物L61H10、N-取代的EF24等,见图 2。荜茇酰胺类似物L50377通过刺激非小细胞肺癌细胞中的活性氧(ROS)生成来促进细胞凋亡和细胞焦亡,而且ROS介导的NF-κB抑制可能为其主要作用机制[21]。硫代吡喃衍生物L61H10作用与荜茇酰胺类似物L50377相仿,其在体内外均表现出良好的抗肺癌细胞活性,也与NF-κB信号通路有关。重要的是L61H10在体外和体内均无明显的不良反应,拥有良好的应用前景[18]。N-取代的EF24可诱导肺癌A549细胞焦亡,有学者发现对N基13d取代可以助其成为高效、无害的肺癌候选药物[20]。这些分子的研究多处于探索相关功能的层次,有待于进一步确认在临床上应用的安全性与有效性,但可以提示细胞焦亡的新通路和新机制。
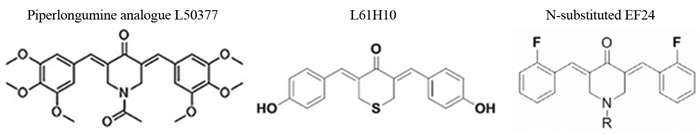
|
| 图 2 诱导焦亡的有机单体分子 Figure 2 Organic monomer molecules that induce pyroptosis |
诱导细胞焦亡的物质分子不断被发现,而如何利用好焦亡来消灭恶性肿瘤是研究中的难点问题,结合上述已经发现的诱导分子作用机制,我们提出了一些抗肿瘤作用的新策略。
4.1 细胞焦亡协同化疗 4.1.1 协同化疗增效化疗多基于剂量依赖来杀伤恶性肿瘤细胞,药物剂量越大越容易取得较好的治疗效果,但限制于患者自身体质、药物毒性等因素,化疗剂量常有上限,即使多周期化疗后依旧可能有恶性肿瘤细胞残存,最终导致复发与转移,因此如何提高化疗疗效是改善患者预后的重要问题。化疗药物可通过多种途径诱导恶性肿瘤细胞凋亡,而如果同时诱导细胞焦亡与凋亡能增大单次化疗对恶性肿瘤细胞的杀伤率,最终获得更好的化疗疗效。
目前,化疗诱导恶性肿瘤细胞焦亡提高了杀伤活性已经得到证实。有研究发现,阿霉素(0~5 μmol/L)和顺铂(0~100 μmol/L)分别处理人恶性间皮瘤细胞系Hmeso,观察到炎性小体NLRP3蛋白水平和Caspase-1水平随着药物浓度的升高而升高,细胞生存率可降低20%~30%[47]。细胞焦亡的启动需要高水平表达的GSDME,而肿瘤细胞内GSDME水平往往不满足此条件,因此发生焦亡的比例较低,如52%的早期胃癌中存在低水平表达的GSDME[48],但这也为化疗增效提供了有利机会,即化疗同时增强焦亡相关GSDME等表达,可起到化疗增敏的作用。如DNA甲基转移酶抑制剂地西他滨可以提高GSDME水平,将其与阿霉素联用,可使人卵巢癌细胞系OVCAR-4的细胞死亡率从14%提高到40%[49]。最新研究揭示了化疗药物引起细胞焦亡的上游机制为BAK/BAX-Caspase-3-GSDME信号通路,更加明确了焦亡与化疗未来的协同方向[50]。
4.1.2 逆转化疗耐药细胞焦亡可由细菌LPS诱发,最早探究焦亡与耐药的关系可见于细菌感染中的抗生素耐药,Liu等研究提出了一种通过注射GSDMD活性N端来治疗抗生素耐药菌的新思路,但细胞焦亡也会释放出细菌,敲响免疫警报的化学信号,免疫警报过于强大能够触发败血症,帮助耐药菌生存[51]。在恶性肿瘤中同样发现焦亡相关GSDME的低表达会使黑色素瘤MeWo细胞获得抗依托泊苷的耐药性,激活肿瘤细胞焦亡有可能会使其对化疗更加敏感[52]。同样还有乳腺癌MCF-7细胞中GSDME高表达,因此推测其在MCF-7细胞中表达降低会导致MCF-7细胞获得抗Taxol的耐药性[34]。因此提高焦亡相关蛋白表达,增强恶性肿瘤细胞的焦亡有利于逆转化疗耐药。
此外肿瘤微环境(TME)是支持肿瘤生长、促进耐药发生的关键因素[53]。化疗药物杀死肿瘤细胞起正面作用的同时也间接导致TME加速形成的负面作用,随着化疗进程的持续,TME支持的癌细胞获得性耐药发生率也在增加,可能导致负面作用强过正面作用,出现耐药肿瘤细胞增殖率大于化疗的杀伤率,从而导致化疗耐药甚至治疗失败。TME中包括多种基质细胞,它们通过释放细胞因子来协助肿瘤细胞耐药。因此诱导TME相关细胞焦亡可以逆转微环境导致的耐药性,但也要注意限制炎性因子释放防止炎性环境有利于TME的维持。
总而言之,诱导恶性肿瘤细胞焦亡有利于化疗的疗效提升,但需注意焦亡后炎性因子的控制。首先,本文综述的诱导焦亡的化疗药物可以通过配合提升焦亡蛋白表达在临床中发挥更大的作用效能; 其次是联合抗TME形成的药物。肿瘤微环境组成包括肿瘤相关成纤维细胞(CAFs)、肿瘤相关巨噬细胞(TAMs)以及血管内皮生长因子(VEGF)、白细胞介素-6(IL-6)等,在化疗时加入抗CAFs生长、抗VEGF制剂可能会有更好疗效。
4.2 机体代谢状态影响恶性肿瘤细胞增殖机体内多种代谢相关激素均与细胞焦亡相关,而细胞焦亡是抑制恶性肿瘤细胞形成的一种保护机制,因此机体代谢状态可能与恶性肿瘤发生发展有关。石汉平教授提出恶性肿瘤可视为一种代谢性疾病,在其代谢中产生大量氨基酸、核苷酸、脂肪酸以及细胞快速生长与增殖需要的其他中间产物,这些代谢产物反过来服务于上述代谢通路,从而促进肿瘤生长、抑制肿瘤凋亡[54]。同理这些代谢产物也会抑制焦亡,如高血糖可激活还原型辅酶Ⅱ(NADPH)-氧化酶系统,导致ROS生成和NLRP3炎性反应小体活性上调激活炎性反应小体,导致细胞焦亡[55]。游离脂肪酸(free fatty acids, FFAs)水平升高被认为是肥胖的重要指标,已经被证实作为损伤相关的分子模式(damage associated molecular patterns,DAMPs)激活NLRP3炎性反应小体引起焦亡,也提示了高FFA水平可能更容易引起细胞焦亡[56]。而恶性肿瘤通过对微环境中糖类、脂肪等能量物质的消耗降低了自身的焦亡,从而加快增殖。因此在治疗恶性肿瘤时改善微环境中的代谢状态有利于消灭癌细胞,调节机体的代谢状态也可能阻止癌细胞转移。
另一大类促进肿瘤细胞焦亡的成分为代谢调节药物如二甲双胍、辛伐他汀等,它们发挥诱导肿瘤细胞焦亡及抗肿瘤机制很可能与调节代谢相关分子的促肿瘤作用相关。因此诱导肿瘤细胞焦亡可能是调节人体代谢药物发挥抗癌作用的关键途径,发掘此途径是探索新型抗肿瘤药物机制的重要方向。
治疗恶性肿瘤中代谢的研究是目前的热点之一,尤其是TME中代谢改变影响了免疫治疗等疗效[57]。细胞焦亡较容易随着机体或局部代谢的改变而激活或抑制,因此通过调节代谢提高恶性肿瘤细胞的焦亡敏感度可能是未来的突破口之一。在恶性肿瘤治疗中,首先应对肿瘤患者饮食等活动进行管理,通过调节其代谢活动从而协助其他抗肿瘤手段发挥。其次是抗肿瘤治疗合理搭配二甲双胍等药物,提升肿瘤治疗效果,改善预后。此外可以从此方向探索更多的调节代谢药物的抗肿瘤效果,有助于新药研发。
5 总结细胞焦亡属于细胞程序性死亡中较新的研究方向,其在肿瘤中发挥的作用也是目前研究的热点。细胞焦亡的途径已经可以确定为经典途径与非经典途径,以及部分凋亡转化,因此近年来的研究重点在于如何应用细胞焦亡解决疾病与发现新的诱导焦亡的分子。通过国内外的最新进展,我们提出了基于诱导细胞焦亡探讨抑制恶性肿瘤的两项新策略,即协同化疗与调节代谢提高肿瘤治疗的疗效,期望对临床有所助益。
作者贡献:
朱潇雨: 文献查找、论文构思与撰写
李杰: 参与论文整体设计与审校
| [1] |
Cookson BT, Brennan MA. Pro-inflammatory programmed cell death[J]. Trends Microbiol, 2001, 9(3): 113-114. |
| [2] |
Fink SL, Cookson BT. Caspase-1-dependent pore formation during pyroptosis leads to osmotic lysis of infected host macrophages[J]. Cell Microbiol, 2006, 8(11): 1812-1825. DOI:10.1111/j.1462-5822.2006.00751.x |
| [3] |
Kayagaki N, Stowe IB, Lee BL, et al. Caspase-11 cleaves gasdermin D for non-canonical inflammasome signalling[J]. Nature, 2015, 526(7575): 666-671. DOI:10.1038/nature15541 |
| [4] |
Shi J, Zhao Y, Wang Y, et al. Inflammatory caspases are innate immune receptors for intracellular LPS[J]. Nature, 2014, 514(7521): 187-192. DOI:10.1038/nature13683 |
| [5] |
Yang D, He Y, Muñoz-Planillo R, et al. Caspase-11 Requires the Pannexin-1 Channel and the Purinergic P2X7 Pore to Mediate Pyroptosis and Endotoxic Shock[J]. Immunity, 2015, 43(5): 923-932. DOI:10.1016/j.immuni.2015.10.009 |
| [6] |
Chen LC, Wang LJ, Tsang NM, et al. Tumour inflammasome-derived IL-1β recruits neutrophils and improves local recurrence-free survival in EBV-induced nasopharyngeal carcinoma[J]. EMBO Mol Med, 2012, 4(12): 1276-1293. DOI:10.1002/emmm.201201569 |
| [7] |
Dinarello CA. Why not treat human cancer with interleukin-1 blockade?[J]. Cancer Metastasis Rev, 2010, 29(2): 317-329. DOI:10.1007/s10555-010-9229-0 |
| [8] |
Zhang H, Li L, Liu L. FcγRI (CD64) contributes to the severity of immune inflammation through regulating NF-κB/NLRP3 inflammasome pathway[J]. Life Sci, 2018, 207: 296-303. DOI:10.1016/j.lfs.2018.06.015 |
| [9] |
Ungerbäck J, Belenki D, Jawad ul-Hassan A, et al. Genetic variation and alterations of genes involved in NF-κB/TNFAIP3- and NLRP3-inflammasome signaling affect susceptibility and outcome of colorectal cancer[J]. Carcinogenesis, 2012, 33(11): 2126-2134. DOI:10.1093/carcin/bgs256 |
| [10] |
Wang Y, Kong H, Zeng X, et al. Activation of NLRP3 inflammasome enhances the proliferation and migration of A549 lung cancer cells[J]. Oncol Rep, 2016, 35(4): 2053-2064. DOI:10.3892/or.2016.4569 |
| [11] |
Ma X. Loss of AIM2 expression promotes hepatocarcinoma progression through activation of m TOR-S6K1 pathway[J]. Oncotarget, 2016, 7(24): 36185-36197. DOI:10.18632/oncotarget.9154 |
| [12] |
Xia X, Wang X, Cheng Z, et al. The role of pyroptosis in cancer: pro-cancer or pro-"host"?[J]. Cell Death Dis, 2019, 10(9): 650. DOI:10.1038/s41419-019-1883-8 |
| [13] |
Zhang CC, Li CG, Wang YF, et al. Chemotherapeutic paclitaxel and cisplatin differentially induce pyroptosis in A549 lung cancer cells via caspase-3/GSDME activation[J]. Apoptosis, 2019, 24(3-4): 312-325. DOI:10.1007/s10495-019-01515-1 |
| [14] |
Wang F, Liu W, Ning J, et al. Simvastatin Suppresses Proliferation and Migration in Non-small Cell Lung Cancer via Pyroptosis[J]. Int J Biol Sci, 2018, 14(4): 406-417. DOI:10.7150/ijbs.23542 |
| [15] |
Teng JF, Mei QB, Zhou XG, et al. Polyphyllin VI Induces Caspase-1-Mediated Pyroptosis via the Induction of ROS/NF-κB/NLRP3/GSDMD Signal Axis in Non-Small Cell Lung Cancer[J]. Cancers, 2020, 12(1): 193. DOI:10.3390/cancers12010193 |
| [16] |
Xie J, Zhuan B, Wang H, et al. Huaier extract suppresses non-small cell lung cancer progression through activating NLRP3-dependent pyroptosis[J]. Anat Rec(Hoboken), 2021, 304(2): 291-301. DOI:10.1002/ar.24307 |
| [17] |
Zhu M, Wang J, Xie J, et al. Design, synthesis, and evaluation of chalcone analogues incorporateα, β-Unsaturated ketone functionality as anti-lung cancer agents via evoking ROS to induce pyroptosis[J]. Eur J Med Chem, 2018, 157: 1395-1405. DOI:10.1016/j.ejmech.2018.08.072 |
| [18] |
Chen L, Weng B, Li H, et al. A thiopyran derivative with low murine toxicity with therapeutic potential on lung cancer acting through a NF-κB mediated apoptosis-to-pyroptosis switch[J]. Apoptosis, 2019, 24(1-2): 74-82. DOI:10.1007/s10495-018-1499-y |
| [19] |
Sannino F, Sansone C, Galasso C, et al. Pseudoalteromonas haloplanktis TAC125 produces 4-hydroxybenzoic acid that induces pyroptosis in human A459 lung adenocarcinoma cells[J]. Sci Rep, 2018, 8(1): 1190. DOI:10.1038/s41598-018-19536-2 |
| [20] |
Chen L, Li Q, Zheng Z, et al. Design and optimize N-substituted EF24 as effective and low toxicity NF-κB inhibitor for lung cancer therapy via apoptosis-to-pyroptosis switch[J]. Chem Biol Drug Des, 2019, 94(1): 1368-1377. DOI:10.1111/cbdd.13514 |
| [21] |
Li Q, Chen L, Dong Z, et al. Piperlongumine analogue L50377 induces pyroptosis via ROS mediated NF-κB suppression in non-small-cell lung cancer[J]. Chem Biol Interact, 2019, 313: 108820. DOI:10.1016/j.cbi.2019.108820 |
| [22] |
Pizato N, Luzete BC, Kiffer LFMV, et al. Omega-3 docosahexaenoic acid induces pyroptosis cell death in triple-negative breast cancer cells[J]. Sci Rep, 2018, 8(1): 1952. DOI:10.1038/s41598-018-20422-0 |
| [23] |
Wang Y, Yin B, Li D, et al. GSDME mediates caspase-3-dependent pyroptosis in gastric cancer[J]. Biochem Biophys Res Commun, 2018, 495(1): 1418-1425. DOI:10.1016/j.bbrc.2017.11.156 |
| [24] |
Yu J, Li S, Qi J, et al. Cleavage of GSDME by caspase-3 determines lobaplatin-induced pyroptosis in colon cancer cells[J]. Cell Death Dis, 2019, 10(3): 193. DOI:10.1038/s41419-019-1441-4 |
| [25] |
Wei Q, Zhu R, Zhu J, et al. E2-Induced Activation of the NLRP3 Inflammasome Triggers Pyroptosis and Inhibits Autophagy in HCC Cells[J]. Oncol Res, 2019, 27(7): 827-834. DOI:10.3727/096504018X15462920753012 |
| [26] |
Chu Q, Jiang Y, Zhang W, et al. Pyroptosis is involved in the pathogenesis of human hepatocellular carcinoma[J]. Oncotarget, 2016, 7(51): 84658-84665. DOI:10.18632/oncotarget.12384 |
| [27] |
Wu M, Wang Y, Yang D, et al. A PLK1 kinase inhibitor enhances the chemosensitivity of cisplatin by inducing pyroptosis in oesophageal squamous cell carcinoma[J]. EBioMedicine, 2019, 41: 244-255. DOI:10.1016/j.ebiom.2019.02.012 |
| [28] |
Wang L, Li K, Lin X, et al. Metformin induces human esophageal carcinoma cell pyroptosis by targeting the miR-497/PELP1 axis[J]. Cancer Lett, 2019, 450: 22-31. DOI:10.1016/j.canlet.2019.02.014 |
| [29] |
Zhou B, Zhang JY, Liu XS, et al. Tom20 senses iron-activated ROS signaling to promote melanoma cell pyroptosis[J]. Cell Res, 2018, 28(12): 1171-1185. DOI:10.1038/s41422-018-0090-y |
| [30] |
Okondo MC, Johnson DC, Sridharan R, et al. DPP8 and DPP9 inhibition induces pro-caspase-1-dependent monocyte and macrophage pyroptosis[J]. Nat Chem Biol, 2017, 13(1): 46-53. DOI:10.1038/nchembio.2229 |
| [31] |
Yue E, Tuguzbaeva G, Chen X, et al. Anthocyanin is involved in the activation of pyroptosis in oral squamous cell carcinoma[J]. Phytomedicine, 2019, 56: 286-294. DOI:10.1016/j.phymed.2018.09.223 |
| [32] |
Zhang R, Chen J, Mao L, et al. Nobiletin Triggers Reactive Oxygen Species-Mediated Pyroptosis through Regulating Autophagy in Ovarian Cancer Cells[J]. J Agric Food Chem, 2020, 68(5): 1326-1336. DOI:10.1021/acs.jafc.9b07908 |
| [33] |
Wang X, Li H, Li W, et al. The role of Caspase-1/GSDMD-mediated pyroptosis in Taxol-induced cell death and a Taxol-resistant phenotype in nasopharyngeal carcinoma regulated by autophagy[J]. Cell Biol Toxicol, 2020, 36(5): 437-457. DOI:10.1007/s10565-020-09514-8 |
| [34] |
Wang Y, Gao W, Shi X, et al. Chemotherapy drugs induce pyroptosis through caspase-3 cleavage of a gasdermin[J]. Nature, 2017, 547(7661): 99-103. DOI:10.1038/nature22393 |
| [35] |
Pezuk JA. Pyroptosis in combinatorial treatment to improve cancer patients' outcome, is that what we want?[J]. EBioMedicine, 2019, 41: 17-18. DOI:10.1016/j.ebiom.2019.03.007 |
| [36] |
Yu P, Wang HY, Tian M, et al. Eukaryotic elongation factor-2 kinase regulates the cross-talk between autophagy and pyroptosis in doxorubicin-treated human melanoma cells in vitro[J]. Acta Pharmacol Sin, 2019, 40(9): 1237-1244. DOI:10.1038/s41401-019-0222-z |
| [37] |
Meng L, Lin H, Zhang J, et al. Doxorubicin induces cardiomyocyte pyroptosis via the TINCR-mediated posttranscriptional stabilization of NLR family pyrin domain containing 3[J]. J Mol Cell Cardiol, 2019, 136: 15-26. DOI:10.1016/j.yjmcc.2019.08.009 |
| [38] |
Zhou CB, Fang JY. The role of pyroptosis in gastrointestinal cancer and immune responses to intestinal microbial infection[J]. Biochim Biophys Acta Rev Cancer, 2019, 1872(1): 1-10. DOI:10.1016/j.bbcan.2019.05.001 |
| [39] |
Wu D, Han R, Deng S, et al. Protective Effects of Flagellin A N/C Against Radiation-Induced NLR Pyrin Domain Containing 3 Inflammasome-Dependent Pyroptosis in Intestinal Cells[J]. Int J Radiat Oncol Biol Phys, 2018, 101(1): 107-117. DOI:10.1016/j.ijrobp.2018.01.035 |
| [40] |
Lee S, Hirohama M, Noguchi M, et al. Influenza A Virus Infection Triggers Pyroptosis and Apoptosis of Respiratory Epithelial Cells through the Type I Interferon Signaling Pathway in a Mutually Exclusive Manner[J]. J Virol, 2018, 92(14): e00396-18. |
| [41] |
Rébé C, Derangère V, Ghiringhelli F. Induction of pyroptosis in colon cancer cells by LXRbeta[J]. Mol Cell Oncol, 2015, 2(1): e970094. DOI:10.4161/23723548.2014.970094 |
| [42] |
Derangère V, Chevriaux A, Courtaut F, et al. Liver X receptorβ activation induces pyroptosis of human and murine colon cancer cells[J]. Cell Death Differ, 2014, 21(12): 1914-1924. DOI:10.1038/cdd.2014.117 |
| [43] |
Jiao Y, Zhao H, Chen G, et al. Pyroptosis of MCF7 Cells Induced by the Secreted Factors of hUCMSCs[J]. Stem Cells Int, 2018, 2018: 5912194. |
| [44] |
Chen YF, Qi HY, Wu FL. Euxanthone exhibits anti-proliferative and anti-invasive activities in hepatocellular carcinoma by inducing pyroptosis: preliminary results[J]. Eur Rev Med Pharmacol Sci, 2018, 22(23): 8186-8196. |
| [45] |
Li G, Zhu L, Cao Z, et al. A New Participant in the Pathogenesis of Alcoholic Gastritis: Pyroptosis[J]. Cell Physiol Biochem, 2018, 49(1): 406-418. DOI:10.1159/000492902 |
| [46] |
Taabazuing CY, Okondo MC, Bachovchin DA. Pyroptosis and Apoptosis Pathways Engage in Bidirectional Crosstalk in Monocytes and Macrophages[J]. Cell Chem Biol, 2017, 24(4): 507-514. DOI:10.1016/j.chembiol.2017.03.009 |
| [47] |
Westbom C, Thompson JK, Leggett A, et al. Inflammasome Modulation by Chemotherapeutics in Malignant Mesothelioma[J]. PloS One, 2015, 10(12): e0145404. DOI:10.1371/journal.pone.0145404 |
| [48] |
Akino K, Toyota M, Suzuki H, et al. Identification of DFNA5 as a target of epigenetic inactivation in gastric cancer[J]. Cancer Sci, 2007, 98(1): 88-95. DOI:10.1111/j.1349-7006.2006.00351.x |
| [49] |
Kim MS, Chang X, Yamashita K, et al. Aberrant promoter methylation and tumor suppressive activity of the DFNA5 gene in colorectal carcinoma[J]. Oncogene, 2008, 27(25): 3624-3634. DOI:10.1038/sj.onc.1211021 |
| [50] |
Hu L, Chen M, Chen X, et al. Chemotherapy-induced pyroptosis is mediated by BAK/BAX-caspase-3-GSDME pathway and inhibited by 2-bromopalmitate[J]. Cell Death Dis, 2020, 11(4): 281. DOI:10.1038/s41419-020-2476-2 |
| [51] |
Liu X, Zhang Z, Ruan J, et al. Inflammasome-activated gasdermin D causes pyroptosis by forming membrane pores[J]. Nature, 2016, 535(7610): 153-158. DOI:10.1038/nature18629 |
| [52] |
Lage H, Helmbach H, Grottke C, et al. DFNA5 (ICERE-1) contributes to acquired etoposide resistance in melanoma cells[J]. FEBS Lett, 2001, 494(1-2): 54-59. DOI:10.1016/S0014-5793(01)02304-3 |
| [53] |
Katheder N S, Khezri R, O'farrell F, et al. Microenvironmental autophagy promotes tumour growth[J]. Nature, 2017, 541(7637): 417-420. DOI:10.1038/nature20815 |
| [54] |
石汉平. 肿瘤是一种代谢性疾病[J]. 肿瘤代谢与营养电子杂志, 2018, 5(2): 111-116. [Shi HP. Cancer is a metabolic disease[J]. Zhong Liu Dai Xie Yu Ying Yang Dian Zi Za Zhi, 2018, 5(2): 111-116.] |
| [55] |
Gao P, He FF, Tang H, et al. NADPH oxidase-induced NALP3 inflammasome activation is driven by thioredoxin-interacting protein which contributes to podocyte injury in hyperglycemia[J]. J Diabetes Res, 2015, 2015: 504761. |
| [56] |
Rheinheimer J, de Souza BM, Cardoso NS, et al. Current role of the NLRP3 inflammasome on obesity and insulin resistance: A systematic review[J]. Metabolism, 2017, 74: 1-9. DOI:10.1016/j.metabol.2017.06.002 |
| [57] |
Leone RD, Powell JD. Metabolism of immune cells in cancer[J]. Nat Rev, Cancer, 2020, 20(9): 516-531. DOI:10.1038/s41568-020-0273-y |
 2021, Vol. 48
2021, Vol. 48