文章信息
- 60例HIV阴性浆母细胞淋巴瘤患者的临床特征及预后
- Clinical Features and Prognosis of 60 Cases of HIV-negative Plasmablastic Lymphomas Patients
- 肿瘤防治研究, 2021, 48(4): 375-380
- Cancer Research on Prevention and Treatment, 2021, 48(4): 375-380
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.20.0878
- 收稿日期: 2020-07-22
- 修回日期: 2020-12-02
浆母细胞淋巴瘤(plasmablastic lymphoma, PBL)是一种临床罕见的恶性肿瘤,其形态学和免疫表型特征与侵袭性大B细胞淋巴瘤和浆细胞肿瘤较为相似。浆母细胞淋巴瘤最初报道见于1997年,大部分是HIV感染的患者,发病部位在口腔,而后越来越多的临床研究报道其与免疫功能抑制有关,2016年WHO将其归为人类免疫功能缺陷相关淋巴瘤[1]。该疾病容易与其他淋巴瘤如浆母细胞样浆细胞瘤、原发性渗出性淋巴瘤等混淆,恶性程度较高,复发率高,多数预后不良。目前HIV阴性的浆母细胞淋巴瘤的报道也越来越多,但大部分为个案报道或小样本分析。本研究搜集1997年1月1日—2020年3月30日在线数据库文献以及本院符合病理诊断的病例,筛选出临床特征、分子病理、治疗以及预后相对完整的病案进行分析,并复习相关文献,以期加深对该疾病的认识。
1 资料与方法 1.1 文献检索及病例收集使用关键词"浆母细胞淋巴瘤",检索1997年1月1日至2020年3月30日中国知网、万方及维普在线数据库,检索到统计源及以上级别杂志收录的文献40篇;同时收集本院2010年1月1日—2020年3月30日间符合病理诊断的HIV阴性的浆母细胞淋巴瘤患者104例。最终入组60例,其中本院患者3例,文献检索57例。纳入标准:(1)有明确的患者年龄、性别、发病时间、发病症状、起病部位、Ann Arbor分期;(2)有IPI评分或通过病例描述可以进行IPI评分;(3)有明确的病理和分子病理资料;(4)有明确的治疗方案、各线化疗的周期数、对治疗的反应;(5)死亡患者有明确的OS,生存患者有明确的随访总时间。如果以上有任何一项缺乏或描述不清,则不能纳入分析。
1.2 研究方法提取并记录每位患者信息:诊断年龄、性别、既往病史、受累部位、Ann Arbor分期、EB病毒(EBV)检测、人类8型疱疹病毒(HHV-8)检测、分子病理特征、治疗方案、疗效、随访时间、存活时间等。疗效定义:治疗后的疗效基于以增强CT或PET/CT为主体的影像学检查,包括完全缓解(CR)、部分缓解(PR)、稳定(SD)和进展(PD)。总体生存时间(overall survival, OS)定义为确诊至死亡或末次随访时间。
1.3 分组根据临床特征,将患者按年龄分为高年龄组(≥70岁)和非高龄组(< 70岁);按发病部位分为单一发病组(结内发病或结外发病)和复合发病组(结内外均有);按非霍奇金淋巴瘤国际预后指数IPI评分分为低-中低危组(评分0~2分)和中高-高危组(3~5分);按Ann Arbor分期分为早中期(Ⅰ~Ⅱ期)和中晚期(Ⅲ~Ⅳ期)。按初次治疗反应分为CR组和非CR组(含PR、SD、PD)。
1.4 统计学方法Logistic回归分析评估临床特征、治疗方案对治疗初次效果的影响。Kaplan-Meier法评估临床特征对生存的影响。Cox回归分析评估临床特征与生存的关系。使用SPSS19.0软件进行数据分析。P < 0.05为差异具有统计学意义。
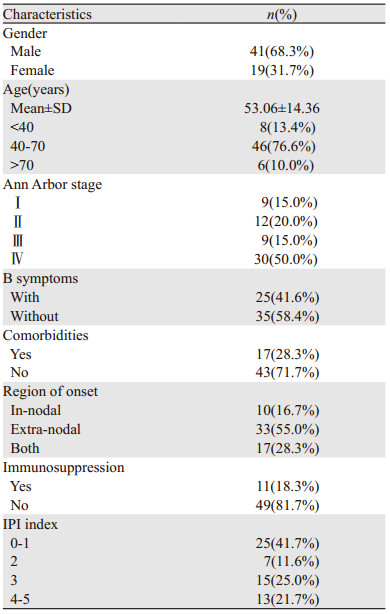
2 结果 2.1 临床特征60例浆母细胞淋巴瘤患者的临床特征,见表 1。患者一般在中老年(40~70岁)发病,中位年龄54.5岁。发病部位涉及淋巴结、鼻腔、口腔、纵隔、腹部、骨髓、中枢神经系统等脏器及系统,甚至原发在心脏、子宫、横纹肌、关节腔等部位。发病时分期一般较晚(早中期35%,中晚期65%)。有免疫抑制的患者11例,其中包括:长期使用糖皮质激素、既往肿瘤、使用免疫抑制剂、实验室检查评价(如淋巴细胞流式细胞术等)的免疫衰退等。17例患者(28.3%)具有合并症:包括乙肝、高血压、糖尿病、慢阻肺等,其中乙肝6例(10%)。
|
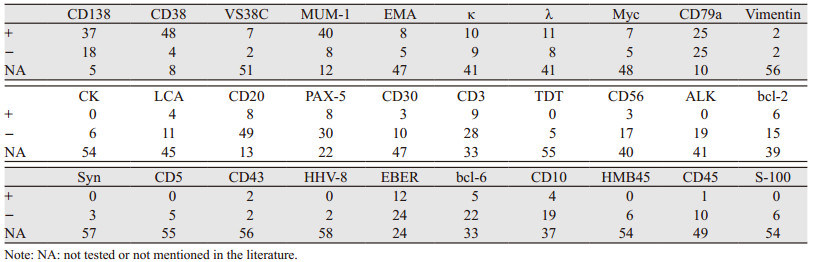
PBL表现为具有免疫母细胞外观的大细胞,具有丰富的细胞质,中央椭圆核,具有突出的核仁。Ki-67多呈现高表达:其中80%~100% 41例(68.3%),60%~79% 12例(20%),50%及以下7例(11.7%)。通过免疫组织化学、EB病毒编码小RNA(EBV-encoded small RNA,EBER)和疱疹病毒(HHV-8)原位杂交检测,结果显示:常见的阳性指标为CD138、CD38和MUM-1,此外还有VSC38C、EMA、κ和λ在检测中也有较高的阳性率。常见的阴性指标为CD20、PAX-5、CD3、CD30、CD56和bcl-6,此外CK、LCA、ALK、bcl-2、CD45和CD10在检测中阴性率较高。而CD79a阳性率及阴性率几乎相当,HHV-8仅2例为阴性,EBER阳性12例,见表 2。
|
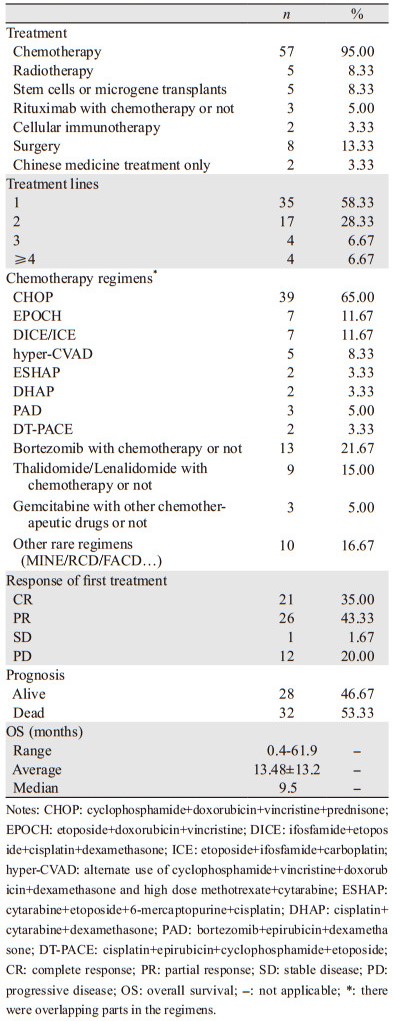
大部分患者接受以化疗为主的综合治疗,患者治疗策略、方案以及初次治疗的反应、OS等情况,见表 3。但患者间的OS差异较大,多数OS在1年内,其中23例OS≤6月,14例6~12月,17例 > 12~24月,2例 > 24~36月,仅1例 > 36~48月,仅2例 > 48~60月,1例≥60月,说明患者整体预后较差。
|
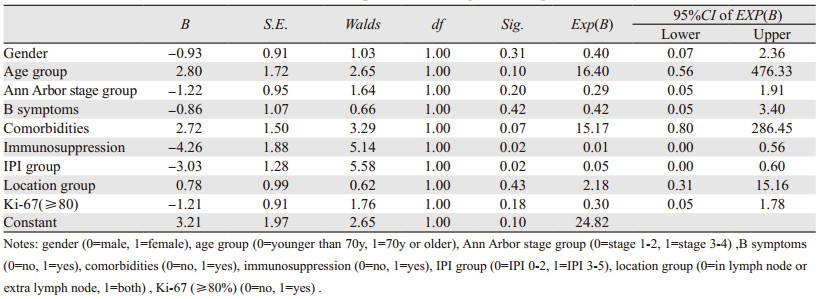
Logistic回归分析结果显示,是否有免疫抑制和IPI评分的危险级别与初始治疗效果是否能达到CR有密切关系(P < 0.05),见表 4。考虑无免疫抑制因素和IPI为0~2分的患者初始治疗的效果可能较好。
|
Kaplan-Meier生存分析发现,Ann Arbor分期早晚(P=0.000)、IPI评分的危险级别(P=0.000)、是否有B症状(P=0.022)、初次治疗是否能达到CR(P=0.000)都与生存密切相关。见图 1。
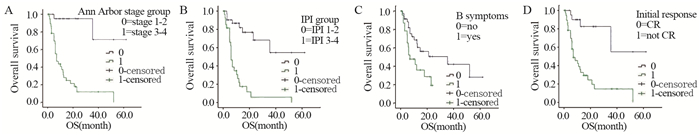
|
| 图 1 Kaplan-Meier法分析患者的总生存与Ann Arbor分期、IPI、B症状及对治疗的初始反应的相关性 Figure 1 Kaplan-Meier analysis of correlation of overall survival with stage, IPI, B symtoms and initial response to treatment |
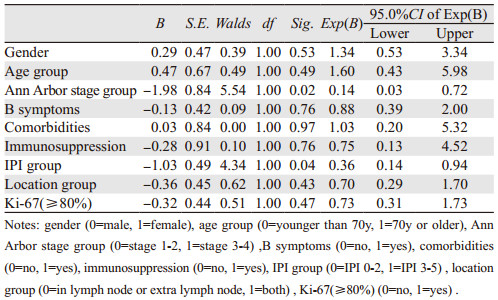
进一步Cox回归分析结果显示,发现Ann Arbor分期早晚与IPI评分的危险级别是患者生存的独立预后因素(P < 0.05),见表 5。病理分子指标与初始治疗反应及预后无相关性,而化疗方案类型、是否接受手术、放疗、靶向、免疫治疗或骨髓移植以及经历化疗的线数与预后也无明显的相关性(P > 0.05)。另仅接受中医保守治疗的两例患者OS分别为5月和4.9月,远远低于平均OS(13.48月)以及中位OS(9.5月)。
|
HIV阴性的PBL常被认为是各种原因引起免疫缺陷,常见的发病因素有医源性免疫抑制如器官移植、淋巴增生、自身免疫紊乱或年龄相关免疫抑制等[2]。本研究发现HIV阴性的浆母细胞淋巴瘤可能发生在任何年龄段,年龄分布主要集中在中老年,青年及少年较为少见,中位年龄54.5岁,70岁及以上的患者占入组患者的1/3,考虑年龄相关的免疫衰退与发病可能有相关性,但在统计分析中没有发现年龄和预后有明显相关。本研究中男性发病率(68.3%)较高,可能与先天免疫功能不足有关[3]。该病发病部位多,从淋巴结到肌肉,甚至脊髓腔和心脏都有报道,结外起病超过一半,结内外同时起病也有28.3%。部分起病具有高度隐匿性,因此在诊断的时候,分期往往较晚,本研究中Ⅲ~Ⅳ期患者有65%,而且B症状患者有41.6%(相较国外报道25%[2]稍高),但是骨髓受侵相对较少,仅有5例。
浆母细胞淋巴瘤的病理生理学尚不完全清楚,但已知浆母细胞是起源细胞,它是一种活化的B细胞,经历了体细胞高突变和类别转换重组,并处于正在成为浆细胞的过程[4]。目前浆母细胞淋巴瘤的发病诱因尚不明确,可能与EBV病毒、人类8型疱疹病毒等感染有关[2],也有研究认为可能与乙肝病毒的感染相关[5]。本研究发现EBER表达12例,乙肝感染者6例,提示这些感染与PBL发病可能有一定相关性,仅两例做了HHV-8检测且全部为阴性,国外也有学者认为HHV-8与PBL发病关系较小[6]。在分子机制上,目前发现MYC致癌基因的变异与PBL密切相关,最常见的改变是MYC与IG的易位以及MYC的扩增和过表达;此外还有PRDM1的突变以及Blimp1蛋白表达的缺失,这些改变与MYC的过表达有关,此外p53肿瘤抑制分子的表达降低也与本病有关[7]。浆母细胞性淋巴瘤的免疫表型与浆细胞肿瘤的免疫表型相似,CD79a、MUM-1、BLIMP-1、CD38和CD138呈阳性,MYC表达为50%;CD19、CD20和PAX-5呈阴性;CD45、CD2或CD4可能成弱阳性或表达。Ki-67增殖指数通常较高,本研究有68.3%的Ki-67≥80%,提示其生长迅速、恶性程度高。与EVB病毒相关或与疱疹病毒相关的浆母细胞淋巴瘤可检测到EBER和HHV-8[8]。本研究的PBL免疫表型状态基本和既往文献报道相似。
HIV阴性的PBL比HIV阳性的PBL预后更差,中位OS为9月,2年OS仅10%[9]。目前没有标准的治疗方案,临床采用联合化疗为主的综合治疗模式。本研究发现目前临床最为常用的是以CHOP为基础的方案,与国外报道[10]一致,但有文献指出考虑到PBL较高的恶性程度,CHOP方案可能强度偏弱,建议使用强度更高的方案,如EPOCH、CODOX-M/IVAC交替使用、hyper-CVAD等[2],也有部分学者认为硼替佐米[11]以及GRMOX方案[12]有较好的疗效。还有学者报道了CD20+的复发的PBL患者在接受利妥昔单抗和地塞米松的非细胞毒性治疗后达到较好的效果,提示CD20+的PBL可能对利妥昔单抗治疗有效,但是PBL细胞中CD20+比例较少,可能限制其在PBL治疗中的应用[13]。本研究中,CD20+的8例患者中2例使用了利妥昔单抗,OS分别为5月(死于化疗后肺部感染)、18月,另1例使用利妥昔单抗的为CD20不明的状态,OS为10月;而有6例CD20+的患者未使用该药,OS差异巨大,为0.4~52月,平均18.6月,未发现使用利妥昔单抗与PBL患者生存获益有显著关系;因为考虑纳入例数据过少,混杂因素较多,这一结论仍需要扩大样本量进一步分析和评估。
目前较新的治疗还包括靶向、免疫、自体干细胞移植等手段。有学者提出Brentuximab vedotin是靶向CD30阳性细胞的抗体-药物偶联物,通常用于治疗霍奇金淋巴瘤和间变性大T细胞淋巴瘤,也有报道CD30阳性PBL患者使用该药进行后线治疗,很快出现明显的治疗反应[14],但也有报道表示该药使食管-隆突区域浸润的肿瘤快速退缩,反而导致了患者食管气管瘘并且死亡[15]。另有报道抗IL-6治疗可能是依赖IL-6类型的PBL的潜在靶点[16],在HIV阴性的HHV-8相关的多中心Castleman病中发生的浆母细胞性微淋巴瘤,在不表达EBV蛋白或CD30的患者中显示出对Siltuximab(一种抗IL6抗体)较为明显的临床反应[17]。来那度胺是一种免疫调节物质,广泛用于多发性骨髓瘤的治疗,可能与抑制NF-κB途径有关,而该途径在PBL的活化中起到重要作用。已有个案报道两例难治性PBL在使用来那度胺后获得快速而短暂的反应,其中一例患者在与CHOP联合使用后达到CR[18]。还有研究认为有22.5%的PBL病例表达程序性死亡受体1(PD-1),不论EBV阳性或阴性,PBL均可高表达PD-1和其配体PDL-1;免疫疗法可能在经过分子病理指标筛选的PBL患者中取得疗效[19]。有学者认为自体造血干细胞移植(auto-HSCT)联合增强诱导化疗对于HIV阴性且化疗敏感的PBL患者而言是一个很好的选择,现也证明其对HIV阳性患者同样有效[20];而在本研究中,4例化疗后PR患者以及1例CR患者接受了自体干细胞移植或微基因移植,PR患者的OS分别为7、10、18和36月,CR患者OS为24月,相较于整体OS有获益趋势(虽然未作出显著统计学差异),因此考虑自体干细胞移植在患者化疗CR或显著PR后是一种可选方案[21]。而放疗、手术或CAR-T治疗,目前仅见于极少数个案报道,本研究中接受过放疗的5例患者的OS为4~36月,平均为16.66月,中位为12.3月。而8例患者接受过手术,1例Ⅳ期患者接受局部手术后仅1.5月死亡,另1例8.4月后死亡,1例Ⅲ期患者术后3月死亡,剩余5例早中期接受手术患者的OS为12~61.9月,平均OS为33.18月,中位OS为23月,推测手术效果与临床分期相关,分期早预后较好。另有1例CAR-T的患者OS为18月。这部分治疗的相关数据及文献报道较少,因此以上方法建议根据患者具体情况选择使用。
综上,HIV阴性的浆母细胞淋巴瘤是较为罕见的疾病,目前临床报道非常少,多数为单例至十来例的报道,无法进行系统的研究。本研究提取了在线数据库所报道的患者资料,并经过信息均一化处理,剔除了信息不全的数据,最终获得60例包括临床信息、分子病理、治疗及随访数据相对完整的患者资料,进行统计学分析。研究初步总结了HIV阴性的PBL的临床特征:多发生在中老年患者,男女性比例约为2:1,诊断时大部分患者Ann Arbor分期偏晚,而肿瘤Ki-67多为高表达;治疗目前以联合化疗为主,部分患者接受了手术、放疗、靶向治疗、细胞免疫治疗、骨髓或微基因移植治疗,但治疗反应和OS的异质性较大,多数预后不良。同时logistic分析指出无免疫抑制和较低的IPI评分(0~2分)与初始治疗效果能否达到CR有密切关系,以上类型患者可能对初始治疗的效果较好。Kaplan-Meier分析提示较早的Ann Arbor分期(Ⅰ~Ⅱ期)、较低的IPI评分(0~2分)、无B症状、初次治疗达到CR都与OS密切相关。Cox回归分析发现了Ann Arbor分期早晚以及IPI高低是显著的独立预后因素。由此可见早发现、早治疗是该疾病治疗的关键;而化疗药物的方案、与否与靶向治疗、免疫治疗、手术、放疗联用,并不是影响结局的绝对重要因素,但是单纯保守治疗的患者预后更差,提示对于这类疾病,仅观察或支持治疗是远远不足的。本研究的不足之处在于纳入的资料仍相对较少,而且为回顾性研究。目前因为该发病率极低,暂时无法进行前瞻性研究,未来希望通过国家罕见病数据库的建立,募集全国范围更多的病例,规范这类罕见疾病的诊断治疗策略,从而明显改善患者预后。
作者贡献:
许文婧:统计分析及论文撰写
王佩:网络数据搜索与整理
马玥诗:临床数据检索与整理,统计分析
高丽萍:论文指导与修改
| [1] |
Swerdlow SH, Campo E, Pileri SA, et al. The 2016 revision of the World Health Organization classification of lymphoid neoplasms[J]. Blood, 2016, 127(20): 2375-2390. DOI:10.1182/blood-2016-01-643569 |
| [2] |
Castillo JJ, Bibas M, Miranda RN. The biology and treatment of plasmablastic lymphoma[J]. Blood, 2015, 125(15): 2323-2330. DOI:10.1182/blood-2014-10-567479 |
| [3] |
Reardon S. Infections reveal inequality between the sexes[J]. Nature, 2016, 54(7608): 447. |
| [4] |
Liu M, Liu B, Liu B, et al. Human immunodeficiency virus-negative plasmablastic lymphoma: a comprehensive analysis of 114 cases[J]. Oncol Rep, 2015, 33(4): 1615-1620. DOI:10.3892/or.2015.3808 |
| [5] |
蓝三春, 谢婧, 朱搏宇, 等. 乙型肝炎病毒相关浆母细胞淋巴瘤1例并文献复习[J]. 军事医学, 2018, 42(1): 77-78, 80. [Lan SC, Xie J, Zhu BY, et al. A case of hepatitis B virus-related plasmablastic lymphoma and literature review[J]. Jun Shi Yi Xue, 2018, 42(1): 77-78, 80.] |
| [6] |
Sarode SC, Sarode GS, Patil A. Plasmablastic lymphoma of the oral cavity: a review[J]. Oral Oncol, 2010, 46(3): 146-153. DOI:10.1016/j.oraloncology.2009.12.009 |
| [7] |
Lopez A, Abrisqueta P. Plasmablastic lymphoma: current perspectives[J]. Blood Lymphat Cancer, 2018, 8: 63-70. |
| [8] |
Bhatt R, Desai DS. Plasmablastic Lymphoma[M/OL]. StatPearls Publishing[2020-8-24]. https://www.ncbi.nlm.nih.gov/books/NBK532975/
|
| [9] |
Castillo JJ, Winer ES, Stachurski D, et al. HIV-negative plasmablastic lymphoma: not in the mouth[J]. Clin Lymphoma Myeloma Leuk, 2011, 11(2): 185-189. DOI:10.1016/j.clml.2011.03.008 |
| [10] |
Castillo JJ, Winer ES, Stachurski D, et al. Clinical and pathological differences between human immunodeficiency virus-positive and human immunodeficiency virus-negative patients with plasmablastic lymphoma[J]. Leuk Lymphoma, 2010, 51(11): 2047-2053. DOI:10.3109/10428194.2010.516040 |
| [11] |
Akce M, Chang E, Haeri M, et al. Bortezomib, Ifosfamide, Carboplatin, and Etoposide in a Patient with HIV-Negative Relapsed Plasmablastic Lymphoma[J]. Case Rep Hematol, 2016, 2016: 3598547. |
| [12] |
范舟, 李基炜, 易平勇, 等. 5例浆母细胞淋巴瘤临床病例分析和文献回顾[J]. 肿瘤药学, 2018, 8(1): 124-128. [Fan Z, Li JW, Yi PY, et al. Case Report on 5 Plasmablastic Lymphoma Patients and Literature Review by Retrospective Analysis[J]. Zhong Liu Yao Xue, 2018, 8(1): 124-128. DOI:10.3969/j.issn.2095-1264.2018.01.29] |
| [13] |
Yan M, Dong Z, Zhao F, et al. CD20-positive plasmablastic lymphoma with excellent response to bortezomib combined with rituximab[J]. Eur J Haematol, 2014, 93(1): 77-80. DOI:10.1111/ejh.12286 |
| [14] |
Holderness BM, Malhotra S, Levy NB, et al. Brentuximab vedotin demonstrates activity in a patient with plasmablastic lymphoma arising from a background of chronic lymphocytic leukemia[J]. J Clin Oncol, 2013, 31(12): e197-199. DOI:10.1200/JCO.2012.46.9593 |
| [15] |
Pretscher D, Kalisch A, Wilhelm M, et al. Refractory plasmablastic lymphoma-a review of treatment options beyond standard therapy[J]. Ann Hematol, 2017, 96(6): 967-970. DOI:10.1007/s00277-016-2904-7 |
| [16] |
Mine S, Hishima T, Suganuma A, et al. Interleukin-6-dependent growth in a newly established plasmablastic lymphoma cell line and its therapeutic targets[J]. Sci Rep, 2017, 7(1): 10188. DOI:10.1038/s41598-017-10684-5 |
| [17] |
Koenig G, Stevens TM, Peker D. Plasmablastic microlymphoma arising in human herpesvirus-8-associated multicentric Castleman disease in a human immunodeficiency virus-seronegative patient with clinical response to anti-interleukin-6 therapy[J]. Histopathology, 2015, 67(6): 930-932. DOI:10.1111/his.12718 |
| [18] |
Yanamandra U, Sahu KK, Jain N, et al. Plasmablastic lymphoma: successful management with CHOP and lenalidomide in resource constraint settings[J]. Ann Hematol, 2016, 95(10): 1715-1717. DOI:10.1007/s00277-016-2732-9 |
| [19] |
Laurent C, Fabiani B, Do C, et al. Immune-checkpoint expression in Epstein-Barr virus positive and negative plasmablastic lymphoma: a clinical and pathological study in 82 patients[J]. Haematologica, 2016, 101(8): 976-984. DOI:10.3324/haematol.2016.141978 |
| [20] |
Cattaneo C, Finel H, McQuaker G, et al. Autologous hematopoietic stem cell transplantation for plasmablastic lymphoma: the European Society for Blood and Marrow Transplantation experience[J]. Biol Blood Marrow Transplant, 2015, 21(6): 1146-1147. DOI:10.1016/j.bbmt.2015.03.008 |
| [21] |
Elyamany G, Al Mussaed E, Alzahrani AM. Plasmablastic Lymphoma: A Review of Current Knowledge and Future Directions[J]. Adv Hematol, 2015, 2015: 315289. |
 2021, Vol. 48
2021, Vol. 48


