文章信息
- TNF-α抑制剂在免疫检查点治疗中的应用研究进展
- Progress in Application of TNF-α Inhibitors in Immune Checkpoint Therapy
- 肿瘤防治研究, 2021, 48(4): 414-417
- Cancer Research on Prevention and Treatment, 2021, 48(4): 414-417
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.20.0862
- 收稿日期: 2020-07-22
- 修回日期: 2021-01-28
据CA2018统计,全球每年约有1 800万新增癌症病例及960万例癌症死亡病例[1],因早期肿瘤缺乏特异性症状,多数患者发现时已是失去手术根治机会的晚期恶性肿瘤,放化疗疗效有限,近年来肿瘤免疫治疗的出现显著改善了晚期癌症患者的生存期。针对肿瘤的特异性免疫逃避机制,免疫检查点抑制剂(immune checkpoint inhibitors, ICIs)通过阻断肿瘤细胞及免疫细胞上的负性T细胞调节因子(检查点)来恢复T细胞介导的免疫反应发挥抗肿瘤作用,但同时也可能导致反应性T细胞和自身免疫间的耐受失衡,从而出现免疫相关不良反应(immune-related adverse events, irAEs)[2]。严重的irAEs常导致免疫治疗的终止,甚至危及患者生命,极大限制了ICIs的应用及疗效。
根据CSCO及NCCN指南推荐,目前临床出现的大多数irAEs可通过糖皮质激素(glucocorticoid, GC)治疗得到改善,但对于部分重症及类固醇难治病例需应用额外的免疫抑制剂。长疗程的激素治疗可引发感染、高血糖、肌萎缩等多种并发症[3],并且对于激素是否会影响ICIs的抗肿瘤疗效目前也仍存在争议。目前,肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)抑制剂作为临床治疗irAEs应用最广泛的免疫抑制剂具有较大的研究价值。许多研究表明TNF-α抑制剂治疗irAEs有效,甚至TNF-α抑制剂与ICIs同步联合用药可能存在协同作用[4]。本文针对目前TNF-α抑制剂在免疫检查点治疗中的临床应用情况及最新研究进展进行了总结。
1 TNF-α抑制剂在irAEs中的治疗应用TNF-α作为巨噬细胞分泌的多功能细胞因子,在本身具有系统炎性反应作用的同时,还可作为调节免疫细胞诱导其他炎性细胞因子的表达(如白介素-1等)[5]。临床上常见的TNF-α抑制剂包括英夫利昔单抗(Infliximab, IFX)、阿达木单抗、依那西普和戈利木单抗,它们通过与TNF-α的高亲和力来阻断其与受体的相互作用,进而达到抑制炎性反应的作用[6],被广泛应用于多种irAEs的治疗中。
1.1 免疫相关性结肠炎免疫相关的结肠炎(immune-related enterocolitis, irEC)是临床最常见的irAE,以英夫利昔单抗为代表的TNF-α抑制剂可作为治疗类固醇难治性结肠炎的首选[7],CSCO指南推荐2级及以上的irEC在类固醇治疗48 h无改善者可加用IFX。剂量参照克罗恩病的应用,单次给予5 mg/kg,通常可在1~3天内快速起效,部分无效及复发患者可在2周及6周后给予后续剂量[8]。
除此之外,近期多项研究表明,以IFX治疗irEC具有多方面的优势。Johnson等[9]于2018年的一项回顾性研究发现,与单独使用GC相比,IFX与GC联合治疗结肠炎可以显著缩短症状消退的时间。而Abu-Sbeih等[10]研究提示,与等待GC治疗irEC无效后再使用IFX相比,早期引入IFX治疗可以减少对GC的依赖性并降低irEC复发的风险,而且具有相对较低的感染率[11]。以上结果均提示对irEC早期进行联合治疗可能取得更好疗效,但此结论仍需更多的前瞻性研究证实。
1.2 免疫相关性肺炎免疫检查点抑制剂相关肺炎(checkpoint inhibitor pneumonitis, CIP)的治疗基础是全身性类固醇,在GC治疗后48~72 h,评估疗效为激素不敏感的CIP可考虑应用包括IFX在内的额外免疫抑制剂(另有丙种球蛋白、L-6受体抑制剂等)[12-13]。目前英夫利昔治疗CIP仅有小样本病例报道,总体疗效为可见临床改善[14]。由于CIP常需要应用长疗程的激素治疗,易出现激素依赖及继发感染等问题而不得不停用ICIs,IFX作为可能的替代或联合治疗仍有广泛的研究前景。但值得注意的是,临床上CIP常合并感染,而IFX存在加重感染及结核活化的风险[15],故拟选择时需严格排除感染及结核。
1.3 免疫相关性心肌炎ICI相关性心肌炎总体发生率估计不超过1%,但一旦发生病程凶险,致死率高达50%[16]。指南对G4的心脏毒性Ⅱ级推荐,激素治疗24 h无效者考虑加用IFX。近期多份报告表明,单独使用GC可能难以控制ICI相关心肌炎,对于类固醇难治性心肌炎,部分患者使用IFX后肌钙蛋白等生化指标正常化,具有显著临床意义[12, 17]。提示IFX的早期加入或可改善ICI相关心肌炎转归,但此结论依然需要更多的证据。另外需特别注意IFX与心力衰竭恶化相关[18],故目前只推荐用于保留心脏功能的心肌炎。
1.4 其他少见不良反应对ICI相关的G3/G4肾损伤,指南推荐激素治疗1周后,若仍 > G2,可考虑加用IFX。对G3的类风湿关节炎,Ⅱ级推荐考虑使用IFX。在ICI引起的严重皮肤毒性(如急性严重银屑病)中亦可考虑IFX。另外,虽指南并未推荐在ICI相关内分泌不良反应中使用免疫抑制剂,但近期有报道使用IFX成功治疗了ICI介导的免疫相关性糖尿病[19]。由于目前以上情况的样本量过小,目前疗效评价尚不确切,具体临床使用建议在风湿及专科医生的共同指导下进行。
尽管以IFX为代表的TNF-α抑制剂在多种irAEs中体现出明显疗效,但需特别注意的是,抗TNF-α存在潜在的肝毒性,可以诱发急性肝细胞损伤及胆汁淤积损伤等[20],故不推荐应用于免疫相关性肝炎,同时在其他irAEs的应用中也建议积极检测肝功能。
2 TNF-α抑制剂对ICIs的疗效影响irAEs是ICIs介入人体免疫系统后出现的免疫紊乱表现,此时加入另一种生物免疫调节药物TNF-α抑制剂存在许多潜在问题,例如是否会加剧机体的免疫紊乱、免疫抑制作用是否会影响ICIs的疗效以及TNF-α抑制剂的最佳使用时机等,以下是针对此类问题的相关研究最新进展。
2.1 TNF-α抑制剂对TILs活性的影响肿瘤浸润淋巴细胞(tumor infiltrating lymphocytes, TILs)是ICIs治疗后发挥抗肿瘤作用的主体。Draghi等[21]的研究在体外测试了临床相关剂量的地塞米松和IFX对TILs活化和杀伤能力的影响,结果表明无论低或高剂量的地塞米松均会损害TILs的激活(分别为46%和62%)及肿瘤细胞杀伤力(48%和53%),相比之下标准剂量的英夫利昔单抗TILs活化(20%)和肿瘤杀伤(10%)影响轻微。另一研究发现TNF-α抑制剂不会影响粒酶B(细胞毒性T细胞杀伤肿瘤细胞的主要效应分子)的活性,这表明抗TNF-α不会显著改变CD8+TILs的细胞毒性潜力[22]。
2.2 TNF-α抑制剂与ICIs的同步应用目前临床上TNF-α抑制剂多用于严重的类固醇难治性irAEs,而大多数3/4级irAEs的标准管理需暂时或永久性停用ICIs后进行免疫抑制治疗,这极大地限制了免疫治疗疗效。Badran等[23]最近的小型回顾性研究中描述了5例严重类固醇耐药性结肠炎患者使用IFX的同时继续进行ICIs治疗,结果显示结肠炎症状均减轻,除1例原发疾病恶化外,其余患者显示出总体疾病稳定性。这提示TNF-α抑制剂与ICIs的同步治疗可能是安全的,可以在达到缓解irAEs的同时继续抗肿瘤治疗,但此结果受样本量及观察范围等多种要素限制。对此,一项正在进行中的Ⅰ期临床试验(TICIMEL, NCT03293784)首次对晚期黑色素瘤患者同时进行抗TNF-α与ICIs治疗,以评估同步治疗的安全性和耐受性[24],其结果或可给临床带来更多价值。
2.3 TNF-α抑制剂的预防性应用相较于单独的免疫检查点治疗,抗PD-1和CTLA-4联合治疗的irAEs发病率更高并且更为广泛[25]。为进一步探索抗TNF-α对免疫治疗的影响,Perez-Ruiz等[26]建立了多个异种移植的小鼠模型,并在抗PD-1和CTLA-4联合治疗前给予TNF-α抑制剂。其中,在炎性肠病的小鼠模型中观察到预防性抗TNF-α改善了ICIs加剧的结肠炎,并且研究发现,对异种移植小鼠预防性TNF-α阻断后,减少了结肠炎和肝炎的发生。重要的是,预防性的抗TNF-α没有影响甚至增强了ICIs的抗肿瘤功效[27]。因临床上ICIs的使用常受到irAEs的限制,尤其是在抗CTLA-4治疗中,常为减少不良反应而降低剂量,这同时也限制了其疗效。若预防性抗TNF-α可减少irAEs的发生,即可使患者耐受更高剂量的ICIs,在免疫检查点治疗方案中增加安全剂量,从而可能增强其抗肿瘤作用。这项研究对抗TNF-α治疗的时机选择带来了新的思路。
2.4 抗TNF-α治疗增强ICIs疗效自1975年发现TNF可使肿瘤细胞发生出血性坏死而命名后,许多学者为探索其抗肿瘤能力作出了研究,但结果表明肿瘤内的TNF水平不足以杀伤肿瘤细胞,而大剂量的TNF因缺少靶向性及严重不良反应使其难以成为合格的抗肿瘤药物[28]。并且后续的实验发现低水平的TNF-α反而构成了一种肿瘤微环境信号,可促进肿瘤血管形成和肿瘤进展[29],提示与提升TNF水平相比,阻断微环境中的TNF-α更可能达到抗癌效果。
基于TNF-α抑制剂本身在irAEs中的应用,近期已有多个动物实验研究TNF-α抑制剂与ICIs联用的疗效,结果均表明抗TNF-α治疗增强了ICIs疗效[21, 26, 30]。其中Bertrand等[22]的研究结果尤为显著,在具有免疫原性的黑色素瘤小鼠中,单独抗PD-1治疗使20%的肿瘤消退,而抗PD-1和抗TNF的联合治疗可促使75%的肿瘤消退。综合上述动物实验结果,抗TNF-α与ICIs治疗的协同作用可能来源于以下机制:首先,TNF-α阻断减少了ICIs治疗后CD8+T细胞活化诱导的细胞死亡(activation induced cell death, AICD),而AICD限制了低肿瘤负荷患者的免疫治疗疗效,抗TNF-α治疗后使肿瘤浸润CD8+T细胞增多,以此增强了对肿瘤细胞的免疫杀伤力。其次,免疫治疗后TNF可触发TIM-3的表达,TIM-3是TILs以及树突状细胞表面的次要免疫检查点分子,与肿瘤逃逸及ICIs治疗后复发关系密切,而抗TNF-α与ICIs的联合治疗则可减少这种现象。最后,TNF-α阻断后可观察到PD-1表达的下调,而高水平的PD-1与CD8+T细胞功能易损为特征的疲劳表型相关,故抗TNF-α后T细胞活性增强。总之,TNF-α阻滞剂可增强ICIs后的特异性免疫反应,但此结果目前仅限于动物实验,见图 1。
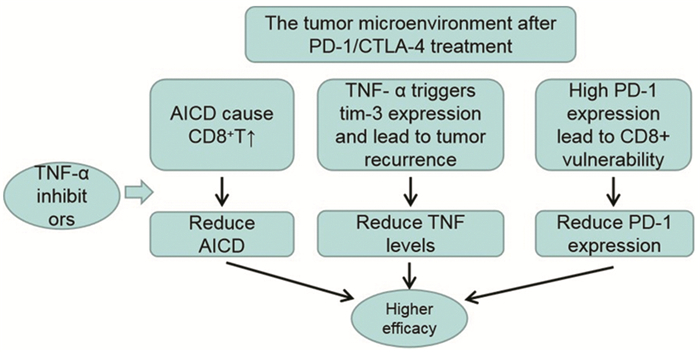
|
| 图 1 TNF-α抑制剂增强ICIs疗效的可能机制 Figure 1 Possible mechanisms of TNF-α inhibitors promoting efficacy of ICIs |
免疫检查点治疗显著改善了晚期恶性肿瘤的总体预后,在临床应用中日渐广泛,其所致各类irAEs的出现也逐渐增多。尽管最近有研究提示irAEs的出现与有效的免疫应答和更好的预后相关[31],但严重的irAEs将导致免疫治疗终止甚至威胁患者生命。目前irAEs首选GC治疗,TNF-α抑制剂作为临床应用最广泛的二线免疫抑制剂主要被推荐用于类固醇难治的结肠炎、肺炎、心肌炎、肾炎、类风湿关节炎等的治疗中,最近在指南未推荐的免疫相关性糖尿病中也有成功使用IFX的报道。目前对GC是否会减弱ICIs疗效尚存在争议,而近期研究表明TNF-α抑制剂对ICIs疗效影响相对较小,并且在某些irAEs中TNF-α抑制剂具有快速消退症状、降低感染风险等多种优势。另外,动物实验结果表明抗TNF-α可与ICIs同步治疗,并且这种联合治疗存在协同作用。
虽然抗TNF-α治疗在防治免疫检查点抑制剂的不良反应和增效作用来源于小样本、单中心等,证据级别偏低,但也确实给克服免疫治疗不良反应提供了新的思路和方法,同时不良反应和增效作用之间的剂量区别以及最大、最小剂量阈值等问题也值得进一步探索。随着大量双盲对照前瞻性的系统研究,TNF-α抑制剂与免疫检查点抑制剂相互关系等将进一步得到阐明。
作者贡献:
赵健蓉: 文献查阅,论文设计、撰写及修改
张献全: 论文设计、指导和审校
| [1] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
Naidoo J, Page DB, Li BT, et al. Toxicities of the anti-PD-1 and anti-PD-L1 immune checkpoint antibodies[J]. Ann Oncol, 2015, 26(12): 2375-2391. DOI:10.1093/annonc/mdv383 |
| [3] |
Hoes JN, Jacobs JWG, Boers M, et al. EULAR evidence-based recommendations on the management of systemic glucocorticoid therapy in rheumatic diseases[J]. Ann Rheum Dis, 2007, 66(12): 1560-1567. DOI:10.1136/ard.2007.072157 |
| [4] |
Montfort A, Dufau C, Colacios C, et al. Anti-TNF, a magic bullet in cancer immunotherapy?[J]. J Immunother Cancer, 2019, 7(1): 303. DOI:10.1186/s40425-019-0802-y |
| [5] |
Palladino MA, Bahjat FR, Theodorakis EA, et al. Anti-TNF-alpha therapies: the next generation[J]. Nat Rev Drug Discov, 2003, 2(9): 736-746. DOI:10.1038/nrd1175 |
| [6] |
Wang A, Xu Y, Fei Y, et al. The role of immunosuppressive agents in the management of severe and refractory immune-related adverse events[J]. Asia Pac J Clin Oncol, 2020, 16(4): 201-210. DOI:10.1111/ajco.13332 |
| [7] |
Friedman CF, Proverbs-Singh TA, Postow MA. Treatment of the Immune-Related Adverse Effects of Immune Checkpoint Inhibitors: A Review[J]. JAMA Oncol, 2016, 2(10): 1346-1353. DOI:10.1001/jamaoncol.2016.1051 |
| [8] |
Martins F, Sykiotis GP, Maillard M, et al. New therapeutic perspectives to manage refractory immune checkpoint-related toxicities[J]. Lancet Oncol, 2019, 20(1): e54-e64. DOI:10.1016/S1470-2045(18)30828-3 |
| [9] |
Johnson DH, Zobniw CM, Trinh VA, et al. Infliximab associated with faster symptom resolution compared with corticosteroids alone for the management of immune-related enterocolitis[J]. J Immunother Cancer, 2018, 6(1): 103. DOI:10.1186/s40425-018-0412-0 |
| [10] |
Abu-Sbeih H, Ali FS, Wang X, et al. Early introduction of selective immunosuppressive therapy associated with favorable clinical outcomes in patients with immune checkpoint inhibitor-induced colitis[J]. J Immunother Cancer, 2019, 7(1): 93. DOI:10.1186/s40425-019-0577-1 |
| [11] |
Wang Y, Abu-Sbeih H, Mao E, et al. Immune-checkpoint inhibitor-induced diarrhea and colitis in patients with advanced malignancies: retrospective review at MD Anderson[J]. J Immunother Cancer, 2018, 6(1): 37. DOI:10.1186/s40425-018-0346-6 |
| [12] |
王汉萍, 郭潇潇, 周佳鑫, 等. 免疫检查点抑制剂相关肺炎的临床诊治建议[J]. 中国肺癌杂志, 2019, 22(10): 621-626. [Wang HP, Guo XX, Zhou JX, et al. Clinical Diagnosis and Treatment Recommendations for the Pneumonitis Associated with Immune Checkpoint Inhibitor[J]. Zhongguo Fei Ai Za Zhi, 2019, 22(10): 621-626. DOI:10.3779/j.issn.1009-3419.2019.10.03] |
| [13] |
Friedman CF, Proverbs-Singh TA, Postow MA. Treatment of the Immune-Related Adverse Effects of Immune Checkpoint Inhibitors: A Review[J]. JAMA Oncol, 2016, 2(10): 1346-1353. DOI:10.1001/jamaoncol.2016.1051 |
| [14] |
Suresh K, Voong KR, Shankar B, et al. Pneumonitis in Non-Small Cell Lung Cancer Patients Receiving Immune Checkpoint Immunotherapy: Incidence and Risk Factors[J]. J Thorac Oncol, 2018, 13(12): 1930-1939. DOI:10.1016/j.jtho.2018.08.2035 |
| [15] |
Murdaca G, Spanò F, Contatore M, et al. Immunogenicity of infliximab and adalimumab: what is its role in hypersensitivity and modulation of therapeutic efficacy and safety?[J]. Expert Opin Drug Saf, 2016, 15(1): 43-52. DOI:10.1517/14740338.2016.1112375 |
| [16] |
Johnson DB, Balko JM, Compton ML, et al. Fulminant Myocarditis with Combination Immune Checkpoint Blockade[J]. N Engl J Med, 2016, 375(18): 1749-1755. DOI:10.1056/NEJMoa1609214 |
| [17] |
Agrawal N, Khunger A, Vachhani P, et al. Cardiac Toxicity Associated with Immune Checkpoint Inhibitors: Case Series and Review of the Literature[J]. Case Rep Oncol, 2019, 12(1): 260-276. DOI:10.1159/000498985 |
| [18] |
Kwon HJ, Coté TR, Cuffe MS, et al. Case reports of heart failure after therapy with a tumor necrosis factor antagonist[J]. Ann Intern Med, 2003, 138(10): 807-811. DOI:10.7326/0003-4819-138-10-200305200-00008 |
| [19] |
Trinh B, Donath MY, Läubli H. Successful Treatment of Immune Checkpoint Inhibitor-Induced Diabetes With Infliximab[J]. Diabetes Care, 2019, 42(9): e153-e154. DOI:10.2337/dc19-0908 |
| [20] |
Ghabril M, Bonkovsky HL, Kum C, et al. Liver injury from tumor necrosis factor-α antagonists: analysis of thirty-four cases[J]. Clin Gastroenterol Hepatol, 2013, 11(5): 558-564. DOI:10.1016/j.cgh.2012.12.025 |
| [21] |
Draghi A, Borch TH, Radic HD, et al. Differential effects of corticosteroids and anti-TNF on tumor-specific immune responses: implications for the management of irAEs[J]. Int J Cancer, 2019, 145(5): 1408-1413. DOI:10.1002/ijc.32080 |
| [22] |
Bertrand F, Montfort A, Marcheteau E, et al. TNFα blockade overcomes resistance to anti-PD-1 in experimental melanoma[J]. Nat Commun, 2017, 8(1): 2256. DOI:10.1038/s41467-017-02358-7 |
| [23] |
Badran YR, Cohen JV, Brastianos PK, et al. Concurrent therapy with immune checkpoint inhibitors and TNFα blockade in patients with gastrointestinal immune-related adverse events[J]. J Immunother Cancer, 2019, 7(1): 226. DOI:10.1186/s40425-019-0711-0 |
| [24] |
Montfort A, Dufau C, Colacios C, et al. Anti-TNF, a magic bullet in cancer immunotherapy?[J]. J Immunother Cancer, 2019, 7(1): 303. DOI:10.1186/s40425-019-0802-y |
| [25] |
Boutros C, Tarhini A, Routier E, et al. Safety profiles of anti-CTLA-4 and anti-PD-1 antibodies alone and in combination[J]. Nat Rev Clin Oncol, 2016, 13(8): 473-486. DOI:10.1038/nrclinonc.2016.58 |
| [26] |
Perez-Ruiz E, Minute L, Otano I, et al. Prophylactic TNF blockade uncouples efficacy and toxicity in dual CTLA-4 and PD-1 immunotherapy[J]. Nature, 2019, 569(7756): 428-432. DOI:10.1038/s41586-019-1162-y |
| [27] |
Alvarez M, Otano I, Minute L, et al. Impact of prophylactic TNF blockade in the dual PD-1 and CTLA-4 immunotherapy efficacy and toxicity[J]. Cell Stress, 2019, 3(7): 236-239. DOI:10.15698/cst2019.07.193 |
| [28] |
Montfort A, Colacios C, Levade T, et al. The TNF Paradox in Cancer Progression and Immunotherapy[J]. Front Immunol, 2019, 10: 1818. DOI:10.3389/fimmu.2019.01818 |
| [29] |
Li B, Vincent A, Cates J, et al. Low levels of tumor necrosis factor alpha increase tumor growth by inducing an endothelial phenotype of monocytes recruited to the tumor site[J]. Cancer Res, 2009, 69(1): 338-348. DOI:10.1158/0008-5472.CAN-08-1565 |
| [30] |
Vredevoogd DW, Kuilman T, Ligtenberg MA, et al. Augmenting Immunotherapy Impact by Lowering Tumor TNF Cytotoxicity Threshold[J]. Cell, 2019, 178(3): 585-599. DOI:10.1016/j.cell.2019.06.014 |
| [31] |
Haratani K, Hayashi H, Chiba Y, et al. Association of Immune-Related Adverse Events With Nivolumab Efficacy in Non-Small-Cell Lung Cancer[J]. JAMA Oncol, 2018, 4(3): 374-378. DOI:10.1001/jamaoncol.2017.2925 |
 2021, Vol. 48
2021, Vol. 48


